文档内容
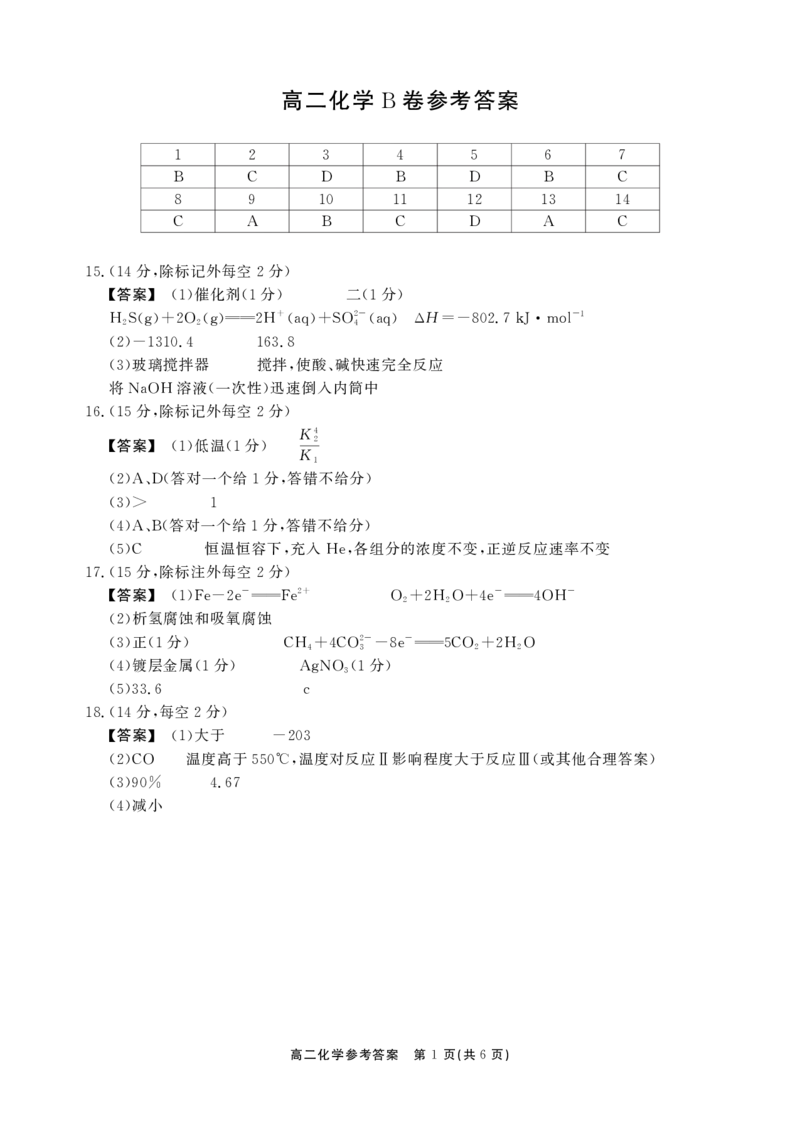
高二化学 卷参考答案
B
1 2 3 4 5 6 7
B C D B D B C
8 9 10 11 12 13 14
C A B C D A C
分 除标记外每空 分
15.(14 , 2 )
【答案】 催化剂 分 二 分
(1) (1 ) (1 )
+ 2- H -1
H2S(g)+2O2(g)2H (aq)+SO4 (aq) Δ =-802.7kJ·mol
(2)-1310.4 163.8
玻璃搅拌器 搅拌 使酸 碱快速完全反应
(3) , 、
将 溶液 一次性 迅速倒入内筒中
NaOH ( )
分 除标记外每空 分
16.(15 , 2 )
K4
【答案】 低温 分 2
(1) (1 ) K
1
答对一个给 分 答错不给分
(2)A、D( 1 , )
(3)> 1
答对一个给 分 答错不给分
(4)A、B( 1 , )
恒温恒容下 充入 各组分的浓度不变 正逆反应速率不变
(5)C , He, ,
分 除标注外每空 分
17.(15 , 2 )
【答案】
- 2+ - -
(1)Fe-2e Fe O2+2H2O+4e 4OH
析氢腐蚀和吸氧腐蚀
(2)
正 分
2- -
(3) (1 ) CH4+4CO3 -8e 5CO2+2H2O
镀层金属 分 分
(4) (1 ) AgNO3(1 )
(5)33.6 c
分 每空 分
18.(14 , 2 )
【答案】 大于
(1) -203
温度高于 温度对反应 影响程度大于反应 或其他合理答案
(2)CO 550℃, Ⅱ Ⅲ( )
(3)90% 4.67
减小
(4)
高二化学参考答案 第 页(共 页)
1 6答案详解
【答案】
1. B
【解析】 和 的反应是吸热反应 但不需要加热 项错误 一次能
Ba(OH)2·8H2O NH4Cl , ,A ;
源是直接来自自然界而未经加工转换的能源 风能属于一次能源 二次能源是由一次能源
, 。
直接或间接转换而来的能源 电能属于二次能源 项正确 非自发进行的反应 当外界提供
, ,B ; ,
足够的能量也可能发生 自发进行的反应条件不足也可能不发生 项错误 催化剂对正 逆
, ,C ; 、
反应速率的影响是同等程度加快 并非减慢逆反应速率 项错误
, ,D 。
【答案】
2. C
【解析】 家用燃气灶是把化学能转化为热能 项错误 光伏电池是光能 或者太阳能 转化
,A ; ( )
为电能 项错误 锂离子电池是把化学能转化为电能 项正确 电解水制氢机是把电能转
,B ; ,C ;
化为化学能 项错误
,D 。
【答案】
3. D
【解析】 完全燃烧生成 放出的热量比不完全燃烧生成 放出的热量多 放热反应
C CO2 CO ,
H 为负值 放出热量越多 H 越小 故 H H 项错误 氨水为弱碱 与硫酸反应
Δ , ,Δ , Δ 1<Δ 2,A ; ,
前 需要发生电离 而弱电解质的电离过程是一个吸热过程 则氨水与稀硫酸反应生成
, , , 1mol
时的反应热 H 项错误 表示燃烧热的热化学方程式中 应
H2O Δ >-57.3kJ·mol,B ; ,H2O
呈液态 项错误 H 反应物的总键能 生成物的总键能 已知 H 则反应物的总键
,C ;Δ = - , Δ >0,
能 生成物的总键能 项正确
> ,D 。
【答案】
4. B
【解析】 因为阴阳两极得失电子守恒 所以电解任何物质阳极上失电子数与阴极上得电子
,
数相等 项正确 将钢铁闸门连接在直流电源的负极属于外接电流的保护法 项错误 电
,A ; ,B ;
解 溶液 阴极上生成氢气 电极反应为 项正确 电解
- -
NaCl , , 2H2O+2e 2OH +H2↑,C ;
两种溶液实际都是电解水 所以参加反应的物质相同 项正确
H2SO4、NaOH , ,D 。
【答案】
5. D
【解析】 装置中依据活泼性差别判断 左装置是原电池 右装置是电解池 锌为原电池负极
, , , ,
石墨和原电池正极相连做电解池的阳极 项错误 锌为原电池负极 发生氧化反应 项错
,A ; , ,B
误 电解池的阳极失去电子经外电路流向原电池的正极 左侧铜电极 项错误 电解池中
; ( ),C ;
移向阴极 原电池中 移向正极 项正确
+ +
H , H ,D 。
【答案】
6. B
【解析】 电解水法制氢气成本较高 不经济 工业上常采用水煤气法制氢气 项错误 步骤
, , ,A ;
中 净化 是除去杂质以防止铁触媒中毒 项正确 合成氨的反应为气体分子数减小的反
① “ ” ,B ;
应 加压有利于平衡正向移动 提高原料转化率 加压也可以提高反应速率 但压强过大对设
, , , ,
备要求高 且不经济 项错误 步骤 加入催化剂只能提高反应速率 不能提高平衡转化率
, ,C ; ④ , ,
加压 液化分离出 和 的循环再利用均可以使平衡正向移动 所以步骤 有利
、 NH3 N2、H2 , ⑤⑥
于提高原料的平衡转化率 步骤 不能 项错误
, ④ ,D 。
【答案】
7. C
【解析】 该反应为可逆反应 则 和 充分反应时反应物依旧无法完全
, 0.5molN2 1.5molH2
转化 放出的热量小于 项正确 恒温恒压下通入惰性气体 体系体积增大 各物质
, 46.2kJ,A ; , ,
浓度减小 相当于减压 平衡向逆反应方向 气体分子数增多的方向 移动 项正确
, , ( ) ,B ;
高二化学参考答案 第 页(共 页)
2 6N2 g + 3H2 g 2NH3 g
初始
mol a a 0
转化 x x x
mol 3 2
平衡 x x x
mol a- a-3 2
x
反应过程中 体积分数为 a- 1 体积分数为恒量 体积分数不再变化 反应不
N2 x= ,N2 ,N2 ,
2a-2 2
一定平衡 项错误 金属钠的液氨溶液放置时缓慢放出气体 生成氨基钠和氢气 发生的是
,C ; , ,
置换反应 所给方程式符合反应原理 项正确
, ,D 。
【答案】
8. C
【解析】 达到平衡后再通入一定量的 浓度增大 容器内活化分子数增多 正
SO3(g),SO3(g) , ,
反应速率加快 项正确 反应的浓度商减小 平衡向正反应方向移动 项正确 通入一定量
,A ; , ,B ;
的 类似于加压 平衡向气体分子数减小的方向移动 的转化率减小 项错
SO3(g), , ,SO3(g) ,C
误 平衡向正反应方向移动 的浓度增大 项正确
; ,SO2(g) ,D 。
【答案】
9. A
【解析】 重铬酸钾溶液中存在平衡 重铬酸根离子为橙
2- 2- +
:Cr2O7 +H2O2CrO4 +2H ,
色 铬酸根离子为黄色 向重铬酸钾溶液中加入硫酸溶液 溶液中氢离子浓度增大 平衡向
, 。 , ,
逆反应方向移动 溶液橙色变深 加入氢氧化钠溶液 平衡正向移动 溶液由橙色变为黄色
, 。 , , ,
则题给装置能达到探究氢离子浓度对化学平衡的影响的实验目的 项正确 不能将 试
,A ; pH
纸直接伸入待测液 且 溶液具有漂白性 不能用 试纸测 溶液的 项
, NaClO , pH NaClO pH,B
错误 不能用长颈漏斗加试剂 且没有秒表计时 项错误 粗铜提炼为纯铜 粗铜应与电源正
; , ,C ; ,
极相连作阳极 项错误
,D 。
【答案】
10. B
【解析】 由图像可知 总反应能量降低 故该反应的热化学方程式为
-1
, 384.5kJ·mol ,
H -1 项错误 反应最快的
2H2S g +O2 g S2 g +2H2O g Δ =-384.5kJ·mol ,A ;
步骤为活化能最小的一步 即从中间体 到过渡态 活化能为
-1
, ② TS2, 18.0kJ·mol -7.4
项正确 该反应共经历 步 所以有 个基元反应 项错
-1 -1
kJ·mol =10.6kJ·mol ,B ; 5 , 5 ,C
误 根据图像 中间体 的能量高于生成物 故 的能量高于 与
; , ④ ⑥, 1molHSSOH 1molS2 1
的能量之和 项错误
molH2O ,D 。
【答案】
11. C
【解析】 温度为 时 在 内 生成量为 根据化学计量关系可
-2
403℃ , 6min SO3 4.8×10 mol,
得 消耗量为 容器体积为 则用 表示的平均反应速率为
-2 -3
O2 2.4×10 mol, 2L, O2 2×10
项正确 实验 和实验 中 生成量之比为 则 的转化
-1 -1
mol·L ·min ,A ; 1 3 ,SO3 7∶10, SO2
率之比为 项正确 升高温度 增大活化分子百分数 反应速率增大 项错误 温度
7∶10,B ; , , ,C ;
升高反应速率加快 实验 中 生成量减小的原因可能是催化剂催化活性下降使反应速
, 4 SO3
率降低 项正确
,D 。
【答案】
12. D
【解析】 该反应的平衡常数的负对数 K 随温度 T 的升高在减小 即温度升高 K 增
(-lg ) ( ) , ,
大 该反应的平衡正向移动 项正确 该反应体系恒容 温度越高 该反应正向进行的程度
, ,A ; , ,
越大 生成的气体的物质的量也越大 所以体系压强越大 故压强 P P 项正确
, , , : a< c,B ;60℃
时 点在曲线上方 浓度商小于平衡常数 反应向正反应方向进行 则 点对应状态v
,b , , , b :正 >
v 项正确 因为反应是由固体生成气体的反应 在题目条件下生成的两种气体的比例始
逆,C ; ,
高二化学参考答案 第 页(共 页)
3 6终不变 则混合气体的平均相对分子质量也始终不变 为一个恒量 不能用来判断反应是否
, , ,
达到平衡状态 项错误
,D 。
【答案】
13. A
【分析】 放电时 负极铝失去电子和氢氧根离子结合生成四羟基合铝酸根
-
, :Al-3e +
正极溶液中的氢离子在电催化剂表面获得电子成为氢原子 氢原
- -
4OH [Al OH 4] , ,
子再将吸附在电催化剂表面的 逐步还原为 正极区发生的总反应为
CO2 HCOOH, CO2+
充电时 金属铝为阴极 多孔 纳米片电极为阳极 据此解答
+ -
2H +2e HCOOH, , , Pd , 。
【解析】 放电时 负极铝失去电子和氢氧根离子结合生成四羟基合铝酸根
-
, :Al-3e +
当转移 电子时 消耗 同时双极膜会有
- - -
4OH [Al OH 4] , 3mol , 4molOH , 3mol
进入负极区 净消耗 故负极区游离的 数目会减少 项错误 氢原子
- - -
OH ,OH 1mol, OH ,A ;
将吸附在电催化剂表面的 逐步还原为 还原 为 由化合
CO2 HCOOH, 1molCO2 HCOOH,
价变化可知 得到 电子 所以理论上需要 氢原子 项正确 充电时 阳离子向
, 2mol , 2mol ,B ; ,
阴极移动 所以充电时 双极膜中的 在外电场作用下向金属铝电极方向迁移 项正确
+
, , H ,C ;
充电时 电池阴极反应式为 阳极反应式为
- - - -
, 4[Al OH 4] +12e 4Al+16OH , 12OH
总反应为
- - -
-12e 3O2↑+6H2O, 4[Al OH 4] 4Al+6H2O+4OH +3O2↑,D
项正确
。
【答案】
14. C
【解析】 该反应为气体体积减小的反应 温度相同时 增大压强 平衡正向移动 平衡转化
, , , ,
率增大 p p p 故 对应 为 项正确 由图可
, L1 > L2 > L3 , L1、L2、L3 α 60%、50%、40%,A ;
知 压强相同时 温度升高 平衡转化率减小 说明升高温度平衡逆向移动 则正反应为放热
, , , , ,
反应 项正确 M N 的进料相同 平衡转化率相等 平衡时各组分体积分数分别相等 则
,B ; 、 , , ,
M N 项错误 由于该反应为放热反应 温度越高平衡常数越小 该反应的平衡
φ
( )=φ ( ),C ; , ,
常数K M K D 项正确
( )> ( ),D 。
分 除标注下 每空 分
15.(14 , , 2 )
【答案】 催化剂 分 二 分
(1) (1 ) (1 )
+ 2- H -1
H2S(g)+2O2(g)2H (aq)+SO4 (aq) Δ =-802.7kJ·mol
(2)-1310.4 163.8
玻璃搅拌器 搅拌 使酸 碱快速完全反应
(3) , 、
将 溶液 一次性 迅速倒入内筒中
NaOH ( )
【解析】 微生物是该转化过程的催化剂 从两步反应的能量变化示意图可知 第二步的
(1) ; ,
活化能高 活化能高反应速率慢 是决速步骤 反应热为生成物与反应物的能量差值 故
, , ; ,
全部被氧化为 的热化学方程式为
2- +
1molH2S g SO4 aq H2S(g)+2O2(g)2H (aq)
2- H -1
+SO4 (aq) Δ =-802.7kJ·mol 。
根据标准生成热的定义可知 该反应的 H
(2) , Δ =(-285.8×4-50.5×2-33.1×2)
反应 中生
-1 -1
kJ·mol =-1310.4kJ·mol 。 2N2H4(l)+2NO2(g)3N2(g)+4H2O(l)
成 转移 N 个电子 放出 热量 则转移N 个电子时 放出 热
3molN2 8 A , 1310.4kJ , A , 163.8kJ
量
。
中和反应反应热的测定 需要用环形玻璃搅拌棒将酸碱混合均匀充分反应 反应时为了
(3) , ;
减少热量损失 需要迅速使酸碱混合反应 上述实验步骤中不合理的操作应为 改成 将
, , ⅲ, :
溶液一次性迅速倒入内筒中
NaOH 。
高二化学参考答案 第 页(共 页)
4 6分 除标记外每空 分
16.(15 , 2 )
K4
【答案】 低温 分 2
(1) (1 ) K
1
答对一个给 分 答错不给分
(2)A、D( 1 , )
(3)> 1
答对一个给 分 答错不给分
(4)A、B( 1 , )
恒温恒容下 充入 各组分的浓度不变 正逆反应速率不变
(5)C , He, ,
【解析】 反应 的正反应是气体体积减小的反应 即 S 已知 H 由自发进
(1) Ⅰ , Δ <0, Δ 1<0,
行的综合判据 G H T S 则反应 在低温自发进行 由 得反应
Δ =Δ - Δ <0, Ⅰ ; Ⅱ×4-Ⅰ
K4
故K 2
CH4(g)+3CO2(g)4CO(g)+2H2O(g), =K 。
1
因为是绝热容器 反应进行过程中体系温度会升高 温度不变 能说明反应达到平衡
(2)A. , , ,
状态 故 符合题意
, A ;
容器中混合气体的密度等于气体的总质量与容器总体积之比 为恒量 不能说明反应达
B. , ,
到平衡状态 故 不符合题意
, B ;
反应 生成的 与 的浓度比恒为 与 的浓度比不变 不能说明反
C. Ⅰ CH4 H2O 1∶2,CH4 H2O ,
应达到平衡状态 故 不符合题意
, C ;
平衡状态的特征是正 逆反应速率相等 不同物质表示速率之比应等于计量系数之比
D. 、 , ,
v v 能说明反应达到平衡状态 故 项符合题意
2 正(CO2)= 逆(H2O) , D 。
从图可知 升高温度v 增大倍数大于v 导致正反应速率大于逆反应速率 平衡正向移
(3) , 正 逆, ,
k
正
动 则正反应为吸热反应 故 H 由反应达到平衡时 正逆反应速率相等可得
, , Δ 2=a>0; , :k 逆
K 则由图可知温度为T 时 平衡常数K
= c, 1K , 2=1。
反应 是气体体积不变的反应 但增大压强 反应 平衡正向移动 与 浓度
(4)A. Ⅱ , , Ⅰ ,CO2 H2
减小 使反应 化学平衡逆向移动 故 错误
, Ⅱ , A ;
使用催化剂不能改变平衡常数 故 错误
B. , B ;
反应 为放热反应 反应 为吸热反应 降低温度 反应 平衡正向移动 反应 逆向移
C. Ⅰ 、 Ⅱ , , Ⅰ , Ⅱ
动 的浓度增大 故 正确
,CH4 , C ;
增大初始时 和 的体积比 转化率会增大 故 正确
D. CO2 H2 ,H2 , D 。
恒温恒容下 充入 各组分的浓度不变 反应速率不变 平衡不移动
(5) , He, , , 。
分 除标注外每空 分
17.(15 , 2 )
【答案】
- 2+ - -
(1)Fe-2e Fe O2+2H2O+4e 4OH
析氢腐蚀和吸氧腐蚀
(2)
正 分
2- -
(3) (1 ) CH4+4CO3 -8e 5CO2+2H2O
镀层金属 分 分
(4) (1 ) AgNO3(1 )
(5)33.6 c
【解析】 在酸性环境下会发生析氢腐蚀 产生氢气 会导致锥形瓶内压强增大 若
Ⅰ.(1)Fe , , ;
介质的酸性很弱或呈中性 并且有氧气参与 此时 就会发生吸氧腐蚀 吸收氧气 会导致
, , Fe , ,
锥形瓶内压强减小 整个过程中 锥形瓶中的 粉和 粉构成了原电池 粉作为原电池
; , Fe C ,Fe
的负极 发生的电极反应式为 故 时 负极电极反应式为
- 2+ -
, Fe-2e =Fe , pH=2.0 , Fe-2e
由图可知 时 锥形瓶内的溶解氧减少 说明有消耗氧气的吸氧腐蚀发
2+
Fe ; ,pH=6.0 , ,
生 同 时 锥 形 瓶 内 的 气 压 减 小 因 此 正 极 主 要 发 生 的 电 极 反 应 式 为
-
, , O2 +4e
高二化学参考答案 第 页(共 页)
5 6-
+2H2O4OH 。
若 时只发生吸氧腐蚀 那么锥形瓶内的气体压强会有下降 而图中
(2) pH=4.0 , , pH=4.0
时 锥形瓶内的压强几乎不变 说明图中反应除了吸氧腐蚀 粉还发生了析氢腐蚀 消耗
, , ,Fe ,
氧气的同时也产生了氢气 因此锥形瓶内压强几乎不变 故发生电化学腐蚀即有析氢腐蚀
, ,
又有吸氧腐蚀
。
乙装置为燃料电池 正极反应为 得到电子 由电池的电解质为熔融碳酸盐知 正
Ⅱ.(3) , O2 , ,
极反应式为 负极反应式为
- 2- 2- -
O2+2CO2+4e 2CO3 , CH4+4CO3 -8e 5CO2+
故乙装置中通入空气的电极是电池的正极 通入甲烷的电极反应式为
2-
2H2O; , CH4+4CO3
-
-8e 5CO2+2H2O。
甲装置为电解池 为阳极 为负极 现用甲装置给铜件镀银 电镀装置中 镀层金属
(4) ,A ,B 。 , ,
必须作阳极 镀件作阴极 所以 应该是镀层金属 电解液含有镀层金属阳离子 故电解液
, , A , ,
为 溶液
AgNO3 。
若甲装置中 均为石墨电极 电解液为 的 溶液 当乙装
-1
(5) A、B , 500mL4mol·L CuSO4 ,
置中消耗 甲烷 转移 电子 甲装置电解 溶液发生两阶段反应 第一阶段
12g , 6mol , CuSO4 , :
通电
转移电子 第二阶段
2CuSO4+2H2O2Cu↓+O2↑+2H2SO4,2molCuSO4 4mol, :
通电
转移 电子消耗了 水 整个过程 电极 阳极 的电
2H2O2H2↑+O2↑, 2mol 1mol 。 A ( )
极反应均为 转移 电子 产生 标准状况下的
- +
2H2O-4e O2↑+4H , 6mol , 1.5molO2,
体积为 第一阶段溶液中减少的是 和 相当于以 形式析出 同时生成
33.6L; Cu O, CuO ,
恢复溶液需补充 即可 第二阶段电解水 恢复溶液需补充 即
H2SO4, 2molCuO , , 1molH2O
可 整个过程需补充 与 的比例为 项不符合 可看作
, CuO H2O 2∶1,a、b ,Cu(OH)2
比例多了 项不符合 故选
CuO·H2O,H2O ,d , c。
分 每空 分
18.(14 , 2 )
【答案】 大于
(1) -203
温度高于 温度对反应 影响程度大于反应 或其他合理答案
(2)CO 550℃, Ⅱ Ⅲ( )
(3)90% 4.67
减小
(4)
【解析】 反应 为吸热反应 则正反应活化能大于逆反应的活化能 根据盖斯定律 反
(1) Ⅰ , ; ,
应 可 由 反 应 反 应 而 得 H
CO(g)+3H2 (g)CH4 (g)+ H2O(g) Ⅱ + Ⅲ ,Δ
-1
=-203kJ·mol 。
升高温度 反应 平衡正向移动 反应 平衡逆向移动 物质的量增大 则曲线 代
(2) , Ⅰ , Ⅱ ,CO , ②
表 温度升高 反应 逆向移动 物质的量降低 则曲线 代表 据此解答 随
CO。 , Ⅲ ,CH4 , ① CH4, 。
温度升高 反应 正向移动 反应 平衡均逆向移动 温度高于 说明温度对反应
, Ⅰ , Ⅱ、Ⅲ , 550℃,
影响程度大于反应
Ⅱ Ⅲ。
时n n n n 根据 原
(3)550℃ ,(H2)=4.8mol,(CO2)=2.1mol,(CH4)= (CO)=0.3mol, C
子守恒 可得n 根据 原子守恒 可得n 也可利用
, (C3H8O3)=0.1mol, O , (H2O)=7.2mol(
原子守恒计算 结果相同 则 的平衡转化率为 由于反应 为反应前后气
H , ), C3H8O3 90%。 Ⅱ
体分子数不变的反应 根据平衡常数K 表达式 可简单计算 K 4.8×2.1
, p , : p= =4.67。
0.3×7.2
增大压强 反应 平衡逆向移动 反应 平衡无直接影响 反应 平衡正向移动 的
(4) , Ⅰ , Ⅱ , Ⅲ ,H2
物质的量将减小
。
高二化学参考答案 第 页(共 页)
6 6