文档内容
2024-2025 学年第一学期第二次月考
高二(化学)试题
注意事项:
1. 考试时间75分钟,试卷总分100分。
2.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
3.请用2B铅笔和0.5毫米黑色墨水签字笔在答题卡上指定区域内作答。
可能用到的相对原子质量:H:1 N:14 O:16 Na:23 S:27 K:39
Fe:56
一、单项选择题(共13小题,每题3分,共39分。在每小题的四个选项中,只有一个选项
符合题目要求。)
1. “世界棉花看中国,中国棉花看新疆”。棉花的主要成分属于
A.油脂 B.糖类 C.蛋白质 D.核酸
2. CuCl 溶液中存在平衡: ,向溶液中加入氨
2
水后,溶液由绿色变为深蓝色。下列说法正确的是
A. 中含16mol σ键 B. 基态 价层电子排布式为3d8
C. 氨气的电子式为 D. 键角
3. 软钾镁矾(化学式为 )是一种重要的钾肥。下列说法正确的是
A. 电离能大小: B. 电负性大小:
C. 半径大小:r(K +) > r(Cl -) D. 碱性强弱:Mg(OH) > KOH
2
4. 实验室利用 制备 晶体,下列实验装置和操作能达到实验目的的是
A. 利用装置甲制备 B. 利用装置乙制备
C. 利用装置丙制备 溶液 D. 利用装置丁蒸发获得 晶体
5. 短周期主族元素X、Y、Z、W原子序数依次增大。基态X原子的2p轨道上有1个电子
的自旋方向与其他电子的自旋方向相反,基态Y原子M层上有两个未成对电子,基态W原
子的电子总数是其最高能级电子数的4倍。下列说法正确的是
A. 第一电离能:W>Z>Y B. 原子半径:W>Y>X
C. 最高价氧化物对应水化物的酸性:W>Z>Y D. 简单氢化物的沸点:W>Z>X
阅读下列资料,完成第6-7小题:卤族元素单质及其化合物应用广泛。常温下,测得氟化氢的相对分子质量约为37。工业用
制备TiCl 的热化学方程式为
4
。 具有
与卤素单质相似的化学性质。
6. 下列说法不正确的是
A. 中心原子的杂化方式均为sp3
B. 是由极性键构成的极性分子
C. 常温下,氟化氢可能以 分子的形式存在
D. 与熔融 反应时一定有氧元素化合价升高
7. 下列关于反应 的说法正确的是
A. 反应过程中分离出CO(g),正反应速率增大
B. 保持其他条件不变,平衡时通入Cl,达到新平衡时 变小
2
C. 加入过量的C(s),可提高Cl 的转化率
2
D. 该反应一定能自发进行
8. 硫及其化合物的转化具有重要应用。下列说法正确的是
A. 工业制硫酸过程中的物质转化:FeS SO HSO HSO
2 2 2 3 2 4
B. 钙基固硫主要反应:2CaO+O +2SO 2CaSO
2 2 4
C. 硫代硫酸钠溶液中滴加稀硫酸:NaSO+2H SO =Na SO +4SO↑+3H O
2 2 3 2 4 2 4 2 2
D. 工业尾气中的SO 处理:SO CaSO CaSO
2 2 3 4
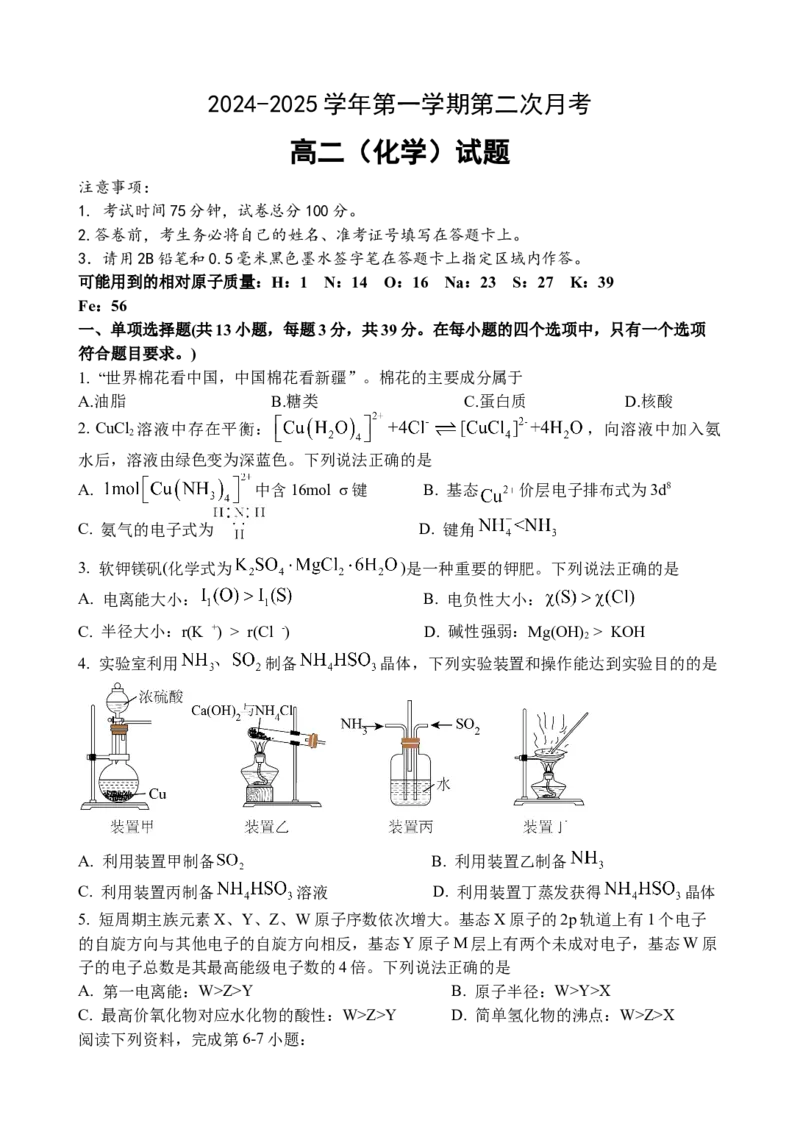
9. 每年全球报废的锂离子电池达到几百万吨以上,当前处理废旧锂离子电池迫在眉睫。一
种将正极材料 转化为 的装置如图所示。工作时甲酸盐转化为 保
持厌氧环境。已知右侧装置为原电池,电极 、 、 均不参与反应。下列说法正确的是A. 在b电极上被氧化
B. 电极反应式为
C. 装置工作时,A室溶液 逐渐增大
D. 电极反应式为
10. 根据下列实验操作和现象得出的结论正确的是
选
探究方案 探究目的
项
室温下,测定浓度均为 0.1 mol/L 的 CHCOONa、 比较室温下 CHCOOH 和
A 3 3
NH Cl溶液的pH NH ·H O的电离能力
4 3 2
向试管中加入0.5 g淀粉和4 mL 2 mol/L H SO 溶液,
2 4 淀粉水解液中存在还原性
B 加热。冷却后,向其中加入少量新制的Cu(OH) ,加
2 糖
热,观察现象
木炭在加热条件下能与浓
C 将灼热的木炭加入浓硝酸中,有红棕色气体产生
硝酸反应
用 pH 计分别测定等体积的 CHCOOH 溶液和 O-H 键的极性增强,羧酸
D 3
CHClCOOH溶液的,CHClCOOH溶液的pH小 酸性增强
2 2
A. A B. B C. C D. D
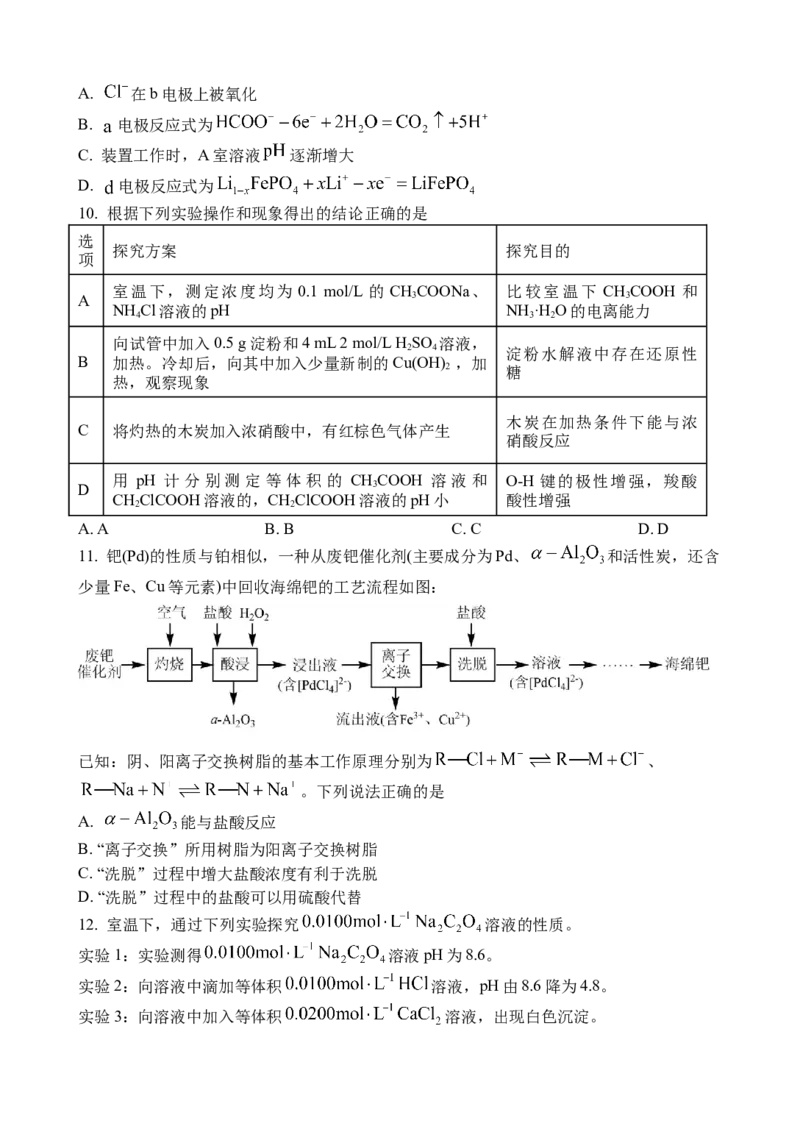
11. 钯(Pd)的性质与铂相似,一种从废钯催化剂(主要成分为Pd、 和活性炭,还含
少量Fe、Cu等元素)中回收海绵钯的工艺流程如图:
已知:阴、阳离子交换树脂的基本工作原理分别为 、
。下列说法正确的是
A. 能与盐酸反应
B. “离子交换”所用树脂为阳离子交换树脂
C. “洗脱”过程中增大盐酸浓度有利于洗脱
D. “洗脱”过程中的盐酸可以用硫酸代替
12. 室温下,通过下列实验探究 溶液的性质。
实验1:实验测得 溶液pH为8.6。
实验2:向溶液中滴加等体积 溶液,pH由8.6降为4.8。
实验3:向溶液中加入等体积 溶液,出现白色沉淀。实验4:向稀硫酸酸化的 溶液中滴加 溶液至溶液褪色。
已知室温时 ,下列说法正确的是
A. 溶液中满足:
B. 实验3所得上层清液中
C. 实验2滴加盐酸过程中不可能满足:
D. 实验4发生反应离子方程式为:
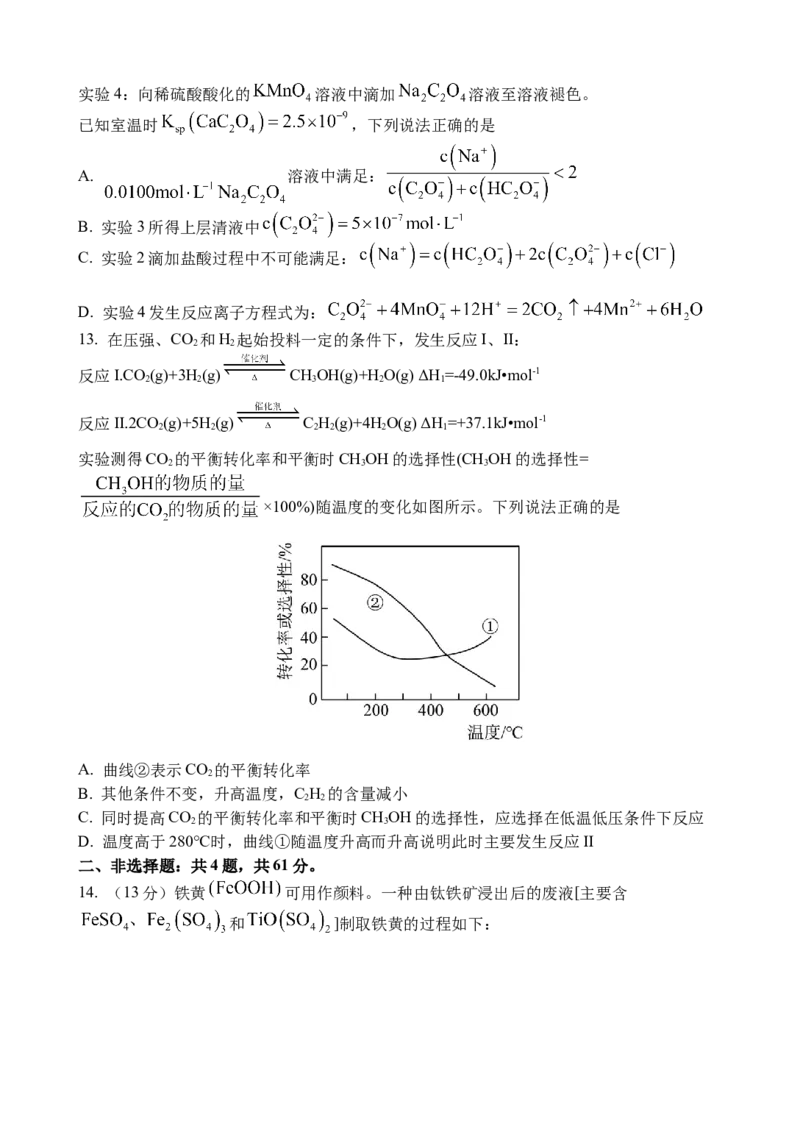
13. 在压强、CO 和H 起始投料一定的条件下,发生反应I、II:
2 2
反应I.CO (g)+3H(g) CHOH(g)+H O(g) ΔH=-49.0kJ•mol-1
2 2 3 2 1
反应II.2CO (g)+5H(g) C H(g)+4HO(g) ΔH=+37.1kJ•mol-1
2 2 2 2 2 1
实验测得CO 的平衡转化率和平衡时CHOH的选择性(CHOH的选择性=
2 3 3
×100%)随温度的变化如图所示。下列说法正确的是
A. 曲线②表示CO 的平衡转化率
2
B. 其他条件不变,升高温度,C H 的含量减小
2 2
C. 同时提高CO 的平衡转化率和平衡时CHOH的选择性,应选择在低温低压条件下反应
2 3
D. 温度高于280℃时,曲线①随温度升高而升高说明此时主要发生反应II
二、非选择题:共4题,共61分。
14. (13分)铁黄 可用作颜料。一种由钛铁矿浸出后的废液[主要含
和 ]制取铁黄的过程如下:已知:实验中 开始生成 沉淀时 开始生成 时
,完全沉淀时 。
(1) 的价电子排布式为___________。
(2)“氧化”时的离子方程式为___________。
(3)测定样品中铁黄的质量分数。
称取铁黄样品 置于 锥形瓶中,加入适量稀盐酸、加热,滴加稍过量的
溶液(将 还原为 )充分反应,再除去过量的 。移取 溶液于锥
形瓶中,用 标准溶液滴定至终点(Cr O2-+H++Fe2+→Cr3++Fe3++H O未
2 7 2
配平),消耗 溶液 。计算该样品中铁黄的质量分数___________(写出计
算过程)。
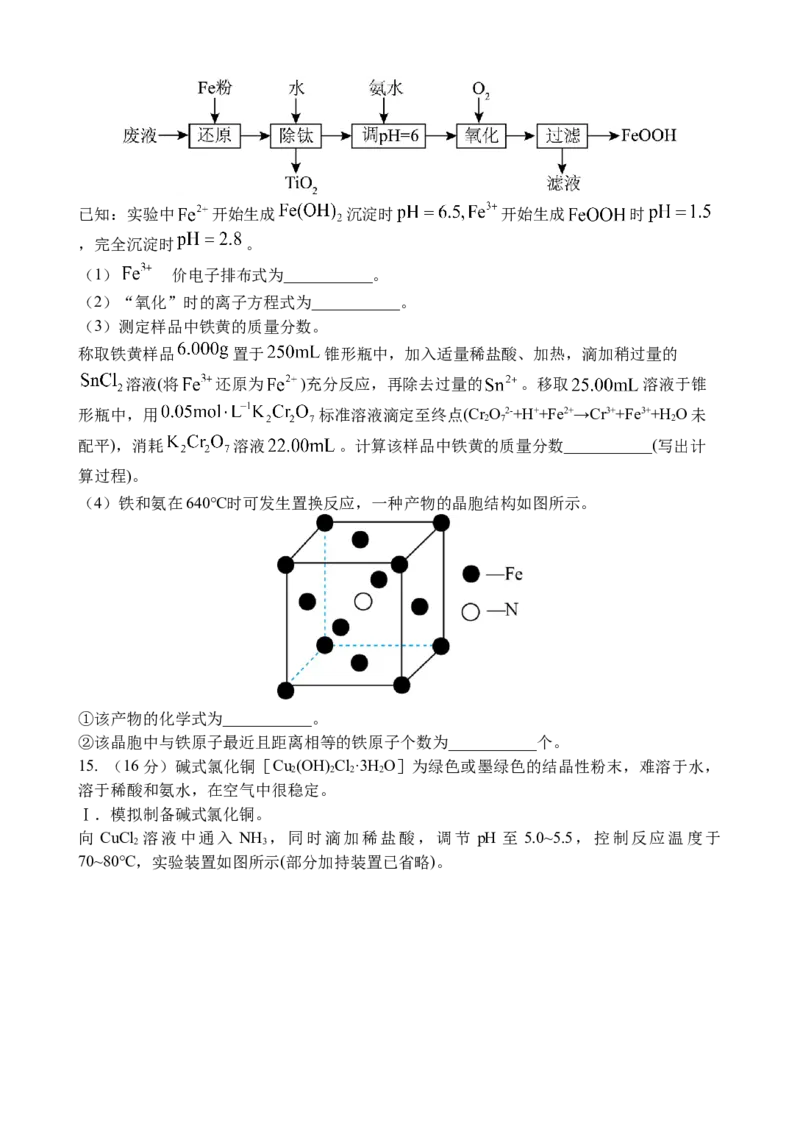
(4)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示。
①该产物的化学式为___________。
②该晶胞中与铁原子最近且距离相等的铁原子个数为___________个。
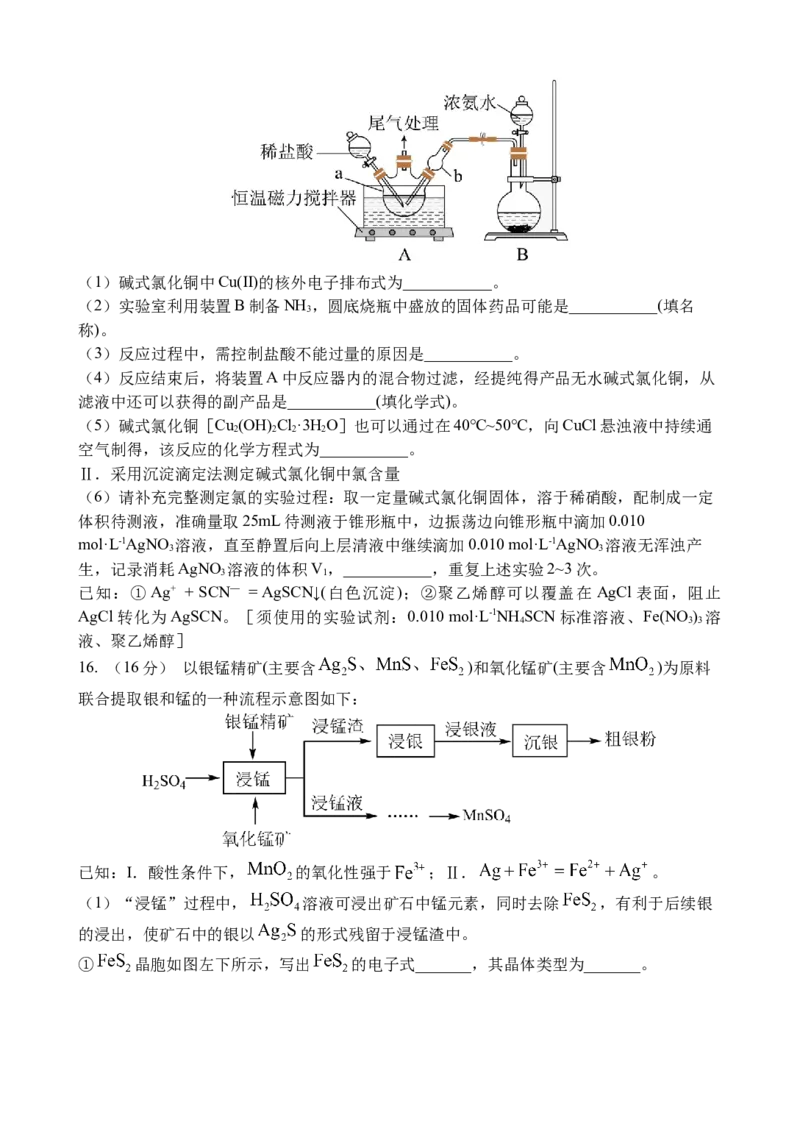
15. (16分)碱式氯化铜[Cu (OH) Cl·3H O]为绿色或墨绿色的结晶性粉末,难溶于水,
2 2 2 2
溶于稀酸和氨水,在空气中很稳定。
Ⅰ.模拟制备碱式氯化铜。
向 CuCl 溶液中通入 NH ,同时滴加稀盐酸,调节 pH 至 5.0~5.5,控制反应温度于
2 3
70~80℃,实验装置如图所示(部分加持装置已省略)。(1)碱式氯化铜中Cu(II)的核外电子排布式为___________。
(2)实验室利用装置B制备NH ,圆底烧瓶中盛放的固体药品可能是___________(填名
3
称)。
(3)反应过程中,需控制盐酸不能过量的原因是___________。
(4)反应结束后,将装置A中反应器内的混合物过滤,经提纯得产品无水碱式氯化铜,从
滤液中还可以获得的副产品是___________(填化学式)。
(5)碱式氯化铜[Cu (OH) Cl·3H O]也可以通过在40℃~50℃,向CuCl悬浊液中持续通
2 2 2 2
空气制得,该反应的化学方程式为___________。
Ⅱ.采用沉淀滴定法测定碱式氯化铜中氯含量
(6)请补充完整测定氯的实验过程:取一定量碱式氯化铜固体,溶于稀硝酸,配制成一定
体积待测液,准确量取25mL待测液于锥形瓶中,边振荡边向锥形瓶中滴加0.010
mol·L-1AgNO 溶液,直至静置后向上层清液中继续滴加0.010 mol·L-1AgNO 溶液无浑浊产
3 3
生,记录消耗AgNO 溶液的体积V,___________,重复上述实验2~3次。
3 1
已知:①Ag+ + SCN— = AgSCN↓(白色沉淀);②聚乙烯醇可以覆盖在 AgCl表面,阻止
AgCl转化为AgSCN。[须使用的实验试剂:0.010 mol·L-1NH SCN标准溶液、Fe(NO ) 溶
4 3 3
液、聚乙烯醇]
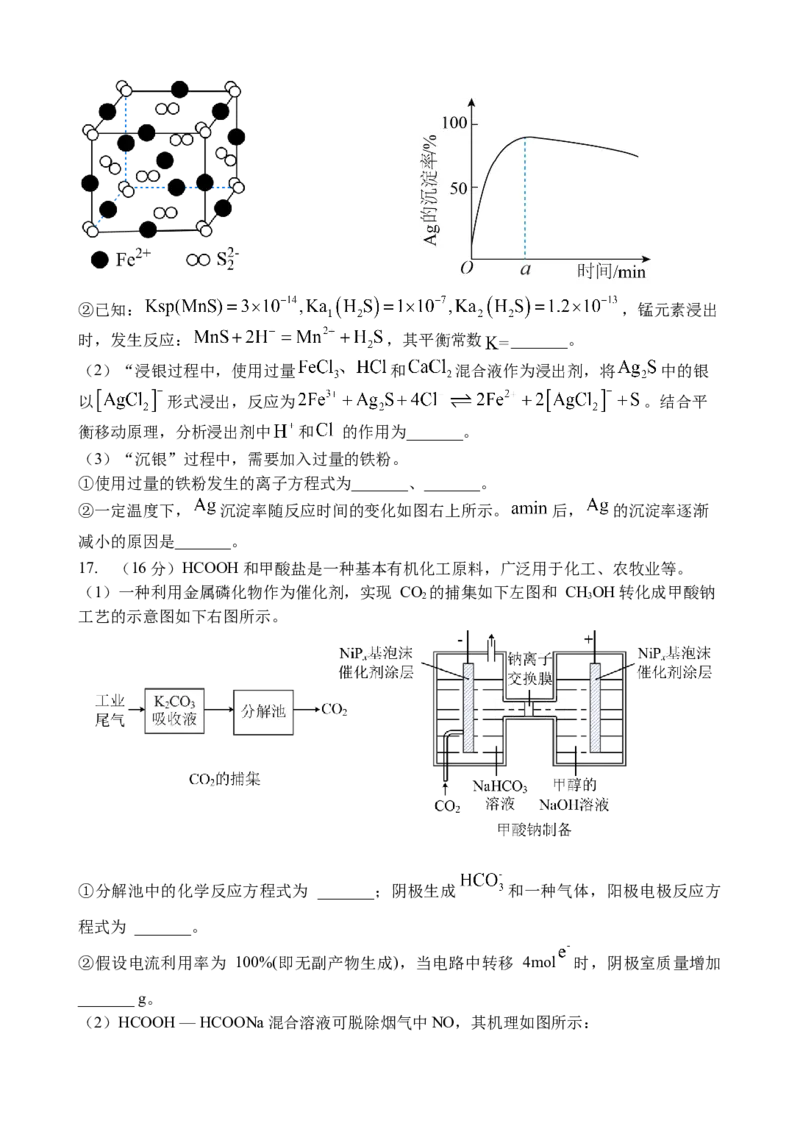
16. (16分) 以银锰精矿(主要含 )和氧化锰矿(主要含 )为原料
联合提取银和锰的一种流程示意图如下:
已知:I.酸性条件下, 的氧化性强于 ;Ⅱ. 。
(1)“浸锰”过程中, 溶液可浸出矿石中锰元素,同时去除 ,有利于后续银
的浸出,使矿石中的银以 的形式残留于浸锰渣中。
① 晶胞如图左下所示,写出 的电子式_______,其晶体类型为_______。②已知: ,锰元素浸出
时,发生反应: ,其平衡常数 _______。
(2)“浸银过程中,使用过量 和 混合液作为浸出剂,将 中的银
以 形式浸出,反应为 。结合平
衡移动原理,分析浸出剂中 和 的作用为_______。
(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉发生的离子方程式为_______、_______。
②一定温度下, 沉淀率随反应时间的变化如图右上所示。 后, 的沉淀率逐渐
减小的原因是_______。
17. (16分)HCOOH和甲酸盐是一种基本有机化工原料,广泛用于化工、农牧业等。
(1)一种利用金属磷化物作为催化剂,实现 CO 的捕集如下左图和 CHOH转化成甲酸钠
2 3
工艺的示意图如下右图所示。
①分解池中的化学反应方程式为 _______;阴极生成 和一种气体,阳极电极反应方
程式为 _______。
②假设电流利用率为 100%(即无副产物生成),当电路中转移 4mol 时,阴极室质量增加
_______ g。
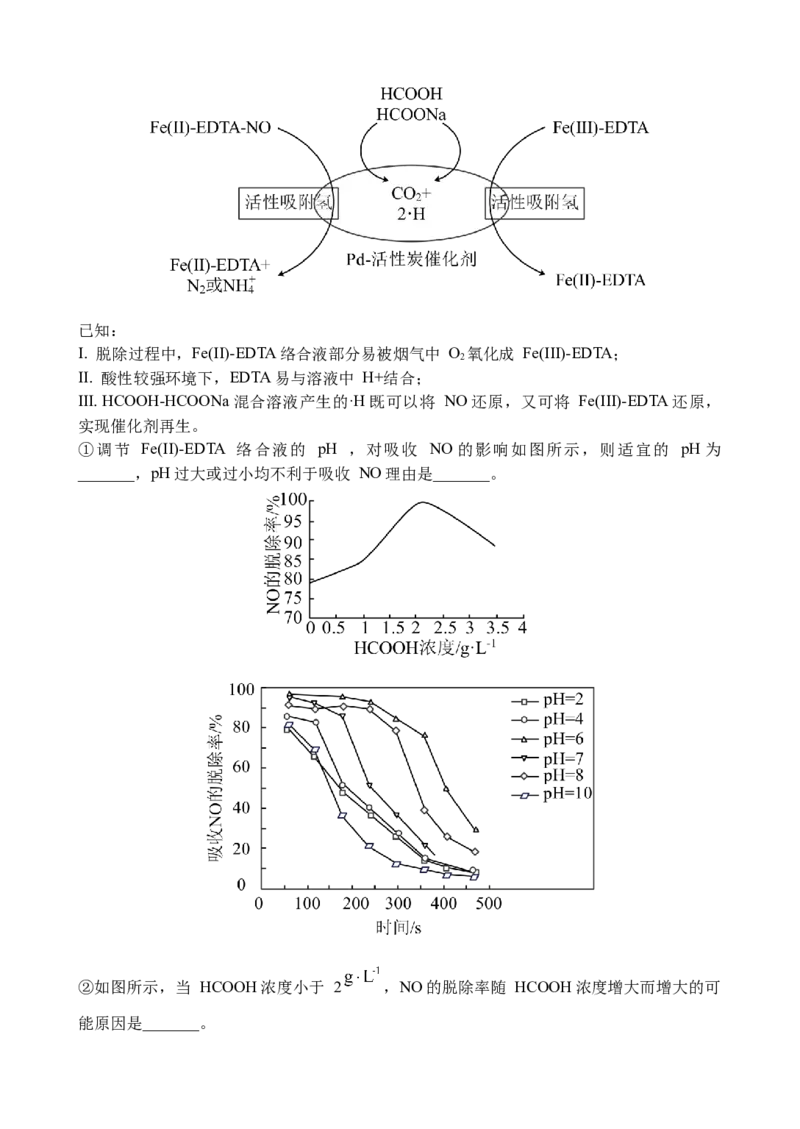
(2)HCOOH — HCOONa混合溶液可脱除烟气中NO,其机理如图所示:已知:
Ⅰ. 脱除过程中,Fe(II)-EDTA络合液部分易被烟气中 O 氧化成 Fe(III)-EDTA;
2
Ⅱ. 酸性较强环境下,EDTA易与溶液中 H+结合;
Ⅲ. HCOOH-HCOONa混合溶液产生的·H既可以将 NO还原,又可将 Fe(III)-EDTA还原,
实现催化剂再生。
①调节 Fe(II)-EDTA 络合液的 pH ,对吸收 NO 的影响如图所示,则适宜的 pH 为
_______,pH过大或过小均不利于吸收 NO理由是_______。
②如图所示,当 HCOOH浓度小于 2 ,NO的脱除率随 HCOOH浓度增大而增大的可
能原因是_______。高二(化学)答案
一、单项选择题(共13小题,每题3分,共39分。)
1 2 3 4 5 6 7 8 9 10
B A A B C B D B C A
11 12 13
C B D
二、非选择题:共4题,共61分。
14.(共计13分)
(1)3d5 (2,)
(2)4Fe2++O+6HO=4FeOOH↓+8H+ (3,)
2 2
(3)97.9% (4,)
根据方程式可知反应的关系式为 ;
n(FeOOH)=n(Fe2+)=(22 )mol=6.6 mol;该样品中铁黄的质量分数= = =97.9%;
(4)①. Fe N (2,)
4
②. 12 (2,)
15.(共计16分)
(1)[Ar]3d9 (2,)
(2)生石灰(或碱石灰或固体氢氧化钠) (2,)
(3)产品碱式氯化铜会溶于稀盐酸中,影响产率 (2,)
(4)NH Cl (2,)
4
(5)4CuCl+O +8H O 2[Cu (OH) Cl·3H O] (3,)
2 2 2 2 2 2
(6)向其中加入适量聚乙烯醇,使沉淀表面被有机物覆盖;然后加入2~3滴(或几
滴)Fe(NO ) 溶液,用0.010 mol/L NH SCN标准溶液滴定过量的AgNO,当滴入最后半滴
3 3 4 3
NH SCN标准溶液时,溶液变为红色,且30s内不变化,停止滴定,记录滴加NH SCN标准
4 4
溶液的体积V (5,)
2
16.(共计16分)
(1)①. (2,) 离子晶体 (2,)
②. (2,)
(2) 与 电离出的 结合生成 ,使平衡正向移动,提高 的浸出
率; 抑制 水解,防止生成 沉淀 (3,)
(3)①. (3,)
(2,)
②. 溶液中生成的 会被空气中的氧气缓慢氧化为 , 把部分 氧化为 ,因此 后 的沉淀率逐渐降低 (2,)
17. (共计16分)
(1)①. 2KHCO KCO+CO ↑+H O (3,)
3 2 3 2 2
②. (3,)
③. 264 (3,)
(2)①. 6 (2,)
pH过小,络合液内EDTA与溶液中H+结合,NO吸收效率降低。pH过大,生成沉
淀,NO吸收效率降低 (3,)
②. 随着HCOOH浓度增大,产生的活性吸附氢量增多,NO的脱除率增大 (2,)