文档内容
长春外国语学校 2025-2026 学年第一学期月考考试 ① 溶液中通入 气体, 减小
②常温下, 溶液中:
高二年级 化学
③ 溶液可以使石蕊溶液变红
出题人 :杨春娜 审题人:周艳杰 ④相同温度下, 溶液的导电能力比 溶液弱
本试卷共8页。考试结束后,将答题卡交回。 A.①② B.①③ C.①②④ D.②③④
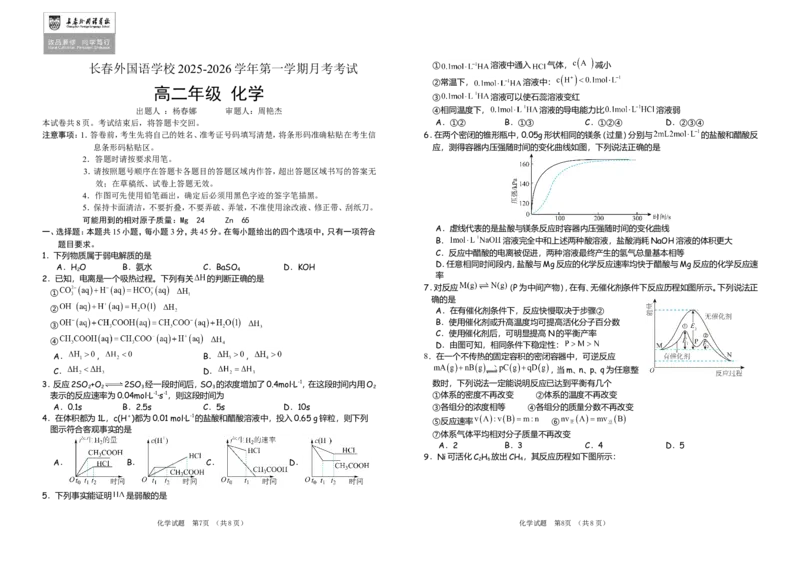
注意事项:1.答卷前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在考生信 6.在两个密闭的锥形瓶中,0.05g形状相同的镁条(过量)分别与 的盐酸和醋酸反
息条形码粘贴区。 应,测得容器内压强随时间的变化曲线如图,下列说法正确的是
2.答题时请按要求用笔。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无
效;在草稿纸、试卷上答题无效。
4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。
5.保持卡面清洁,不要折叠,不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。
可能用到的相对原子质量:Mg 24 Zn 65
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项符合
A.虚线代表的是盐酸与镁条反应时容器内压强随时间的变化曲线
题目要求。
B. 溶液完全中和上述两种酸溶液,盐酸消耗NaOH溶液的体积更大
C.反应中醋酸的电离被促进,两种溶液最终产生的氢气总量基本相等
1.下列物质属于弱电解质的是
D.任意相同时间段内,盐酸与Mg反应的化学反应速率均快于醋酸与Mg反应的化学反应速
A.H O B.氨水 C.BaSO D.KOH
2 4
率
2.已知,电离是一个吸热过程。下列有关 的判断正确的是
7.对反应 (P为中间产物),在有、无催化剂条件下反应历程如图所示。下列说法正
①
确的是
② A.在有催化剂条件下,反应快慢取决于步骤②
③
B.使用催化剂或升高温度均可提高活化分子百分数
C.使用催化剂后,可明显提高N的平衡产率
④
D.由图可知,相同条件下稳定性:
A. , B. , 8.在一个不传热的固定容积的密闭容器中,可逆反应
C. D. ,当m、n、p、q为任意整
3.反应2SO +O 2SO 经一段时间后,SO 的浓度增加了0.4mol·L-1,在这段时间内用O 数时,下列说法一定能说明反应已达到平衡有几个
2 2 3 3 2
表示的反应速率为0.04mol·L-1·s-1,则这段时间为 ①体系的密度不再改变 ②体系的温度不再改变
A.0.1s B.2.5s C.5s D.10s ③各组分的浓度相等 ④各组分的质量分数不再改变
4.在体积都为1L,c(H+)都为0.01 mol·L-1的盐酸和醋酸溶液中,投入0.65 g锌粒,则下列
⑤反应速率 ⑥
图示符合客观事实的是
⑦体系气体平均相对分子质量不再改变
A.2 B.3 C.4 D.5
9.Ni可活化C H 放出CH ,其反应历程如下图所示:
A. B. C. D. 2 6 4
5.下列事实能证明 是弱酸的是
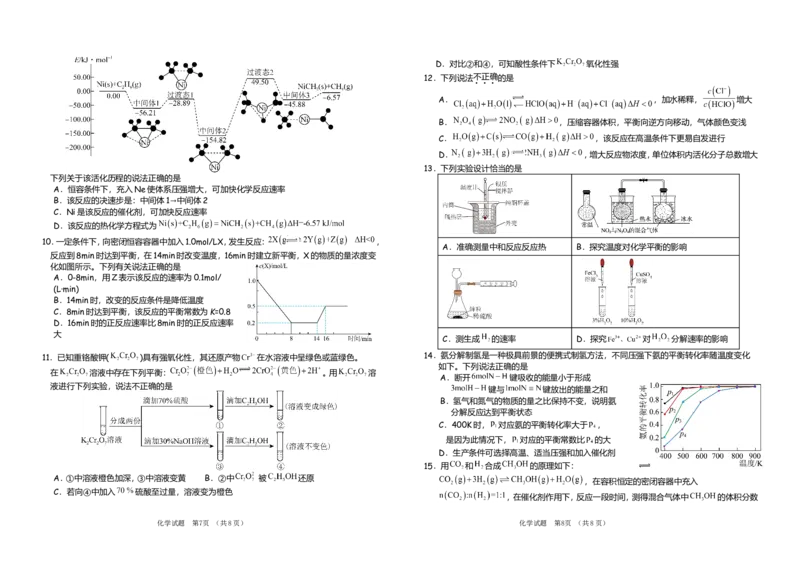
化学试题 第7页 (共8页) 化学试题 第8页 (共8页)D.对比②和④,可知酸性条件下 氧化性强
12.下列说法不正确的是
A. ,加水稀释, 增大
B. ,压缩容器体积,平衡向逆方向移动,气体颜色变浅
C. ,该反应在高温条件下更易自发进行
D. ,增大反应物浓度,单位体积内活化分子总数增大
13.下列实验设计恰当的是
下列关于该活化历程的说法正确的是
A.恒容条件下,充入Ne使体系压强增大,可加快化学反应速率
B.该反应的决速步是:中间体1→中间体2
C.Ni是该反应的催化剂,可加快反应速率
D.该反应的热化学方程式为
10.一定条件下,向密闭恒容容器中加入1.0mol/LX,发生反应: ,
A.准确测量中和反应反应热 B.探究温度对化学平衡的影响
反应到8min时达到平衡,在14min时改变温度,16min时建立新平衡,X的物质的量浓度变
化如图所示。下列有关说法正确的是
A.0-8min,用Z表示该反应的速率为0.1mol/
(L·min)
B.14min时,改变的反应条件是降低温度
C.8min时达到平衡,该反应的平衡常数为K=0.8
D.16min时的正反应速率比8min时的正反应速率
大
C.测生成 的速率 D.探究 对 分解速率的影响
11.已知重铬酸钾( )具有强氧化性,其还原产物 在水溶液中呈绿色或蓝绿色。 14.氨分解制氢是一种极具前景的便携式制氢方法,不同压强下氨的平衡转化率随温度变化
如下。下列说法正确的是
在 溶液中存在下列平衡: 。用 溶
A.断开 键吸收的能量小于形成
液进行下列实验,说法不正确的是
键与 键放出的能量之和
B.氢气和氮气的物质的量之比保持不变,说明氨
分解反应达到平衡状态
C.400K时, 对应氨的平衡转化率大于 ,
是因为此情况下, 对应的平衡常数比 的大
D.生产条件可选择高温、适当压强和加入催化剂
15.用 和 合成 的原理如下:
A.①中溶液橙色加深,③中溶液变黄 B.②中 被 还原
,在容积恒定的密闭容器中充入
C.若向④中加入 硫酸至过量,溶液变为橙色
,在催化剂作用下,反应一段时间,测得混合气体中 的体积分数
化学试题 第7页 (共8页) 化学试题 第8页 (共8页)某同学在课外资料中获悉:在锌和稀硫酸的反应中,加入硫酸铜溶液会影响反应的快慢。为此,
与温度的关系如下图所示。下列说法错误的是
A.该反应低温下可自发进行 该同学进行了探究。
B.平衡常数:
C.反应速率:
D.c点时,向容器中再充入等物质的量的 和 ,再次达到平
衡时, 的体积分数不变
二、非选择题:本题共4小题,共55分。
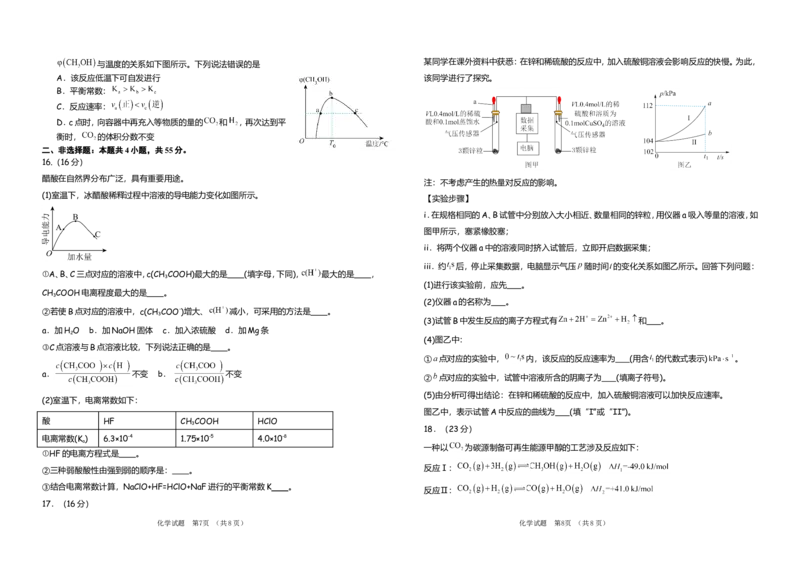
16.(16分)
醋酸在自然界分布广泛,具有重要用途。
注:不考虑产生的热量对反应的影响。
(1)室温下,冰醋酸稀释过程中溶液的导电能力变化如图所示。
【实验步骤】
i.在规格相同的A、B试管中分别放入大小相近、数量相同的锌粒,用仪器a吸入等量的溶液,如
图甲所示,塞紧橡胶塞;
ii.将两个仪器a中的溶液同时挤入试管后,立即开启数据采集;
iii.约 后,停止采集数据,电脑显示气压 随时间 的变化关系如图乙所示。回答下列问题:
①A、B、C三点对应的溶液中,c(CH COOH)最大的是 (填字母,下同), 最大的是 ,
3
(1)进行该实验前,应先 。
CH COOH电离程度最大的是 。
3
(2)仪器a的名称为 。
②若使B点对应的溶液中,c(CH COO-)增大、 减小,可采用的方法是 。
3
(3)试管B中发生反应的离子方程式有 和 。
a.加H O b.加NaOH固体 c.加入浓硫酸 d.加Mg条
2
(4)图乙中:
③C点溶液与B点溶液比较,下列说法正确的是 。
① 点对应的实验中, 内,该反应的反应速率为 (用含 的代数式表示) 。
a. 不变 b. 不变
② 点对应的实验中,试管中溶液所含的阴离子为 (填离子符号)。
(5)由分析可得出结论:在锌和稀硫酸的反应中,加入硫酸铜溶液可以加快反应速率。
(2)室温下,电离常数如下:
图乙中,表示试管A中反应的曲线为 (填“I”或“II”)。
酸 HF CH COOH HClO
3
18.(23分)
电离常数(K ) 6.3×10-4 1.75×10-5 4.0×10-8
a
一种以 为碳源制备可再生能源甲醇的工艺涉及反应如下:
①HF的电离方程式是 。
②三种弱酸酸性由强到弱的顺序是: 。 反应Ⅰ:
③结合电离常数计算,NaClO+HF=HClO+NaF进行的平衡常数K 。
反应Ⅱ:
17.(16分)
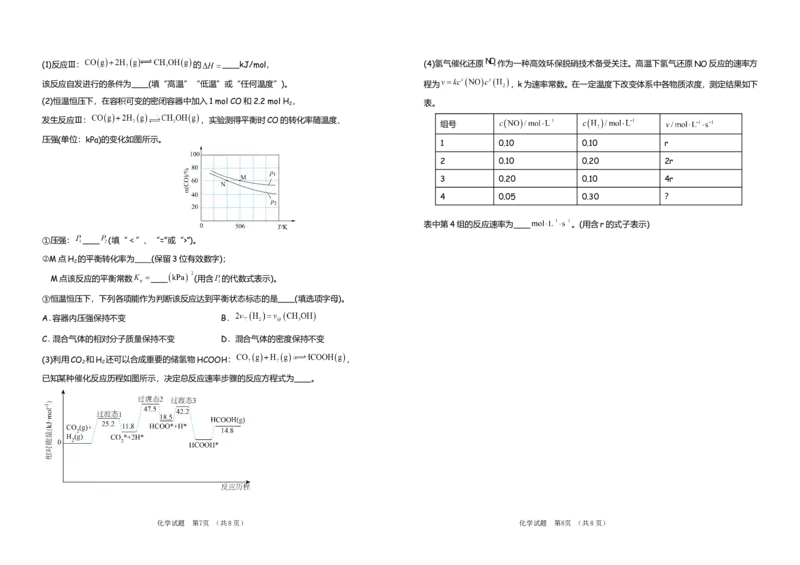
化学试题 第7页 (共8页) 化学试题 第8页 (共8页)(1)反应Ⅲ: 的 kJ/mol, (4)氢气催化还原 作为一种高效环保脱硝技术备受关注。高温下氢气还原NO反应的速率方
该反应自发进行的条件为 (填“高温”“低温”或“任何温度”)。 程为 ,k为速率常数。在一定温度下改变体系中各物质浓度,测定结果如下
(2)恒温恒压下,在容积可变的密闭容器中加入1 mol CO和2.2 mol H 2 , 表。
发生反应Ⅲ: ,实验测得平衡时CO的转化率随温度、
组号
压强(单位:kPa)的变化如图所示。
1 0.10 0.10 r
2 0.10 0.20 2r
3 0.20 0.10 4r
4 0.05 0.30 ?
表中第4组的反应速率为 。(用含r的式子表示)
①压强: (填“<”、“=”或“>”)。
②M点H 的平衡转化率为 (保留3位有效数字);
2
M点该反应的平衡常数 (用含 的代数式表示)。
③恒温恒压下,下列各项能作为判断该反应达到平衡状态标志的是 (填选项字母)。
A.容器内压强保持不变 B.
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
(3)利用CO 和H 还可以合成重要的储氢物HCOOH: ,
2 2
已知某种催化反应历程如图所示,决定总反应速率步骤的反应方程式为 。
化学试题 第7页 (共8页) 化学试题 第8页 (共8页)2025-2026 学年上学期月考考试
高二年级 化学学科参考答案
一、单项选择题
1 2 3 4 5 6 7 8
A C C A C C B B
9 10 11 12 13 14 15
D D C B B D D
二、非选择题
1.A
【详解】A.HO只有一部分发生电离,所以HO为弱电解质,故A选;
2 2
B.氨水是混合物,既不是电解质也不是非电解质,故B不选;
C.BaSO 虽然难溶于水,但溶于水的部分发生完全电离,所以BaSO 是强电解质,故C不选;
4 4
D.KOH是强电解质,故D不选;
故选:A。
2.C
【详解】A. 为 的电离,是吸热过程,①是其逆过程,可得
;②为强碱的稀溶液与强酸的稀溶液的中和反应,为放热反应, ,A错误;
B.③属于中和反应,放热,④是电离过程,吸热,则 、 ,B错误;
C.③-②得④, ,即 ,C正确;
D.③-②得④, ,即 ,D错误;
故选C。
3.C
【详解】用O 表示的反应速率为0.04mol•L-1•s-1,由速率之比等于化学计量数之比可知,
2
v(SO )=2v(O)= 0.08mol·L-1·s-1,这段时间内SO 的浓度增加了0.4mol·L-1,根据
3 2 3
0.08mol·L-1·s-1,则这段时间为5s,故选:C。
4.A
化学试题答案 第 1页【详解】醋酸是弱酸,盐酸是强酸,常温下,盐酸的浓度为0.01mol/L,而醋酸的浓度要明显大于
0.01mol/L;因此二者体积均为1L时,对于盐酸而言0.65g锌显然是过量的,因此二者在与锌反应时,
最终醋酸生成的氢气会更多;盐酸与醋酸初始c(H+)相等,由于醋酸弱电离的原因,导致其相比于盐
酸,氢离子浓度下降的更慢即c(H+)变化的更为缓慢;又因为氢离子浓度越大时,酸与金属反应生成
氢气的速率越快,因此反应开始后,醋酸生成氢气的速率要比盐酸更快;
A.通过分析可知,盐酸浓度仅为0.01mol/L,醋酸浓度明显大于0.01mol/L,体积均为1L时,二者均与
0.65g锌反应,醋酸会以更快的反应速率生成更多的氢气,故A图符合;
B.通过分析可知,由于醋酸是弱酸,溶液中存在醋酸的电离平衡,这就导致其与锌发生反应时,相比
于盐酸,氢离子浓度下降的较慢,那么pH变化的也就更为平缓,故B图不符;
C.通过分析可知,由于反应开始后盐酸中氢离子浓度下降较快,导致其氢离子浓度相比于醋酸更低,
因此在与锌反应时反应速率更低,故C图不符;
D.通过分析可知,由于醋酸溶液中存在醋酸的电离平衡,使得其氢离子浓度下降的更为缓慢,故D
图不符;
答案选A;
5.C
【详解】①通入 (强酸)导致 减小,说明 存在电离平衡(勒夏特列原理),证明HA为弱酸;
② ,说明 未完全电离,是弱酸;
③石蕊变红仅说明溶液呈酸性,无法区分强弱酸;
④导电能力弱于同浓度HCl,说明HA电离程度低,是弱酸。
综上所述①、②、④均正确,C正确;
答案选C。
6.C
【详解】A.盐酸和醋酸浓度和体积相同,因为醋酸为弱酸不完全电离,溶液中氢离子浓度小于盐酸,
与镁反应时生成气体速率较慢,故初始时压强增大的速率慢于盐酸,因此实线表示盐酸与镁条反应
时容器内压强随时间的变化曲线,A错误;
B.两种酸都是一元酸且物质的量相同,1mol/LNaOH溶液完全中和上述两种酸溶液,消耗的NaOH
溶液的体积一样大,B错误;
C.醋酸中存在电离平衡 ,电离出的H+和镁条不断反应,促进醋酸的电
离平衡正向进行,由于醋酸和盐酸的浓度体积均相同,两份溶液最终产生的氢气总量基本相等,C正
化学试题答案 第 2页确;
D.通过比较图中曲线的斜率来比较两种酸与Mg反应的速率,从图中可知,100s后的一段时间内,醋
酸曲线的斜率大于盐酸,说明此时醋酸与Mg反应的速率大于盐酸与Mg反应的速率,D错误;
故选C。
7.B
【详解】A.在有催化剂条件下,反应分两步:M→P(步骤①,活化能E)和P→N(步骤②,活化能E)。
1 2
反应快慢取决于活化能更大的慢步骤,由图可知步骤①的活化能E 大于步骤②的E,故反应快慢取
1 2
决于步骤①,A错误;
B.使用催化剂可降低活化能,使更多普通分子变为活化分子;升高温度能增加分子能量,使更多分
子达到活化能以上,二者均能提高活化分子百分数,B正确;
C.催化剂仅改变反应速率,不影响平衡移动,因此N的平衡产率不变,C错误;
D.物质能量越低越稳定,由图可知能量:P>M>N,故稳定性:N>M>P,D错误;
故选B。
8.B
【详解】①密度是否变化取决于总物质的体积和总质量的变化,固定容积体积不变,质量不变,密度为
恒值,不能用来说明反应已达到平衡,①错误;
②不传热的固定容积中,温度为变量,当体系的温度不再改变时,表明正逆反应速率相等,达到平衡
状态,②正确;
③各组分的浓度相等,无法判断各组分的浓度是否继续变化,则无法判断是否达到平衡状态,③错误;
④各组分的质量分数不再改变,表明正逆反应速率相等,该反应达到平衡状态,④正确;
⑤反应速率与化学计量数成正比,则反应速率始终满足v(A):v(B)=m:n,无法判断是否达到平衡状
态,⑤错误;
⑥表示的是正逆反应速率,且满足化学计量数关系,说明达到平衡状态,⑥正确;
⑦m、n、p、q不确定,无法判断体系气体的平均相对分子质量是否为变量,则无法判断平衡状态,⑦错
误;
故选B。
9.D
【详解】A.恒容充入稀有气体,参加反应气体浓度不变,反应速率不变,A错误;
B.决速步是活化能最大步,即能量差值最大,反应速率最慢,为中间体2→中间体3,B错误;
C.Ni参与反应并生成NiCH,是反应物不是催化剂,C错误;
2
D.由图像可知该反应的热化学方程式为 ,D正
化学试题答案 第 3页确;
故答案选D。
10.D
【详解】A.由图可知,8min时X的物质的量浓度为0.2mol/L,0-8min,用X表示该反应的速率为
=0.1 mol/(L·min),由反应速率之比等于化学计量数之比可知,用Z表示该反应的
速率为0.1 mol/(L·min) × =0.05 mol/(L·min),A错误;
B.该反应为放热反应,降低温度,平衡向正反应方向移动,X的物质的量浓度减小,由图可知,改变
温度后X的浓度增大,所以14min时,改变的反应条件不可能是降低温度,B错误;
C.由图可知,8min反应达到平衡时,X的物质的量浓度为0.2mol/L,由方程式可知,平衡时,Y、Z的
浓度分别为(1.0mol/L-0.2mol/L)= 0.8mol/L 、(1.0mol/L-0.2mol/L) × = 0.4mol/L ,则反应的平衡常数
K= =6.4,C错误;
D.该反应为放热反应,降低温度,平衡向正反应方向移动,X的物质的量浓度减小,由图可知,14min
改变条件的瞬间,X的物质的量浓度不变,后增大,说明改变的条件为升高温度或增大生成物的物质
的量浓度,升高温度或增大生成物的物质的量浓度,反应速率均加快,所以16min时的正反应速率比
8min时的正反应速率大,D正确;
故选D。
11.C
【详解】A.①在 溶液中滴加 的硫酸, 增大,
平衡逆移, 增大,溶液橙色加深;③在
溶液中滴加 的氢氧化钠溶液, , 减小,
平衡正移, 减小、 增大,溶液变黄,A
正确;
化学试题答案 第 4页B.②在酸性 溶液中滴加 , 被 氧化为 ,而 被还原为
, 减小, 增大,溶液变为绿色,B正确;
C.④是含有 的碱性溶液, 未被氧化,该溶液中滴加 硫酸至过量,溶液为酸性,
增大, 将氧化 ,本身被还原为 ,使溶液变为绿色,C错误;
D.②在酸性 溶液中滴加 ,溶液变为绿色, 氧化 ,④在碱性溶液中
滴加 ,溶液未变为绿色, 未被氧化,可以说明酸性条件下 氧化性强,D正确;
故选C。
12.B
【详解】A.加水稀释, 平衡正向移动,
平衡正向移动, 减小的程度比 的小, 增大,
A正确;
B. 是气体体积增大的反应,压缩容器体积,压强增大,平衡向逆方向移动,但
的浓度增大,气体颜色变深,B错误;
C. 是气体体积增大的反应, , , 时反应能
够自发进行,则该反应在高温条件下更易自发进行,C正确;
D.增大反应物浓度,活化分子百分数不变,单位体积内活化分子总数增大,反应速率加快,D正确;
故选B。
13.B
【详解】A.银质搅拌器、纯铜杯盖都是导热性好的材料,会使体系热量散失,导致测定的反应热的值
不准,A错误;
B.实验只设置了温度这一个变量,故可以探究温度对化学平衡的影响,B正确;
化学试题答案 第 5页C.图示装置中反应产生的气体从长颈漏斗逸出,不能测生成 的速率,C错误;
D.探究 对 分解速率的影响,需要让HO 的浓度保持相同,且 对应阴离子
2 2
种类也要相同,D错误;
故选B。
14.D
【详解】A.氨分解反应为2NH (g)⇌N (g)+3H(g),由图像知温度升高氨平衡转化率增大,说明正反应
3 2 2
吸热ΔH>0。ΔH=反应物键能总和-生成物键能总和,则断开6mol N-H键吸收的能量大于形成3mol
H-H键与1mol N≡N键放出的能量之和,故A错误;
B.该反应中N 和H 的物质的量之比始终为1:3,比值均是恒量,N 和H 的物质的量之比不变,反应
2 2 2 2
不一定平衡,故B错误;
C.平衡常数K仅与温度有关,400K时温度相同,p 和p 的K相等,故C错误;
1 4
D.正反应吸热,高温可提高转化率,减小压强平衡正向移动,催化剂加快反应速率,所以生产条件可
选择高温、适当压强和加入催化剂,故D正确;
选D。
15.D
【详解】A.由图可知, 之后随着温度的升高, 减小,即平衡逆向移动,根据勒夏特列原理
可知,该反应为放热反应,则正反应 ,由化学方程式可知 ,根据 ,可
知该反应低温自发进行,A正确;
B.平衡常数只和温度有关,该反应为放热反应,温度越高,平衡常数越小,所以 ,B正确;
C.根据图像可知a、c两点各组分的浓度分别相同,但c点的温度高于a点,所以c点的反应速率高于
a点, ,C正确;
D.c点时反应达到平衡状态,向容器中再充入等物质的量的 和 ,根据等效平衡原理,再次达
到平衡时,相当于增大体系的压强,平衡正向移动, 的体积分数变小,D错误;
故答案选:D。
16.(1) A B C bd a
化学试题答案 第 6页(2) HF>CH COOH>HClO 经计算该反应的K≈1.6×104接近于105,说明该反应正
3
反应进行的程度较大
【详解】(1)①加水量越多c(CHCOOH)越小,c(CHCOOH)最大的是A;醋酸是弱电解质,随着醋酸的
3 3
稀释,醋酸电离程度越大,根据导电能力图可知,导电能力强的点是氢离子浓度大的点,氢离子浓度
最大的是B;醋酸是弱电解质,随着醋酸的稀释,醋酸电离程度越大,根据图片知,醋酸电离程度最大
的是C点;
②a.加HO则c(CHCOO-)、c(H+)都减小;
2 3
b.加NaOH固体中和氢离子则醋酸电离平衡正向移动,c(CHCOO-)增大、c(H+)减小;
3
c.加入浓硫酸,醋酸电离平衡逆向移动,则c(CHCOO-)减小、c(H+)增大;
3
d.加Mg条消耗氢离子则醋酸电离平衡正向移动,c(CHCOO-)增大、c(H+)减小;
3
故选bd;
③a. = ,温度不变, 不变;
b. ,C点 更小,则C点的 更大;
故选a;
(2)①HF是弱酸,电离方程式是HF H+ + F-;
②电离平衡常数越大,酸性越强,则三种弱酸酸性由强到弱的顺序是:HF>CH COOH>HClO;
3
③该反应NaClO + HF = HClO + NaF的平衡常数为:
,可知该反应进行的
程度较大。
17.(1)检查装置气密性
(2)胶头滴管
(3)
(4) 和
(5) II
【详解】(1)本实验中锌和稀硫酸的反应有气体生成,对于有气体参与的反应在进行实验前应先检查
化学试题答案 第 7页装置气密性;
(2)仪器a的名称为:胶头滴管,常用于吸取和滴加少量液体;
(3)试管B中锌会先和硫酸铜发生置换反应,发生反应的离子方程式为: ,之后
锌再与稀硫酸反应,反应离子方程式为: ;
(4)①反应速率可以用单位时间内气压的变化量来表示。0~ts内,气压从104 kPa变为112kPa,变化
1
量为112 kPa -104 kPa =8 kPa,所以反应速率为 ;
②试管B中发生了锌与硫酸铜、锌与稀硫酸的反应,它们的阴离子都是 ,溶液中水也会电离出少
量的OH-,所以反应后溶液中的阴离子为 、OH-;
(5)①试管A中没有加入硫酸铜溶液,反应速率比试管B慢,气压上升慢,所以表示试管A中反应的
曲线为 Ⅱ;
18.(1) -90.0 低温
(2) > 54.5% CD
(3)CO ⁕+H⁕=HCOO⁕或CO⁕+2H⁕=HCOO⁕+H⁕
2 2
(4)0.75r
【详解】(1)由盖斯定律可知,反应Ⅰ-反应Ⅱ =反应Ⅲ,则反应ΔH=(- 49.0kJ/mol) - (+ 41.0kJ/mol)
=-90.0kJ/mol;该反应是熵减的放热反应,低温条件下反应ΔH—TΔS<0,能自发进行;
(2)①该反应为气体体积减小的反应,增大压强,平衡向正反应方向移动,一氧化碳的转化率增大,
由图可知,温度一定是=时p 条件下一氧化碳转化率大于p 条件下一氧化碳转化率,则压强p 大于
1 2 1
p;
2
②由图可知,M点一氧化碳的转化率为60%,则由方程式可知,平衡时一氧化碳、氢气、甲醇的物质
的量为1 mol-1 mol×60%=0.4mol、2.2mol-1 mol×60%×2=1mol、1 mol×60%=0.64mol,则氢气的转化率
为 ×100%≈54.5%,平衡常数K = = ;
p
化学试题答案 第 8页③A.恒温恒压下,容器内压强始终不变,则容器内压强保持不变不能说明正逆反应速率相等,无法判
断反应是否达到平衡,故错误;
B.由反应速率之比等于化学计量数之比可知, 不能说明正逆反应速率相等,
无法判断反应是否达到平衡,故错误;
C.由质量守恒定律可知,反应前后气体的质量相等,该反应是气体体积减小的反应,反应中混合气
体的相对分子质量增大,则相对分子质量保持不变说明正逆反应速率相等,反应已达到平衡,故正确;
D.由质量守恒定律可知,反应前后气体的质量相等,该反应是气体体积减小的反应,恒温恒压下反
应中容器体积减小,混合气体的密度增大,则混合气体的密度保持不变说明正逆反应速率相等,反应
已达到平衡,故正确;
故选CD;
(3)反应的活化能越大,反应速率越慢,慢反应是反应的决速步,由图可知,反应
CO⁕+2H⁕=HCOO⁕+H⁕的活化能最大,反应速率最慢,则决定总反应速率步骤的反应方程式为
2
CO⁕+H⁕=HCOO⁕或CO⁕+2H⁕=HCOO⁕+H⁕;
2 2
(4)由第1组和第3组实验可得: = =( )x,解得x=2;由第1组和第3组实验可得: = =(
)y,解得y=1;由第1组实验可得:速率常数k= =103r,则第4组实验的反应速率为
(103r×0.052×0.3) =0.75r 。
化学试题答案 第 9页