文档内容
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案字母涂黑,如需改
动,用橡皮擦干净后,再选涂其他答案字母。回答非选择题时,将答案写在答题卡上,写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
考试时间为75分钟,满分100分
可能用到的相对原子质量:H:1 Li:7 C:12 N:14 O:16 Cl:35.5 Fe:56
Cu:64 Zn:65
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1. 下列说法错误的是
A. 需要加热才能发生的反应可能是吸热反应,也可能是放热反应
B. 已知4P(红磷,s) (白磷,s) ,则红磷比白磷稳定
C. “冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量低
D. 盐酸与碳酸氢钠的反应属于放热反应
2. 在25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的摩尔燃烧焓依次是393.5 kJ/mol、285.8 kJ/mol、890.3
kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是
A. C(s)+ O(g)=CO(g) ΔH=-393.5 kJ/mol
2
B. CH(g)+2O(g)=CO (g)+2HO(l) ΔH=-890.3 kJ/mol
4 2 2 2
C. 2H(g)+O(g)=2HO(l) ΔH=+571.6 kJ/mol
2 2 2
D. C H O(s)+3O(g)=3CO (g)+3HO(g) ΔH=-1 400 kJ/mol
6 12 6 2 2 2
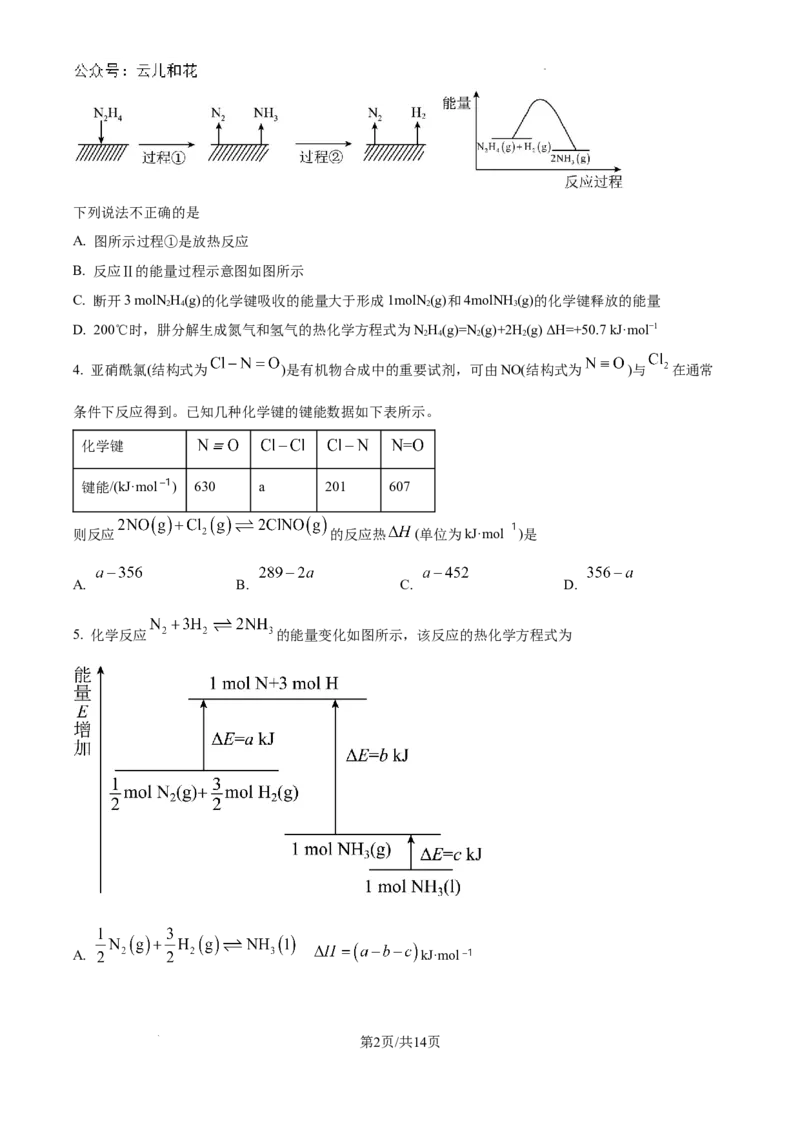
3. 肼(N H)在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图。已知200℃时:反应Ⅰ:
2 4
3NH(g)=N(g)+4NH (g) ΔH =−32.9 kJ·mol−1;反应Ⅱ:NH(g)+H(g)=2NH (g) ΔH =−41.8kJ·mol−1
2 4 2 3 1 2 4 2 3 2
第1页/共14页
学科网(北京)股份有限公司下列说法不正确的是
A. 图所示过程①是放热反应
B. 反应Ⅱ的能量过程示意图如图所示
C. 断开3 molNH(g)的化学键吸收的能量大于形成1molN (g)和4molNH (g)的化学键释放的能量
2 4 2 3
D. 200℃时,肼分解生成氮气和氢气的热化学方程式为NH(g)=N(g)+2H(g) ΔH=+50.7 kJ·mol−1
2 4 2 2
4. 亚硝酰氯(结构式为 )是有机物合成中的重要试剂,可由NO(结构式为 )与 在通常
条件下反应得到。已知几种化学键的键能数据如下表所示。
化学键
键能/(kJ·mol ) 630 a 201 607
则反应 的反应热 (单位为kJ·mol )是
A. B. C. D.
5. 化学反应 的能量变化如图所示,该反应的热化学方程式为
A. kJ·mol
第2页/共14页
学科网(北京)股份有限公司B. kJ·mol
C. kJ·mol
D. kJ·mol
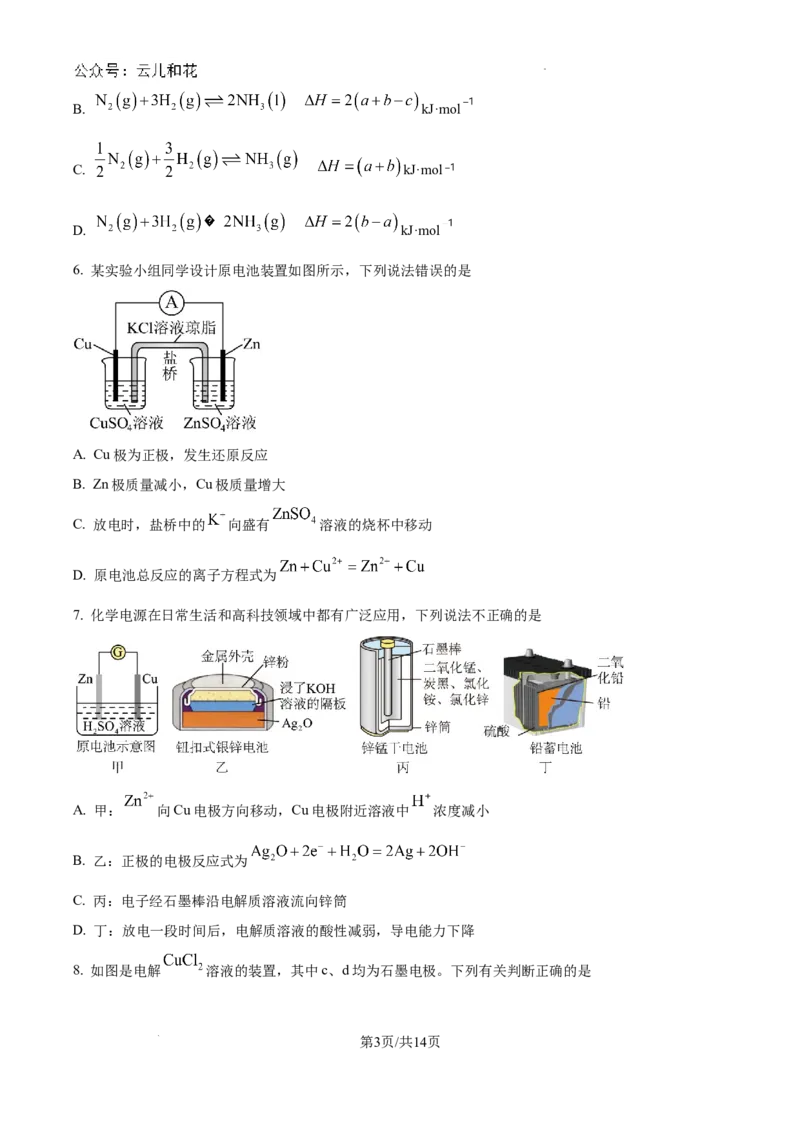
6. 某实验小组同学设计原电池装置如图所示,下列说法错误的是
A. Cu极为正极,发生还原反应
B. Zn极质量减小,Cu极质量增大
C. 放电时,盐桥中的 向盛有 溶液的烧杯中移动
D. 原电池总反应的离子方程式为
7. 化学电源在日常生活和高科技领域中都有广泛应用,下列说法不正确的是
A. 甲: 向Cu电极方向移动,Cu电极附近溶液中 浓度减小
B. 乙:正极的电极反应式为
C. 丙:电子经石墨棒沿电解质溶液流向锌筒
D. 丁:放电一段时间后,电解质溶液的酸性减弱,导电能力下降
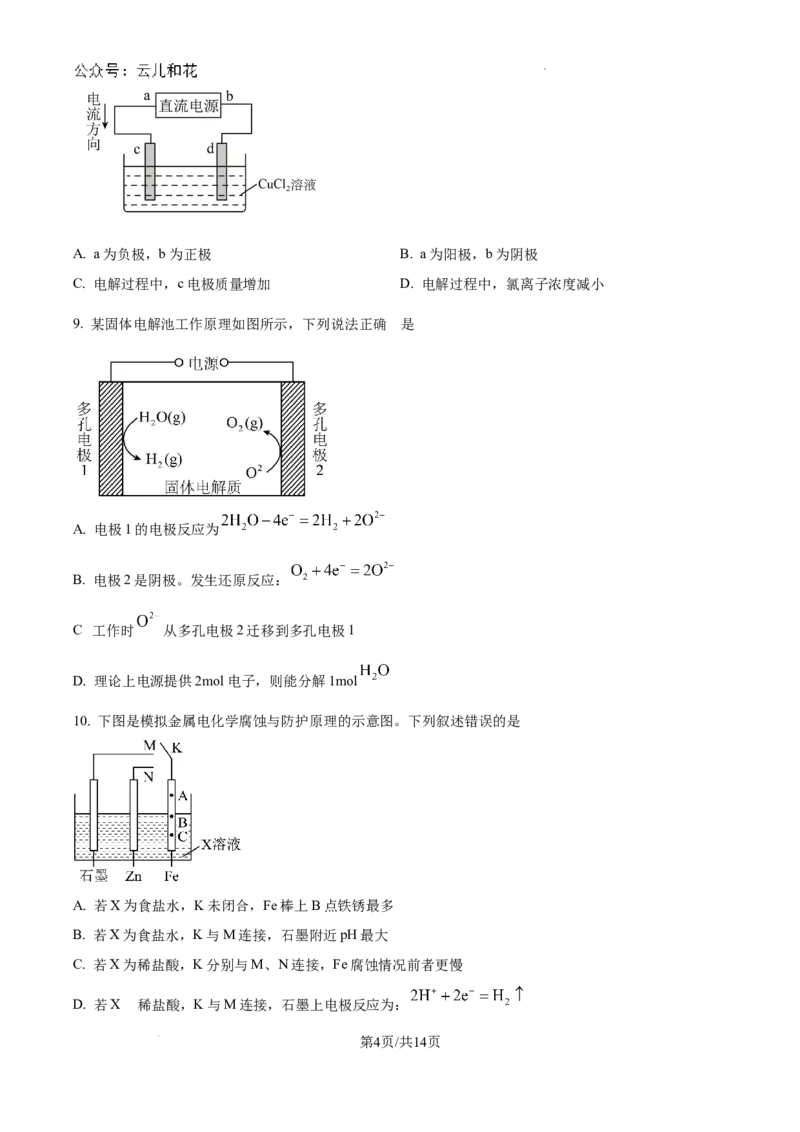
8. 如图是电解 溶液的装置,其中c、d均为石墨电极。下列有关判断正确的是
第3页/共14页
学科网(北京)股份有限公司A. a为负极,b为正极 B. a为阳极,b为阴极
C. 电解过程中,c电极质量增加 D. 电解过程中,氯离子浓度减小
的
9. 某固体电解池工作原理如图所示,下列说法正确 是
A. 电极1的电极反应为
B. 电极2是阴极。发生还原反应:
.
C 工作时 从多孔电极2迁移到多孔电极1
D. 理论上电源提供2mol电子,则能分解1mol
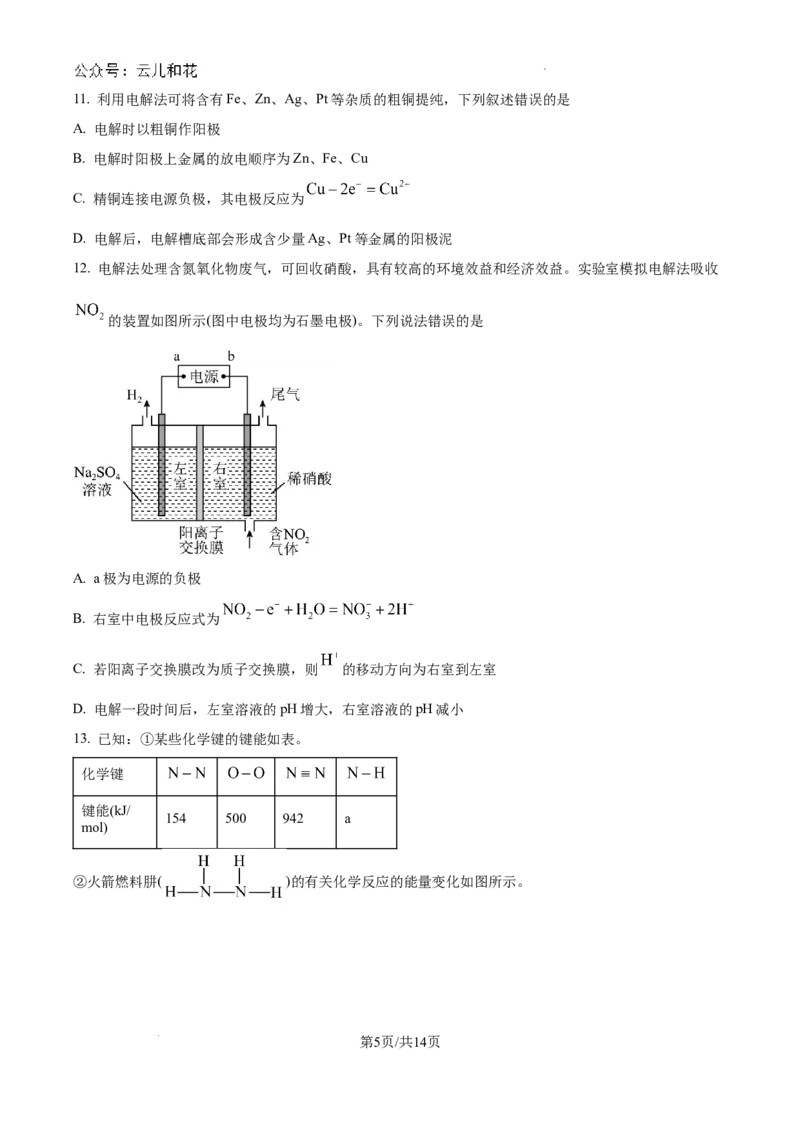
10. 下图是模拟金属电化学腐蚀与防护原理的示意图。下列叙述错误的是
A. 若X为食盐水,K未闭合,Fe棒上B点铁锈最多
B. 若X为食盐水,K与M连接,石墨附近pH最大
C. 若X为稀盐酸,K分别与M、N连接,Fe腐蚀情况前者更慢
为
D. 若X 稀盐酸,K与M连接,石墨上电极反应为:
第4页/共14页
学科网(北京)股份有限公司11. 利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述错误的是
A. 电解时以粗铜作阳极
B. 电解时阳极上金属的放电顺序为Zn、Fe、Cu
C. 精铜连接电源负极,其电极反应为
D. 电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
12. 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收
的装置如图所示(图中电极均为石墨电极)。下列说法错误的是
A. a极为电源的负极
B. 右室中电极反应式为
C. 若阳离子交换膜改为质子交换膜,则 的移动方向为右室到左室
D. 电解一段时间后,左室溶液的pH增大,右室溶液的pH减小
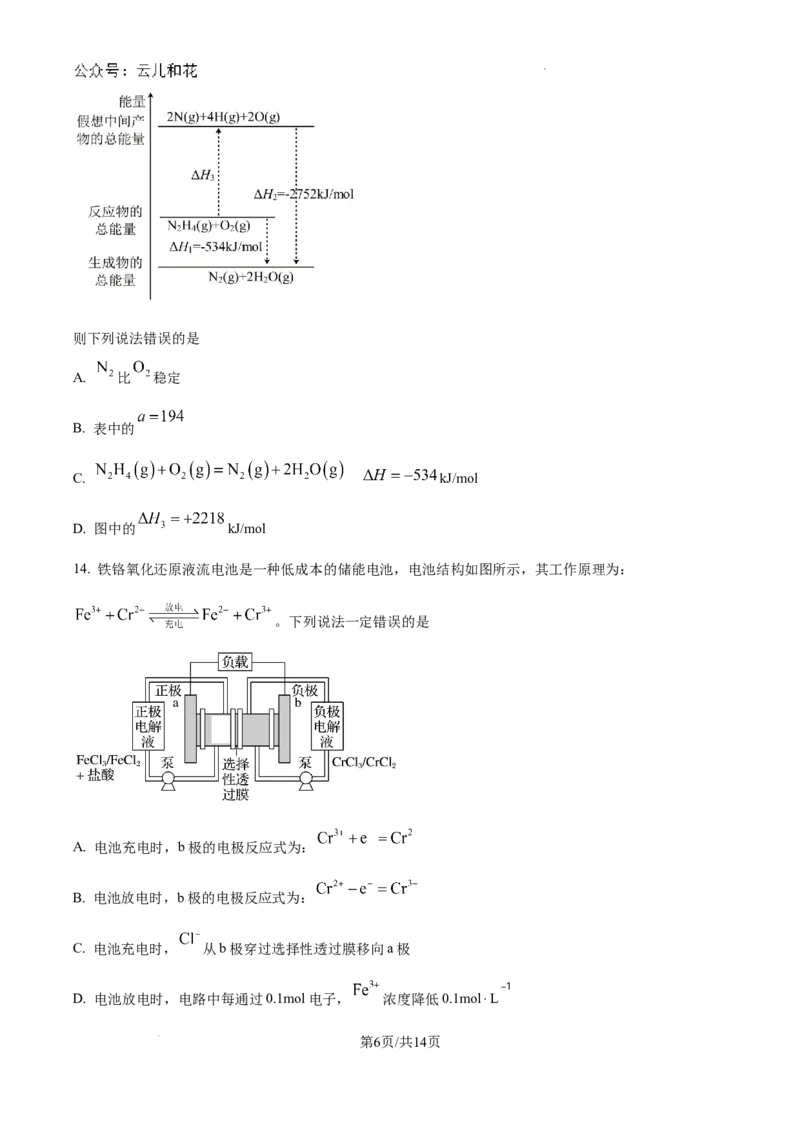
13. 已知:①某些化学键的键能如表。
化学键
键能(kJ/
154 500 942 a
mol)
②火箭燃料肼( )的有关化学反应的能量变化如图所示。
第5页/共14页
学科网(北京)股份有限公司则下列说法错误的是
A. 比 稳定
B. 表中的
C. kJ/mol
D. 图中的 kJ/mol
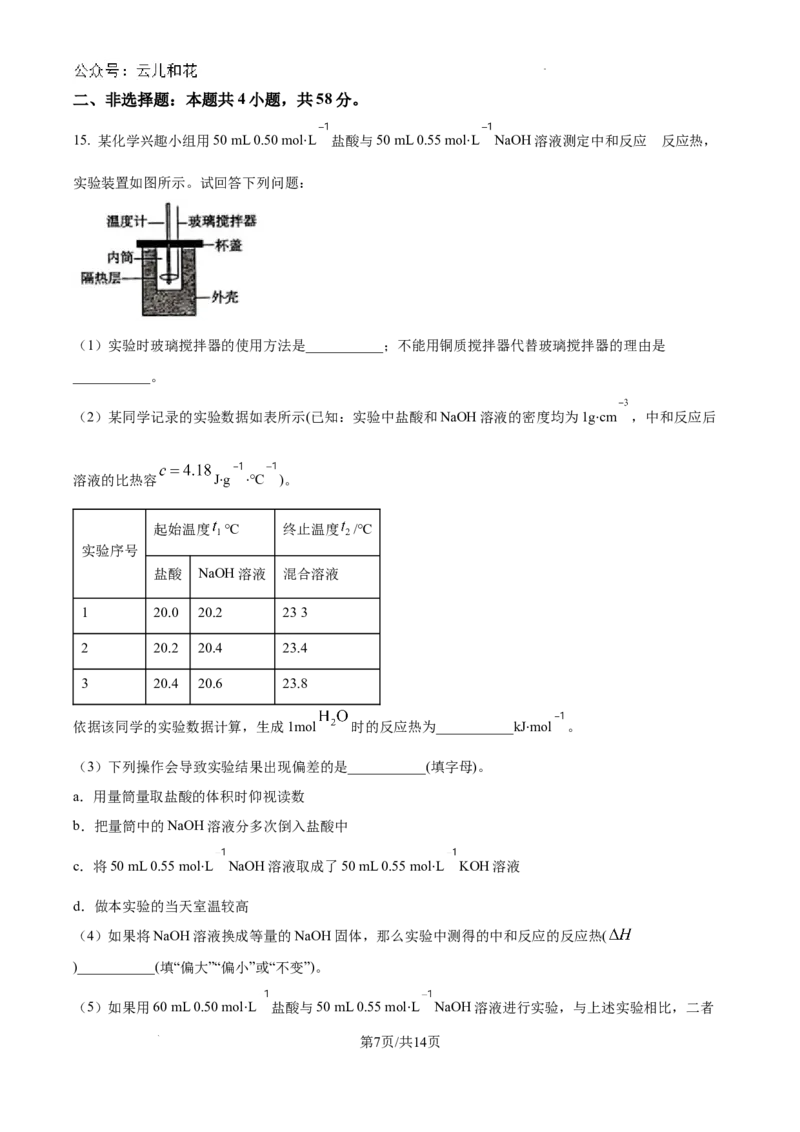
14. 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,其工作原理为:
。下列说法一定错误的是
A. 电池充电时,b极的电极反应式为:
B. 电池放电时,b极的电极反应式为:
C. 电池充电时, 从b极穿过选择性透过膜移向a极
D. 电池放电时,电路中每通过0.1mol电子, 浓度降低0.1mol⋅L
第6页/共14页
学科网(北京)股份有限公司二、非选择题:本题共4小题,共58分。
的
15. 某化学兴趣小组用50 mL 0.50 molL 盐酸与50 mL 0.55 molL NaOH溶液测定中和反应 反应热,
⋅ ⋅
实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是___________;不能用铜质搅拌器代替玻璃搅拌器的理由是
___________。
(2)某同学记录的实验数据如表所示(已知:实验中盐酸和NaOH溶液的密度均为1gcm ,中和反应后
⋅
溶液的比热容 Jg ℃ )。
⋅ ⋅
起始温度 ℃ 终止温度 /℃
实验序号
盐酸 NaOH溶液 混合溶液
.
1 20.0 20.2 233
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,生成1mol 时的反应热为___________kJmol 。
⋅
(3)下列操作会导致实验结果出现偏差的是___________(填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的NaOH溶液分多次倒入盐酸中
c.将50 mL 0.55 molL NaOH溶液取成了50 mL 0.55 molL KOH溶液
⋅ ⋅
d.做本实验的当天室温较高
(4)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应的反应热(
)___________(填“偏大”“偏小”或“不变”)。
(5)如果用60 mL 0.50 molL 盐酸与50 mL 0.55 molL NaOH溶液进行实验,与上述实验相比,二者
⋅ 第7页/共⋅14页
学科网(北京)股份有限公司所放出的热量___________(填“相等”或“不相等”,下同),所求的中和反应的反应热( )___________。
16. 将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应
为: 。 , 和 完全燃烧的热化学方程式分别为:
① kJ⋅mol
② kJ⋅mol
③ kJ⋅mol
(1)请根据以上数据,写出 与水蒸气反应生成CO和 的热化学方程式:___________。
(2)比较反应热数据可知,1mol 和1mol 完全燃烧放出的热量之和,比1mol 完全燃
烧放出的热量___________(填“多”或“少”)。
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量。”
乙同学根据盖斯定律作出了下列循环图:
①请写出 , , , 之间存在的关系式:___________。
②乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,与直接燃烧煤放出的热量相同。”请分析:甲、
乙两同学的观点正确的是___________(填“甲”或“乙”)同学,另一同学出现错误观点的原因是___________。
(3)研究 的利用对促进低碳社会的构建具有重要意义。工业上利用废气中的 合成 ,主
要有以下反应:
反应Ⅰ: kJ·mol
反应Ⅱ:
第8页/共14页
学科网(北京)股份有限公司反应Ⅲ: kJ·mol
已知某些化学键的键能数据如下表。
化学键
键能/(kJ·mol ) 750 343 465
氢气中的 键比甲醇中的 键___________(填“强”或“弱”)。用盖斯定律计算反应Ⅱ中的
___________kJ·mol 。
17. 通常氢氧燃料电池有酸性和碱性两种,试回答下列问题:
(1)写出在酸性介质中,酸性电池的电极反应负极:___________,正极:___________。工作过程中,
电解质溶液中的 会___________(填“变大”“变小”或“不变”)。
(2)写出在碱性介质中,碱性电池的电极反应负极:___________,正极:___________。工作过程中,
电解质溶液中的 会___________(填“变大”“变小”或“不变”)。
(3)一种高效耐用的新型可充电电池,该电池的总反应式为:
①该电池放电时负极反应式为___________。
②放电时每转移3mol电子,则正极有___________mol 被还原。
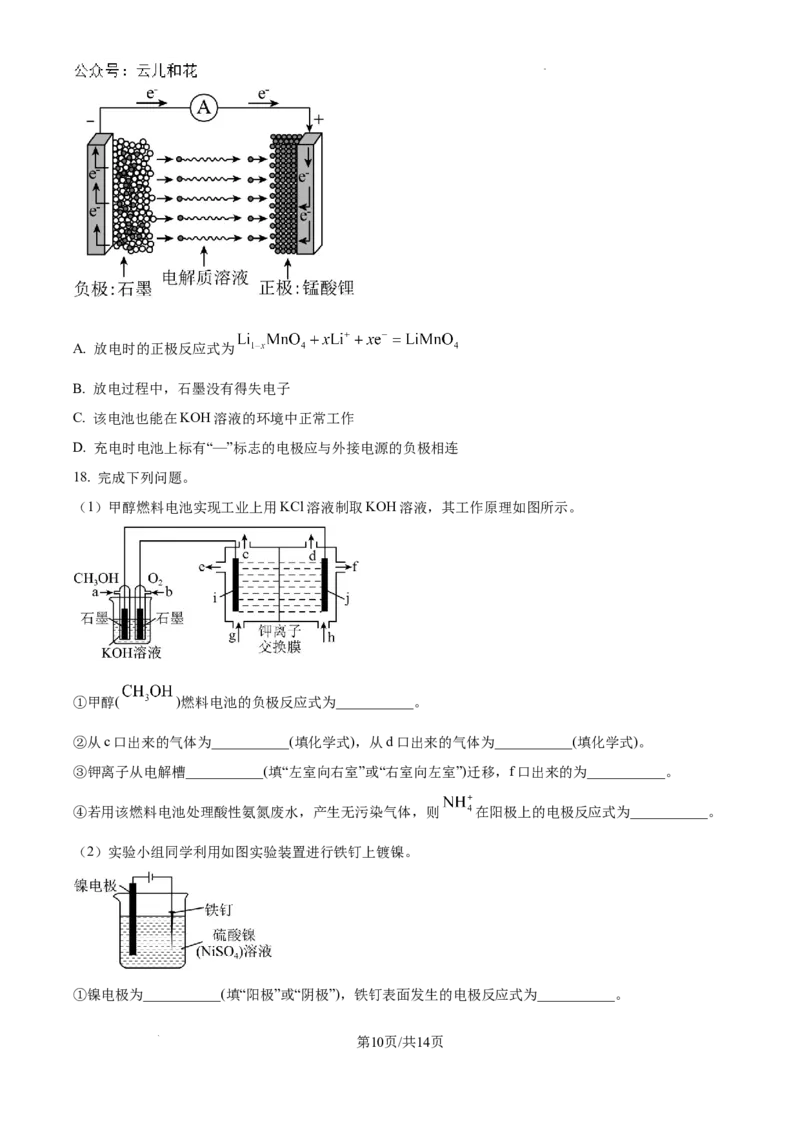
(4)锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。电池工作原理如图所示,电池
反应式为: ,下列说法不正确的是___________(填字母)。
第9页/共14页
学科网(北京)股份有限公司A. 放电时的正极反应式为
B. 放电过程中,石墨没有得失电子
C. 该电池也能在KOH溶液的环境中正常工作
D. 充电时电池上标有“—”标志的电极应与外接电源的负极相连
18. 完成下列问题。
(1)甲醇燃料电池实现工业上用KCl溶液制取KOH溶液,其工作原理如图所示。
①甲醇( )燃料电池的负极反应式为___________。
②从c口出来的气体为___________(填化学式),从d口出来的气体为___________(填化学式)。
③钾离子从电解槽___________(填“左室向右室”或“右室向左室”)迁移,f口出来的为___________。
④若用该燃料电池处理酸性氨氮废水,产生无污染气体,则 在阳极上的电极反应式为___________。
(2)实验小组同学利用如图实验装置进行铁钉上镀镍。
①镍电极为___________(填“阳极”或“阴极”),铁钉表面发生的电极反应式为___________。
第10页/共14页
学科网(北京)股份有限公司②溶液中镍离子的浓度___________(填“增大”“减小”或“基本不变”)。
(3)下列事实中,属于电化学腐蚀的是___________(填序号)。
①金属钠置于空气中表面变暗;②银牌在室内长时间摆放则颜色变暗;③生铁比软铁芯(几乎是纯铁)容易
生锈;④铁制器件附有铜制配件,在接触处易生铁锈;⑤黄铜(铜锌合金)制作的铜锣不易产生铜绿
第11页/共14页
学科网(北京)股份有限公司化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案字母涂黑,如需改
动,用橡皮擦干净后,再选涂其他答案字母。回答非选择题时,将答案写在答题卡上,写在
本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
考试时间为75分钟,满分100分
可能用到的相对原子质量:H:1 Li:7 C:12 N:14 O:16 Cl:35.5 Fe:56
Cu:64 Zn:65
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】D
【2题答案】
【答案】B
【3题答案】
【答案】C
【4题答案】
【答案】A
【5题答案】
【答案】A
【6题答案】
【答案】C
【7题答案】
【答案】C
【8题答案】
【答案】D
【9题答案】
【答案】D
【10题答案】
第12页/共14页
学科网(北京)股份有限公司【答案】C
【11题答案】
【答案】C
【12题答案】
【答案】D
【13题答案】
【答案】B
【14题答案】
【答案】D
二、非选择题:本题共4小题,共58分。
【15题答案】
【答案】(1) ①. 上下匀速搅动 ②. 金属铜是热的良导体,传热快,热量损失大
(2)-53.504 (3)ab
(4)偏小 (5) ①. 不相等 ②. 相等
【16题答案】
【答案】(1) kJ⋅mol
(2) ①. 多 ②. ③. 乙 ④. 甲同学忽略了煤转化为水煤气要吸
收热量
(3) ①. 强 ②. -121.4
【17题答案】
【答案】(1) ①. ②. ③. 变小
(2) ①. ②. ③. 变小
(3) ①. ②. 1 (4)C
【18题答案】
【答案】(1) ①. ②. ③. ④. 左室向右室
⑤. 高浓度KOH溶液 ⑥.
第13页/共14页
学科网(北京)股份有限公司(2) ①. 阳极 ②. ③. 基本不变
(3)③④⑤
第14页/共14页
学科网(北京)股份有限公司