文档内容
2024-2025 学年上期高二年级期中联考试题
化学学科
考试时间: 75分钟 分值: 100分
注意事项:本试卷分试题卷和答题卡两部分。考生应首先阅读试题卷上的文字信息,然后在
答题卡上作答(答题注意事项见答题卡) 。在试题卷上作答无效。
可能用到的相对原子质量:H:1 B:11 C:12 O:16 S:32 Pb:207
第Ⅰ卷
一、选择题(共16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
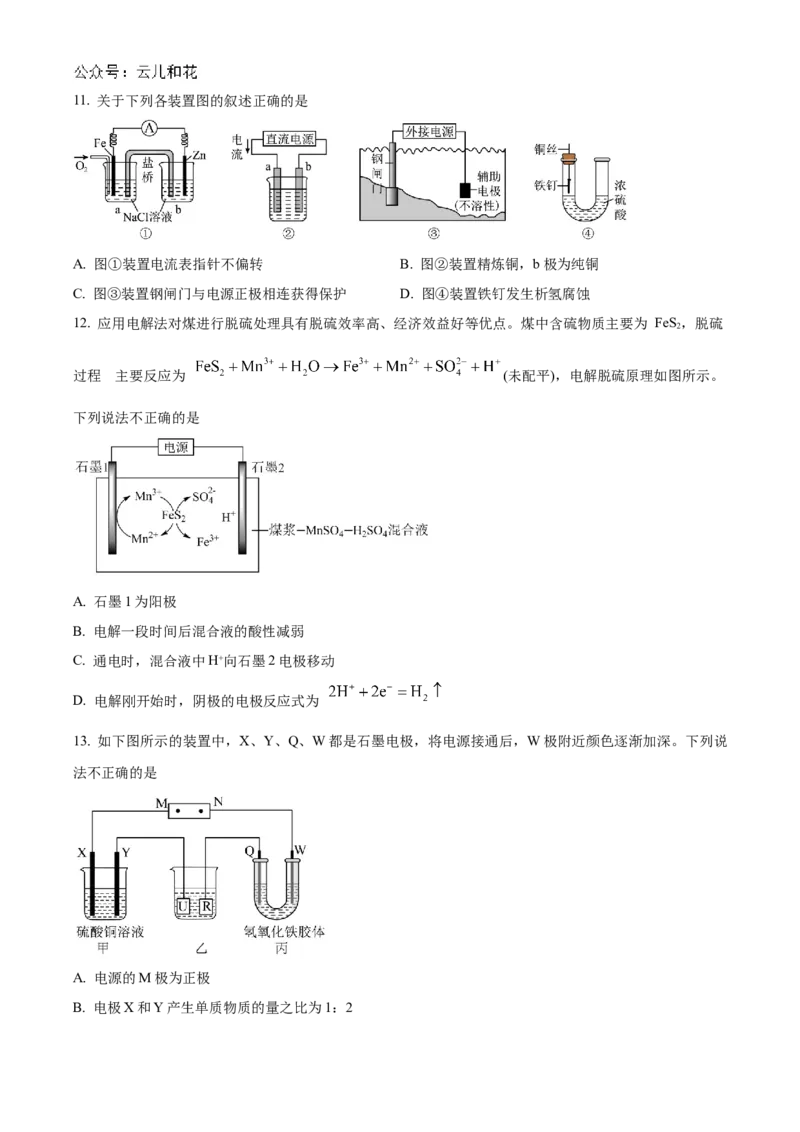
1. 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A. 规模化使用氢能有助于实现碳达峰
B. 太阳能电池是一种将化学能转化为电能的装置
C. 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D. 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
2. 2024年5月8日,我国第三艘航空母舰福建舰顺利完成首次海试。舰体表面需要采取有效的防锈措施,
下列防锈措施不属于在金属表面覆盖保护层的是
A. 船底四周镶嵌锌块 B. 钢铁表面发蓝处理
C. 钢铁表面喷涂油漆 D. 铝制品的阳极氧化
3. 下列说法正确的是
A. 氢氧化钠固体溶于水放出大量的热,故该过程是放热反应
B. 放热反应不需要加热就能进行,吸热反应不加热就不能进行
C. 可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关
D. 同温同压下,反应 在光照和点燃条件下的ΔH不同
4. 下列事实不能用平衡移动原理解释的是
A. 晒自来水养小金鱼
B. 合成氨时采用700K的温度
C. 开启啤酒瓶后,瓶中马上泛起大量泡沫
D. 实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出
5. 恒温恒容下反应 达到平衡状态时,再通入一定量的 N。下列说法正
2确的是(K 为平衡常数,Q 为浓度商)
A. Q 不变,K 变大,H 转化率增大
2
B. Q 增大,K 变大,N 转化率减小
2
C. Q 变小,K 不变,N 转化率减小
2
D. Q 增大,K 不变,H 转化率增大
2
6. 对于可逆反应A(g)+2B(g) 2C (g) ΔH<0,达到平衡时,要使正反应速率增大,且使A的转化率
增大,以下采取的措施可行的是
A. 升高温度 B. 增大A的浓度 C. 减少C的浓度 D. 增大压强
7. 下列说法正确的是
A. 化学平衡正向移动,反应物的转化率一定增大
B. 平衡常数发生变化,化学平衡不一定发生移动
.
C 对于任何化学反应来说,反应速率越大,反应现象越明显
D. AgCl(s) Ag+(aq)+Cl-(aq)的平衡常数表达式为K=c (Ag+)∙c (Cl-)
平 平
8. 下列有关铅蓄电池 的说法错误的是
A. 放电时,两个电极的质量均增加 B. 放电时, 溶液中 H⁺向 PbO 极移动
2
C. 充电时,电解质溶液密度增大 D. 用铅蓄电池电解 MgCl 溶液可制备 Mg
2
9. 羰基硫(COS)是一种粮食熏蒸剂,能防止某些害虫和真菌的危害。在容积不变的密闭容器中,使 CO和
HS发生下列反应并达到平衡:CO(g)+HS(g) COS(g)+H (g)。若反应前CO的物质的量为10mol,达到
2 2 2
平衡时CO的物质的量为8mol,且化学平衡常数为0.1,下列说法不正确的是
A. 升高温度,HS的浓度增大,表明该反应是放热反应
2
B. 通入 CO后,正反应速率逐渐增大
C. 反应前 HS的物质的量为7mol
2
D. 达到平衡时CO 的转化率为20%
10. 在一定温度下的密闭容器中发生反应:xA(g)+yB(g) zC(g),平衡时测得B的浓度为0.60mol∙L−1。保
持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得 B的浓度为0.36mol∙L−1。下列有关判断
正确的是
A. x+y
. 加2滴淀粉溶液, 溶液变 为蓝色
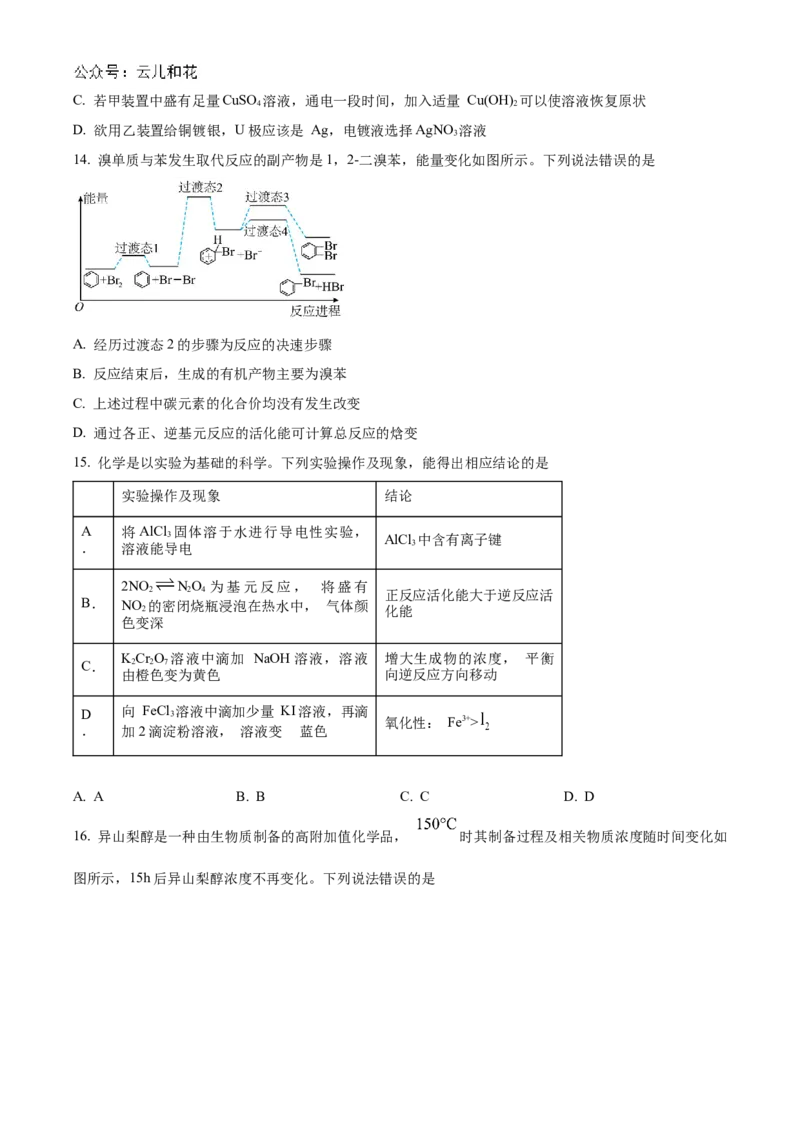
A. A B. B C. C D. D
16. 异山梨醇是一种由生物质制备的高附加值化学品, 时其制备过程及相关物质浓度随时间变化如
图所示,15h后异山梨醇浓度不再变化。下列说法错误的是A. 该温度下的平衡常数:①<②
B. 3h时,反应②正、逆反应速率不相等
C. 0~3h平均速率 v(异山梨醇)
D. 反应②加入催化剂不改变其平衡转化率
第Ⅱ卷
二、非选择题(本题包括4小题,共52分)
17. 用相关化学反应原理解释下列问题。
(1)三元催化器可以将高温汽车尾气中的CO和NO转化为无毒气体,写出该反应的化学方程式
___________。
(2)5.6g B H 气体在氧气中燃烧, 生成固态B O 和液态水, 放出433kJ热量, 写出该反应的热化学方
2 6 2 3
程式___________。
(3)酸性较弱时,钢铁发生电化学腐蚀的正极反应式为___________。
(4)CO与血红蛋白( Hb)结合的能力比O 更强,该过程可表示为
2
如果一旦发现有人CO中毒,应该立刻采取的措施 是___________。
(5)二甲醚(CHOCH )被称为“21世纪的清洁燃料”,二甲醚可用作燃料电池,若电解质溶液为KOH溶液,
3 3
则负极的电极反应式为___________。
18. 化学反应的过程不仅包括物质变化,还包括能量变化。研究化学能与其他形式能量之间的相互转化具
有重要的意义。
I.化学能与热能
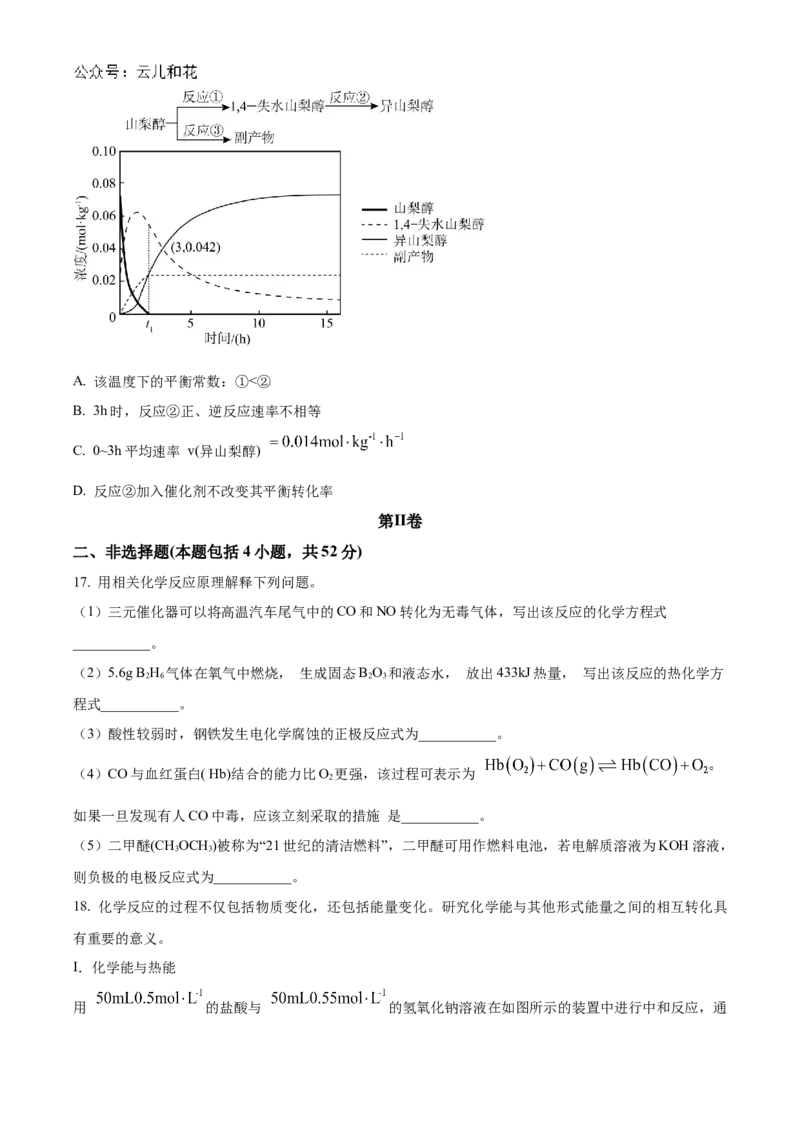
用 的盐酸与 的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
(1)仪器A的名称是___________。
(2)已知:近似认为溶液密度是1g·cm⁻³,溶液的比热容c= 忽略溶液体积变化。实验数据
如下,请计算中和热ΔH=___________。
起始温度t/℃
1
实验次 终 止 温 度
数 氢氧化钠溶 t 2 /℃
盐酸 平均值
液
.
1 26.4 26.2 263 29.4
2 27.0 27.4 27.2 31.7
3 25.9 25.9 25.9 28.8
(3)上述实验测得的中和热与理论值 存在较大偏差,产生偏差的原因可能是
___________(填字母)。
A.量取盐酸时仰视读数
B.实验装置保温隔热效果差
C.为了使反应充分,向酸溶液中分次加入碱溶液
Ⅱ. 化学能与电能
在如图所示装置中, A、B、E、F为多孔的石墨惰性电极; C、D为两个铂夹,夹在被 Na₂SO₄溶液浸湿
的滤纸条上,滤纸中部滴有 KMnO 溶液; 电源有a、b两极。试管中充满KOH 溶液后倒立于 KOH溶液
4
的水槽中,烧杯中为 500mL0.04mol·L⁻¹的 AgNO 溶液。断开 K, 闭合K、K, 通直流电, 实验现象
3 1 2 3
如图所示。(4)a为电源的___________极,在NaSO 溶液浸湿的滤纸条中部的 溶液处观察到的现象是
2 4
___________。
(5)开始时,烧杯中发生的离子反应方程式___________。一段时间后,在标准状况下A、B处共收集到
气体672mL,忽略溶液体积变化,则此时烧杯中 c(H⁺)=___________,烧杯中产生的气体体积为
___________。
(6)若电解一段时间后,A、B均有气体包围电极。此时切断K、K,闭合K,观察到检流计的指针移
2 3 1
动,其理由___________。
19. 某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验。
[实验原理]
[实验内容及记录]
试管中所加试剂及其用量/mL
实
实
验
验 溶液褪
温
编 0.6mol∙L−1HC O 3mol∙L−1HSO 0.05mol∙L−1KMnO 至无色
度 / 2 2 4 HO 2 4 4
号 溶液 2 溶液 溶液 所需时
℃
间/ min
I 25 3.0 2.0 2.0 3.0 t
1
.
Ⅱ 25 2.0 30 2.0 3.0 t
2
III 35 2.0 3.0 2.0 3.0 t
3
(1)I、Ⅱ实验目的是___________。
(2)实验Ⅰ中加入2.0mL水的原因是___________。
(3)若将实验Ⅱ中: 溶液换成6mol∙L−1盐酸,溶液褪至无色所需时间变短,可能原因
是___________(用离子方程式表示)。
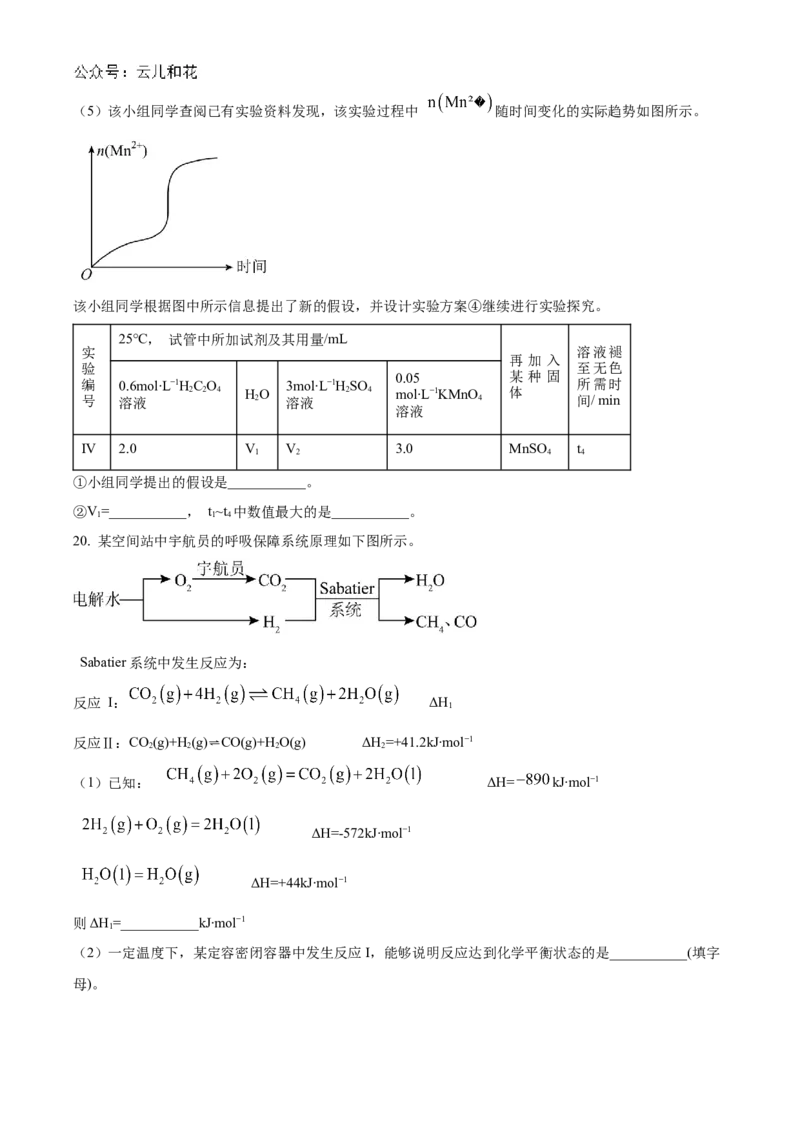
(4)探究温度对化学反应速率的影响,应选择实验___________(填实验编号)。(5)该小组同学查阅已有实验资料发现,该实验过程中 随时间变化的实际趋势如图所示。
该小组同学根据图中所示信息提出了新的假设,并设计实验方案④继续进行实验探究。
25℃, 试管中所加试剂及其用量/mL
实 溶液褪
再 加 入
验 至无色
0.05 某 种 固
编 0.6mol∙L−1HC O 3mol∙L−1HSO 所需时
2 2 4 HO 2 4 mol∙L−1KMnO 体
号 溶液 2 溶液 4 间/ min
溶液
IV 2.0 V V 3.0 MnSO t
1 2 4 4
①小组同学提出的假设是___________。
②V=___________, t~t 中数值最大的是___________。
1 1 4
20. 某空间站中宇航员的呼吸保障系统原理如下图所示。
Sabatier系统中发生反应为:
反应 Ⅰ: ΔH
1
反应Ⅱ:CO
2
(g)+H
2
(g)⇌CO(g)+H
2
O(g) ΔH
2
=+41.2kJ∙mol−1
(1)已知: ΔH= kJ∙mol−1
ΔH=-572kJ∙mol−1
ΔH=+44kJ∙mol−1
则ΔH=___________kJ∙mol−1
1
(2)一定温度下,某定容密闭容器中发生反应I,能够说明反应达到化学平衡状态的是___________(填字
母)。A. B. HO的质量不再变化
2
C. 混合气体的密度不再变化 D. 混合气体的平均相对分子质量不再变化
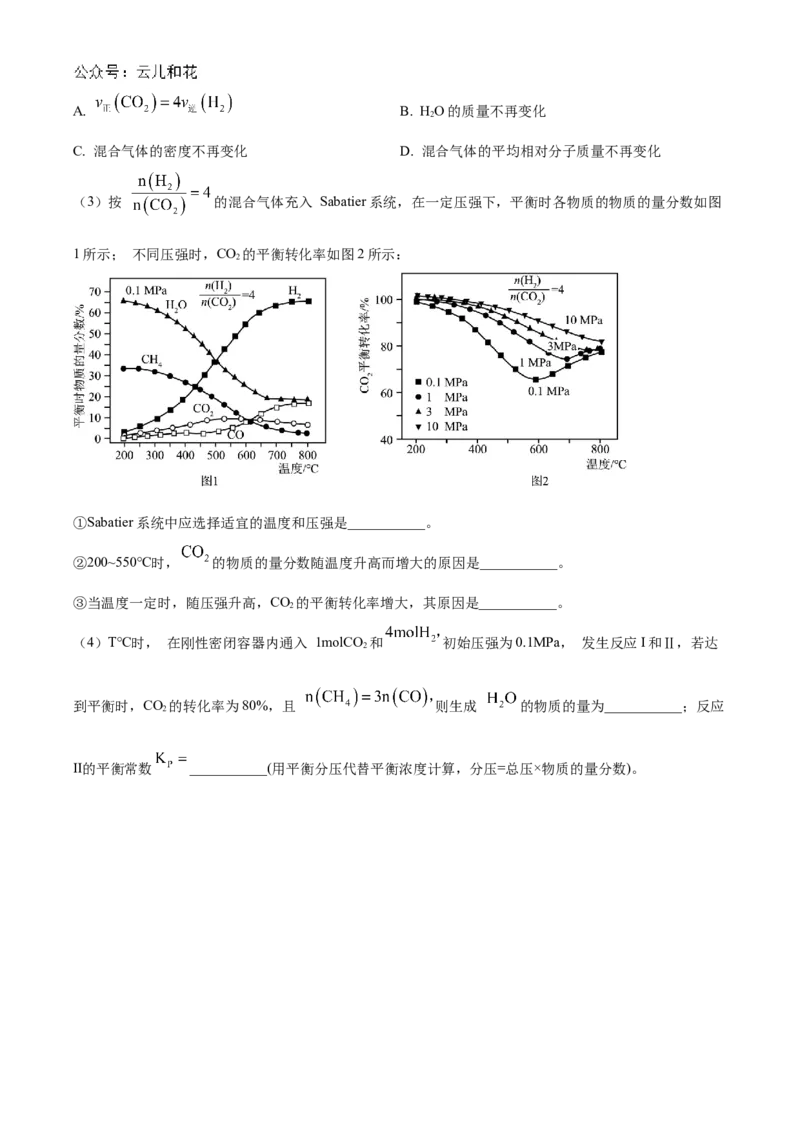
(3)按 的混合气体充入 Sabatier系统,在一定压强下,平衡时各物质的物质的量分数如图
1所示; 不同压强时,CO 的平衡转化率如图2所示:
2
①Sabatier系统中应选择适宜的温度和压强是___________。
②200~550℃时, 的物质的量分数随温度升高而增大的原因是___________。
③当温度一定时,随压强升高,CO 的平衡转化率增大,其原因是___________。
2
(4)T℃时, 在刚性密闭容器内通入 1molCO 和 初始压强为0.1MPa, 发生反应I和Ⅱ,若达
2
到平衡时,CO 的转化率为80%,且 则生成 的物质的量为___________;反应
2
Ⅱ的平衡常数 ___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。