文档内容
2024-2025学年高二年级第一学期第一次单元测试(化学)
学年高二年级第一学期第一次单元测试
2024~2025
化学试题
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 Cl-35.5
一、选择题:本题共 8小题,每小题 2分,共16分。在每小题给出的四个选项中,只有一项是符合题
目要求的。
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法正确的是( )
A.液氧-液氢、液态NO -肼、液氮-液氢都可以作为火箭推进剂
2
B.将重油裂解为轻油作为燃料,是促进碳中和最直接有效的手段
C.高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
D.飞船返回舱表层材料中的玻璃纤维属于天然有机高分子
2.元末陶宗仪《辍耕录》中记载:“杭人削松木为小片,其薄为纸,熔硫磺涂木片顶端分许,名日发烛……,盖以发
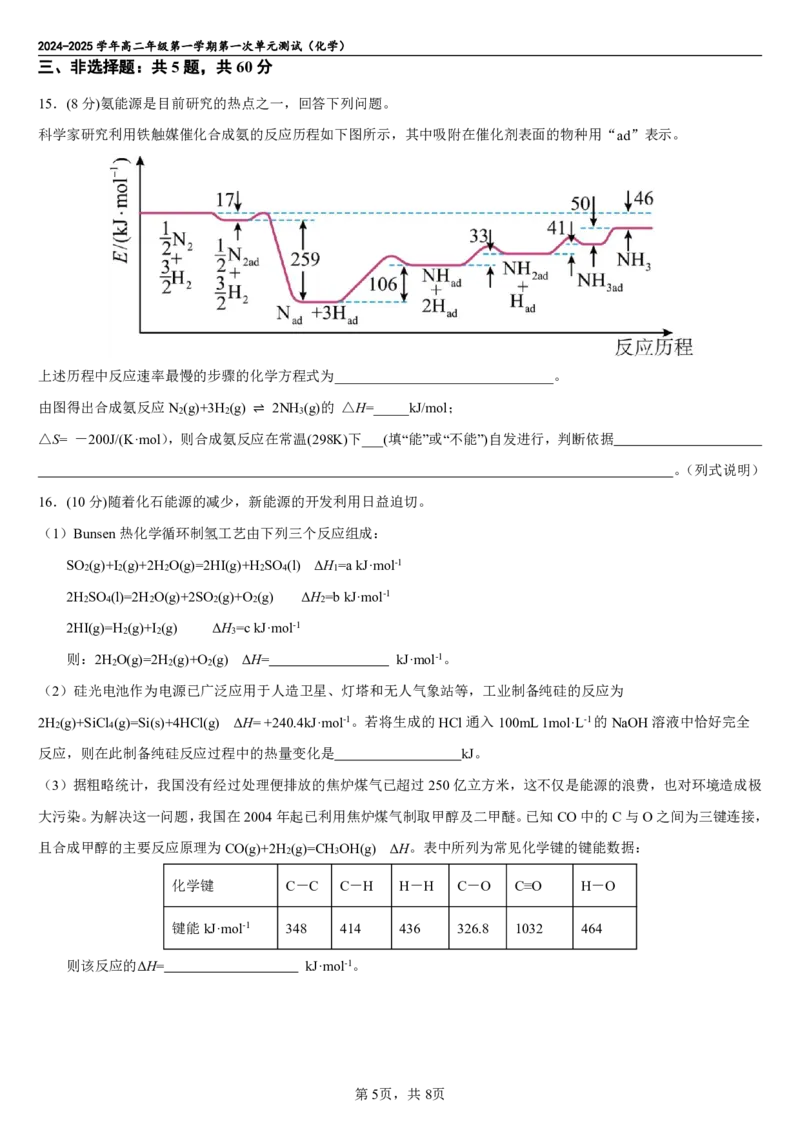
火及代灯烛用也。”下列有关说法错
.
误
.
的是( )
A.将松木削薄为纸片状有助于发火和燃烧
B.“发烛”发火和燃烧利用了物质的可燃性
C.“发烛”发火和燃烧伴随不同形式的能量转化
D.硫磺是“发烛”发火和燃烧反应的催化剂
3.人体血液内的血红蛋白(Hb)易与O 结合生成HbO ,因此具有输氧能力,CO吸入肺中发生反应:
2 2
CO+HbO O +HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO 浓度的0.02倍,会使人智力受
2 2 2
损。据此,下列结论错误的是( )
A.CO与HbO 反应的平衡常数K=
2
B.人体吸入的CO越多,与血红蛋白结合的O 越少
2
C.当吸入的CO与O 浓度之比大于或等于11000时,人的智力才会受损
2
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向逆反应方向移动
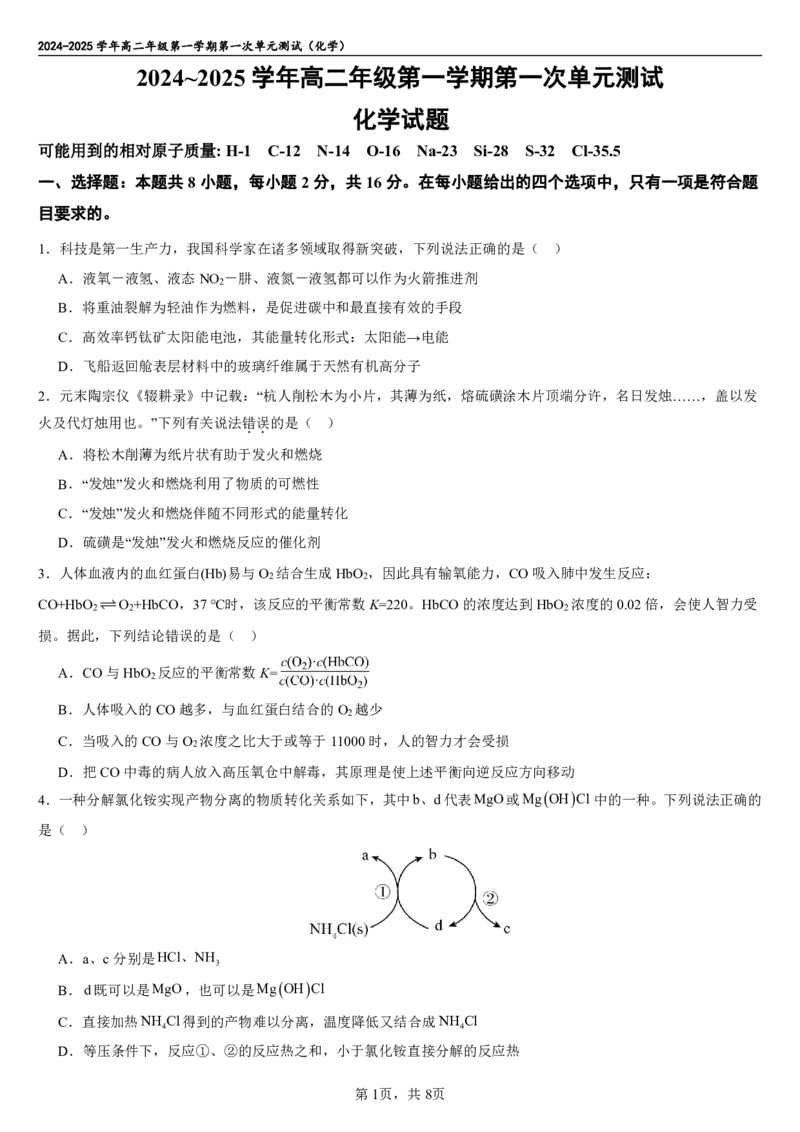
4.一种分解氯化铵实现产物分离的物质转化关系如下,其中b、d代表MgO或MgOHCl中的一种。下列说法正确的
是( )
A.a、c分别是HCl、NH
3
B.d既可以是MgO,也可以是MgOHCl
C.直接加热NH Cl得到的产物难以分离,温度降低又结合成NH Cl
4 4
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
第1页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}命题、审题:王碧翠、黄静
5.在含Fe3、S O2和I的溶液中,发生反应:S O2aq2Iaq 2SO2 aq I aq,其反应进程中的能量变化
2 8 2 8 4 2
如下,下列有关该反应的说法正确的是( )
A.步骤①的热化学方程为:
2Fe3(+ aq)+2I(- aq)=I(aq)+2Fe2(+ aq) H=(E -E)kJ.mol-1
2 3 1
B.决速步是第②步
C.升高温度可以更容易检测到Fe2+
D.Fe2+可以使反应物分子中活化分子百分数增大
6.下列事实与对应的方程式相符的是( )
1 1 1
A.已知中和热为57.3kJ/mol: H SO (aq)+ Ba(OH) (aq)== BaSO (s)+H O(l) ΔH=-57.3kJ·mol-1
2 4 2 4 2
2 2 2
B.一定条件下,1molH 与1molI (g)充分反应生成HI(g)放热akJ,其热化学方程式为:H (g)+I (g) 2HI(g)
2 2 2 2
ΔH=-akJ·mol-1
C.“NO 球”浸入冷水中颜色变浅: 2NO (g) N O (g) △H>0
2 2 2 4
D.硫代硫酸钠溶液与稀硫酸混合出现浑浊:S O2-+2H+==S↓+SO ↑+H O
2 3 2 2
7.体积均为1L的两个恒容密闭容器I、Ⅱ中,均充入2molCO(g)和2molNO(g),发生反应:
2COg2NOg N g2CO g Δ△HH,相对容器Ⅱ,容器I只改变一个外界条件,测得n(N )与时间关系如图所
2 2 2
示。下列叙述正确的是( )
A.该反应是吸热反应,容器I改变的条件可能是使用了催化剂
B.相对容器Ⅱ,容器I改变的条件可能是升温或者加压
C.容器Ⅱ中NO的平衡转化率为80%
D.容器Ⅱ中0~10min内, ν(NO)=0.05mol∙L-1∙min-1
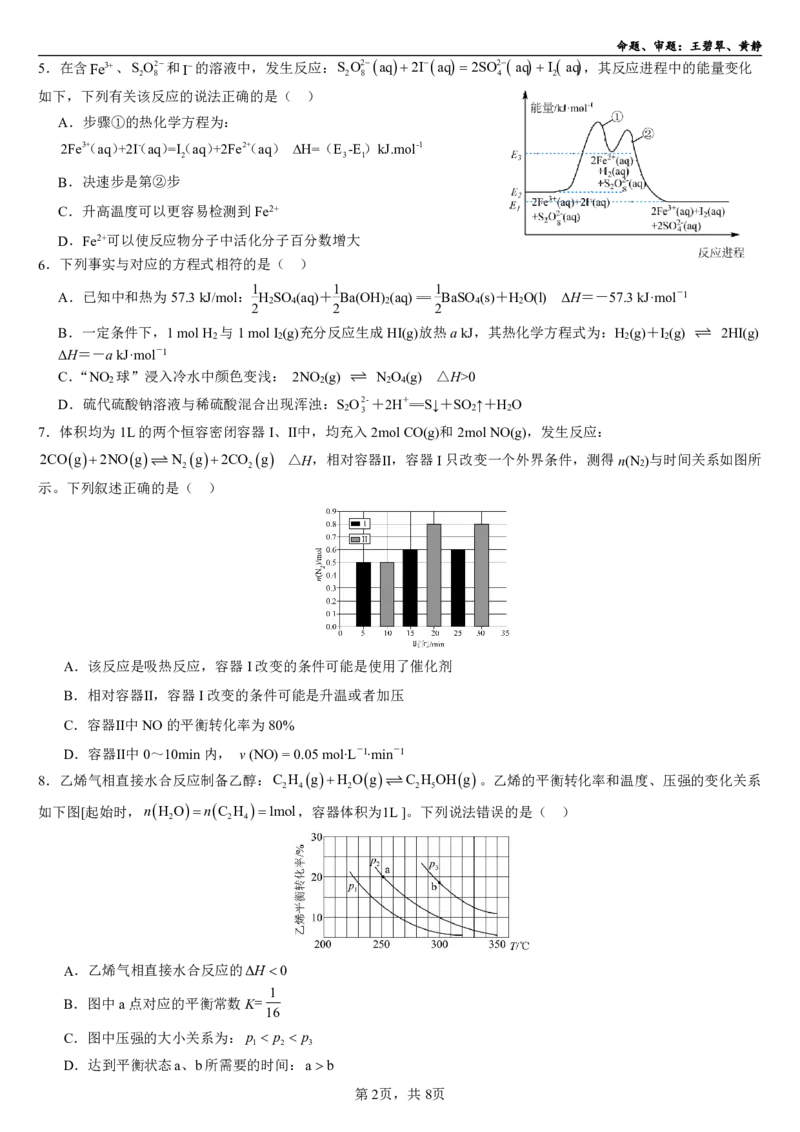
8.乙烯气相直接水合反应制备乙醇:C H gH Og C H OHg。乙烯的平衡转化率和温度、压强的变化关系
2 4 2 2 5
如下图[起始时,nH OnC H 1mol,容器体积为1L]。下列说法错误的是( )
2 2 4
A.乙烯气相直接水合反应的ΔH 0
1
B.图中a点对应的平衡常数KK
16
C.图中压强的大小关系为: p p p
1 2 3
D.达到平衡状态a、b所需要的时间:ab
第2页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}2024-2025学年高二年级第一学期第一次单元测试(化学)
二、选择题:本题共 6小题,每小题 4分,共24分。每小题有一
.
个
.
或
.
两
.
个
.
选项符合题意。若正确答案
只包括一个选项, 多选得 0分;若正确答案包括两个选项,只选一个且正确得 2分,选两个且都正确
得4分,但只要选错一个就得 0分。
9.各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
物质 C H g C H g H g
2 6 2 4 2
ΔH /
kJmol1
1559.8 1411 285.8
A.C H (g)3O (g)2CO (g)2H O(g) ΔHH1411kJmol1
2 4 2 2 2
B.C H (g)C H (g)H (g) ΔHH137kJmol1
2 6 2 4 2
C.H OlO gH g ΔHH285.8kJmol1
2 2 2
7
D.C H (g) O (g) 2CO (g)3H O(l)ΔHH1559.8kJmol1
2 6 2 2 2 2
10.工业上用CH 消除氮氧化物的污染:CH g2NO g N gCO g2H Og
4 4 2 2 2 2
ΔΔHH867.0kJmol1。下列说法正确的是( )
cCO cN
A.上述反应平衡常数KK 2 2
c2NO cCH
2 4
B.其他条件不变时,NO 去除率随温度升高而增大的原因可能是平衡常数变大
2
C.其他条件不变时,恒压条件下通入一定量的惰性气体可以提高NO 去除率
2
D.实际应用中,采用高分子分离膜及时分离出水蒸气,可以使正反应速率增大,NO 去除率增大
2
11.已知:2SO (g)+O (g) 催 化 剂 2SO (g) ΔHH=-=-197.8kJmol-1。下列说法错误的是( )
2 2 3
A.进入接触室的气体要控制O 含量比SO 含量大
2 2
B.高温条件有利于该反应自发进行
C.工业生产中选择400C~500C进行该反应是为了提高反应速率及原料的平衡转化率
D.工业上利用热交换器将该反应放出的热量预热反应前的原料气(SO 和O ),实现能量的循环利用
2 2
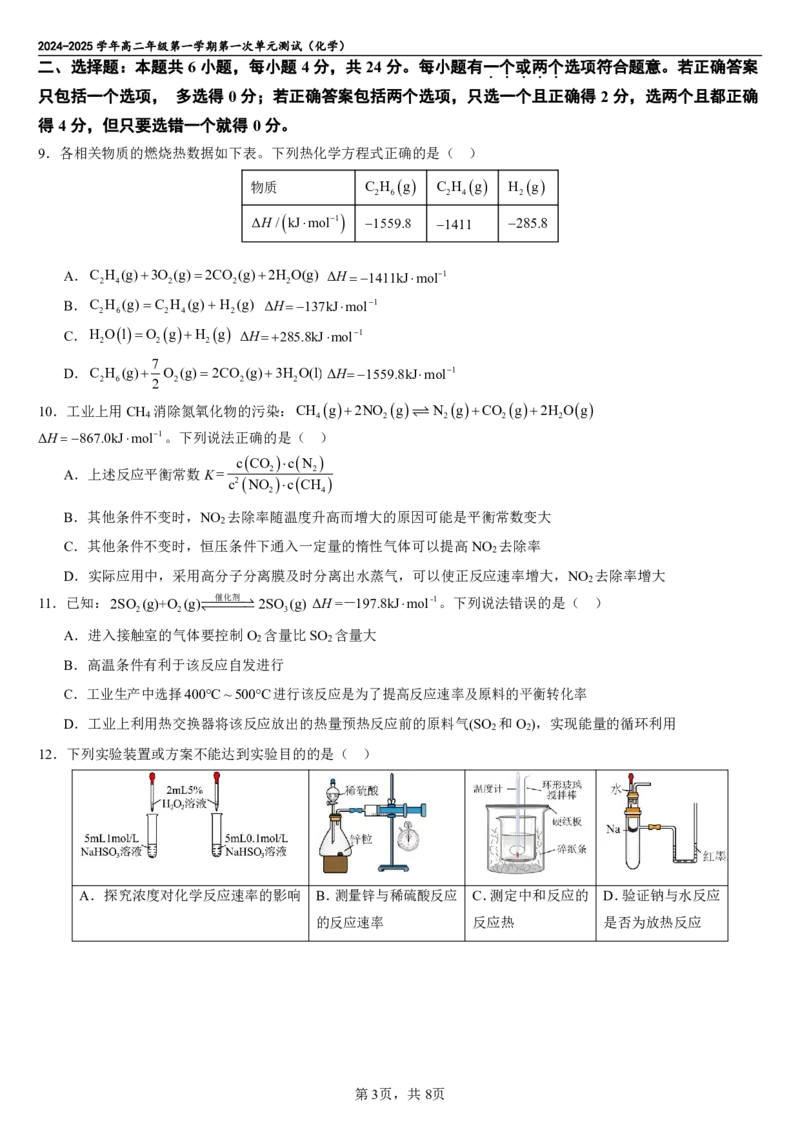
12.下列实验装置或方案不能达到实验目的的是( )
A.探究浓度对化学反应速率的影响 B.测量锌与稀硫酸反应 C.测定中和反应的 D.验证钠与水反应
的反应速率 反应热 是否为放热反应
第3页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}命题、审题:王碧翠、黄静
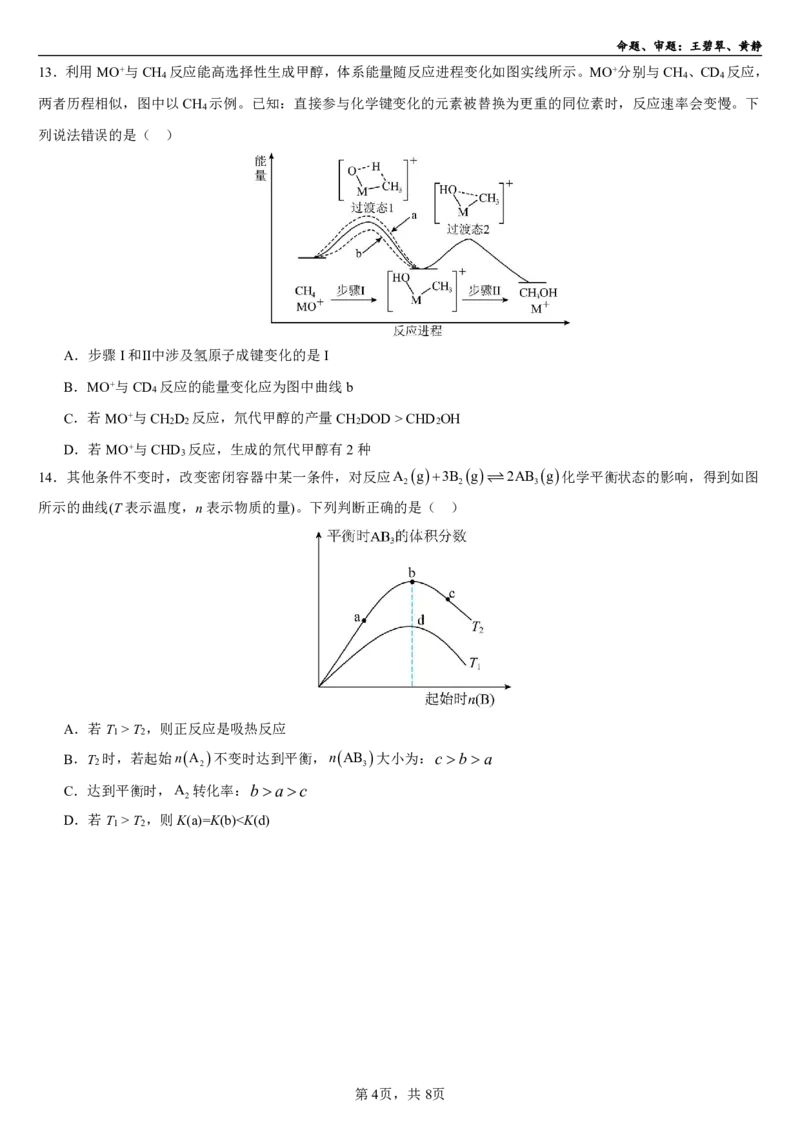
13.利用MO+与CH 反应能高选择性生成甲醇,体系能量随反应进程变化如图实线所示。MO+分别与CH 、CD 反应,
4 4 4
两者历程相似,图中以CH 示例。已知:直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下
4
列说法错误的是( )
A.步骤I和Ⅱ中涉及氢原子成键变化的是I
B.MO+与CD 反应的能量变化应为图中曲线b
4
C.若MO+与CH D 反应,氘代甲醇的产量CH DOD>CHD OH
2 2 2 2
D.若MO+与CHD 反应,生成的氘代甲醇有2种
3
14.其他条件不变时,改变密闭容器中某一条件,对反应A g3B g 2AB g化学平衡状态的影响,得到如图
2 2 3
所示的曲线(T表示温度,n表示物质的量)。下列判断正确的是( )
A.若T >T ,则正反应是吸热反应
1 2
B.T 时,若起始nA 不变时达到平衡,nAB 大小为:c ba
2 2 3
C.达到平衡时,A 转化率:bac
2
D.若T >T ,则K(a)=K(b)”或 “=”);
(2)830℃时,向体积为10L的密闭容器中充入0.2mol的A和0.2mol的B,如反应初始到10s内A的平均反应速率
v(A)=0.001mol·L-1·s-1,则10s时c(D)=_____。此时,该反应是否处于平衡状态:___ (填“是”或“否”)。达到平衡时
A的转化率为__________,如果这时向该密闭容器中充入1mol氦气,A的转化率________(填“变大”、“变小”或“不变”)。
(3)可用于判断该反应达到平衡状态的依据为________(填选项符号):
a. 压强不随时间改变 b. 气体的密度不再发生改变
c.c(D)不随时间改变 d. 单位时间内生成A和C的物质的量相等
(4)1000℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值___________。
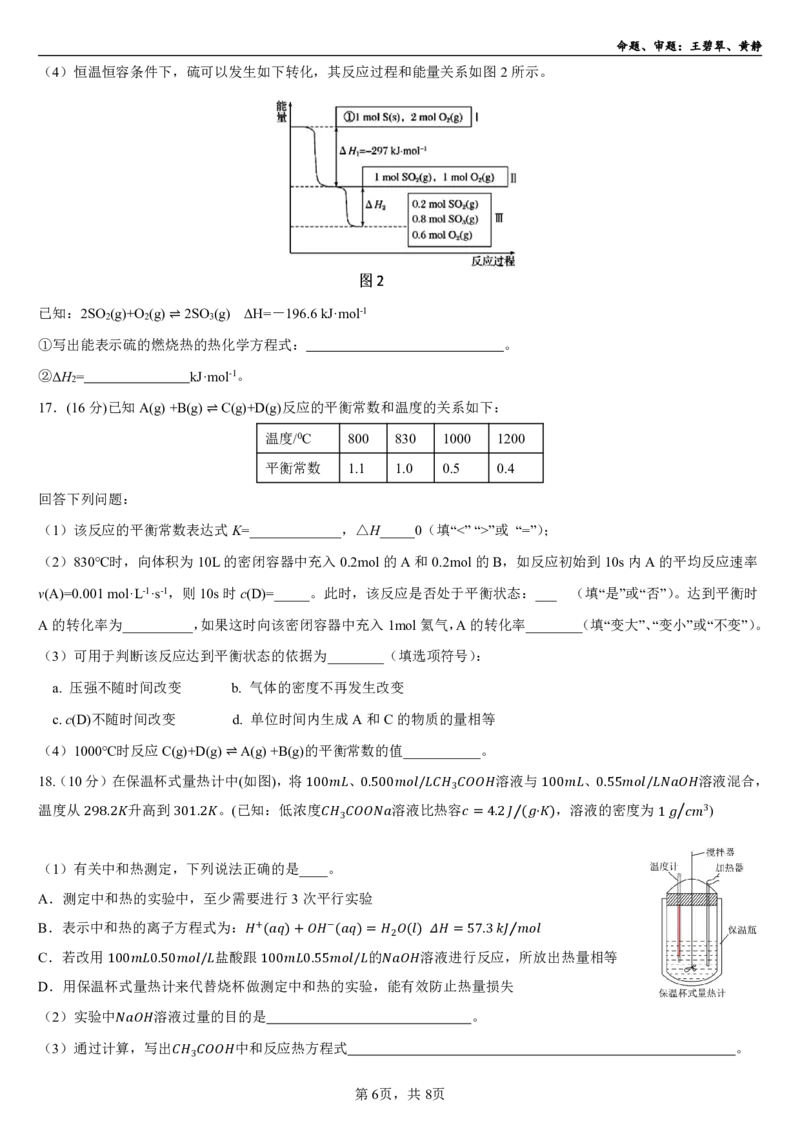
18.(10分)在保温杯式量热计中⇌(如图),将 、 溶液与 、 溶液混合,
温度从 升高到 。(已知:低浓1度00 0.500溶 液 /比 热 容3 10,0 溶 液0的.5密5 度 为 / )
3
298.2 301.2 3 =4.2 ( ⋅ ) 1
(1)有关中和热测定,下列说法正确的是____。
A.测定中和热的实验中,至少需要进行3次平行实验
B.表示中和热的离子方程式为:
+ −
C.若改用 盐酸跟 ( )+ ( )=的 2 ( )溶 液 进=行57反.3应 , 所 放 出热量相等
D.用保温杯10式0 量 热0.5计0来 代 /替 烧杯做测10定0 中 和0.5热5 的 实 /验 , 能 有 效防止热量损失
(2)实验中 溶液过量的目的是 。
(3)通过计算 , 写出 中和反应热方程式 。
3
第6页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}2024-2025学年高二年级第一学期第一次单元测试(化学)
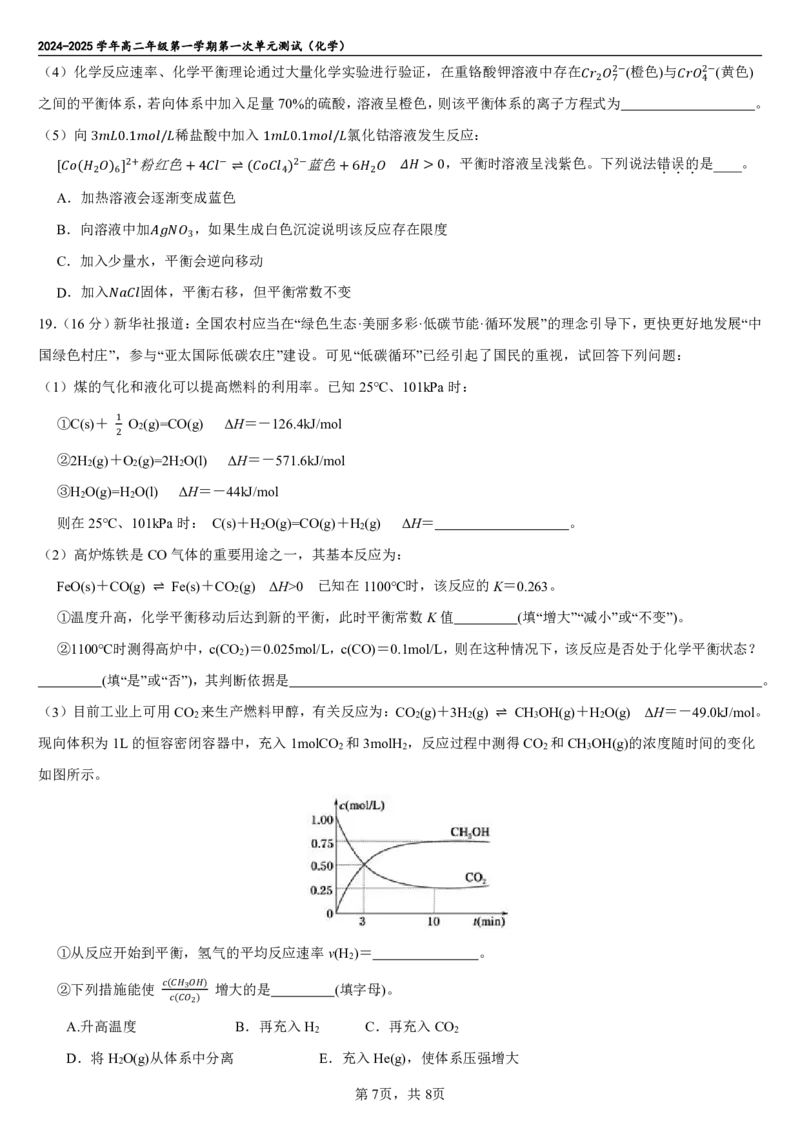
(4)化学反应速率、化学平衡理论通过大量化学实验进行验证,在重铬酸钾溶液中存在 (橙色)与 (黄色)
2− 2−
之间的平衡体系,若向体系中加入足量70%的硫酸,溶液呈橙色,则该平衡体系的离子方程 式2 为7 4 。
(5)向 稀盐酸中加入 氯化钴溶液发生反应:
3 0.1 粉 红 /色 1 0.1蓝 色 / ,平衡时溶液呈浅紫色。下列说法错 . 误 . 的 . 是____。
2+ − 2−
[A . (加 2热 溶)6]液会逐渐变+成4 蓝 色⇌( 4) +6 2 >0
B.向溶液中加 ,如果生成白色沉淀说明该反应存在限度
C.加入少量水, 平 衡3会逆向移动
D.加入 固体,平衡右移,但平衡常数不变
19.(16分) 新 华 社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中
国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。已知25℃、101kPa时:
①C(s)+ O (g)=CO(g) ΔH=-126.4kJ/mol
2
1
②2H (g)+2 O (g)=2H O(l) ΔH=-571.6kJ/mol
2 2 2
③H O(g)=H O(l) ΔH=-44kJ/mol
2 2
则在25℃、101kPa时: C(s)+H O(g)=CO(g)+H (g) ΔH= 。
2 2
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO (g) ΔH>0 已知在1100℃时,该反应的K=0.263。
2
①温度升高,化⇌学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO )=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?
2
(填“是”或“否”),其判断依据是 。
(3)目前工业上可用CO 来生产燃料甲醇,有关反应为:CO (g)+3H (g) CH OH(g)+H O(g) ΔH=-49.0kJ/mol。
2 2 2 3 2
现向体积为1L的恒容密闭容器中,充入1molCO 和3molH ,反应过程中测⇌得CO 和CH OH(g)的浓度随时间的变化
2 2 2 3
如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H )= 。
2
②下列措施能使 增大的是 (填字母)。
( 3 )
A.升高温度 ( 2) B.再充入H C.再充入CO
2 2
D.将H O(g)从体系中分离 E.充入He(g),使体系压强增大
2
第7页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}命题、审题:王碧翠、黄静
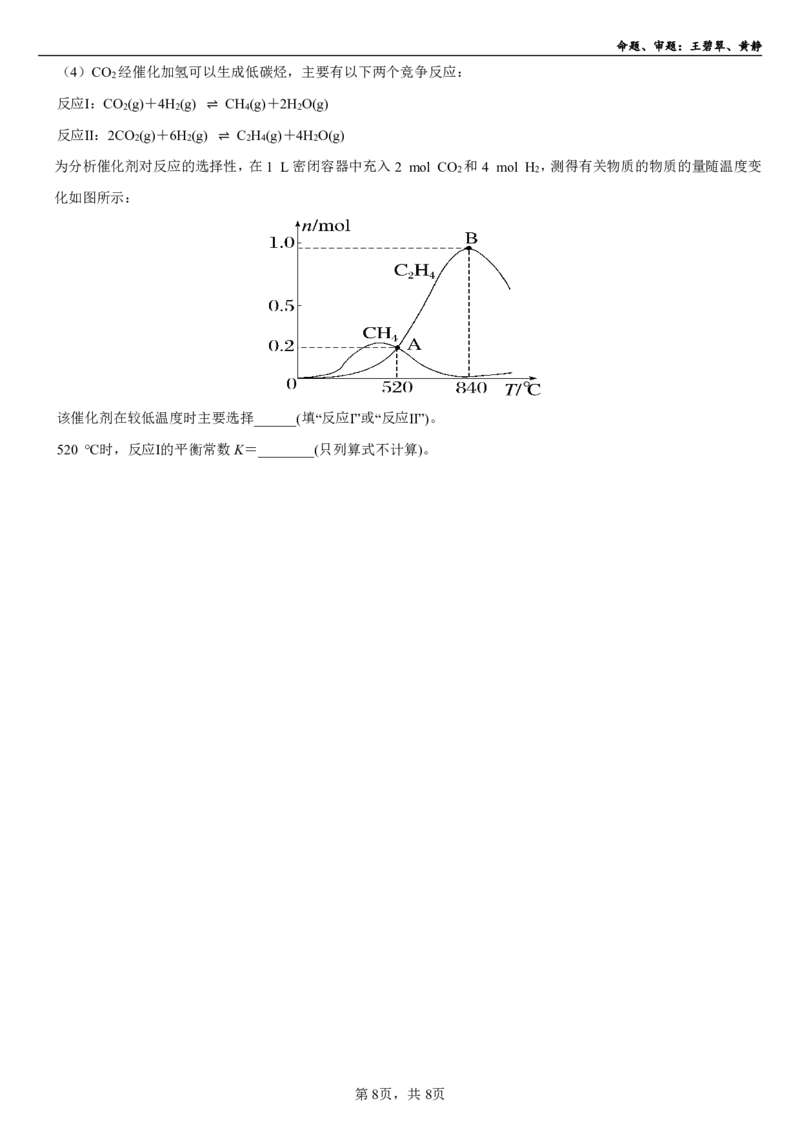
(4)CO 经催化加氢可以生成低碳烃,主要有以下两个竞争反应:
2
反应Ⅰ:CO (g)+4H (g) CH (g)+2H O(g)
2 2 4 2
反应Ⅱ:2CO (g)+6H (g)⇌ C H (g)+4H O(g)
2 2 2 4 2
为分析催化剂对反应的选择⇌性,在1 L密闭容器中充入2 mol CO 和4 mol H ,测得有关物质的物质的量随温度变
2 2
化如图所示:
该催化剂在较低温度时主要选择______(填“反应Ⅰ”或“反应Ⅱ”)。
520 ℃时,反应Ⅰ的平衡常数K=________(只列算式不计算)。
第8页,共8页
{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}{#{QQABaQQEoggIAJIAAAhCUwU4CAEQkAGACQgOBFAIIAAAyQNABCA=}#}