文档内容
配套《高中必刷题 化学 必修第一册 LK》使用
第2章 元素与物质世界
第3节 氧化还原反应
课时1氧化还原反应
一、多角度认识氧化还原反应
1.从得失氧的角度认识氧化还原反应
请根据初中学过的氧化反应与还原反应的知识,分析以下反应,完成表格。
2CuO+C=====2Cu+CO↑;
2
Fe O+3CO=====2Fe+3CO。
2 3 2
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 C 、 CO 氧化反应
失氧物质 CuO 、 Fe O 还原反应
2 3
结论:一种物质得到氧发生氧化反应,必然有一种物质失去氧发生还原反应。也就是说,
氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
2.从元素化合价升降的角度认识氧化还原反应
(1)请标出1中两个反应中各物质所含元素的化合价,比较反应前后价态有无变化。
(2)在这两个反应中,得氧物质:C和CO发生氧化反应时,相应元素化合价升高。
失氧物质:CuO和Fe O 发生还原反应时,相应元素化合价降低。
2 3
结论:凡是有元素化合价升降的反应都是氧化还原反应,物质所含元素化合价升高的反应
称为氧化反应,物质所含元素化合价降低的反应称为还原反应。
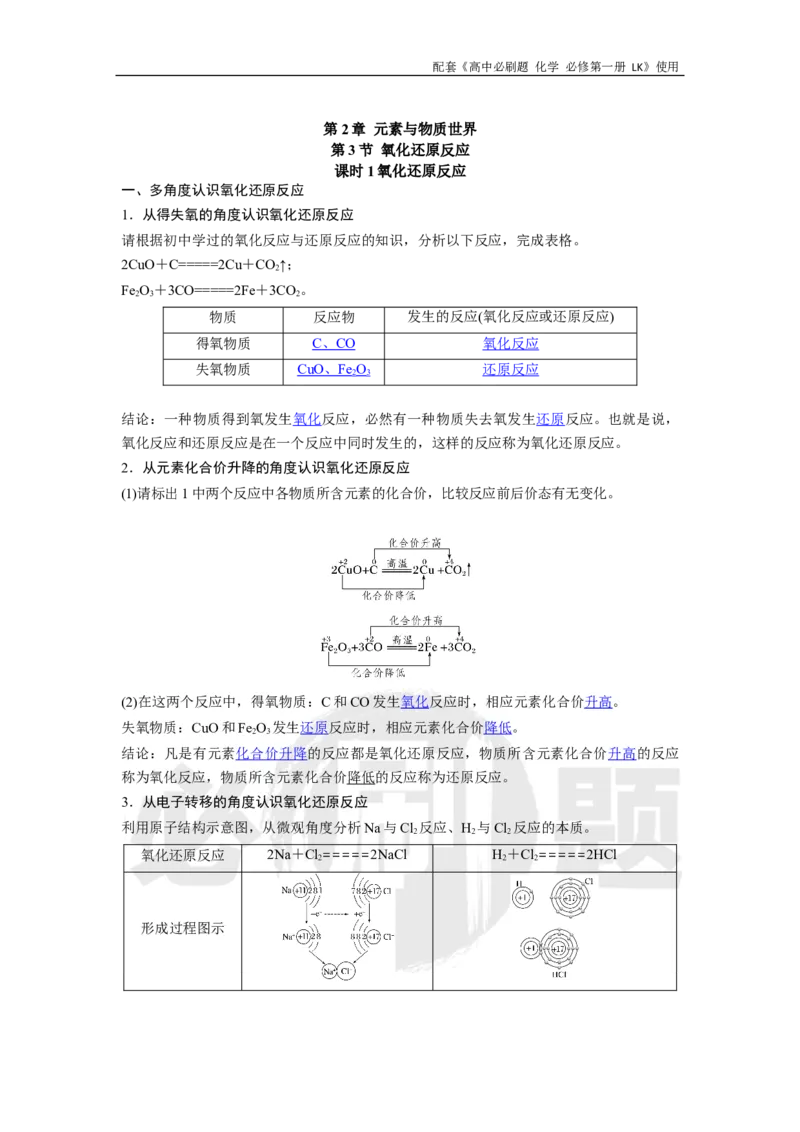
3.从电子转移的角度认识氧化还原反应
利用原子结构示意图,从微观角度分析Na与Cl 反应、H 与Cl 反应的本质。
2 2 2
氧化还原反应 2Na+Cl=====2NaCl H+Cl=====2HCl
2 2 2
形成过程图示配套《高中必刷题 化学 必修第一册 LK》使用
变化过程图示
NaCl是通过得失电子形成
HCl是通过共用电子对形成的,由于
的,由于氯原子得1个电
氯原子得电子能力更强,共用电子对
子,氯元素化合价从0价降
偏向氯原子,氯元素显负价,氢元素
微观分析或解释 低到-1价,发生还原反
显正价。氯元素化合价降低,发生还
应;钠原子失去1个电子,
原反应,氢元素化合价升高,发生氧
钠元素化合价从0价升高到
化反应
+1价,发生氧化反应
氧化还原反应的本质是电子转移(电子得失或共用电子对偏移),氧化
结论
还原反应的特征是有元素化合价的升降
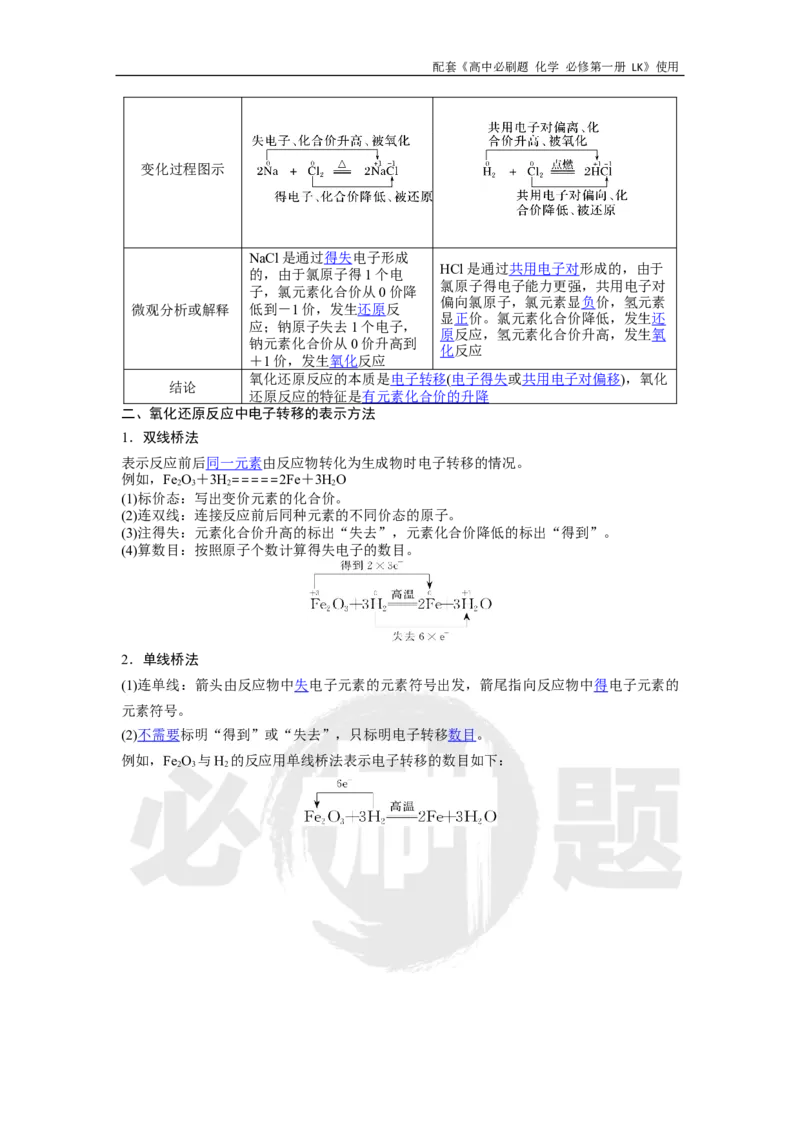
二、氧化还原反应中电子转移的表示方法
1.双线桥法
表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
例如,Fe O+3H=====2Fe+3HO
2 3 2 2
(1)标价态:写出变价元素的化合价。
(2)连双线:连接反应前后同种元素的不同价态的原子。
(3)注得失:元素化合价升高的标出“失去”,元素化合价降低的标出“得到”。
(4)算数目:按照原子个数计算得失电子的数目。
2.单线桥法
(1)连单线:箭头由反应物中失电子元素的元素符号出发,箭尾指向反应物中得电子元素的
元素符号。
(2)不需要标明“得到”或“失去”,只标明电子转移数目。
例如,Fe O 与H 的反应用单线桥法表示电子转移的数目如下:
2 3 2