文档内容
2022年山东省枣庄市中考化学试卷
一、选择题(共8小题,每小题2分,满分16分)
1.2022年北京冬奥会取得圆满成功。下列冬奥会用品涉及的材料中,属于金属材料的是( )
A. “冰墩墩”——PET纤维
B. 场馆使用的太阳能电池——晶体硅
C. 速滑冰刀——钛合金
D. 冰壶——花岗岩
2.氯元素形成的化合物种类较多。下列化合物中氯元素为+5价的是( )
A.NaClO B.KClO C.HClO D.ClO
3 4 2
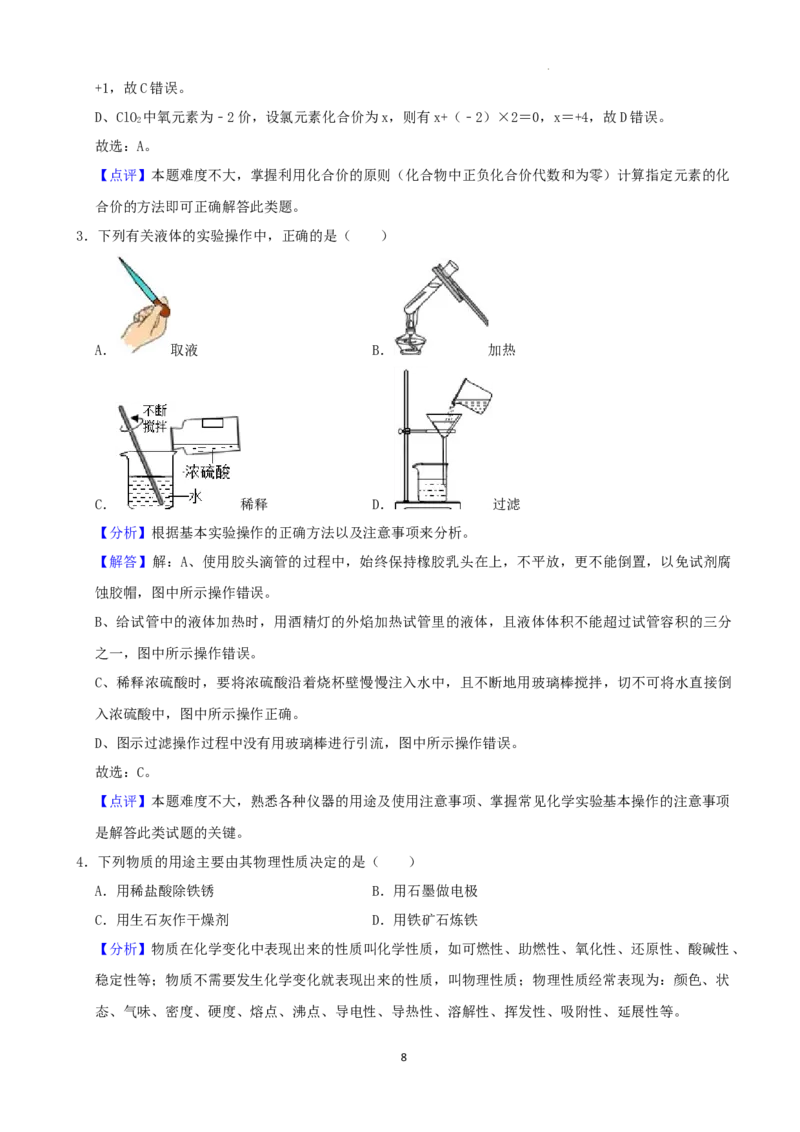
3.下列有关液体的实验操作中,正确的是( )
A. 取液 B. 加热
C. 稀释 D. 过滤
4.下列物质的用途主要由其物理性质决定的是( )
1
学科网(北京)股份有限公司A.用稀盐酸除铁锈 B.用石墨做电极
C.用生石灰作干燥剂 D.用铁矿石炼铁
5.下列图像能正确反映其对应关系的是( )
A.电解水
B.向NaOH溶液中不断加水
C.向CaCl 溶液中滴加NaCO 溶液至过量
2 2 3
D.向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀硫酸至过量
6.下列物质中,前者属于氧化物,后者属于混合物的是( )
A.熟石灰、海水 B.冰水混合物、食盐水
C.干冰、硫酸钠 D.生铁、二氧化锰
7.下列几种常用的灭火方法及灭火原理均正确的是( )
选项 实例 灭火方法 灭火原理
A 油锅着火 用水浇灭 使温度降
到可燃物
的着火点
以下
B 液化气起 关闭阀门 隔绝空气
火
C 住宅失火 用高压水 降低可燃
枪灭火 物着火点
D 森林着火 砍伐出隔 移走可燃
离带 物
A.A B.B C.C D.D
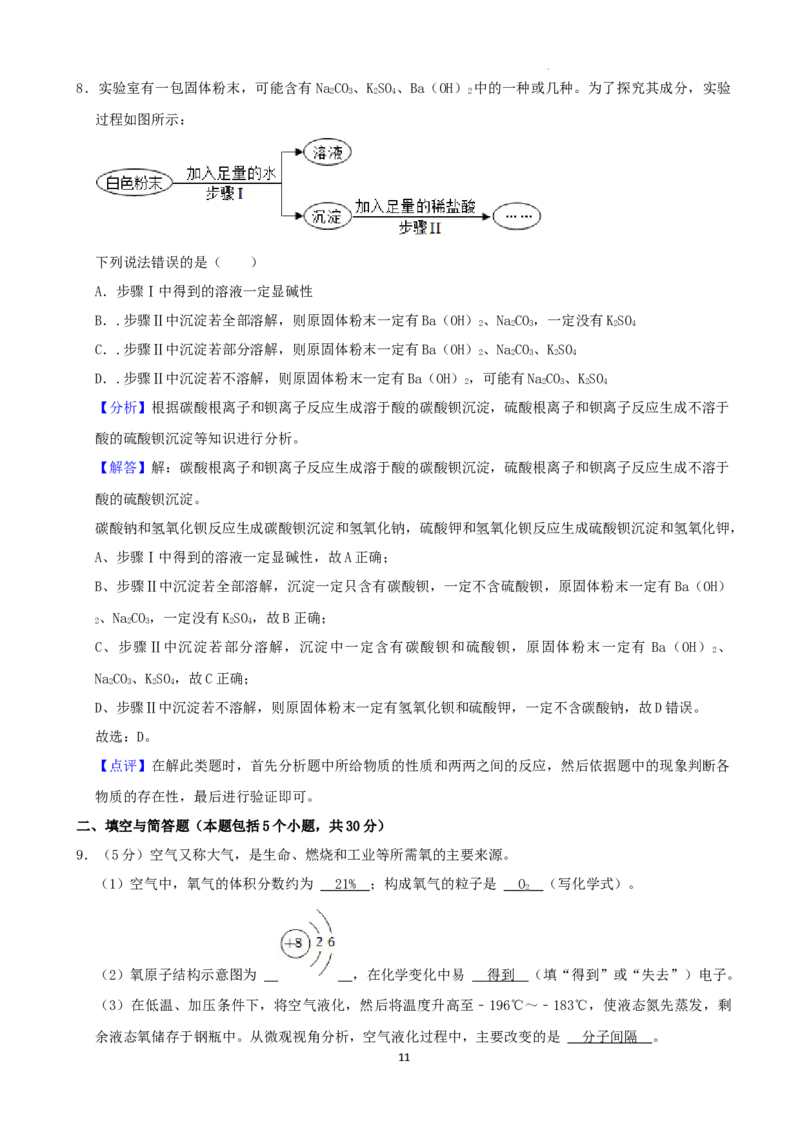
8.实验室有一包固体粉末,可能含有NaCO 、KSO 、Ba(OH) 中的一种或几种。为了探究其成分,实验
2 3 2 4 2
过程如图所示:
下列说法错误的是( )
A.步骤Ⅰ中得到的溶液一定显碱性
2
学科网(北京)股份有限公司B..步骤Ⅱ中沉淀若全部溶解,则原固体粉末一定有Ba(OH)、NaCO,一定没有KSO
2 2 3 2 4
C..步骤Ⅱ中沉淀若部分溶解,则原固体粉末一定有Ba(OH)、NaCO、KSO
2 2 3 2 4
D..步骤Ⅱ中沉淀若不溶解,则原固体粉末一定有Ba(OH),可能有NaCO、KSO
2 2 3 2 4
二、填空与简答题(本题包括5个小题,共30分)
9.(5分)空气又称大气,是生命、燃烧和工业等所需氧的主要来源。
(1)空气中,氧气的体积分数约为 ;构成氧气的粒子是 (写化学式)。
(2)氧原子结构示意图为 ,在化学变化中易 (填“得到”或“失去”)电子。
(3)在低温、加压条件下,将空气液化,然后将温度升高至﹣196℃~﹣183℃,使液态氮先蒸发,剩
余液态氧储存于钢瓶中。从微观视角分析,空气液化过程中,主要改变的是 。
10.(5分)溶液与人类的生产生活息息相关。
(1)下列物质分别放入适量水中,充分搅拌,能够得到溶液的是 (填字母标号)。
A.面粉
B.白糖
C.豆油
(2)配制一定溶质质量分数的溶液的步骤有:①溶解②计算③装瓶并贴标签④称量(量取)。其正确
的顺序为 (填序号)。
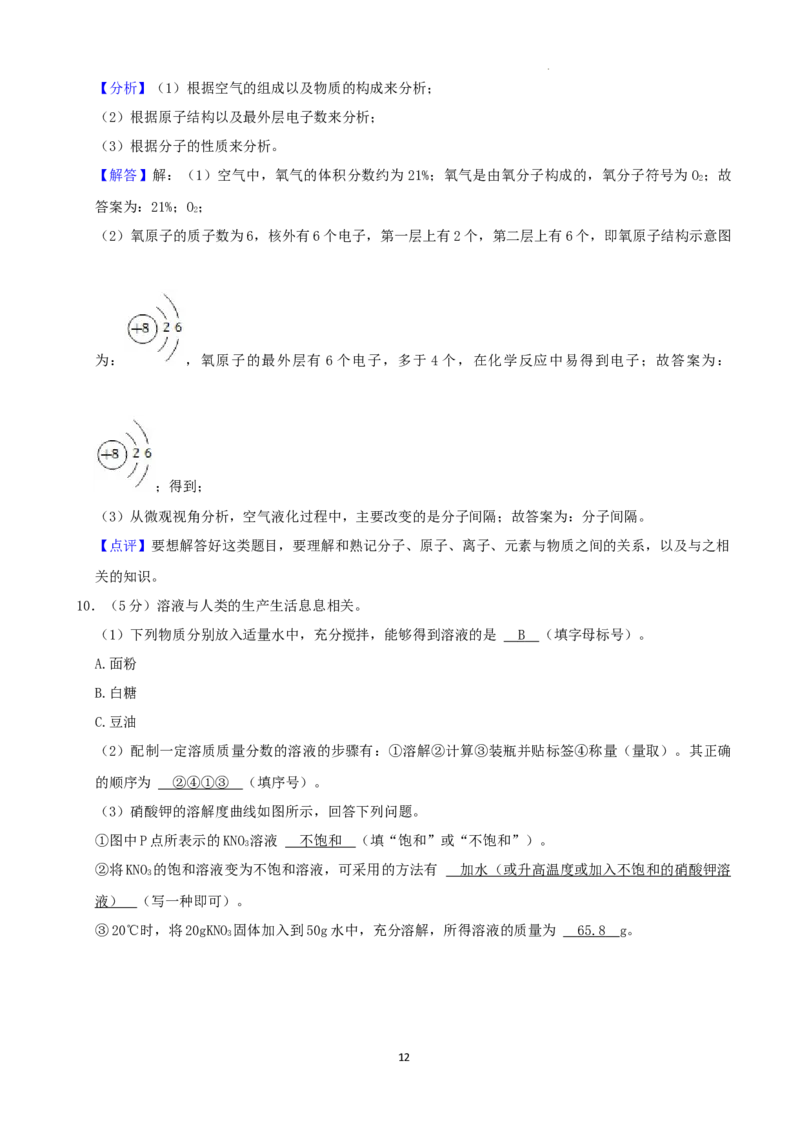
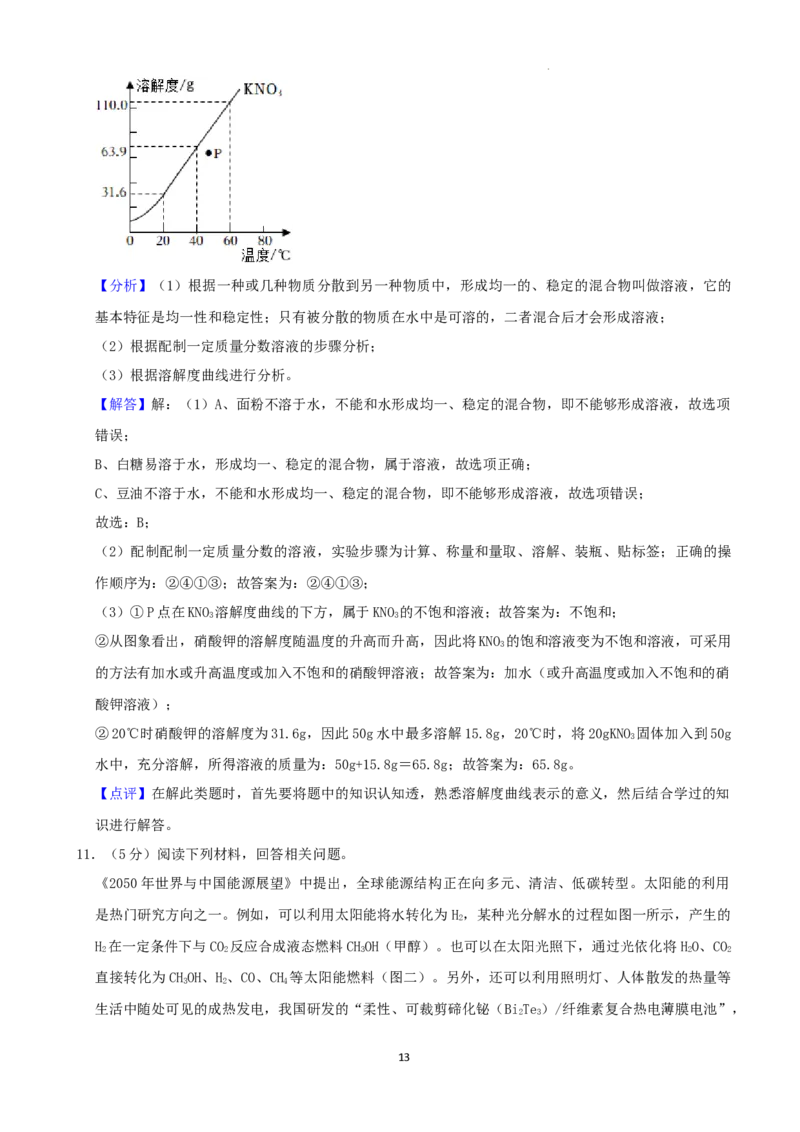
(3)硝酸钾的溶解度曲线如图所示,回答下列问题。
①图中P点所表示的KNO 溶液 (填“饱和”或“不饱和”)。
3
②将KNO 的饱和溶液变为不饱和溶液,可采用的方法有 (写一种即可)。
3
③20℃时,将20gKNO 固体加入到50g水中,充分溶解,所得溶液的质量为 g。
3
11.(5分)阅读下列材料,回答相关问题。
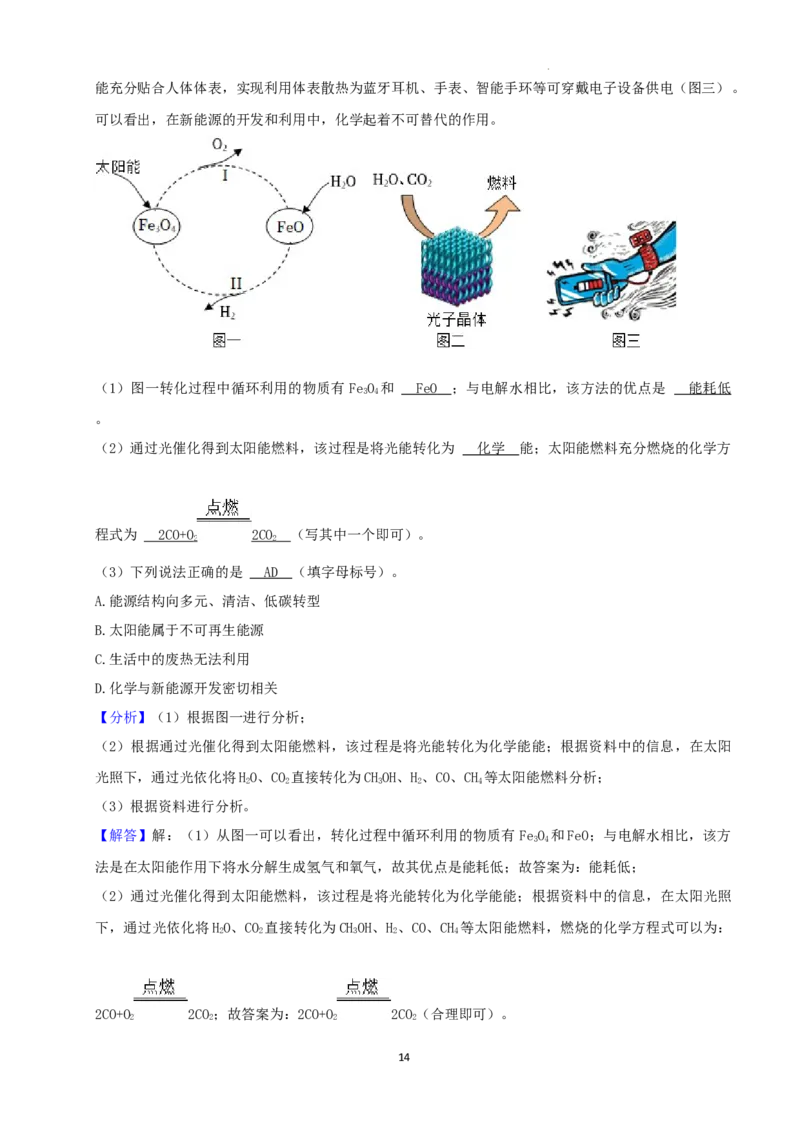
《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用
是热门研究方向之一。例如,可以利用太阳能将水转化为H,某种光分解水的过程如图一所示,产生的
2
H 在一定条件下与CO 反应合成液态燃料CHOH(甲醇)。也可以在太阳光照下,通过光依化将 HO、CO
2 2 3 2 2
直接转化为CHOH、H 、CO、CH 等太阳能燃料(图二)。另外,还可以利用照明灯、人体散发的热量等
3 2 4
生活中随处可见的成热发电,我国研发的“柔性、可裁剪碲化铋(BiTe)/纤维素复合热电薄膜电池”,
2 3
3
学科网(北京)股份有限公司能充分贴合人体体表,实现利用体表散热为蓝牙耳机、手表、智能手环等可穿戴电子设备供电(图三)。
可以看出,在新能源的开发和利用中,化学起着不可替代的作用。
(1)图一转化过程中循环利用的物质有FeO 和 ;与电解水相比,该方法的优点是 。
3 4
(2)通过光催化得到太阳能燃料,该过程是将光能转化为 能;太阳能燃料充分燃烧的化学方
程式为 (写其中一个即可)。
(3)下列说法正确的是 (填字母标号)。
A.能源结构向多元、清洁、低碳转型
B.太阳能属于不可再生能源
C.生活中的废热无法利用
D.化学与新能源开发密切相关
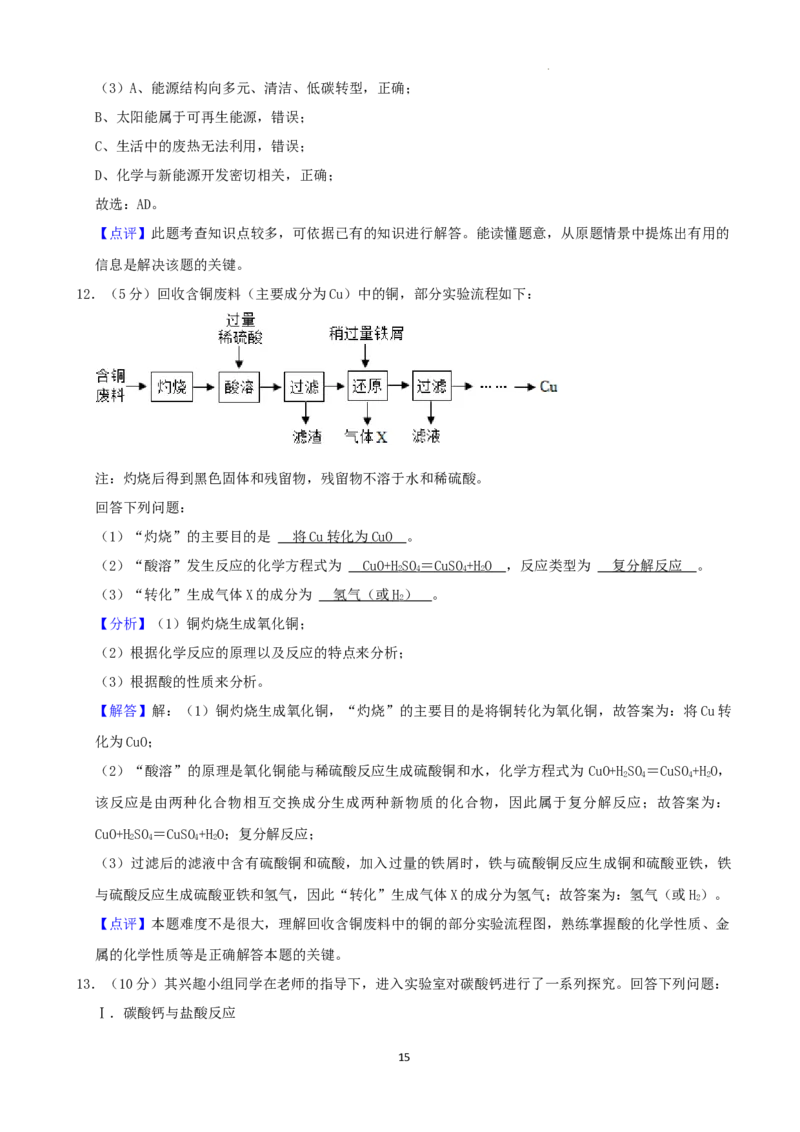
12.(5分)回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
回答下列问题:
(1)“灼烧”的主要目的是 。
(2)“酸溶”发生反应的化学方程式为 ,反应类型为 。
(3)“转化”生成气体X的成分为 。
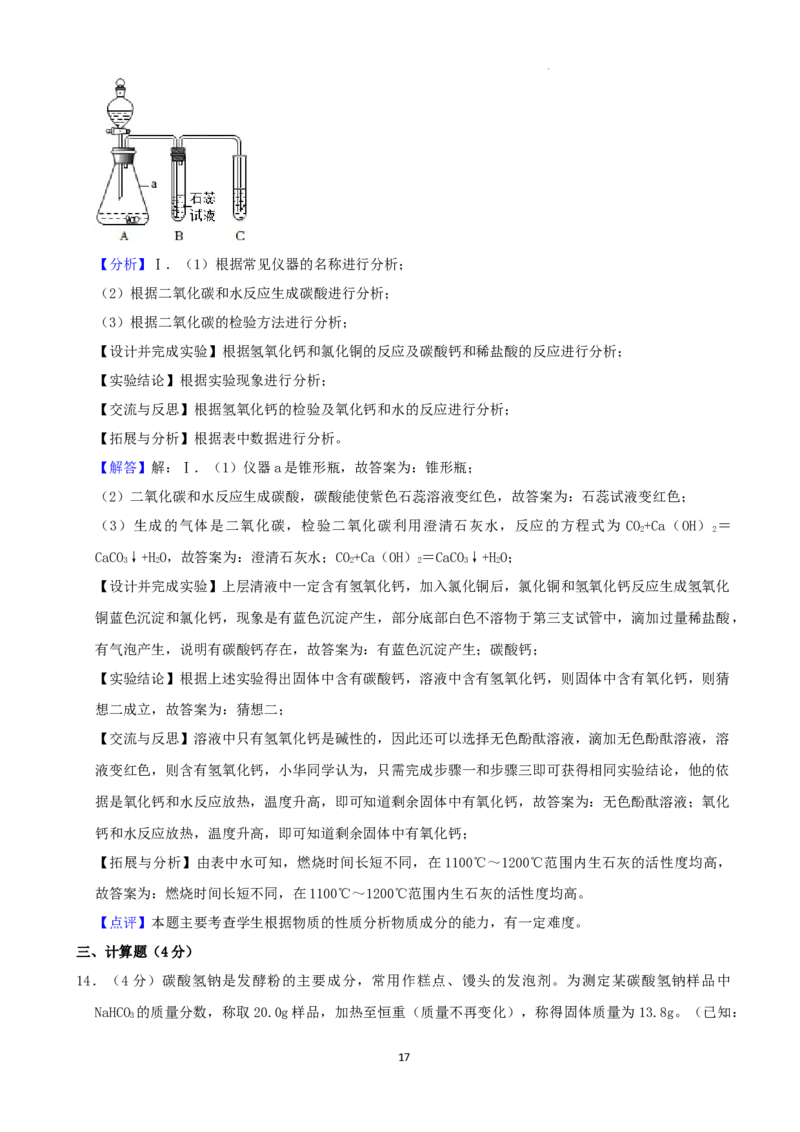
13.(10分)其兴趣小组同学在老师的指导下,进入实验室对碳酸钙进行了一系列探究。回答下列问题:
Ⅰ.碳酸钙与盐酸反应
(1)装置A中仪器a的名称为 。
(2)装置B中的现象是 。
4
学科网(北京)股份有限公司(3)装置C若用于检验生成的气体,其中试剂为 (写名称),发生反应的化学方程式为
。
Ⅱ.碳酸钙分解
碳酸钙在电炉中高温煅烧一段时间后,对剩余固体进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】猜想一:全部是碳酸钙
猜想二:是碳酸钙和氧化钙的混合物
猜想三:全部是氧化钙
【设计并完成实验】
实验操作 实验现象 解释与结论
步骤一:取剩余固体于试管中,加水振荡后静置 底部有白色不\
溶物
步骤二:取上层清液于另一试管中,滴加氯化铜溶 有 上层清液中一定含有氢
液 氧化钙
步骤三:取部分底部白色不溶物于第三支试管中, 有气泡产生 白色不溶物中一定含有
滴加过量稀盐酸
【实验结论】正确的猜想是 。
【交流与反思】小芳同学认为,步骤二中还可滴加其他试剂用来替代氯化铜溶液,该试剂可以是
(写一种即可);小华同学认为,只需完成步骤一和步骤三即可获得相同实验结论,他的依据是
。
【拓展与分析】查阅资料:生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一
定质量的生石灰,加入一定量的水,用一定溶质质量分数的盐酸中和,记录所消耗盐酸的体积(单位为
mL)。消耗盐酸的体积数越大,“活性度”越高。
测得煅烧产物(CaO)的活性度,数据见如表。
煅烧温度 1050℃ 1100℃ 1150℃ 1200℃ 1250℃ 1300℃
活性度
煅烧时间
12 min 790 836 868 808 454 412
16 min 793 856 871 845 556 530
20 min 795 863 873 864 617 623
石灰石煅烧的最佳温度范围一般为1100℃~1200℃的证据是 。
5
学科网(北京)股份有限公司三、计算题(4分)
14.(4分)碳酸氢钠是发酵粉的主要成分,常用作糕点、馒头的发泡剂。为测定某碳酸氢钠样品中
NaHCO 的质量分数,称取20.0g样品,加热至恒重(质量不再变化),称得固体质量为13.8g。(已知:
3
样品中杂质在加热过程中不发生变化)
(1)计算样品中NaHCO 的质量分数。(写出计算过程)
3
(2)若上述测定过程中未加热至恒重,则测得NaHCO 的质量分数将 。(填“偏小”、“偏
3
大”或“无影响”)。
6
学科网(北京)股份有限公司一、选择题(共8小题,每小题2分,满分16分)
1.2022年北京冬奥会取得圆满成功。下列冬奥会用品涉及的材料中,属于金属材料的是( )
A. “冰墩墩”——PET纤维
B. 场馆使用的太阳能电池——晶体硅
C. 速滑冰刀——钛合金
D. 冰壶——花岗岩
【分析】金属材料包括纯金属和合金。
【解答】解:A、PET纤维是一种合成纤维,属于合成材料,故错误;
B、晶体硅是一种固态非金属单质,故错误;
C、钛合金属于金属材料,故正确;
D、花岗岩是一种天然材料,故错误。
故选:C。
【点评】解答这类题目时,要熟记和理解金属材料及其应用等相关知识。
2.氯元素形成的化合物种类较多。下列化合物中氯元素为+5价的是( )
A.NaClO B.KClO C.HClO D.ClO
3 4 2
【分析】根据化合物中正负化合价代数和为0分析。
【解答】解:A、NaClO 中钠元素为+1价,氧元素为﹣2价,设氯元素化合价为x,则有(+1)+x+(﹣
3
2)×3=0,x=+5,故A正确。
B、KClO 中钾元素为+1价,氧元素为﹣2价,设氯元素化合价为x,则有(+1)+x+(﹣2)×4=0,x=
4
+7,故B错误。
C、HClO中氢元素为+1价,氧元素为﹣2价,设氯元素化合价为x,则有(+1)+x+(﹣2)=0,x=
7
学科网(北京)股份有限公司+1,故C错误。
D、ClO 中氧元素为﹣2价,设氯元素化合价为x,则有x+(﹣2)×2=0,x=+4,故D错误。
2
故选:A。
【点评】本题难度不大,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化
合价的方法即可正确解答此类题。
3.下列有关液体的实验操作中,正确的是( )
A. 取液 B. 加热
C. 稀释 D. 过滤
【分析】根据基本实验操作的正确方法以及注意事项来分析。
【解答】解:A、使用胶头滴管的过程中,始终保持橡胶乳头在上,不平放,更不能倒置,以免试剂腐
蚀胶帽,图中所示操作错误。
B、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的三分
之一,图中所示操作错误。
C、稀释浓硫酸时,要将浓硫酸沿着烧杯壁慢慢注入水中,且不断地用玻璃棒搅拌,切不可将水直接倒
入浓硫酸中,图中所示操作正确。
D、图示过滤操作过程中没有用玻璃棒进行引流,图中所示操作错误。
故选:C。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项
是解答此类试题的关键。
4.下列物质的用途主要由其物理性质决定的是( )
A.用稀盐酸除铁锈 B.用石墨做电极
C.用生石灰作干燥剂 D.用铁矿石炼铁
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱性、
稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状
态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、吸附性、延展性等。
8
学科网(北京)股份有限公司【解答】解:A、用稀盐酸除铁锈是利用盐酸的酸性,属于化学性质;故选项错误;
B、用石墨做电极是利用石墨的导电性,属于物理性质;故选项正确;
C、用生石灰作干燥剂是利用生石灰和水反应生成熟石灰,属于生石灰的化学性质;故选项错误;
D、用铁矿石炼铁利用的是化学性质;故选项错误;
故选:B。
【点评】本考点考查了物理性质和化学性质的区分,要记忆有关盐酸、石墨、生石灰、铁矿石的性质,
并能够在比较的基础上进行应用,本考点的基础性比较强,主要出现在选择题和填空题中。
5.下列图像能正确反映其对应关系的是( )
A.电解水
B.向NaOH溶液中不断加水
C.向CaCl 溶液中滴加NaCO 溶液至过量
2 2 3
D.向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀硫酸至过量
【分析】A、根据电解水的知识来分析;
B、根据溶液的pH与酸碱性来分析;
C、根据盐之间的反应来分析;
D、根据金属与酸的反应来分析。
【解答】解:A、电解水时,生成氢气与氧气的体积比为2:1,质量比为1:8,图像错误;
B、氢氧化钠溶液显碱性,pH大于7,加水稀释时溶液的碱性减弱,pH变小,但溶液始终呈碱性,pH不
会等于7,更不会小于7,图像错误;
C、氯化钙与碳酸钠反应生成氯化钠和碳酸钙沉淀,因此向 CaCl 溶液中滴加NaCO 溶液时,立即产生沉
2 2 3
淀,当氯化钙完全反应后,沉淀的质量不再增大,图像错误;
D、向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀硫酸,开始一段时间滴加硫酸量相等,产生氢气
应相等,线应重合一段,最后镁生成的氢气质量多于铁生成的氢气质量,图像正确。
故选:D。
【点评】本题是一道图象坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确
分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图象。
6.下列物质中,前者属于氧化物,后者属于混合物的是( )
A.熟石灰、海水 B.冰水混合物、食盐水
9
学科网(北京)股份有限公司C.干冰、硫酸钠 D.生铁、二氧化锰
【分析】物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成;纯净物是由一种物质组成。
纯净物又分为单质和化合物。由同种元素组成的纯净物叫单质;由两种或两种以上的元素组成的纯净物
叫化合物。氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素。
【解答】解:A、熟石灰属于化合物但不是氧化物,因为它有三种元素,海水属于混合物,故选项错误;
B、冰水混合物中只有水分子,属于氧化物;食盐水属于混合物,故选项正确;
C、干冰属于氧化物,硫酸钠属于化合物但不是氧化物,因为它有三种元素,故选项错误;
D、生铁属于混合物,二氧化锰属于氧化物,故选项错误;
故选:B。
【点评】本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,
并能够区分应用。本考点的基础性比较强,主要出现在选择题和填空题中。
7.下列几种常用的灭火方法及灭火原理均正确的是( )
选项 实例 灭火方法 灭火原理
A 油锅着火 用水浇灭 使温度降
到可燃物
的着火点
以下
B 液化气起 关闭阀门 隔绝空气
火
C 住宅失火 用高压水 降低可燃
枪灭火 物着火点
D 森林着火 砍伐出隔 移走可燃
离带 物
A.A B.B C.C D.D
【分析】根据灭火的原理判断,灭火的原理有三个,一是清除可燃物或把可燃物与其它物品隔离,二是
隔绝氧气或空气,三是降低可燃物的温度到着火点以下,三者具其一即可.
【解答】解:A、油锅着火不能用水浇灭,因为油不溶于水且密度比水小,浮于水面上,达不到灭火的
目的,故错误。
B、液化气起火,关闭阀门,清除可燃物而灭火,故错误。
C、住宅失火用水浇,水蒸发吸热,能降低可燃物的温度到着火点以下,从而达到灭火的目的。可燃物
的着火点一般不变,故错误。
D、森林着火,砍伐出隔离带是利用清除可燃物或把可燃物与其它物品隔离的原理,故正确。
故选:D。
【点评】燃烧是初中化学上的基本概念,是考查的重点之一,主要以考查燃烧的定义、燃烧的条件和灭
火的原理及逃生措施,理解燃烧的定义,掌握燃烧的条件和灭火的原理是解题的前提.
10
学科网(北京)股份有限公司8.实验室有一包固体粉末,可能含有NaCO 、KSO 、Ba(OH) 中的一种或几种。为了探究其成分,实验
2 3 2 4 2
过程如图所示:
下列说法错误的是( )
A.步骤Ⅰ中得到的溶液一定显碱性
B..步骤Ⅱ中沉淀若全部溶解,则原固体粉末一定有Ba(OH)、NaCO,一定没有KSO
2 2 3 2 4
C..步骤Ⅱ中沉淀若部分溶解,则原固体粉末一定有Ba(OH)、NaCO、KSO
2 2 3 2 4
D..步骤Ⅱ中沉淀若不溶解,则原固体粉末一定有Ba(OH),可能有NaCO、KSO
2 2 3 2 4
【分析】根据碳酸根离子和钡离子反应生成溶于酸的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于
酸的硫酸钡沉淀等知识进行分析。
【解答】解:碳酸根离子和钡离子反应生成溶于酸的碳酸钡沉淀,硫酸根离子和钡离子反应生成不溶于
酸的硫酸钡沉淀。
碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,硫酸钾和氢氧化钡反应生成硫酸钡沉淀和氢氧化钾,
A、步骤Ⅰ中得到的溶液一定显碱性,故A正确;
B、步骤Ⅱ中沉淀若全部溶解,沉淀一定只含有碳酸钡,一定不含硫酸钡,原固体粉末一定有Ba(OH)
、NaCO,一定没有KSO,故B正确;
2 2 3 2 4
C、步骤Ⅱ中沉淀若部分溶解,沉淀中一定含有碳酸钡和硫酸钡,原固体粉末一定有 Ba(OH) 、
2
NaCO、KSO,故C正确;
2 3 2 4
D、步骤Ⅱ中沉淀若不溶解,则原固体粉末一定有氢氧化钡和硫酸钾,一定不含碳酸钠,故D错误。
故选:D。
【点评】在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各
物质的存在性,最后进行验证即可。
二、填空与简答题(本题包括5个小题,共30分)
9.(5分)空气又称大气,是生命、燃烧和工业等所需氧的主要来源。
(1)空气中,氧气的体积分数约为 21 % ;构成氧气的粒子是 O (写化学式)。
2
(2)氧原子结构示意图为 ,在化学变化中易 得到 (填“得到”或“失去”)电子。
(3)在低温、加压条件下,将空气液化,然后将温度升高至﹣196℃~﹣183℃,使液态氮先蒸发,剩
余液态氧储存于钢瓶中。从微观视角分析,空气液化过程中,主要改变的是 分子间隔 。
11
学科网(北京)股份有限公司【分析】(1)根据空气的组成以及物质的构成来分析;
(2)根据原子结构以及最外层电子数来分析;
(3)根据分子的性质来分析。
【解答】解:(1)空气中,氧气的体积分数约为21%;氧气是由氧分子构成的,氧分子符号为O ;故
2
答案为:21%;O;
2
(2)氧原子的质子数为6,核外有6个电子,第一层上有2个,第二层上有6个,即氧原子结构示意图
为: ,氧原子的最外层有 6个电子,多于 4个,在化学反应中易得到电子;故答案为:
;得到;
(3)从微观视角分析,空气液化过程中,主要改变的是分子间隔;故答案为:分子间隔。
【点评】要想解答好这类题目,要理解和熟记分子、原子、离子、元素与物质之间的关系,以及与之相
关的知识。
10.(5分)溶液与人类的生产生活息息相关。
(1)下列物质分别放入适量水中,充分搅拌,能够得到溶液的是 B (填字母标号)。
A.面粉
B.白糖
C.豆油
(2)配制一定溶质质量分数的溶液的步骤有:①溶解②计算③装瓶并贴标签④称量(量取)。其正确
的顺序为 ②④①③ (填序号)。
(3)硝酸钾的溶解度曲线如图所示,回答下列问题。
①图中P点所表示的KNO 溶液 不饱和 (填“饱和”或“不饱和”)。
3
②将KNO 的饱和溶液变为不饱和溶液,可采用的方法有 加水(或升高温度或加入不饱和的硝酸钾溶
3
液) (写一种即可)。
③20℃时,将20gKNO 固体加入到50g水中,充分溶解,所得溶液的质量为 65. 8 g。
3
12
学科网(北京)股份有限公司【分析】(1)根据一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的
基本特征是均一性和稳定性;只有被分散的物质在水中是可溶的,二者混合后才会形成溶液;
(2)根据配制一定质量分数溶液的步骤分析;
(3)根据溶解度曲线进行分析。
【解答】解:(1)A、面粉不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项
错误;
B、白糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项正确;
C、豆油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误;
故选:B;
(2)配制配制一定质量分数的溶液,实验步骤为计算、称量和量取、溶解、装瓶、贴标签;正确的操
作顺序为:②④①③;故答案为:②④①③;
(3)①P点在KNO 溶解度曲线的下方,属于KNO 的不饱和溶液;故答案为:不饱和;
3 3
②从图象看出,硝酸钾的溶解度随温度的升高而升高,因此将KNO 的饱和溶液变为不饱和溶液,可采用
3
的方法有加水或升高温度或加入不饱和的硝酸钾溶液;故答案为:加水(或升高温度或加入不饱和的硝
酸钾溶液);
②20℃时硝酸钾的溶解度为31.6g,因此50g水中最多溶解15.8g,20℃时,将20gKNO 固体加入到50g
3
水中,充分溶解,所得溶液的质量为:50g+15.8g=65.8g;故答案为:65.8g。
【点评】在解此类题时,首先要将题中的知识认知透,熟悉溶解度曲线表示的意义,然后结合学过的知
识进行解答。
11.(5分)阅读下列材料,回答相关问题。
《2050年世界与中国能源展望》中提出,全球能源结构正在向多元、清洁、低碳转型。太阳能的利用
是热门研究方向之一。例如,可以利用太阳能将水转化为H,某种光分解水的过程如图一所示,产生的
2
H 在一定条件下与CO 反应合成液态燃料CHOH(甲醇)。也可以在太阳光照下,通过光依化将 HO、CO
2 2 3 2 2
直接转化为CHOH、H 、CO、CH 等太阳能燃料(图二)。另外,还可以利用照明灯、人体散发的热量等
3 2 4
生活中随处可见的成热发电,我国研发的“柔性、可裁剪碲化铋(BiTe)/纤维素复合热电薄膜电池”,
2 3
13
学科网(北京)股份有限公司能充分贴合人体体表,实现利用体表散热为蓝牙耳机、手表、智能手环等可穿戴电子设备供电(图三)。
可以看出,在新能源的开发和利用中,化学起着不可替代的作用。
(1)图一转化过程中循环利用的物质有FeO 和 FeO ;与电解水相比,该方法的优点是 能耗低
3 4
。
(2)通过光催化得到太阳能燃料,该过程是将光能转化为 化学 能;太阳能燃料充分燃烧的化学方
程式为 2CO+ O 2CO (写其中一个即可)。
2 2
(3)下列说法正确的是 A D (填字母标号)。
A.能源结构向多元、清洁、低碳转型
B.太阳能属于不可再生能源
C.生活中的废热无法利用
D.化学与新能源开发密切相关
【分析】(1)根据图一进行分析;
(2)根据通过光催化得到太阳能燃料,该过程是将光能转化为化学能能;根据资料中的信息,在太阳
光照下,通过光依化将HO、CO 直接转化为CHOH、H、CO、CH 等太阳能燃料分析;
2 2 3 2 4
(3)根据资料进行分析。
【解答】解:(1)从图一可以看出,转化过程中循环利用的物质有 FeO 和FeO;与电解水相比,该方
3 4
法是在太阳能作用下将水分解生成氢气和氧气,故其优点是能耗低;故答案为:能耗低;
(2)通过光催化得到太阳能燃料,该过程是将光能转化为化学能能;根据资料中的信息,在太阳光照
下,通过光依化将HO、CO 直接转化为CHOH、H 、CO、CH 等太阳能燃料,燃烧的化学方程式可以为:
2 2 3 2 4
2CO+O 2CO;故答案为:2CO+O 2CO(合理即可)。
2 2 2 2
14
学科网(北京)股份有限公司(3)A、能源结构向多元、清洁、低碳转型,正确;
B、太阳能属于可再生能源,错误;
C、生活中的废热无法利用,错误;
D、化学与新能源开发密切相关,正确;
故选:AD。
【点评】此题考查知识点较多,可依据已有的知识进行解答。能读懂题意,从原题情景中提炼出有用的
信息是解决该题的关键。
12.(5分)回收含铜废料(主要成分为Cu)中的铜,部分实验流程如下:
注:灼烧后得到黑色固体和残留物,残留物不溶于水和稀硫酸。
回答下列问题:
(1)“灼烧”的主要目的是 将 C u 转化为 Cu O 。
(2)“酸溶”发生反应的化学方程式为 CuO+ HSO = CuS O+H O ,反应类型为 复分解反应 。
2 4 4 2
(3)“转化”生成气体X的成分为 氢气(或 H) 。
2
【分析】(1)铜灼烧生成氧化铜;
(2)根据化学反应的原理以及反应的特点来分析;
(3)根据酸的性质来分析。
【解答】解:(1)铜灼烧生成氧化铜,“灼烧”的主要目的是将铜转化为氧化铜,故答案为:将Cu转
化为CuO;
(2)“酸溶”的原理是氧化铜能与稀硫酸反应生成硫酸铜和水,化学方程式为 CuO+HSO =CuSO+HO,
2 4 4 2
该反应是由两种化合物相互交换成分生成两种新物质的化合物,因此属于复分解反应;故答案为:
CuO+HSO=CuSO+HO;复分解反应;
2 4 4 2
(3)过滤后的滤液中含有硫酸铜和硫酸,加入过量的铁屑时,铁与硫酸铜反应生成铜和硫酸亚铁,铁
与硫酸反应生成硫酸亚铁和氢气,因此“转化”生成气体X的成分为氢气;故答案为:氢气(或H)。
2
【点评】本题难度不是很大,理解回收含铜废料中的铜的部分实验流程图,熟练掌握酸的化学性质、金
属的化学性质等是正确解答本题的关键。
13.(10分)其兴趣小组同学在老师的指导下,进入实验室对碳酸钙进行了一系列探究。回答下列问题:
Ⅰ.碳酸钙与盐酸反应
15
学科网(北京)股份有限公司(1)装置A中仪器a的名称为 锥形瓶 。
(2)装置B中的现象是 石蕊试液变红 。
(3)装置C若用于检验生成的气体,其中试剂为 澄清石灰水 (写名称),发生反应的化学方程式
为 C O +C a ( O H ) = CaC O ↓ + H O 。
2 2 3 2
Ⅱ.碳酸钙分解
碳酸钙在电炉中高温煅烧一段时间后,对剩余固体进行探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】猜想一:全部是碳酸钙
猜想二:是碳酸钙和氧化钙的混合物
猜想三:全部是氧化钙
【设计并完成实验】
实验操作 实验现象 解释与结论
步骤一:取剩余固体于试管中,加水振荡后静置 底部有白色不\
溶物
步骤二:取上层清液于另一试管中,滴加氯化铜溶 有 蓝色沉 上层清液中一定含有氢
液 淀产生 氧化钙
步骤三:取部分底部白色不溶物于第三支试管中, 有气泡产生 白色不溶物中一定含有
滴加过量稀盐酸 碳酸钙
【实验结论】正确的猜想是 猜想二 。
【交流与反思】小芳同学认为,步骤二中还可滴加其他试剂用来替代氯化铜溶液,该试剂可以是 无
色酚酞溶液 (写一种即可);小华同学认为,只需完成步骤一和步骤三即可获得相同实验结论,他的
依据是 氧化钙和水反应放热,温度升高,即可知道剩余固体中有氧化钙 。
【拓展与分析】查阅资料:生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一
定质量的生石灰,加入一定量的水,用一定溶质质量分数的盐酸中和,记录所消耗盐酸的体积(单位为
mL)。消耗盐酸的体积数越大,“活性度”越高。
测得煅烧产物(CaO)的活性度,数据见如表。
煅烧温度 1050℃ 1100℃ 1150℃ 1200℃ 1250℃ 1300℃
活性度
煅烧时间
12 min 790 836 868 808 454 412
16 min 793 856 871 845 556 530
20 min 795 863 873 864 617 623
石灰石煅烧的最佳温度范围一般为1100℃~1200℃的证据是 燃烧时间长短不同,在 110 0 ℃~ 120 0 ℃
范围内生石灰的活性度均高 。
16
学科网(北京)股份有限公司【分析】Ⅰ.(1)根据常见仪器的名称进行分析;
(2)根据二氧化碳和水反应生成碳酸进行分析;
(3)根据二氧化碳的检验方法进行分析;
【设计并完成实验】根据氢氧化钙和氯化铜的反应及碳酸钙和稀盐酸的反应进行分析;
【实验结论】根据实验现象进行分析;
【交流与反思】根据氢氧化钙的检验及氧化钙和水的反应进行分析;
【拓展与分析】根据表中数据进行分析。
【解答】解:Ⅰ.(1)仪器a是锥形瓶,故答案为:锥形瓶;
(2)二氧化碳和水反应生成碳酸,碳酸能使紫色石蕊溶液变红色,故答案为:石蕊试液变红色;
(3)生成的气体是二氧化碳,检验二氧化碳利用澄清石灰水,反应的方程式为 CO+Ca(OH) =
2 2
CaCO↓+HO,故答案为:澄清石灰水;CO+Ca(OH)=CaCO↓+HO;
3 2 2 2 3 2
【设计并完成实验】上层清液中一定含有氢氧化钙,加入氯化铜后,氯化铜和氢氧化钙反应生成氢氧化
铜蓝色沉淀和氯化钙,现象是有蓝色沉淀产生,部分底部白色不溶物于第三支试管中,滴加过量稀盐酸,
有气泡产生,说明有碳酸钙存在,故答案为:有蓝色沉淀产生;碳酸钙;
【实验结论】根据上述实验得出固体中含有碳酸钙,溶液中含有氢氧化钙,则固体中含有氧化钙,则猜
想二成立,故答案为:猜想二;
【交流与反思】溶液中只有氢氧化钙是碱性的,因此还可以选择无色酚酞溶液,滴加无色酚酞溶液,溶
液变红色,则含有氢氧化钙,小华同学认为,只需完成步骤一和步骤三即可获得相同实验结论,他的依
据是氧化钙和水反应放热,温度升高,即可知道剩余固体中有氧化钙,故答案为:无色酚酞溶液;氧化
钙和水反应放热,温度升高,即可知道剩余固体中有氧化钙;
【拓展与分析】由表中水可知,燃烧时间长短不同,在1100℃~1200℃范围内生石灰的活性度均高,
故答案为:燃烧时间长短不同,在1100℃~1200℃范围内生石灰的活性度均高。
【点评】本题主要考查学生根据物质的性质分析物质成分的能力,有一定难度。
三、计算题(4分)
14.(4分)碳酸氢钠是发酵粉的主要成分,常用作糕点、馒头的发泡剂。为测定某碳酸氢钠样品中
NaHCO 的质量分数,称取20.0g样品,加热至恒重(质量不再变化),称得固体质量为13.8g。(已知:
3
17
学科网(北京)股份有限公司样品中杂质在加热过程中不发生变化)
(1)计算样品中NaHCO 的质量分数。(写出计算过程)
3
(2)若上述测定过程中未加热至恒重,则测得NaHCO 的质量分数将 偏小 。(填“偏小”、“偏
3
大”或“无影响”)。
【分析】根据质量守恒定律,混合物减少的质量即为生成二氧化碳和水的质量之和,由反应的化学方程
式列式计算出参加反应的碳酸氢钠的质量即可。
【解答】解:(1)生成二氧化碳和水的质量之和为20g﹣13.8g=6.2g。
设样品中NaHCO 的质量为x。
3
2NaHCO NaCO+HO+CO↑
3 2 3 2 2
168 18 44 18+44=62
x 6.2g
x=16.8g
样品中NaHCO 的质量分数为 ×100%=84%。
3
(2)若上述测定过程中未加热至恒重,测定的剩余固体的质量偏大,则测得NaHCO 的质量分数将偏小。
3
答:(1)样品中NaHCO 的质量分数为84%。
3
(2)偏小。
【点评】本题有一定难度,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二
氧化碳和水的质量之和是正确解答本题的前提和关键。
18
学科网(北京)股份有限公司19
学科网(北京)股份有限公司