文档内容
重难点 01 离子反应及其应用
1.(2024·高一上·山西省部分学校·期末)NaCl溶于水的过程如图所示。下列叙述正确的是
A.NaCl固体不导电的原因是不含导电的离子
B.NaCl溶于水发生了化学变化
C.水分子能减弱 和 之间的作用力
D. 、 分别与水分子形成大小相同的环
【答案】C
【解析】A.NaCl固体中存在Na+、Cl-,但不能自由移动,无法导电,故A错误;
B.NaCl溶于水的过程没有生成新物质,属于物理变化,故B错误;
C.如图所示,水分子作用于阳离子和阴离子形成水合钠离子、水合氯离子,减弱了阴阳离子之间的作
用力,促进离子自由移动,故C正确;
D.6个水分子与氯离子形成六元环,5个水分子与钠离子形成5元环,环的大小不同,故D错误;
故答案为:C。
2.(2024·高一上·福建省龙岩市一级校联盟·期末)下列化学方程式或离子方程式中,正确的是
A.盐酸与铁屑的反应:
B. 与NaOH溶液的反应:
C. 溶液与铁粉的反应:
D.稀硝酸与铜片的反应:
【答案】B
【解析】A.盐酸与铁屑的反应生成氯化亚铁和氢气,反应的离子方程式为 ,故
A错误;
B. 与NaOH溶液的反应生成亚硫酸钠和水,反应的离子方程式是 ,故B
正确;
C. 溶液与铁粉的反应生成氯化亚铁,反应的离子方程式是 ,故C错误;
D.稀硝酸与铜片的反应放出一氧化氮气体,反应的化学方程式是
学科网(北京)股份有限公司,故D错误;
选B。
3.(2024·高一上·河南省开封市联考·期末)下列各组离子能在溶液中大量共存的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
【答案】B
【解析】A.溶液中的氯离子与银离子反应生成氯化银沉淀,不能大量共存,故A错误;
B.四种离子在溶液中不发生任何反应,能大量共存,故B正确;
C.酸性溶液中亚铁离子能与高锰酸根离子发生氧化还原反应,不能大量共存,故C错误;
D.溶液中氢离子能与碳酸氢根离子反应生成二氧化碳和水,不能大量共存,故D错误;
故选B。
4.(2024·高一上·河南省开封市联考·期末)下列反应的离子方程式书写正确的是
A.氧化亚铁与稀盐酸反应:
B.氢氧化钡溶液与硫酸铜溶液反应:
C.过氧化钠与水反应:
D.碳酸氢钠溶液与 溶液反应:
【答案】D
【解析】A.氧化亚铁与稀盐酸反应生成氯化亚铁和水,反应的离子方程式为 ,
故A错误;
B.氢氧化钡溶液与硫酸铜溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为
,故B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为
,故C错误;
D.碳酸氢钠溶液与氢氧化钠溶液反应生成碳酸钠和水,反应的离子方程式为
,故D正确;
故选D。
5.(2024·高一上·广东省茂名市·期末)下列反应方程式或离子方程式正确的是
A.铁和氯气反应的化学方程式:
B.钠和水反应的化学方程式:
C.用 溶液腐蚀覆铜板:
D.碳酸氢钠溶液和稀硫酸反应的离子方程式:
学科网(北京)股份有限公司【答案】C
【解析】A.铁与氯气反应生成氯化铁,A错误;
B.钠和水反应的化学方程式: ,B错误;
C.用 溶液腐蚀覆铜板实质是铜被氧化为铜离子: ,C正确;
D.碳酸氢钠溶液和稀硫酸反应的离子方程式: ,D错误;
故选C。
6.(2024·高一上·山西省部分学校·期末)下列指定反应的离子方程式书写正确的是
A. 溶液与过量NaOH溶液反应:
B. 溶液与 溶液反应:
C.酸性条件下 溶液与KI溶液发生反应生成 :
D.MgO与稀盐酸反应:
【答案】C
【解析】A. 与OH-反应生成 和水,反应的离子方程式为 ,故A错
误;
B.HSO 与Ba(OH) 反应的离子方程式为 ,故B错误;
2 4 2
C.酸性条件下KIO 溶液与KI溶液发生氧化还原反应生成I,反应的离子方程式为
3 2
,故C正确;
D.MgO不可拆分,反应的离子方程式为 ,故D错误;
故答案为:C。
7.(2024·高一上·江西省新余市·期末)下列实验对应的离子方程式书写正确的是
A.家庭中用食醋溶解水垢中的 :
B.向 溶液中加入过量的氨水:
C.碘化钾溶液酸化后加入少量双氧水:
D.将 通入水中与水反应:
【答案】C
【解析】A.醋酸是弱酸,离子方程式中不能拆成离子,应该写分子式,食醋溶解水垢中的 的离
子方程式为 ,A错误;
B.Al(OH) 不溶于氨水,向 溶液中加入过量的氨水的离子方程式为:
3
,B错误;
C.双氧水具有氧化性,碘离子具有还原性,碘化钾溶液酸化后加入少量双氧水反应的离子方程式为:
学科网(北京)股份有限公司,C正确;
D.HClO是弱酸,离子方程式中不能拆成离子,将 通入水中与水反应:
,D错误;
答案选C。
8.(2024·高一上·山东省青岛市·期末)能正确表示下列反应的离子方程式为
A.用稀硝酸清洗试管内壁的银:
B.铜箔制作印刷电路板:
C.向 溶液中加足量 溶液:
D. 溶液中通入足量氯气:
【答案】C
【解析】A.稀硝酸与铜反应时,生成硝酸银、一氧化氮等,则用稀硝酸清洗试管内壁的银:
,A不正确;
B.Cu的金属活动性比Fe弱,Cu不能还原Fe2+,则用铜箔制作印刷电路板:
,B不正确;
C.向 溶液中加足量 溶液, 完全转化为 : ,C正
确;
D.Cl 具有强氧化性,能将Fe2+、I-氧化,则 溶液中通入足量氯气:
2
,D不正确;
故选C。
9.(2024·高一上·湖南省名校联考联合体·期末)下列反应的离子方程式书写正确的是
A.金属铝溶于盐酸中:
B.向硫酸知中加入过量的氨水:
C. 溶液与 溶液混合:
D.实验室用二氧化锰和浓盐酸制氯气:
【答案】B
【解析】A.选项所给离子方程式得失电子不守恒,正确的离子方程式应为 ,
A错误;
B.氨水是弱碱,硫酸铝中加入过量氨水,生成氢氧化铝,同时生成铵根,选项所给离子方程式正确,
B正确;
C. 溶液与 溶液混合,生成氢氧化铜沉淀和硫酸钡沉淀,正确离子方程式应为
学科网(北京)股份有限公司,C错误;
D.实验室用二氧化锰和浓盐酸制氯气,离子方程式应为 ,
浓盐酸应拆开写,D错误;
本题选B。
10.(2024·高一上·江西省部分学校·期末)下列离子方程式中,正确的是
A. 和稀盐酸反应:
B. 溶液与过量氨水反应:
C. 与稀硫酸反应:
D. 溶液与 溶液反应:
【答案】B
【解析】A.Fe O 与盐酸反应生成氯化铁、氯化亚铁和水,离子方程式为:
3 4
,A项错误;
B.Al(OH) 不溶于氨水,所给离子方程式正确,B项正确;
3
C. 与稀硫酸反应生成硫酸镁和水,离子方程式为 ,C项错
误;
D. 溶液与 溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为
,D项错误;
故选B。
11.(2024·高一上·山东省日照市·期末)下列反应的离子方程式书写正确的是
A.向 溶液中投入少量 :
B.向酸性 溶液中滴加少量双氧水:
C.向漂白粉溶液中通入足量 :
D.向 溶液中滴加足量澄清石灰水:
【答案】C
【解析】A. 溶液中加少量 ,过氧化钠和水生成氢氧化钠和氧气,氢氧化钠和铁离子反应
生成氢氧化铁沉淀,A错误;
B.碘离子还原性大于亚铁离子,故少量的过氧化氢先氧化碘离子生成碘单质,B错误;
C.向漂白粉溶液中通入足量 ,会生成碳酸氢钙和次氯酸,C正确;
D.向 溶液中滴加足量澄清石灰水,少量的物质完全反应,应按少量的物质的电离比例书写
离子方程式, ,D错误;
学科网(北京)股份有限公司答案选C。
12.(2024·高一上·湖北省荆门市·期末)下列指定反应的离子方程式书写正确的是
A. 溶液中加入足量 溶液:
B.氢氧化钠溶液中加入过量碳酸氢钙溶液:
C.氢氧化镁溶于稀醋酸中:
D.向酸性 溶液中滴入少量 稀溶液:
【答案】D
【解析】A.Fe (SO ) 的酸性溶液中通入足量 ,Fe3+和 按照2:3比例完全反应,离子方程
2 4 3
式必须满足电荷守恒,正确的离子方程式为: ,
A错误;
B.氢氧化钠溶液中加入过量碳酸氢钙溶液,反应生成碳酸钙沉淀和水,正确的离子方程式为:
,B错误;
C.醋酸是弱酸,不能拆开,离子方程式为 ,C错
误;
D.向酸性 溶液中滴入少量 稀溶液,双氧水在酸性条件下将二价铁氧化生成三价铁:
,D正确;
答案选D。
13.(2024·高一上·重庆·期末)下列各组离子在水溶液中能大量共存的是
A. 、 、 、 B. 、 、 、
C. 、 、 、 D. 、 、 、
【答案】A
【解析】A.K+、Cu2+、 、Cl-相互间不能反应,能大量共存,故A选;
B.Mg2+与OH﹣反应成Mg(OH) 沉淀而不能大量共存,故B不选;
2
C.酸性条件下的 具有强氧化性,能将Fe2+氧化,不能大量共存,故C不选;
D.Ba2+与 生成BaCO 沉淀而不能大量共存,故D不选;
3
故选A。
14.(2024·高一上·天津市重点校·期末)下列指定反应的离子方程式正确的是
A.向 溶液中加入过量的 溶液:
B.将一粒钠投入硫酸铜溶液中:
C.向 的溶液中通入 :
学科网(北京)股份有限公司D.向澄清石灰水中加入过量的 溶液:
【答案】D
【解析】A.氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为Al3++4OH-
=AlO +2H O,故A错误;
2
B.钠投入硫酸铜溶液中,钠先与水反应,生成的NaOH和硫酸铜溶液再发生反应,反应的离子方程
式为2Na+2OH-+Cu2++2H O=2Na++Cu(OH) ↓+H ↑,故B错误;
2 2 2
C.亚铁离子还原性强于溴离子,向 的溶液中通入 ,离子方程式为
,故C错误;
D.向澄清石灰水中加入过量的 溶液,离子方程式为Ca2++OH-+ =CaCO ↓+H O,故D
3 2
正确;
故选D。
15.(2024·高一上·江西省新余市·期末)下列各组离子在指定溶液中一定能大量共存的是
A.强酸性溶液中: 、 、 、
B.澄清透明溶液中: 、 、 、
C.含有 的溶液: 、 、 、
D.与Al反应能生成 的溶液: 、 、 、
【答案】B
【解析】A.强酸性溶液中, 和 发生氧化还原反应生成铁离子,不共存,故A不符合题
意;
B.澄清透明溶液中: 、 、 、 不发生反应,可以大量共存,B符合题意;
C.含有 的溶液, 、 会和碳酸氢根反应生成碳酸钡沉淀,不能共存,故C不符合题
意;
D.与Al反应能生成 的溶液可以是酸性溶液,也可以是碱性溶液,在酸性条件下ClO-与H+反应生
成HClO弱电解质不能大量共存,D不符合题意;
答案选B。
16.(2024·高一上·吉林省长春市东北师范大学附属中学·期末)下列各组溶液中的离子能大量共存,且加
入(或通入)X试剂后发生反应的离子方程式书写正确的是
选项 离子组 X试剂 离子方程式
溶
A 、 、 、
液
B 、 、 、 过量氨水
学科网(北京)股份有限公司C 、 、 、 少量盐酸
D 、 、 、 足量
【答案】C
【解析】A.四种离子相互不反应在溶液中可大量共存,加入NaOH溶液,氢氧根离子、碳酸氢根离
子、钙离子生成碳酸钙沉淀和水,A错误;
B.铁离子具有氧化性,能和硫离子发生氧化还原反应而不能大量共存,B错误;
C.四种离子相互不反应在溶液中可大量共存,加入少量盐酸, 和氢离子生成氢氧化铝沉
淀和水,C正确;
D.四种离子相互不反应在溶液中可大量共存,通入足量的二氧化硫,和次氯酸根离子生成硫酸根离
子和氯离子: ,D错误;
故选C。
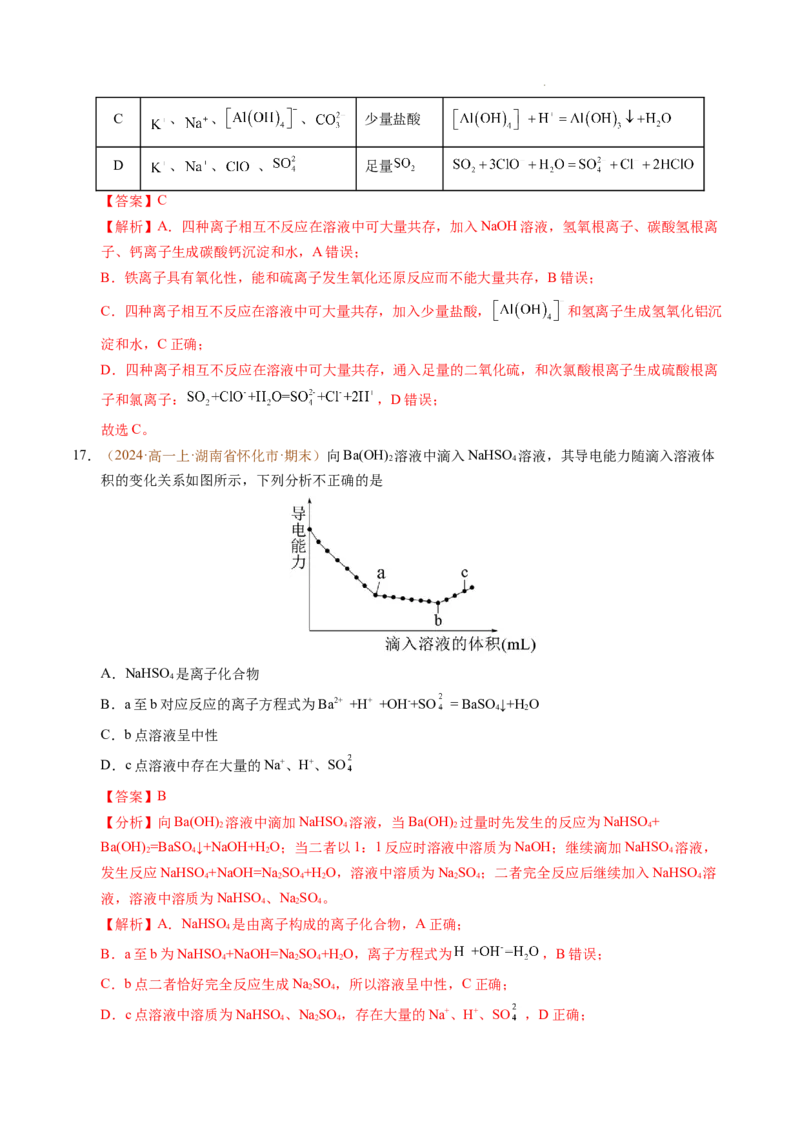
17.(2024·高一上·湖南省怀化市·期末)向Ba(OH) 溶液中滴入NaHSO 溶液,其导电能力随滴入溶液体
2 4
积的变化关系如图所示,下列分析不正确的是
A.NaHSO 是离子化合物
4
B.a至b对应反应的离子方程式为Ba2+ +H+ +OH-+SO = BaSO↓+H O
4 2
C.b点溶液呈中性
D.c点溶液中存在大量的Na+、H+、SO
【答案】B
【分析】向Ba(OH) 溶液中滴加NaHSO 溶液,当Ba(OH) 过量时先发生的反应为NaHSO+
2 4 2 4
Ba(OH) =BaSO ↓+NaOH+HO;当二者以1:1反应时溶液中溶质为NaOH;继续滴加NaHSO 溶液,
2 4 2 4
发生反应NaHSO+NaOH=Na SO +H O,溶液中溶质为NaSO ;二者完全反应后继续加入NaHSO 溶
4 2 4 2 2 4 4
液,溶液中溶质为NaHSO、NaSO 。
4 2 4
【解析】A.NaHSO 是由离子构成的离子化合物,A正确;
4
B.a至b为NaHSO+NaOH=Na SO +H O,离子方程式为 ,B错误;
4 2 4 2
C.b点二者恰好完全反应生成NaSO ,所以溶液呈中性,C正确;
2 4
D.c点溶液中溶质为NaHSO、NaSO ,存在大量的Na+、H+、SO ,D正确;
4 2 4
学科网(北京)股份有限公司答案选B。
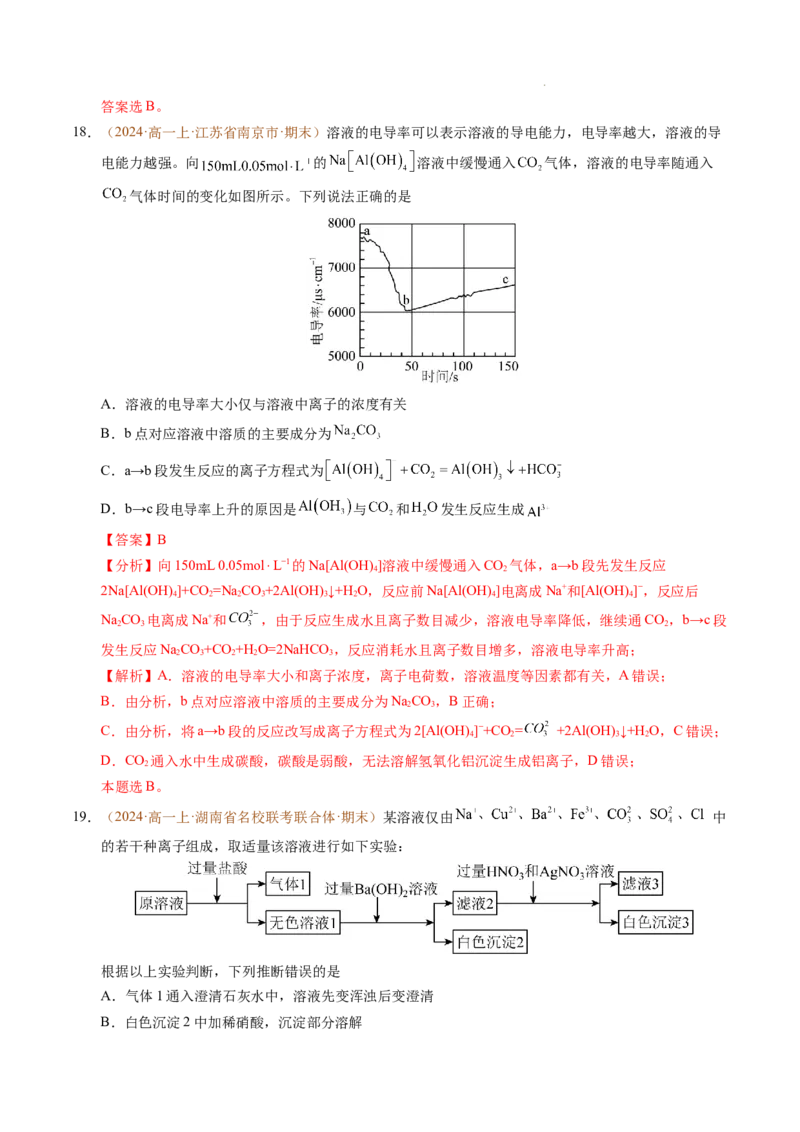
18.(2024·高一上·江苏省南京市·期末)溶液的电导率可以表示溶液的导电能力,电导率越大,溶液的导
电能力越强。向 的 溶液中缓慢通入 气体,溶液的电导率随通入
气体时间的变化如图所示。下列说法正确的是
A.溶液的电导率大小仅与溶液中离子的浓度有关
B.b点对应溶液中溶质的主要成分为
C.a→b段发生反应的离子方程式为
D.b→c段电导率上升的原因是 与 和 发生反应生成
【答案】B
【分析】向150mL 0.05mol⋅L−1的Na[Al(OH)]溶液中缓慢通入CO 气体,a→b段先发生反应
4 2
2Na[Al(OH)]+CO =Na CO+2Al(OH) ↓+H O,反应前Na[Al(OH)]电离成Na+和[Al(OH) ]−,反应后
4 2 2 3 3 2 4 4
NaCO 电离成Na+和 ,由于反应生成水且离子数目减少,溶液电导率降低,继续通CO,b→c段
2 3 2
发生反应NaCO+CO +H O=2NaHCO ,反应消耗水且离子数目增多,溶液电导率升高;
2 3 2 2 3
【解析】A.溶液的电导率大小和离子浓度,离子电荷数,溶液温度等因素都有关,A错误;
B.由分析,b点对应溶液中溶质的主要成分为NaCO,B正确;
2 3
C.由分析,将a→b段的反应改写成离子方程式为2[Al(OH) ]−+CO = +2Al(OH) ↓+H O,C错误;
4 2 3 2
D.CO 通入水中生成碳酸,碳酸是弱酸,无法溶解氢氧化铝沉淀生成铝离子,D错误;
2
本题选B。
19.(2024·高一上·湖南省名校联考联合体·期末)某溶液仅由 中
的若干种离子组成,取适量该溶液进行如下实验:
根据以上实验判断,下列推断错误的是
A.气体1通入澄清石灰水中,溶液先变浑浊后变澄清
B.白色沉淀2中加稀硝酸,沉淀部分溶解
学科网(北京)股份有限公司C.原溶液中阳离子浓度一定大于阴离子浓度
D.滤液2中加入碳酸钠溶液一定会产生白色沉淀
【答案】B
【分析】向原溶液中加入过量盐酸,有气体生成,气体1为CO,并得到无色溶液,则溶液中含
2
,不能含与 反应的Ba2+及蓝色Cu2+和黄色Fe3+;向所得的无色溶液1中加入过量氢氧化钡溶液,
产生白色沉淀,该白色沉淀2为BaSO,则原溶液中含 ;向所得的滤液2中加入过量稀硝酸和硝
4
酸银溶液,产生白色沉淀,,即有AgCl生成,但由于开始操作中加入了过量HCl,引入了Cl-,则不能
确定原溶液中是否有Cl-。根据溶液呈电中性规则可知,原溶液中一定含Na+;综上所述可知:原溶液
中一定含有Na+、 、 ,一定不含有Cu2+、Ba2+、Fe3+,可能含有Cl-,据此分析解答。
【解析】A.气体1是 ,将其通入澄清石灰水中,首先反应产生 沉淀,当 气体过量
时, 、 反应产生可溶性 ,因此气体1通入澄清石灰水中,溶液先变浑浊
后变澄清,A正确;
B.盐酸过量,白色沉淀2只能是 ,该物质既不溶于水,也不溶于稀硝酸,因此向沉淀2中加
稀硝酸,沉淀不溶解,B错误;
C.根据上述分析可知:原溶液中一定存在 ,不存在 , 可能存
在,也可能不存在,溶液电荷守恒,故 浓度一定大于阴离子浓度,C正确;
D.滤液2中含有 ,向其中加入碳酸钠溶液, 与 发生复分解反应产生
沉淀和 ,故一定会产生白色沉淀,D正确;
本题选B。
20.(2024·高一上·湖北省十堰市·期末)某溶液中只含有 、 、 、 、 、 、 中
的几种离子。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉
淀;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加足量 溶液,得到4.66g不溶于盐酸的
沉淀。(已知: ),由此可知原溶液中
A.至少存在5种离子 B. 一定存在,且
C. 、 一定存在,可能有 D. 、 一定不存在, 可能存在
【答案】B
【分析】由溶液中加入过量氢氧化钠溶液,加热,得到气体和红褐色沉淀可知,溶液中一定含有铵根
离子和铁离子,则溶液中一定不含有碳酸根离子,由原子个数守恒可知,溶液中铵根离子的物质的量
为0.02mol,铁离子的物质的量为 ×2=0.02mol;向滤液中加入足量氯化钡溶液,产生不溶于盐
酸的沉淀说明溶液中含有硫酸根离子,由硫酸钡的质量可知,溶液中硫酸根离子的物质的量为
学科网(北京)股份有限公司=0.02mol,阳离子电荷总数为0.02mol+3×0.02mol=0.08mol,阴离子电荷总数为
2×0.02mol=0.04mol,阳离子电荷总数大于阴离子电荷总数,则由电荷守恒可知,溶液中一定含有氯离
子,无法确定是否含有铝离子和钾离子。
【解析】A.由分析可知,溶液中一定含有铵根离子、铁离子、硫酸根离子和氯离子,一定不含有碳
酸根离子,无法确定是否含有铝离子和钾离子,故A错误;
B.由分析可知,溶液中一定含有铵根离子、铁离子、硫酸根离子和氯离子,一定不含有碳酸根离
子,无法确定是否含有铝离子和钾离子,则由电荷守恒可知,溶液中氯离子浓度不小于
=0.4mol/L,故B正确;
C.由分析可知,溶液中一定含有铵根离子、铁离子、硫酸根离子和氯离子,故C错误;
D.由分析可知,溶液中一定不含有碳酸根离子,无法确定是否含有铝离子,故D错误;故选B。
21.(2024·高一上·吉林省长春市东北师范大学附属中学·期末)某溶液X中仅可能含有 、 、
、 、 、 、 、 、 、 中的一种或多种,且溶液中各离子浓度相同。现进行
下列实验,下列说法正确的是(已知: 不能与 、 共存)
A.该溶液X中可能有 、
B.为了确认溶液X中是否含有 ,还需要取溶液滴加 观察现象
C.该溶液可能由是硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.如果气体Y能使石蕊试液变红,说明溶液中一定含有
【答案】C
【分析】
由实验流程图可知,原溶液中加入过量氯水,向反应后的溶液加入CCl 萃取,下层呈紫红色,则原溶
4
液中含有I-,但与Fe3+不能同时存在于溶液中,即原溶液中无Fe3+;此时上层的水溶液中一定含有氯
水还原生成的Cl-,所以不能确定Cl-是否存在于原溶液中;另外一份加入NaOH产生红褐色沉淀说
明溶液中存在Fe3+,那只能是Fe2+被氯水氧化生成的Fe3+,所以原溶液中含有Fe2+,Fe2+与 、
不共存,则原溶液中无 、 ,同时加热产生气体Y,则Y为NH ,则原溶液中含有
3
学科网(北京)股份有限公司;溶液Z的焰色反应为黄色说明含钠离子,但开始时加入了 NaOH,则不能确定原溶液中是否含Na
+,透过钴玻璃观察焰色反应为紫色火焰证明一定含K+;由于溶液中各离子浓度相等,即物质的量相
等,设离子物质的量为1mol,正电荷总数:1mol 2+1mol 1+1mol 1=4mol,根据溶液电荷守恒可
知,原溶液中一定含有 和Cl-,负电荷总数=1mol 2+1mol 1+1mol 1=4mol,所以溶液中没有
Na+;综上原溶液中一定含有 K+、Fe2+、 、 、I-、Cl-,一定没有Fe3+、Na+、 、
;
【解析】A.根据上述分析可知,一定没有 、 ,选项A错误;
B.根据上述分析可知,根据溶液电荷守恒可知,原溶液中一定含有 和Cl-,选项B错误;
C.原溶液中一定含有K+、Fe2+、 、 、I-、Cl-,则溶质可能为硫酸亚铁、碘化钾和氯化
铵,选项C正确;
D.如果气体Y能使湿润的红
22.(2024·高一上·湖北省部分省级示范高中·期末)某100mL无色溶液可能含有K+、NH 、Mg2+、Al3+、
Fe3+、CO 、Cl-中的若干种,取该溶液进行连续实验,试验过程如图(所加试剂均过量,气体全部逸
出),下列说法正确的是
A.原溶液一定存在K+、NH 、Mg2+、Al3+,一定不存在Fe3+、CO
B.原溶液中c(NH )=0.6mol/L
C.沉淀2的成分为Mg(OH) ,还有少量的Al(OH)
2 3
D.原溶液中c(Cl-)≥6mol/L
【答案】D
【分析】分析实验过程:无色溶液中不可能有黄色的Fe3+,加入氨水,生成沉淀,且沉淀部分溶解于
KOH溶液,则所得沉淀1一定是Mg(OH) 和Al(OH) 的混合物,沉淀2一定是Mg(OH) ,质量为
2 3 2
5.8g,Al(OH) 的质量为13.6g-5.8g=7.8g,则原溶液中一定存在Mg2+、Al3+;CO 和Mg2+、Al3+不共
3
存,则原溶液中一定不存在CO 。向所得到的滤液中加入氢氧化钾,出现气体,该气体为氨气;加
入了KOH再进行焰色反应,透过蓝色钴玻璃看到紫色,说明溶液中存在K+,但无法确定K+是原溶液
中存在的还是加入KOH溶液后引入的。
【解析】A.根据分析可知,可以确定原溶液中存在NH 、Mg2+、Al3+,一定不存在Fe3+、CO ,无
法确定是否存在K+,A项错误;
学科网(北京)股份有限公司B.由分析可知,加入KOH溶液后,产生的氨气的物质的量= ,可知在滤液中
n(NH )=0.6mol;滤液中的NH 一部分来源于加入的适量氨水,根据分析,可知生成的Mg(OH) 的物
2
质的量= ,Al(OH) 的物质的量= ,根据Mg2+、Al3+与氨水的反应方程
3
式,有关系式:OH-~NH ·H O,则加入的氨水的物质的量为0.5mol,原溶液中n(NH )=0.1mol,则原
3 2
溶液中c(NH )=1mol/L,B项错误;
C.沉淀2的成分为Mg(OH) ,因为在沉淀1中加入过量KOH溶液,Al(OH) 沉淀与KOH完全反应,
2 3
沉淀2中不含Al(OH) 沉淀,C项错误;
3
D.根据电荷守恒,氯离子的物质的量≥n(NH )+2n(Mg2+)+3n(Al3+)=0.1mol+0.2mol+0.3mol,则原溶液
中c(Cl-)≥6mol/L,D项正确;
答案选D。
23.(2024·高一上·湖南省名校联考联合体·期末)碘化亚铁( )在常温下为灰黑色固体,易升华,可溶
于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置
制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
(1)球形干燥管中的药品为 ,若无此装置,写出铁粉参与的副反应的化学方程式:
,硬质玻璃管中制备碘化亚铁的化学方程式为 。
(2)硬质玻璃管直接接入收集器而不用导管的原因是 ,收集器浸泡在冷水中的原因是
。
(3)试剂a的作用是 。
(4)已知氧化性: 。往含 的溶液中通入 标准状况下的氯气,充分反
应,请写出该反应的离子方程式: 。
【答案】(1)碱石灰(或无水 或 )
(2)防止碘化亚铁冷凝堵塞导管 利于碘化亚铁冷凝收集
(3)防止水蒸气进入收集器中
(4)
学科网(北京)股份有限公司【分析】为防止铁被氧气氧化,用焦性没食子酸的碱性溶液出去空气中的氧气,球形干燥管内盛干燥
剂防止水蒸气进入硬质玻璃管,硬质玻璃管内铁和碘单质反应生成碘化亚铁,FeI 在收集器内冷凝收
2
集,a中盛浓硫酸防止水进入收集器中。
【解析】(1) 可溶于水,易潮解,故球形干燥管中的药品为碱石灰(或无水 或 ),用于
除去气体中的水蒸气;若无此装置,铁粉会在高温条件下和水蒸气反应生成四氧化三铁和氢气,反应
方程式为3Fe+4H O(g) Fe O+4H ,硬质玻璃管中碘单质与铁粉反应生成碘化亚铁,化学方程式为
2 3 4 2
Fe+I FeI;
2 2
(2) 易升华,硬质玻璃管直接接入收集器而不用导管的原因是防止碘化亚铁冷凝堵塞导管;收
集器浸泡在冷水中的原因是利于碘化亚铁冷凝收集;
(3) 易潮解,故试剂a为浓硫酸,其作用是防止水蒸气进入收集器中使FeI 潮解;
2
(4)由氧化性: ,可知 与 均能反应,且还原性: ,因此往含
的溶液中通入 标准状况下的氯气(为 ), 首先氧化 ,根据 ,将
完全氧化消耗 ;剩下的 再氧化部分 生成 ,消耗 。故
该反应的离子方程式: 。
24.(2024·高一上·湖南省怀化市·期末)硫酰氯(SO Cl)常用于制造医药品、染料等。某实验小组拟用干燥
2 2
的氯气和二氧化硫在活性炭催化下制取硫酰氯,装置如图所示:
已知:SO Cl 的沸点为69℃,遇水能发生剧烈反应并产生白雾。
2 2
(1)仪器m的名称为 。
(2)②中所盛试剂为 ;③的作用是
(3)④采用 (“热水浴”或“冰水浴”,下同);⑤采用 。
(4)“尾气处理”装置最好选用 。(填字母序号)
A.盛有氢氧化钠溶液的洗气瓶
B.盛有浓硫酸的洗气瓶
C.盛有碱石灰的U型管
学科网(北京)股份有限公司(5)下图为地康法制氯气的反应原理示意图(反应I温度为450℃):
①反应II的化学方程式为
②一定条件下将Cl 通入填充有固体NaClO 的反应柱内,充分反应可制得新型自来水消毒剂ClO 。若
2 2 2
消耗标准状况下1.12LCl ,则理论制得ClO g。
2 2
【答案】(1)圆底烧瓶
(2)饱和食盐水 干燥氯气
(3)热水浴 冰水浴
(4)C
(5)2CuCl +O =2CuO+2Cl 6.75
2 2 2
【分析】利用纯净干燥的氯气和二氧化硫反应制取硫酰氯,由实验装置可知,装置①中制备氯气,装
置②中用饱和食盐水除去氯气中的氯化氢,装置③中浓硫酸干燥氯气,装置④中发生SO (g)
2
+Cl(g)=SOCl(l),SO Cl 的沸点为69℃,要使其变为蒸汽,应该采用热水浴,装置⑤中吸收产物,应
2 2 2 2 2
该采用冰水浴,最后吸收尾气。
【解析】(1)仪器m的名称为圆底烧瓶;
(2)由分析可知,②中所盛试剂为饱和食盐水,装置③的作用是干燥氯气;
(3)由分析可知,④采用热水浴;⑤采用冰水浴;
(4)由于SO Cl 遇水能发生剧烈反应并产生白雾,因此尾气处理装置既要吸收氯气,又要防止空气
2 2
中的水蒸气进入⑤中;
A.如果用盛有氢氧化钠溶液的洗气瓶,水蒸气可能进入⑤中,故不选;
B.盛有浓硫酸的洗气瓶不能吸收氯气,故不选;
C.盛有碱石灰的U型管既可以吸收氯气,又要防止空气中的水蒸气进入⑤中,故选;
答案为C;
(5)①由示意图可知,反应II的化学方程式为:2CuCl +O =2CuO+2Cl ;
2 2 2
②Cl 通入填充有固体NaClO 的反应柱内,充分反应可制得新型自来水消毒剂ClO ,反应的化学方程
2 2 2
式为:Cl+ 2NaClO=2ClO +2NaCl,若消耗标准状况下1.12LCl ,即消耗Cl0.05mol,生成的ClO 为
2 2 2 2 2 2
0.1mol,质量为 =6.75g。
25.(2024·高一上·湖南省名校联考联合体·期末)Ⅰ.某无色透明溶液中可能大量存在
中的几种,为确定溶液中的离子组成,取三份少量溶
液于试管中,进行了如下实验:
①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气
泡冒出;
学科网(北京)股份有限公司③向第三份溶液中先加入 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
已知: 可与水作用,产生较多的 ,使溶液呈碱性; 溶于稀硝酸。
(1)根据上述实验现象可知,原溶液中一定存在的离子是 ,一定不存在的离子是 ,
不能确定是否存在的离子是 。
Ⅱ.次磷酸 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与 溶液反应生成 气
体和 ,后者再与 反应生成 。
(2)写出白磷 与 溶液反应的化学方程式: ,反应中每消耗 ,转移的电子
数为 。
(3)写出 与足量 溶液反应的离子方程式: 。
(4)工业上利用 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产
物中 元素的化合价为 。
【答案】(1)
(2) 或
(3)
(4)
【解析】(1)溶液无色,则不含有 ;①向第一份溶液中滴入几滴酚酞试液,溶液变红,则溶液
显碱性,可能含有 或 ,不能含有 ;②向第二份溶液中加入过量 溶液,生成白色
沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出,说明含有 ,因为 不溶于
盐酸, 可溶于盐酸,同时说明原溶液中不含有 ;③向第三份溶液中先加入 溶液,
生成白色沉淀,再加入稀硝酸,沉淀完全溶解, 溶于稀硝酸,则溶液中不含有 ,根据溶液
电中性可知,一定含有 ,综上,不能确定是否存在的离子是OH-;
(2) ,其中一部分 的化合价由0降低到 价,每2
个 分子参加反应,转移电子数为6.故每消耗 ,转移电子的数目为 或 ;
(3) 为一元弱酸,与足量氢氧化钠溶液反应生成 和水,离子方程式为
;
(4)该反应中 是氧化剂、 是还原剂,氧化剂与还原剂的物质的量之比为 ,根据得失电
子守恒知, 失去 电子,所以氧化产物中 元素为 价,是 。
学科网(北京)股份有限公司