文档内容
2024-2025 学年高一化学上学期期中模拟卷
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证
号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:1~2章(人教版2019必修第一册)。
5.难度系数:0.65
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na23 P 31 S 32 K 39 Cl 35.5
第Ⅰ卷(选择题 共42分)
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合
题目要求的。
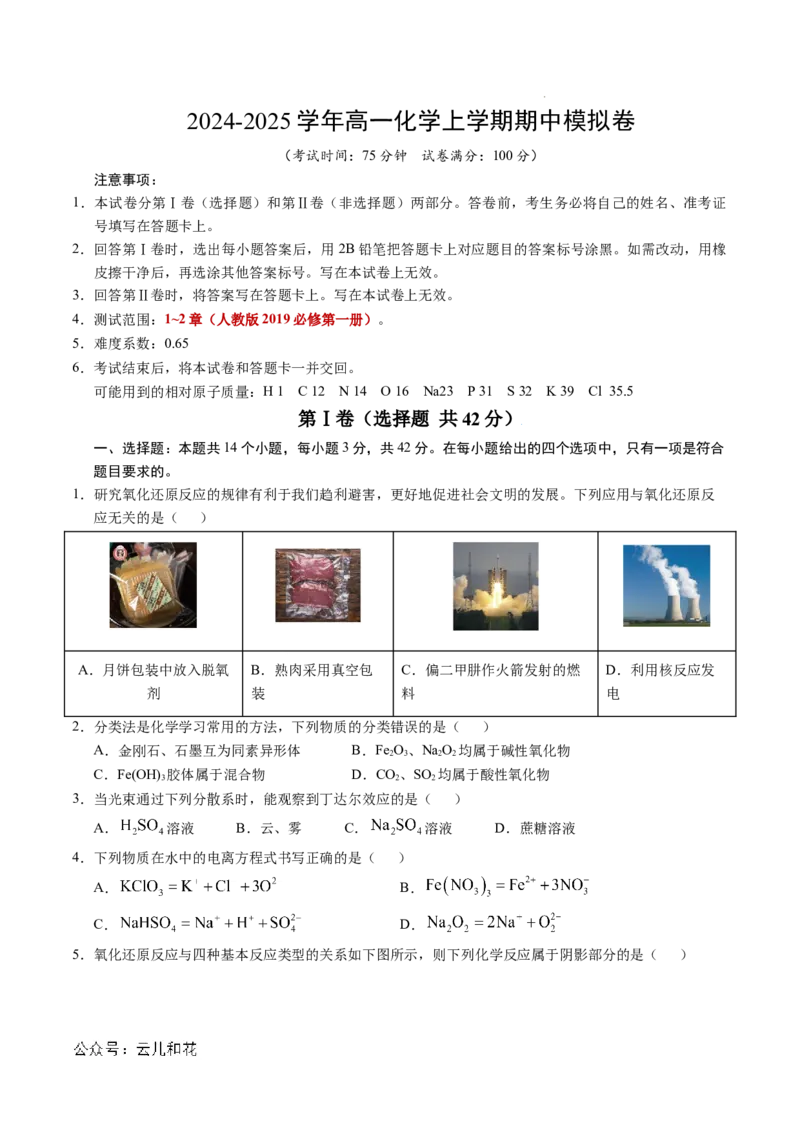
1.研究氧化还原反应的规律有利于我们趋利避害,更好地促进社会文明的发展。下列应用与氧化还原反
应无关的是( )
A.月饼包装中放入脱氧 B.熟肉采用真空包 C.偏二甲肼作火箭发射的燃 D.利用核反应发
剂 装 料 电
2.分类法是化学学习常用的方法,下列物质的分类错误的是( )
A.金刚石、石墨互为同素异形体 B.Fe O、NaO 均属于碱性氧化物
2 3 2 2
C.Fe(OH) 胶体属于混合物 D.CO、SO 均属于酸性氧化物
3 2 2
3.当光束通过下列分散系时,能观察到丁达尔效应的是( )
A. 溶液 B.云、雾 C. 溶液 D.蔗糖溶液
4.下列物质在水中的电离方程式书写正确的是( )
A. B.
C. D.
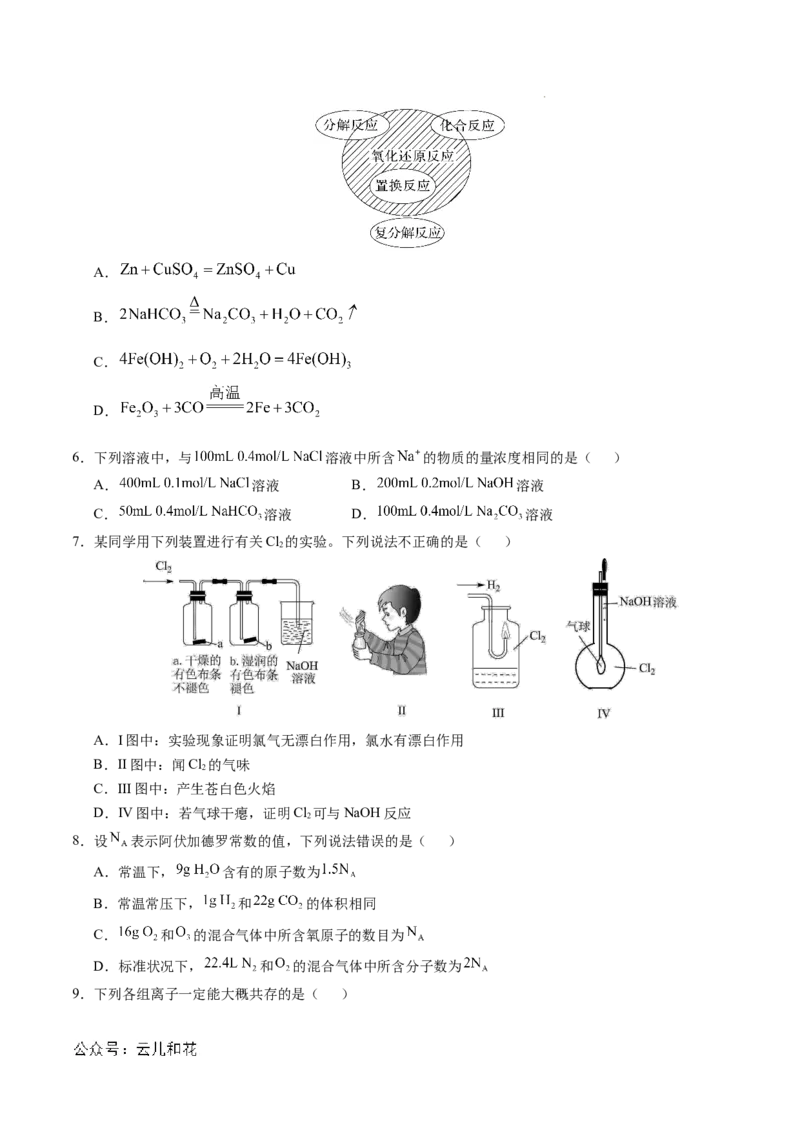
5.氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是( )
学科网(北京)股份有限公司A.
B.
C.
D.
6.下列溶液中,与 溶液中所含 的物质的量浓度相同的是( )
A. 溶液 B. 溶液
C. 溶液 D. 溶液
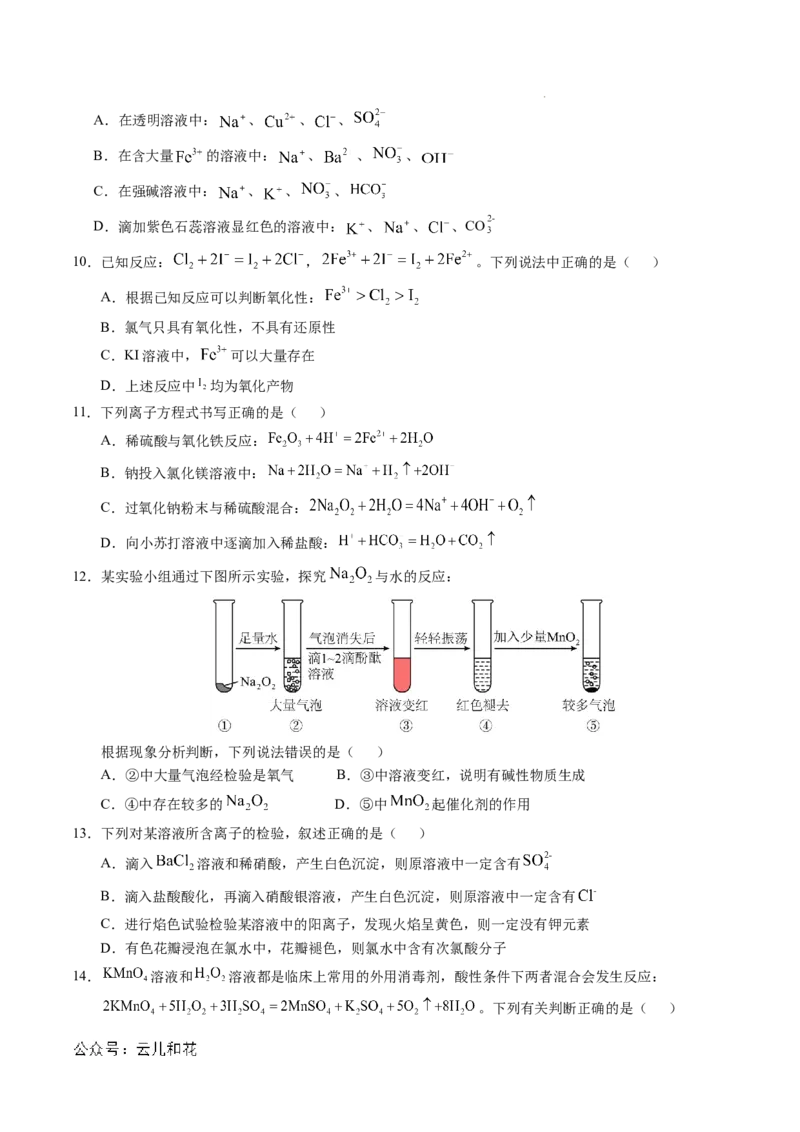
7.某同学用下列装置进行有关Cl 的实验。下列说法不正确的是( )
2
A.I图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.II图中:闻Cl 的气味
2
C.III图中:产生苍白色火焰
D.IV图中:若气球干瘪,证明Cl 可与NaOH反应
2
8.设 表示阿伏加德罗常数的值,下列说法错误的是( )
A.常温下, 含有的原子数为
B.常温常压下, 和 的体积相同
C. 和 的混合气体中所含氧原子的数目为
D.标准状况下, 和 的混合气体中所含分子数为
9.下列各组离子一定能大穊共存的是( )
学科网(北京)股份有限公司A.在透明溶液中: 、 、 、
B.在含大量 的溶液中: 、 、 、
C.在强碱溶液中: 、 、 、
D.滴加紫色石蕊溶液显红色的溶液中: 、 、 、CO
10.已知反应: , 。下列说法中正确的是( )
A.根据已知反应可以判断氧化性:
B.氯气只具有氧化性,不具有还原性
C.KI溶液中, 可以大量存在
D.上述反应中 均为氧化产物
11.下列离子方程式书写正确的是( )
A.稀硫酸与氧化铁反应:
B.钠投入氯化镁溶液中:
C.过氧化钠粉末与稀硫酸混合:
D.向小苏打溶液中逐滴加入稀盐酸:
12.某实验小组通过下图所示实验,探究 与水的反应:
根据现象分析判断,下列说法错误的是( )
A.②中大量气泡经检验是氧气 B.③中溶液变红,说明有碱性物质生成
C.④中存在较多的 D.⑤中 起催化剂的作用
13.下列对某溶液所含离子的检验,叙述正确的是( )
A.滴入 溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有
B.滴入盐酸酸化,再滴入硝酸银溶液,产生白色沉淀,则原溶液中一定含有
C.进行焰色试验检验某溶液中的阳离子,发现火焰呈黄色,则一定没有钾元素
D.有色花瓣浸泡在氯水中,花瓣褪色,则氯水中含有次氯酸分子
14. 溶液和 溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应:
。下列有关判断正确的是( )
学科网(北京)股份有限公司A.该反应中 作氧化剂 B. 的氧化性强于
C.反应中 发生了还原反应 D.每生成1个 分子时,反应中转移4个电子
第II卷(非选择题 共58分)
二、非选择题(本题共4个小题,共58分)
15.(12分)“84消毒液”是一种常用的含氯消毒剂,某“84消毒液”瓶体的部分标签如图所示。
84消毒液
有效成分:
(相对分子质量:74.5)
质量分数:
密度:
(1)某同学向 该“84消毒液”中加入 水后,滴加酚酞,溶液变红,之后的短时间内无明显变
化;通入 后,溶液快速褪色。
①实验说明 溶液呈 (填“酸性”或“碱性”)。
②比较通入 前后颜色的变化得出的结论是 。
(2)某同学实验过程中需要用 溶液。
①配制过程中使用的玻璃仪器有量筒、烧杯、玻璃棒、 。
②需要用量筒量取该消毒液的体积为 。
③配制过程中若出现以下情况,所配溶液的浓度偏小的是 (填字母)。
A.转移溶液前容量瓶内有少量蒸馏水
B.定容摇匀后,发现液面下降,继续加水至刻度线
C.未洗涤烧杯及玻璃棒
(3)某同学欲测定该“84消毒液”中 的浓度,进行以下实验操作:取待测“84消毒液”
于锥形瓶中,加入 稀释,加入适量稀硫酸和过量 溶液,密封在暗处静置 。再逐
滴加入 溶液,恰好完全反应时,消耗 溶液 。实验中涉及的离子
方程式为 、 。则该“84消毒液”中 的物质的
量浓度为 。
16.(12分)氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀
手”,服用含硒元素(Se)的化合物亚硒酸钠 ,能消除人体内的活性氧,由此推断 的
作用是作 (填“氧化剂”或“还原剂”)
(2) 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
①消除废液中的氰化物(如KCN),可经以下反应实现:KCN+H O+H O═X+NH↑,则生成物X的化学
2 2 2 3
式为 ,HO 被称为“绿色氧化剂”的理由是
2 2
学科网(北京)股份有限公司②从HO 氧元素的化合价可推测,HO 既具有氧化性,又具有还原性。某实验小组同学设计实验探
2 2 2 2
究HO 在某强酸性反应体系中的性质。
2 2
实验I:探究HO 的氧化性。
2 2
向含5%H O 的酸性溶液中滴加淀粉-KI溶液,溶液变蓝。写出该反应的离子方程式 。
2 2
实验Ⅱ:探究HO 的还原性。
2 2
向含5%H O 的溶液中滴加酸性KMnO 溶液。已知反应物和生成物共有六种粒子:
2 2 4
O、 、HO、Mn2+、HO、H+。
2 2 2 2
若该反应中HO 只发生了如下过程:HO O,则该反应的离子方程式为 。
2 2 2 2 2
(3)亚硝酸钠(NaNO )是一种工业盐,某化学兴趣小组设计实验探究NaNO 的性质,实验操作及现象如
2 2
下表(已知 遇淀粉变蓝)。
实
实验操作及现象或结果
验
① 取5mLNaNO 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝
2
取2mLKMnO 溶液(先酸化好)于试管中,滴加足量的NaNO 溶液,可观察到的实验现象为溶液紫红
4 2
②
色褪去。
③ NaNO 固体与70%硫酸反应生成了NO和NO 两种气体
2 2
通过上述实验可知,NaNO 、KMnO 、 的氧化性由强到弱的顺序为 。
2 4
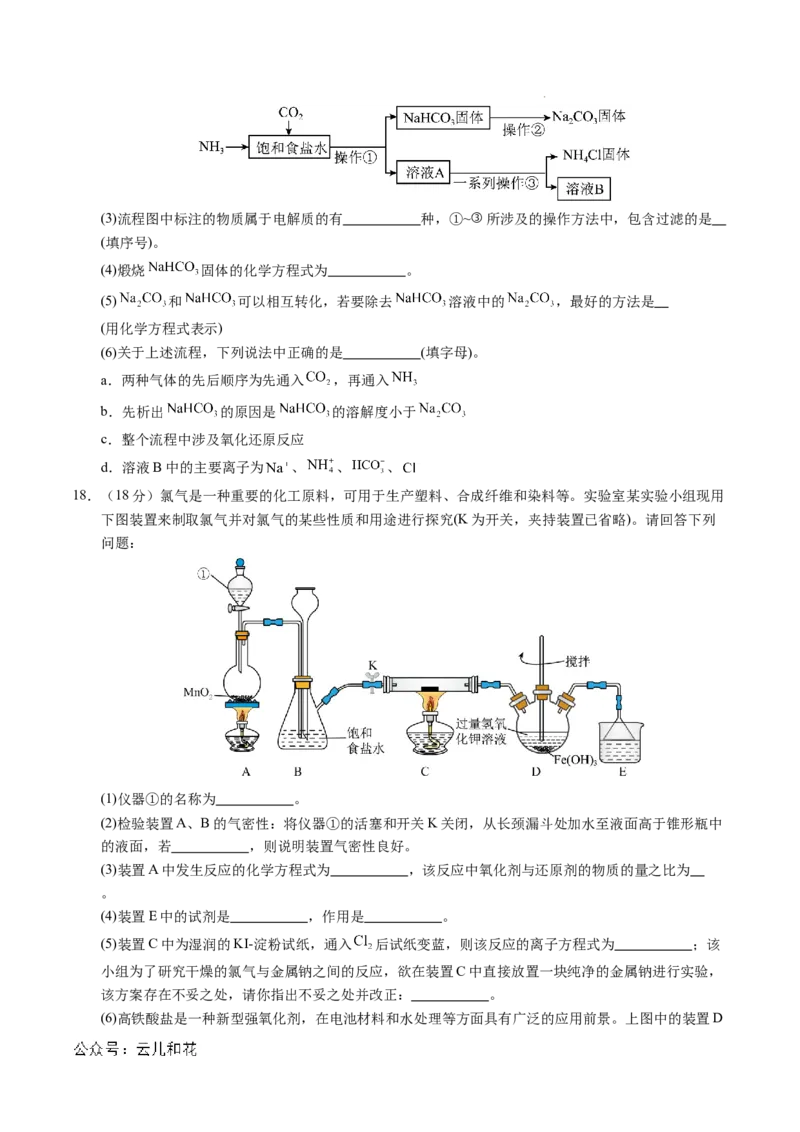
17.(16分)钠及其化合物在日常生活中有许多重要应用。回答下列问题:
Ⅰ.如图为钠的价类二维图。
(1)若①处是淡黄色固体,其化学式为 ,②处所属的物质类别为 。
(2)氢化钠能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式并用双线桥标明电子转移的方向
和数目: 。
Ⅱ.我国化学家侯德榜发明了联合制碱法( ),对世界制碱
工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去)。
学科网(北京)股份有限公司(3)流程图中标注的物质属于电解质的有 种,①~③所涉及的操作方法中,包含过滤的是
(填序号)。
(4)煅烧 固体的化学方程式为 。
(5) 和 可以相互转化,若要除去 溶液中的 ,最好的方法是
(用化学方程式表示)
(6)关于上述流程,下列说法中正确的是 (填字母)。
a.两种气体的先后顺序为先通入 ,再通入
b.先析出 的原因是 的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 、 、 、
18.(18分)氯气是一种重要的化工原料,可用于生产塑料、合成纤维和染料等。实验室某实验小组现用
下图装置来制取氯气并对氯气的某些性质和用途进行探究(K为开关,夹持装置已省略)。请回答下列
问题:
(1)仪器①的名称为 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中
的液面,若 ,则说明装置气密性良好。
(3)装置A中发生反应的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为
。
(4)装置E中的试剂是 ,作用是 。
(5)装置C中为湿润的KI-淀粉试纸,通入 后试纸变蓝,则该反应的离子方程式为 ;该
小组为了研究干燥的氯气与金属钠之间的反应,欲在装置C中直接放置一块纯净的金属钠进行实验,
该方案存在不妥之处,请你指出不妥之处并改正: 。
(6)高铁酸盐是一种新型强氧化剂,在电池材料和水处理等方面具有广泛的应用前景。上图中的装置D
学科网(北京)股份有限公司可用于实验室制备高铁酸钾( ),反应原理如下,请用单线桥表示出该反应的电子转移情况:
。
学科网(北京)股份有限公司