文档内容
2024-2025 学年高一化学上学期期中模拟卷
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证
号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡
皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:1~2章(人教版2019必修第一册)。
5.难度系数:0.65
6.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na23 P 31 S 32 K 39 Cl 35.5
第Ⅰ卷(选择题 共42分)
一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合
题目要求的。
1.研究氧化还原反应的规律有利于我们趋利避害,更好地促进社会文明的发展。下列应用与氧化还原反
应无关的是( )
A.月饼包装中放入脱氧 B.熟肉采用真空包 C.偏二甲肼作火箭发射的燃 D.利用核反应发
剂 装 料 电
【答案】D
【解析】月饼包装中放入脱氧剂与氧化还原反应有关,A不符题意;熟肉采用真空包装防止变质,与氧
化还原反应有关,B不符题意;偏二甲肼作火箭发射的燃料,燃烧过程与氧化还原反应有关,C不符题
意;核反应不属于化学变化,D符合题意;故选D。
2.分类法是化学学习常用的方法,下列物质的分类错误的是( )
A.金刚石、石墨互为同素异形体 B.Fe O、NaO 均属于碱性氧化物
2 3 2 2
C.Fe(OH) 胶体属于混合物 D.CO、SO 均属于酸性氧化物
3 2 2
【答案】B
【解析】由同种元素形成的不同种单质为同素异形体,则金刚石、石墨互为同素异形体,都为C的单
质,A正确;NaO 不是碱性氧化物,B错误;胶体是混合物,C正确;能和碱反应生成盐和水的为碱
2 2
性氧化物,CO、SO 均属于酸性氧化物,D正确;故选B。
2 2
3.当光束通过下列分散系时,能观察到丁达尔效应的是( )
学科网(北京)股份有限公司A. 溶液 B.云、雾 C. 溶液 D.蔗糖溶液
【答案】B
【解析】光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生
丁达尔效应。 溶液属于分散系中的溶液,不能产生丁达尔效应,A错误;云、雾为胶体,有丁
达尔效应,B正确; 溶液属于分散系中的溶液,不能产生丁达尔效应,C错误;蔗糖溶液属于
分散系中的溶液,不能产生丁达尔效应,D错误;故选B。
4.下列物质在水中的电离方程式书写正确的是( )
A. B.
C. D.
【答案】C
【解析】氯酸钾是强电解质,正确的电离方程式为: ,故A错误;硝酸铁是强电
解质,正确的电离方程式为: ,故B错误;硫酸氢钠是强电解质,正确的
电离方程式为: ,故C正确;过氧化钠会和水反应,不能在水中电离,
故D错误;故选C。
5.氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于阴影部分的是( )
A.
B.
C.
D.
【答案】D
【解析】由题干图示信息可知,图中阴影部分表示不属于四大基本反应类型的氧化还原反应,据此分
析解题。 是置换反应,属于氧化还原反应,A不合题意;
学科网(北京)股份有限公司是分解反应,不属于氧化还原反应,B不合题意;
是化合反应,属于氧化还原反应,C不合题意;
不属于四大基本反应类型,属于氧化还原反应,D符合题意;故选
D。
6.下列溶液中,与 溶液中所含 的物质的量浓度相同的是( )
A. 溶液 B. 溶液
C. 溶液 D. 溶液
【答案】C
【解析】溶液中离子的浓度与溶液体积无关。 溶液所含 的物质的量浓度是
0.4mol/L, 溶液 的物质的量浓度是0.1mol/L,A错误;
溶液所含 的物质的量浓度是0.4mol/L, 溶液 的物质的量浓度是
0.2mol/L,B错误; 溶液所含 的物质的量浓度是0.4mol/L,
溶液 的物质的量浓度是0.4mol/L,C正确;
溶液所含 的物质的量浓度是0.4mol/L, 溶液 的物
质的量浓度是0.8mol/L,D错误;故选C。
7.某同学用下列装置进行有关Cl 的实验。下列说法不正确的是( )
2
A.I图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.II图中:闻Cl 的气味
2
C.III图中:产生苍白色火焰
D.IV图中:若气球干瘪,证明Cl 可与NaOH反应
2
【答案】D
【解析】干燥的氯气不能使干燥的有色布条褪色,能使湿润的有色布条褪色,说明氯气无漂白作用,
氯水有漂白作用,故A正确;在实验室,闻某些气体的气味时,只能通过扇闻得方法,以免有毒有害
气体浓度过高导致中毒,故B正确;氯气和氢气燃烧生成HCl,火焰呈苍白色,故C正确;气球在氯
气的气压下处于干瘪状态,当滴入NaOH溶液,氯气与NaOH反应使烧瓶内压力减小,气球逐渐膨
学科网(北京)股份有限公司胀,故D错误;故选D。
8.设 表示阿伏加德罗常数的值,下列说法错误的是( )
A.常温下, 含有的原子数为
B.常温常压下, 和 的体积相同
C. 和 的混合气体中所含氧原子的数目为
D.标准状况下, 和 的混合气体中所含分子数为
【答案】D
【解析】 含有3个原子,常温下, 的物质的量为 =0.5mol,含有的原子数为
,A正确; 的物质的量为 =0.5mol, 的物质的量为 =0.5mol,二者物质的
量相等,常温常压下体积相同,B正确; 和 都是由O原子构成的, 和 的混合气体中所
含氧原子的数目为 = ,C正确;
标准状况下, 和 的混合气体物质的量为1mol,所含分子数为 ,D错误;故选D。
9.下列各组离子一定能大穊共存的是( )
A.在透明溶液中: 、 、 、
B.在含大量 的溶液中: 、 、 、
C.在强碱溶液中: 、 、 、
D.滴加紫色石蕊溶液显红色的溶液中: 、 、 、CO
【答案】A
【解析】在透明溶液中:Na+、 、Cl−、 各离子相互不反应,能大量共存,A正确;铁离子会
和氢氧根离子反应生成氢氧化铁沉淀而不能大量共存,B错误;强碱溶液中,OH−与 反应生成水
和CO 而不能大量共存,C错误;滴加紫色石蕊溶液显红色的溶液显酸性,溶液中含有一定量的氢离
子,氢离子和CO 会反应,不能大量共存,D错误。故选A。
10.已知反应: , 。下列说法中正确的是( )
A.根据已知反应可以判断氧化性:
B.氯气只具有氧化性,不具有还原性
C.KI溶液中, 可以大量存在
D.上述反应中 均为氧化产物
学科网(北京)股份有限公司【答案】D
【解析】氧化剂氧化性大于氧化产物, 可知氧化性氯气大于碘单质,
可知氧化性铁离子大于碘单质,无法判断出 与 的氧化性强弱,A错
误;氯元素有正价,而氯气中氯元素化合价为0,能升高,具有还原性,B错误; 与 能反应生
成碘单质,不能大量共存,C错误;反应中均为 ,碘化合价升高,发生氧化反应生成氧化产
物碘单质,D正确;故选D。
11.下列离子方程式书写正确的是( )
A.稀硫酸与氧化铁反应:
B.钠投入氯化镁溶液中:
C.过氧化钠粉末与稀硫酸混合:
D.向小苏打溶液中逐滴加入稀盐酸:
【答案】D
【解析】稀硫酸与氧化铁反应: ,A项错误;钠投入氯化镁溶液中:
,B项错误;过氧化钠粉末与稀硫酸混合:
,C项错误;碳酸氢根与酸反应生成二氧化碳和水,D项正确;故
选D。
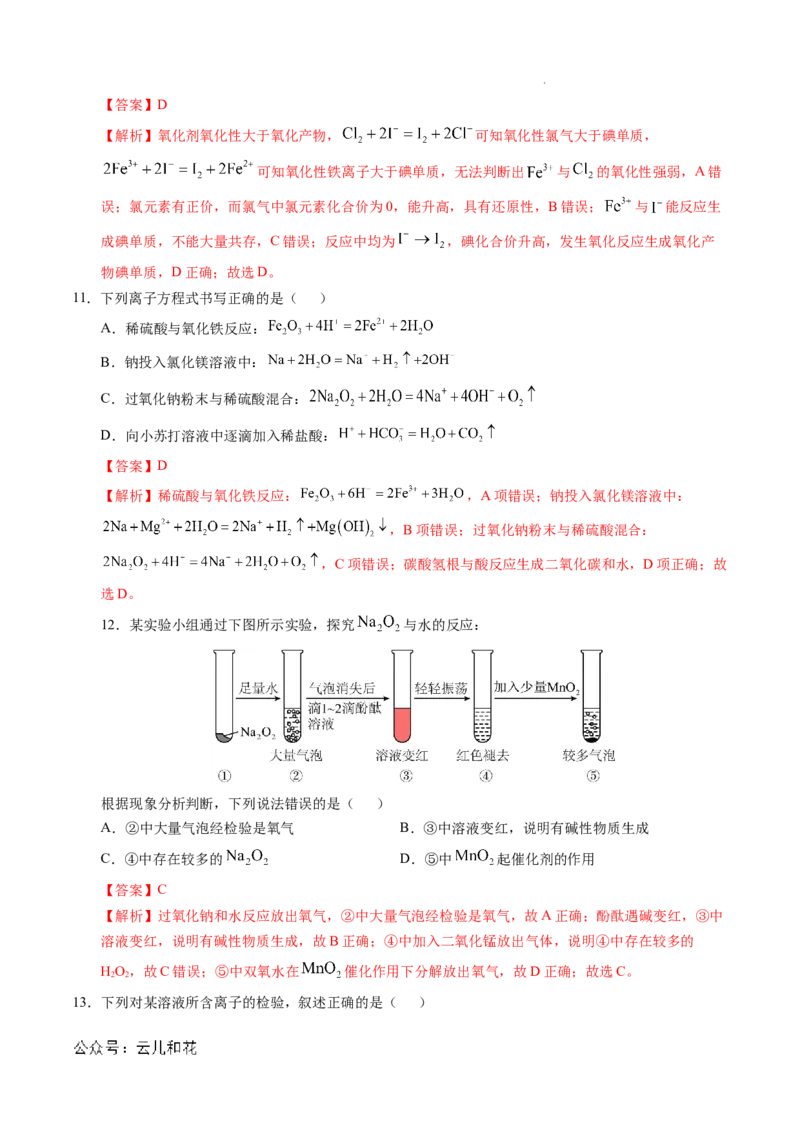
12.某实验小组通过下图所示实验,探究 与水的反应:
根据现象分析判断,下列说法错误的是( )
A.②中大量气泡经检验是氧气 B.③中溶液变红,说明有碱性物质生成
C.④中存在较多的 D.⑤中 起催化剂的作用
【答案】C
【解析】过氧化钠和水反应放出氧气,②中大量气泡经检验是氧气,故A正确;酚酞遇碱变红,③中
溶液变红,说明有碱性物质生成,故B正确;④中加入二氧化锰放出气体,说明④中存在较多的
HO,故C错误;⑤中双氧水在 催化作用下分解放出氧气,故D正确;故选C。
2 2
13.下列对某溶液所含离子的检验,叙述正确的是( )
学科网(北京)股份有限公司A.滴入 溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有
B.滴入盐酸酸化,再滴入硝酸银溶液,产生白色沉淀,则原溶液中一定含有
C.进行焰色试验检验某溶液中的阳离子,发现火焰呈黄色,则一定没有钾元素
D.有色花瓣浸泡在氯水中,花瓣褪色,则氯水中含有次氯酸分子
【答案】D
【解析】滴入 溶液和稀硝酸,产生白色沉淀,则原溶液中也可能含有银离子生成氯化银沉淀,
A错误;滴入盐酸酸化引入氯离子,再滴入硝酸银溶液,产生白色沉淀,不能证明原溶液中一定含有
,B错误;进行焰色试验检验某溶液中的阳离子,要证明钾元素存在,需要透过蓝色钴玻璃观
察,C错误; 有色花瓣浸泡在氯水中,花瓣褪色,则氯水中含有次氯酸分子,D正确;故选D。
14. 溶液和 溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应:
。下列有关判断正确的是( )
A.该反应中 作氧化剂 B. 的氧化性强于
C.反应中 发生了还原反应 D.每生成1个 分子时,反应中转移4个电子
【答案】B
【解析】 中氧元素化合价升高,是还原剂,A错误;KMnO 是氧化剂,氧化剂的氧化性强于还
4
原剂 ,B正确; 中元素化合价未改变,未发生还原反应或氧化反应,C错误;生成1个
分子时,氧元素化合价由 价升高为0价,反应转移2个电子,D错误;故选B。
第II卷(非选择题 共58分)
二、非选择题(本题共4个小题,共58分)
15.(12分)“84消毒液”是一种常用的含氯消毒剂,某“84消毒液”瓶体的部分标签如图所示。
84消毒液
有效成分:
(相对分子质量:74.5)
质量分数:
密度:
(1)某同学向 该“84消毒液”中加入 水后,滴加酚酞,溶液变红,之后的短时间内无明显变
化;通入 后,溶液快速褪色。
①实验说明 溶液呈 (填“酸性”或“碱性”)。
②比较通入 前后颜色的变化得出的结论是 。
(2)某同学实验过程中需要用 溶液。
①配制过程中使用的玻璃仪器有量筒、烧杯、玻璃棒、 。
学科网(北京)股份有限公司②需要用量筒量取该消毒液的体积为 。
③配制过程中若出现以下情况,所配溶液的浓度偏小的是 (填字母)。
A.转移溶液前容量瓶内有少量蒸馏水
B.定容摇匀后,发现液面下降,继续加水至刻度线
C.未洗涤烧杯及玻璃棒
(3)某同学欲测定该“84消毒液”中 的浓度,进行以下实验操作:取待测“84消毒液”
于锥形瓶中,加入 稀释,加入适量稀硫酸和过量 溶液,密封在暗处静置 。再逐
滴加入 溶液,恰好完全反应时,消耗 溶液 。实验中涉及的离子
方程式为 、 。则该“84消毒液”中 的物质的
量浓度为 。
【答案】(1) 碱性 (2分) 起漂白作用的是HClO,HClO浓度越大,漂白能力越强(合理即可) (2
分)
(2) 胶头滴管、 容量瓶 (2分) 5.0 (2分) BC (2分)
(3) (2分)
【解析】(1)①滴加酚酞后溶液变红,说明NaClO溶液呈碱性;
②碳酸酸性强于HClO,NaClO溶液中通入CO 后生成次氯酸,溶液快速褪色,说明起漂白作用的是
2
HClO,HClO浓度越大,漂白能力越强;
(2)①配制 溶液过程中使用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴
管、 容量瓶;
②84消毒液c( )= ,设需要用量筒量取该消毒液
的体积为V ,则V×10-3L×2.00mol/L=0.5L×0.02mol/L,解得V=5.0 ;
③转移溶液前容量瓶内有少量蒸馏水,不影响容量瓶中溶质的物质的量,对所配溶液浓度无影响,故
A不符合题意; 定容摇匀后,发现液面下降,若继续加水至刻度线,则所配溶液浓度偏小,故B符
合题意; 未洗涤烧杯及玻璃棒,则溶质有所损失,所配溶液浓度偏小,故C符合题意;故选BC;
(3)由题意得关系式NaClO~ ,则n(NaClO)=
,所以该“84消毒液”中NaClO的物质的量浓度为
。
16.(12分)氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀
手”,服用含硒元素(Se)的化合物亚硒酸钠 ,能消除人体内的活性氧,由此推断 的
作用是作 (填“氧化剂”或“还原剂”)
(2) 可作为矿业废液消毒剂,有“绿色氧化剂”的美称。
学科网(北京)股份有限公司①消除废液中的氰化物(如KCN),可经以下反应实现:KCN+H O+H O═X+NH↑,则生成物X的化学
2 2 2 3
式为 ,HO 被称为“绿色氧化剂”的理由是
2 2
②从HO 氧元素的化合价可推测,HO 既具有氧化性,又具有还原性。某实验小组同学设计实验探
2 2 2 2
究HO 在某强酸性反应体系中的性质。
2 2
实验I:探究HO 的氧化性。
2 2
向含5%H O 的酸性溶液中滴加淀粉-KI溶液,溶液变蓝。写出该反应的离子方程式 。
2 2
实验Ⅱ:探究HO 的还原性。
2 2
向含5%H O 的溶液中滴加酸性KMnO 溶液。已知反应物和生成物共有六种粒子:
2 2 4
O、 、HO、Mn2+、HO、H+。
2 2 2 2
若该反应中HO 只发生了如下过程:HO O,则该反应的离子方程式为 。
2 2 2 2 2
(3)亚硝酸钠(NaNO )是一种工业盐,某化学兴趣小组设计实验探究NaNO 的性质,实验操作及现象如
2 2
下表(已知 遇淀粉变蓝)。
实
实验操作及现象或结果
验
① 取5mLNaNO 溶液于试管中,加入少量KI溶液,充分反应后,再滴加淀粉溶液,溶液变蓝
2
取2mLKMnO 溶液(先酸化好)于试管中,滴加足量的NaNO 溶液,可观察到的实验现象为溶液紫红
② 4 2
色褪去。
③ NaNO 固体与70%硫酸反应生成了NO和NO 两种气体
2 2
通过上述实验可知,NaNO 、KMnO 、 的氧化性由强到弱的顺序为 。
2 4
【答案】(1)还原剂 (2分)
(2) KHCO (2分) HO 作氧化剂时,其还原产物为无污染的无毒物质 (2分) 2I-
3 2 2
+H O+2H+=I +2H O (2分) 2MnO -+5 H O+6H+=5O ↑+8H O+2Mn2+ (2分)
2 2 2 2 4 2 2 2 2
(3)KMnO>NaNO >I (2分)
4 2 2
【解析】(1)亚硒酸钠(NaSeO)能消除人体内的活性氧,可知Se元素的化合价升高,则作还原
2 3
剂,故答案为:还原剂;
(2)①根据元素守恒原理,可知反应KCN+H O+H O═X+NH↑中的X为KHCO ,由于HO 作氧化
2 2 2 3 3 2 2
剂时,其还原产物为无污染的无毒物质,故其被称为“绿色氧化剂”,故答案为:KHCO ;HO 作氧
3 2 2
化剂时,其还原产物为无污染的无毒物质;
②向含5%H O 的酸性溶液中滴加淀粉-KI溶液,溶液变蓝,说明有I 生成,故该反应的离子方程式
2 2 2
为:2I-+H O+2H+=I +2H O,向含5%H O 的溶液中滴加酸性KMnO 溶液。已知反应物和生成物共有
2 2 2 2 2 2 4
六种粒子:O、MnO -、HO、Mn2+、HO、H+,若该反应中HO 只发生了如下过程:HO O,
2 4 2 2 2 2 2 2 2 2
则该反应的离子方程式为2MnO -+5 H O+6H+=5O +8H O+2Mn2+;
4 2 2 2 2
(3)已知氧化还原反应中氧化剂的氧化性强于还原剂,氧化剂的氧化性强于氧化产物,由实验①可
知NaNO 可以氧化KI生成I,说明NaNO 的氧化性强于I,由实验②可知KMnO 能够被NaNO 还
2 2 2 2 4 2
学科网(北京)股份有限公司原,即KMnO 能够氧化NaNO ,即有KMnO 的氧化性强于NaNO ,综上分析可知,氧化性:KMnO
4 2 4 2 4
>NaNO >I。
2 2
17.(16分)钠及其化合物在日常生活中有许多重要应用。回答下列问题:
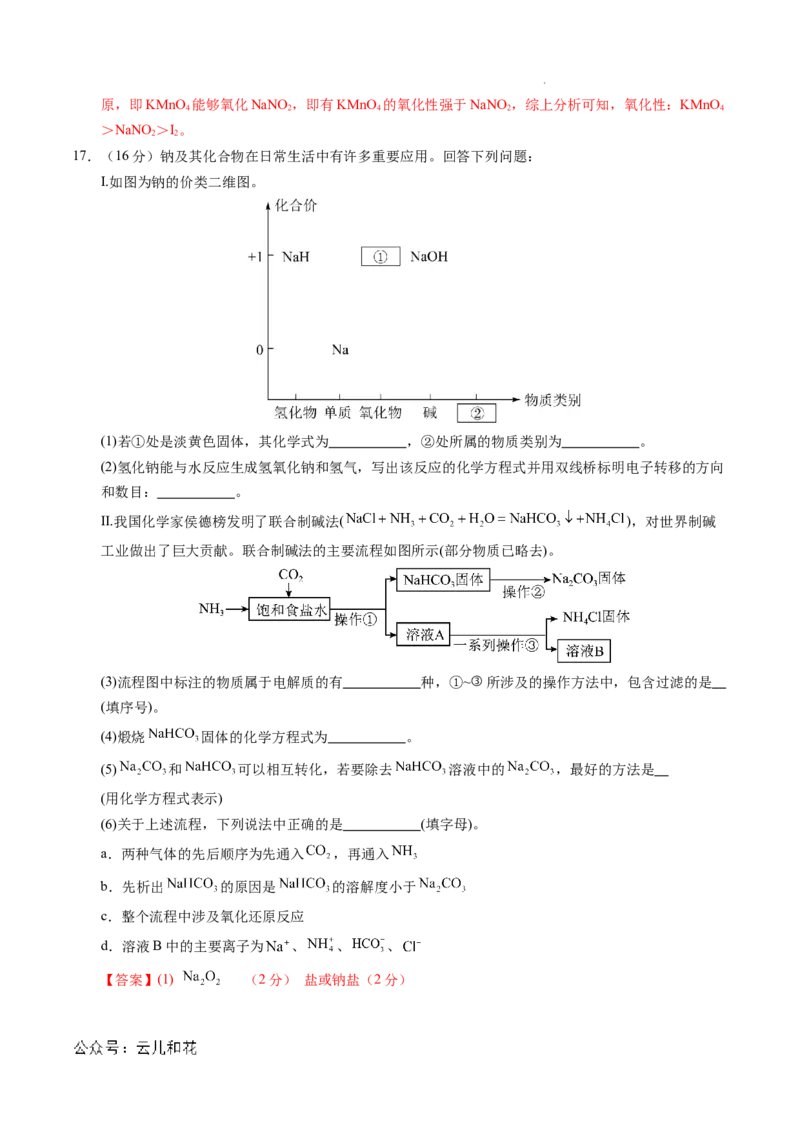
Ⅰ.如图为钠的价类二维图。
(1)若①处是淡黄色固体,其化学式为 ,②处所属的物质类别为 。
(2)氢化钠能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式并用双线桥标明电子转移的方向
和数目: 。
Ⅱ.我国化学家侯德榜发明了联合制碱法( ),对世界制碱
工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去)。
(3)流程图中标注的物质属于电解质的有 种,①~③所涉及的操作方法中,包含过滤的是
(填序号)。
(4)煅烧 固体的化学方程式为 。
(5) 和 可以相互转化,若要除去 溶液中的 ,最好的方法是
(用化学方程式表示)
(6)关于上述流程,下列说法中正确的是 (填字母)。
a.两种气体的先后顺序为先通入 ,再通入
b.先析出 的原因是 的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 、 、 、
【答案】(1) (2分) 盐或钠盐(2分)
学科网(北京)股份有限公司(2) (2分)
(3) 3 (2分) ①③ (2分)
(4) (2分)
(5) + +H O=2 (2分)
2
(6)bd (2分)
【分析】侯氏制碱法的原理是往饱和的食盐水中通入足量的氨气后,再通入足量的二氧化碳气体,利
用碳酸氢钠的溶解度小的原理,使其从水溶液中析出,则操作①为过滤,操作②为加热,操作③为过
滤,溶液A主要成分为氯化铵,溶液B主要成分为氯化钠,据此分析解答。
【解析】(1)从①所在位置的横坐标和纵坐标来看,①是钠的+1价的淡黄色氧化物,则①是
;钠是金属元素,从横坐标的物质类别来看,碱后应该是盐了,故答案为盐或钠盐。
(2)氢化钠中氢的化合价为-1价,氢气中的氢的化合价为0价,氢气即是该反应的氧化产物又是还原
产物,则用双线桥标明电子转移的方向和数目的化学方程式为 。
(3)流程图中标注的物质属于电解质的有 、 、 三种, 和 不属于电
解质;①~③所涉及的操作方法中,经分析包含过滤的是①③。
(4) 受热分解生成碳酸钠、二氧化碳、和水,则反应的化学方程式是
。
(5) 溶液中通入 ,可以使 转化为 ,则除去 溶液中的 ,
最好的方法是通入 ,反应的化学方程式是 + +H O=2 。
2
(6) 极易溶于水,溶于水后溶液显碱性,可以吸收更多的 气体,从而产生大量的碳酸氢
根,则应先通入 ,后通入 ,故a错误;相同温度下, 的溶解度小于 ,故b正
确;生成 ,制备 ,分离出 固体,其过程都没有涉及到氧化还原反应,故c错
误;经分析,溶液B是混合物,含有剩余的 、 和 ,则溶液B中的主要离子为
、 、 、 ,故d正确;答案为bd。
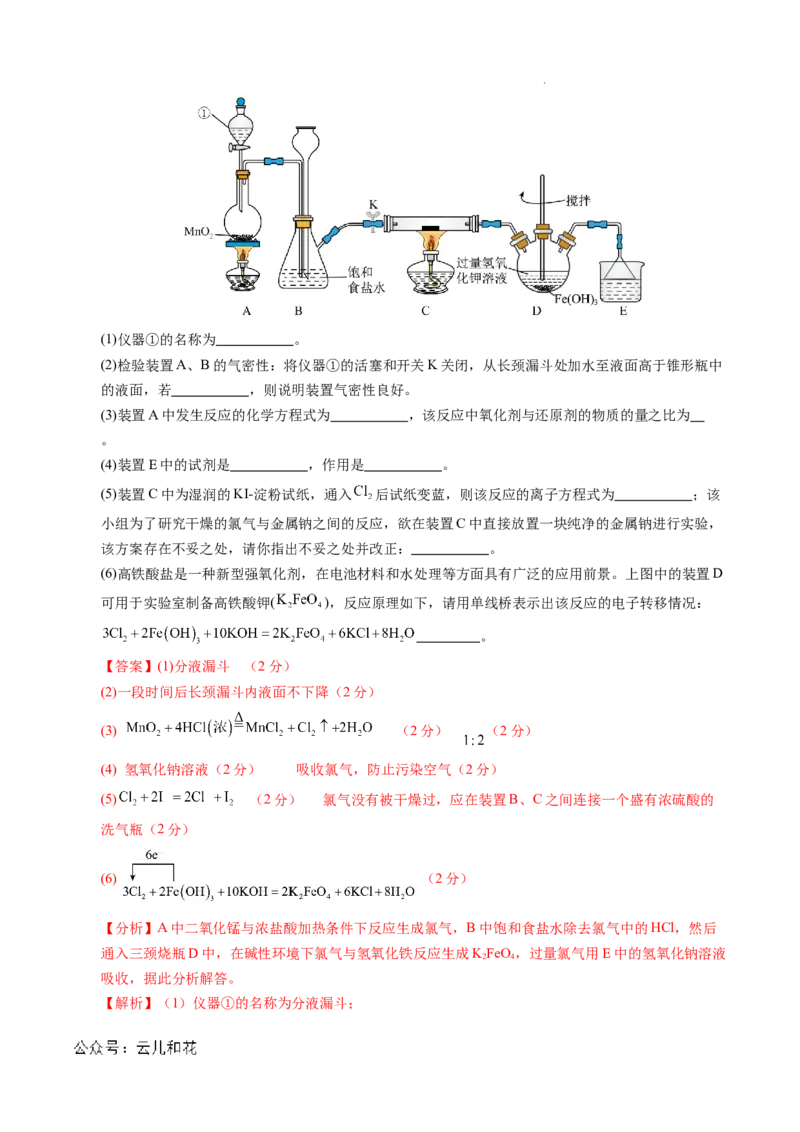
18.(18分)氯气是一种重要的化工原料,可用于生产塑料、合成纤维和染料等。实验室某实验小组现用
下图装置来制取氯气并对氯气的某些性质和用途进行探究(K为开关,夹持装置已省略)。请回答下列
问题:
学科网(北京)股份有限公司(1)仪器①的名称为 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中
的液面,若 ,则说明装置气密性良好。
(3)装置A中发生反应的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为
。
(4)装置E中的试剂是 ,作用是 。
(5)装置C中为湿润的KI-淀粉试纸,通入 后试纸变蓝,则该反应的离子方程式为 ;该
小组为了研究干燥的氯气与金属钠之间的反应,欲在装置C中直接放置一块纯净的金属钠进行实验,
该方案存在不妥之处,请你指出不妥之处并改正: 。
(6)高铁酸盐是一种新型强氧化剂,在电池材料和水处理等方面具有广泛的应用前景。上图中的装置D
可用于实验室制备高铁酸钾( ),反应原理如下,请用单线桥表示出该反应的电子转移情况:
。
【答案】(1)分液漏斗 (2分)
(2)一段时间后长颈漏斗内液面不下降(2分)
(3) (2分) (2分)
(4) 氢氧化钠溶液(2分) 吸收氯气,防止污染空气(2分)
(5) (2分) 氯气没有被干燥过,应在装置B、C之间连接一个盛有浓硫酸的
洗气瓶(2分)
(6) (2分)
【分析】A中二氧化锰与浓盐酸加热条件下反应生成氯气,B中饱和食盐水除去氯气中的HCl,然后
通入三颈烧瓶D中,在碱性环境下氯气与氢氧化铁反应生成KFeO,过量氯气用E中的氢氧化钠溶液
2 4
吸收,据此分析解答。
【解析】(1)仪器①的名称为分液漏斗;
学科网(北京)股份有限公司(2)将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,一段时间后长
颈漏斗内液面不下降,则说明装置气密性良好;
(3)A中二氧化锰与浓盐酸加热条件下反应生成氯气,方程式为MnO +4HCl
2
(浓)=====MnCl +Cl↑+2H O;氧化剂为MnO ,还原剂为HCl ,根据方程式可知有一半的HCl 体现还
2 2 2 2
原性,一半的HCl 体现酸性,则氧化剂和还原剂的物质的量之比为1:2;
(4)根据分析可知装置E中试剂为氢氧化钠溶液,吸收多余的氯气,防止污染空气;
(5)Cl 和 KI反应生成氯化钾和单质碘,离子方程式为Cl+2I−=2Cl−+I ;欲在装置C中直接放置一块
2 2 2
纯净的金属钠进行实验,需要干燥的氯气,则在B和C之间加一个浓硫酸干燥氯气。
(6)Cl元素化合价由0价降低到-1价,3个Cl原子得到6个电子,Fe元素化合价从+3价到+6价,2
个Fe铁原子失去6个电子,则单线桥法表示为 。
学科网(北京)股份有限公司