文档内容
… … … …
… … … …
… … … …
○ … ○ …
… … … …
… 2024-2025 学年高一化学上学期期中模拟卷 是( )
… … … …
学 校
… …
_____
外 … 内 …
_____ (考试时间:75分钟 试卷满分:100分)
… … … …
____
… … … … 注意事项:
姓 名
… …
○ … _____ ○ … 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考证号
_____
… … … …
___ 班 填写在答题卡上。
… … … …
级 :
… …
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮
_____
装 … 装 …
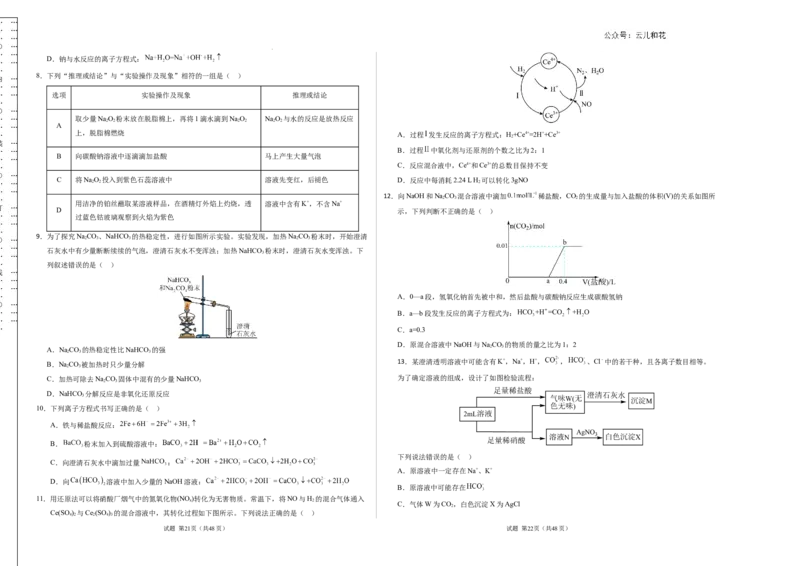
_____ A.由图(1)可知,光照下氯水酸性减弱
… … … … 擦干净后,再选涂其他答案标号。写在本试卷上无效。
… …_____ … …
… 考 号 … 3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。 B.由图(2)可知,光照下氯水中氯元素质量增大
○ …_____ ○ …
… …_____ … … 4.测试范围:1~2章(人教版2019必修第一册)。 C.由图(3)可知,光照下,水分解生成了
… …_____ … …
… _____ … 5.难度系数:0.65 D.由实验可知,氯水应贮存于棕色试剂瓶中
订 …__ 订 …
6.考试结束后,将本试卷和答题卡一并交回。 5.N 为阿伏加德罗常数的值。下列说法正确的是( )
… … … … A
… … … … 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na23 P 31 S 32 K 39 Cl 35.5 Br 80 A.标准状况下,11.2L H O所含分子数为0.5N
2 A
… …
○ … ○ … 第Ⅰ卷(选择题 共42分) B.16gO 和O 的混合气体含有的原子数为2.5N
2 3 A
… … … …
… … … … 一、选择题:本题共14个小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合 C.1molCl 2 与足量的铁发生反应,转移的电子总数为3N A
… …
D.1L2 mol/L的氯化镁溶液中氯离子数为4N
线 … 线 … 题目要求的。 A
… … … …
… … … … 1.下列物质既不属于电解质,又不属于非电解质,但其水溶液能导电的是( ) 6.室温下,下列各组离子在指定溶液(溶质物质的量浓度均为0.1 mol⋅L )中一定能够大量共存的是
… …
A.乙醇 B.碱石灰 C.铁 D.二氧化碳 ( )
○ … ○ …
… … … …
2.下列关于物质分类的组合正确的是( ) A.NaOH溶液: 、 、 、
… … … …
… …
碱 酸 盐 碱性氧化物 酸性氧化物 B.NaCl溶液: , 、 、
C. 溶液: 、 、 、
A Ca(OH) 硫酸 胆矾(CuSO ·5H O) CaO MnO
2 4 2 2 7
D.NaClO溶液: 、 、 ,
B 烧碱 盐酸 氯化钠 过氧化钠 二氧化碳
7.设计如图装置(夹持装置省略)检验钠与水反应的产物,先在U形管内加入少量煤油和几粒钠块,再从U
形管高端加入水(含有酚酞),打开止气夹,赶出空气,一段时间后加热铜丝。下列说法正确的是( )
C 石灰水 冰醋酸(CHCOOH) 小苏打 氧化钠 二氧化硫
3
D NH HNO 碳酸钙 氧化铁 SO
3 3 3
3.在水溶液中,下列电离方程式书写正确的是( )
A. B.
A.钠块在煤油和水交界处四处游走,直至消失
C. D. B.铜丝由黑色变成红色,说明有 生成
4.用强光照射氯水,测得氯水的pH、氯离子浓度、氧气体积分数与时间的关系如图所示。下列叙述正确的 C.U形管溶液右侧从上到下逐渐由无色变为红色
试题 第11页(共48页) 试题 第12页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… …
… …
… …
○ …
… …
D.钠与水反应的离子方程式:
… …
…
8.下列“推理或结论”与“实验操作及现象”相符的一组是( )
内 …
… …
… … 选项 实验操作及现象 推理或结论
…
○ …
… … 取少量NaO 粉末放在脱脂棉上,再将1滴水滴到NaO NaO 与水的反应是放热反应
2 2 2 2 2 2
… … A
… 上,脱脂棉燃烧 A.过程 发生反应的离子方程式:H+Ce4+=2H++Ce3+
2
装 …
… … B.过程 中氧化剂与还原剂的个数之比为2:1
B 向碳酸钠溶液中逐滴滴加盐酸 马上产生大量气泡
… …
…
C.反应混合液中,Ce4+和Ce3+的总数目保持不变
○ …
C 将NaO 投入到紫色石蕊溶液中 溶液先变红,后褪色 D.反应中每消耗2.24 L H 可以转化3gNO
… … 2 2 2
… …
12.向NaOH和NaCO 混合溶液中滴加 稀盐酸,CO 的生成量与加入盐酸的体积(V)的关系如图所
… 2 3 2
用洁净的铂丝蘸取某溶液样品,在酒精灯外焰上灼烧,透 溶液中含有K+,不含Na+
订 …
D 示,下列判断不正确的是( )
… … 过蓝色钴玻璃观察到火焰为紫色
… …
…
9.为了探究NaCO、NaHCO 的热稳定性,进行如图所示实验。实验发现,加热NaCO 粉末时,开始澄清
○ … 2 3 3 2 3
… …
石灰水中有少量断断续续的气泡,澄清石灰水不变浑浊;加热NaHCO 粉末时,澄清石灰水变浑浊。下
3
… …
… 列叙述错误的是( )
线 …
… …
… …
… A.0—a段,氢氧化钠首先被中和,然后盐酸与碳酸钠反应生成碳酸氢钠
○ …
… … B.a—b段发生反应的离子方程式为:
… …
… C.a=0.3
D.原混合溶液中NaOH与NaCO 的物质的量之比为1:2
2 3
A.NaCO 的热稳定性比NaHCO 的强
2 3 3
13.某澄清透明溶液中可能含有K+,Na+,H+, , 、Cl﹣中的若干种,且各离子数目相等。
B.NaCO 被加热时只少量分解
2 3
C.加热可除去NaCO 固体中混有的少量NaHCO 为了确定溶液的组成,设计了如图检验流程:
2 3 3
D.NaHCO 分解反应是非氧化还原反应
3
10.下列离子方程式书写正确的是( )
A.铁与稀盐酸反应:
B. 粉末加入到硫酸溶液中:
下列说法错误的是( )
C.向澄清石灰水中滴加过量 :
A.原溶液中一定存在Na+、K+
D.向 溶液中加入少量的NaOH溶液:
B.原溶液中可能存在
11.用还原法可以将硝酸厂烟气中的氮氧化物(NO )转化为无害物质。常温下,将NO与H 的混合气体通入
x 2
C.气体W为CO,白色沉淀X为AgCl
2
Ce(SO) 与Ce (SO ) 的混合溶液中,其转化过程如下图所示。下列说法正确的是( )
4 2 2 4 3
试题 第21页(共48页) 试题 第22页(共48页)
学科网(北京)股份有限公司… …
… …
… …
○ …
… …
… …
…
内 …
… …
… …
…
○ …
… …
… …
…
装 …
… …
… …
…
○ …
… …
… …
…
订 …
… …
… …
…
○ …
… …
… …
…
线 …
… …
… …
…
○ …
… …
… …
…
… … … …
… … … …
… … … …
○ … ○ …
… … … …
D.向原溶液中滴加澄清石灰水溶液变浑浊 制情况回答下列问题:
…
… … … …
学 校
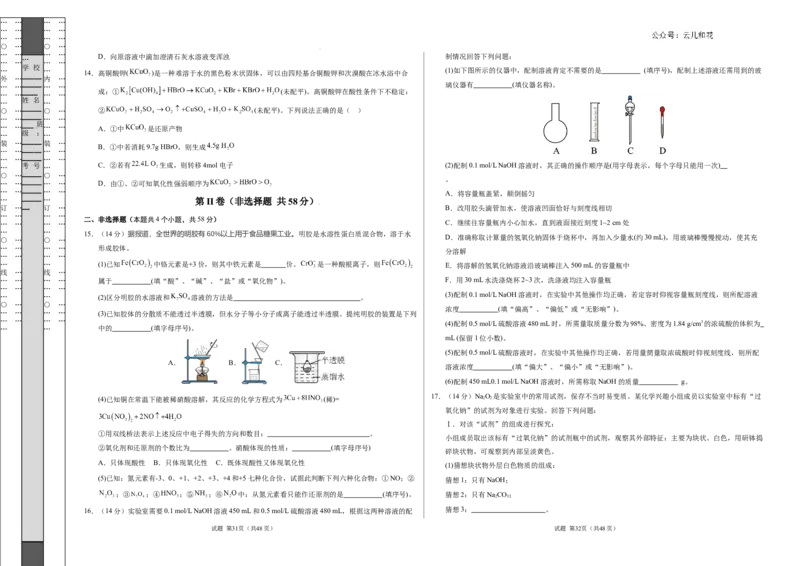
… … (1)如下图所示的仪器中,配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻
14.高铜酸钾( )是一种难溶于水的黑色粉末状固体,可以由四羟基合铜酸钾和次溴酸在冰水浴中合
_____
外 … 内 …
… … _____ … … 璃仪器有 (填仪器名称)。
____ 成:① (未配平)。高铜酸钾在酸性条件下不稳定:
… … … …
姓 名
… …
_____
○ … ○ … ② (未配平)。下列说法正确的是( )
_____
… … … …
___ 班
… … … … A.①中 是还原产物
级 :
… …
_____
装 … 装 …
B.①中若消耗9.7g HBrO,则生成
_____
… … … …
… …_____ … …
… 考 号 … C.②若有 生成,则转移4mol电子 (2)配制0.1 mol/L NaOH溶液时,其正确的操作顺序是(用字母表示,每个字母只能用一次)
○ …_____ ○ …
。
… …_____ … … D.由①、②可知氧化性强弱顺序为
… …_____ … … A.将容量瓶盖紧,颠倒摇匀
… _____ … 第II卷(非选择题 共58分)
订 …__ 订 … B.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
… … … …
二、非选择题(本题共4个小题,共58分)
… … … … C.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
… …
15.(14分)据报道,全世界的明胶有60%以上用于食品糖果工业。明胶是水溶性蛋白质混合物,溶于水
D.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其充
○ … ○ …
… … … … 形成胶体。
分溶解
… … … …
… … (1)已知 中铬元素是+3价,则其中铁元素是 价。 是一种酸根离子,则 E.将溶解的氢氧化钠溶液沿玻璃棒注入500 mL的容量瓶中
线 … 线 …
… … … … 属于 (填“酸”、“碱”、“盐”或“氧化物”)。 F.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
… … … …
… … (2)区分明胶的水溶液和 溶液的方法是 。 (3)配制0.1 mol/L NaOH溶液时,在实验中其他操作均正确,若定容时仰视容量瓶刻度线,则所配溶液
○ … ○ …
浓度 (填“偏高”、“偏低”或“无影响”)。
… … … … (3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列
… … … …
(4)配制0.5 mol/L硫酸溶液480 mL时,所需量取质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
… … 中的 (填字母序号)。
mL (保留1位小数)。
(5)配制0.5 mol/L硫酸溶液时,在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所配
A. B. C.
溶液浓度 (填“偏大”、“偏小”或“无影响”)。
(6)配制450 mL0.1 mol/L NaOH溶液时,所需称取NaOH的质量 g。
17.(14分)NaO 是实验室中的常用试剂,保存不当时易变质。某化学兴趣小组成员以实验室中标有“过
(4)已知铜在常温下能被稀硝酸溶解,其反应的化学方程式为 (稀)= 2 2
氧化钠”的试剂为对象进行实验。回答下列问题:
Ⅰ.对该“试剂”的组成进行探究:
①用双线桥法表示上述反应中电子得失的方向和数目: 。
小组成员取出该标有“过氧化钠”的试剂瓶中的试剂,观察其外部特征:主要为块状、白色,用研钵捣
②氧化剂和还原剂的个数比为 。硝酸体现的性质: (填字母序号)
碎块状物,可观察到内部呈淡黄色。
A.只体现酸性 B.只体现氧化性 C.既体现酸性又体现氧化性
(1)猜想块状物外层白色物质的组成:
(5)已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列六种化合物:①NO;② 猜想1:只有NaOH;
;③ ;④ ;⑤ ;⑥ 中:从氮元素看只能作还原剂的是 (填序号)。 猜想2:只有NaCO;
2 3
16.(14分)实验室需要0.1 mol/L NaOH溶液450 mL和0.5 mol/L硫酸溶液480 mL,根据这两种溶液的配 猜想3: 。
试题 第31页(共48页) 试题 第32页(共48页)
学科网(北京)股份有限公司… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
外 … 内 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… …
… …
… …
○ …
… …
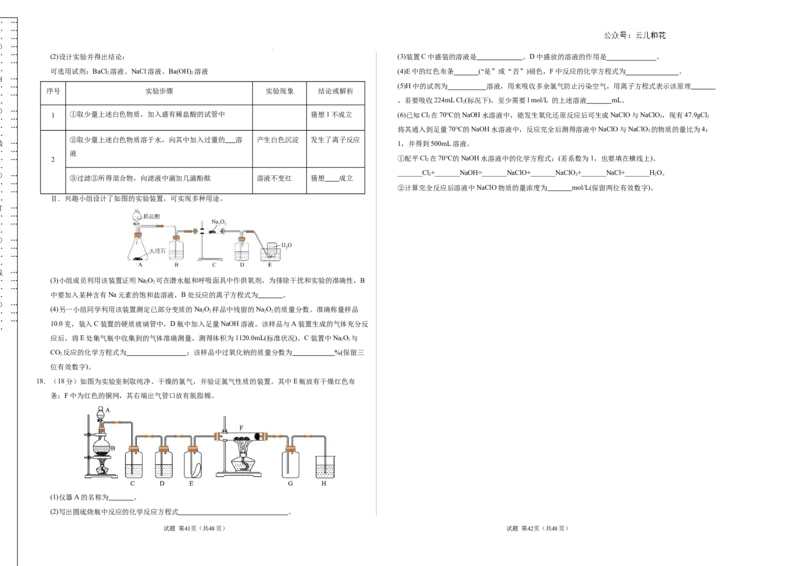
(2)设计实验并得出结论: (3)装置C中盛装的溶液是 。D中盛放的溶液的作用是 。
… …
… 可选用试剂:BaCl 溶液、NaCl溶液、Ba(OH) 溶液 (4)E中的红色布条 (“是”或“否”)褪色,F中反应的化学方程式为 。
2 2
内 …
… … (5)H中的试剂为 溶液,用来吸收多余氯气防止污染空气,用离子方程式表示该原理
序号 实验步骤 实验现象 结论或解析
… …
,若要吸收224mL Cl (标况下),至少需要l mol/L 的上述溶液 mL。
… 2
○ …
1 ①取少量上述白色物质,加入盛有稀盐酸的试管中 猜想1不成立 (6)已知Cl 在70℃的NaOH水溶液中,能发生氧化还原反应后可生成NaClO与NaClO,现有47.9gCl
… … 2 3 2
… …
将其通入到足量70℃的NaOH水溶液中,反应完全后测得溶液中NaClO与NaClO 的物质的量比为4:
3
…
②取少量上述白色物质溶于水,向其中加入过量的 溶 产生白色沉淀 发生了离子反应
装 … 1,并得到500mL溶液。
… …
液
… … 2 ①配平Cl 2 在70℃的NaOH水溶液中的化学方程式:(若系数为1,也要填在横线上)。
…
_______Cl+_______NaOH=_______NaClO+_______NaClO +_______NaCl+_______HO。
○ … 2 3 2
③过滤②所得混合物,向滤液中滴加几滴酚酞 溶液不变红 猜想 成立
… …
②计算完全反应后溶液中NaClO物质的量浓度为 mol/L(保留两位有效数字)。
… …
… Ⅱ.兴趣小组设计了如图的实验装置,可实现多种用途。
订 …
… …
… …
…
○ …
… …
… …
…
线 …
… … (3)小组成员利用该装置证明NaO 可在潜水艇和呼吸面具中作供氧剂,为排除干扰和实验的准确性,B
2 2
… …
… 中要加入某种含有Na元素的饱和盐溶液,B处反应的离子方程式为 。
○ …
(4)另一小组同学利用该装置测定已部分变质的NaO 样品中残留的NaO 的质量分数。准确称量样品
… … 2 2 2 2
… …
10.0克,装入C装置的硬质玻璃管中,D瓶中加入足量NaOH溶液。该样品与A装置生成的气体充分反
…
应后,将E处集气瓶中收集到的气体准确测量,测得体积为1120.0mL(标准状况)。C装置中NaO 与
2 2
CO 反应的化学方程式为 ;该样品中过氧化钠的质量分数为 %(保留三
2
位有效数字)。
18.(18分)如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布
条;F中为红色的铜网,其右端出气管口放有脱脂棉。
(1)仪器A的名称为 。
(2)写出圆底烧瓶中反应的化学反应方程式 。
试题 第41页(共48页) 试题 第42页(共48页)
学科网(北京)股份有限公司