文档内容
专题10 化学计算
1.【2022年上海卷】冰层表面摩擦力小,原因可能是其表面有一层液态水,现有一冰面面积为200m2,
液态水厚度为 m,水的密度为1g·cm⁻³,求液态水分子数
A. B. C. D.
【答案】C
【解析】由题目信息可知,液态水的体积为 cm3,再根据 得出其质
量为20 g,物质的量 ,分子数 ,故
答案选C。
2.【2022年1月浙江卷】某同学设计实验确定Al(NO )·xH O的结晶水数目。称取样品7.50g,经热分解
3 3 2
测得气体产物中有NO 、O、HNO、HO,其中HO的质量为3.06g;残留的固体产物是Al O,质量
2 2 3 2 2 2 3
为1.02g。计算:
(1)x=_______(写出计算过程)。
(2)气体产物中n(O )_______mol。
2
【答案】(1)9
(2)0.0100
【解析】
(1)Al(NO )·xH O的摩尔质量为(213+18x)g/mol,根据固体产物氧化铝的质量为1.02g,可知样品中
3 3 2
n(Al)= ,则 ,解得x=9。
(2)气体产物中n(H O)=3.06g÷18g/mol=0.17mol,则n(HNO)=0.02×9×2-0.17×2=0.02mol,根据氮元素守
2 3
恒,n(NO )=样品中N的物质的量-HNO 中N的物质的量=0.02×3-0.02=0.04mol,根据氧元素守恒,
2 3
n(O )=(0.02×18-0.17-0.02×3-0.04×2-0.03)÷2=0.0100mol。
2
3.【2022年6月浙江卷】联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
,石灰石分解需要的能量由焦炭燃烧提供。将石灰石
与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧生成 ,其热量有效利用率为
50%。石灰窑中产生的富含 的窑气通入氨的氯化钠饱和溶液中,40%的 最终转化为纯碱。已
知:焦炭的热值为 (假设焦炭不含杂质)。请回答:
(1)每完全分解 石灰石(含 ,杂质不参与反应),需要投料_______kg焦炭。
(2)每生产106kg纯碱,同时可获得_______ (列式计算)。【答案】(1)10.8
(2)70
【解析】
(1)完全分解 石灰石(含 ,杂质不参与反应),需要吸收的热量是
=162000kJ,已知:焦炭的热值为 (假设焦炭不含杂质),其热量有
效利用率为50%,所以需要投料焦炭的质量是 =10800g=10.8kg。
(2)根据(1)中计算可知消耗焦炭的物质的量是 =900mol,参加反应的碳酸钙的物质的量是
900mol,这说明参加反应的碳酸钙和焦炭的物质的量之比为1:1,所以根据原子守恒可知生成氧化钙
的质量是 =70kg。
4.(2021.6·浙江真题)将3.00g某有机物(仅含C.H、O元素,相对分子质量为150)样品置于燃烧器中充
分燃烧,依次通过吸水剂、CO 吸收剂,燃烧产物被完全吸收。实验数据如下表:
2
吸水
CO 吸收剂
2
剂
实验前质量/g 20.00 26.48
实验后质量/g 21.08 30.00
请回答:
(1)燃烧产物中水的物质的量为_______mol。
(2)该有机物的分子式为_______(写出计算过程)。
【答案】(1)0.0600 (2)C HO
4 6 6
【解析】
(1)根据表格中的数据,吸水剂增加的质量全部为有机物完全燃烧生成水的质量,则生成水的物质的量
n(H O)= = =0.0600mol;
2
(2)n(H)=0.0600mol×2=0.120mol,
n(C)= =0.0800mol,
n(O)= =0.120mol,
则最简式为C HO,由于相对分子质量为150,则可以得到有机物的分子式为C HO。
2 3 3 4 6 6
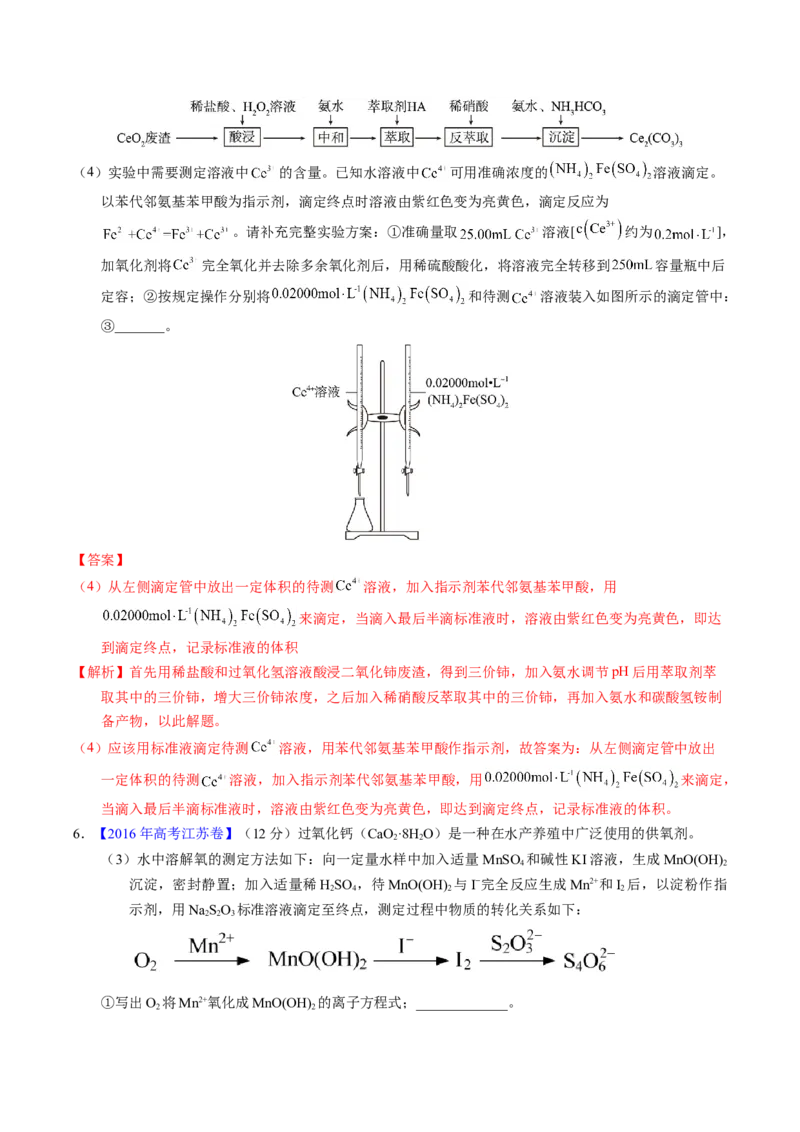
5.【2022年江苏卷】实验室以二氧化铈( )废渣为原料制备 含量少的 ,其部分实验过程
如下:(4)实验中需要测定溶液中 的含量。已知水溶液中 可用准确浓度的 溶液滴定。
以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为
。请补充完整实验方案:①准确量取 溶液[ 约为 ],
加氧化剂将 完全氧化并去除多余氧化剂后,用稀硫酸酸化,将溶液完全转移到 容量瓶中后
定容;②按规定操作分别将 和待测 溶液装入如图所示的滴定管中:
③_______。
【答案】
(4)从左侧滴定管中放出一定体积的待测 溶液,加入指示剂苯代邻氨基苯甲酸,用
来滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,即达
到滴定终点,记录标准液的体积
【解析】首先用稀盐酸和过氧化氢溶液酸浸二氧化铈废渣,得到三价铈,加入氨水调节pH后用萃取剂萃
取其中的三价铈,增大三价铈浓度,之后加入稀硝酸反萃取其中的三价铈,再加入氨水和碳酸氢铵制
备产物,以此解题。
(4)应该用标准液滴定待测 溶液,用苯代邻氨基苯甲酸作指示剂,故答案为:从左侧滴定管中放出
一定体积的待测 溶液,加入指示剂苯代邻氨基苯甲酸,用 来滴定,
当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,即达到滴定终点,记录标准液的体积。
6.【2016年高考江苏卷】(12分)过氧化钙(CaO·8H O)是一种在水产养殖中广泛使用的供氧剂。
2 2
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量 MnSO 和碱性KI溶液,生成MnO(OH)
4 2
沉淀,密封静置;加入适量稀HSO ,待MnO(OH) 与I−完全反应生成Mn2+和I 后,以淀粉作指
2 4 2 2
示剂,用NaSO 标准溶液滴定至终点,测定过程中物质的转化关系如下:
2 2 3
①写出O 将Mn2+氧化成MnO(OH) 的离子方程式;_____________。
2 2②取加过一定量CaO·8H O的池塘水样100.00 mL,按上述方法测定水中溶解氧量,消耗0.01000
2 2
mol·L−1 NaSO 标准溶液13.50 mL。计算该水样中的溶解氧(用mg·L−1表示),写出计算过
2 2 3
程。
【答案】(3)①O+2Mn2++4OH-=MnO(OH)↓
2 2
②在100.00mL水样中
I+2SO2-=2I-+SO2-
2 2 3 4 6
n(I)=
2
=
=6.750×10-5mol
n[MnO(OH) ]= n(I )= 6.750×10-5mol
2 2
n(O )= n[MnO(OH) ]= ×6.750×10-5mol=3.375×10-5mol
2 2
水中溶解氧= =10.80mg/L
【解析】
(3)①O 将Mn2+氧化成MnO(OH) 中氧气是氧化剂,得到4个电子,Mn元素的化合价从+2价升高
2 2
到+4价,失去2个电子,所以根据电子得失守恒以及原子守恒可知反应的离子方程式为 O +
2
2Mn2++4OH-=MnO(OH) ↓。
2
②根据流程图并依据电子得失守恒可知氧气得到的电子就是硫代硫酸钠失去的电子,在反应中S元素
化合价从+2价升高到+2.5价,1mol硫代硫酸钠失去1mol电子,一分子氧气得到4个电子,所
以根据电子得失守恒可知该水样中的溶解氧为 =
10.80mg/L。
7.【2016年高考新课标Ⅰ卷】 (15分)
(3)在化学分析中采用KCrO 为指示剂,以AgNO 标准溶液滴定溶液中的Cl−,利用Ag+与CrO2−生
2 4 3 4
成砖红色沉淀,指示到达滴定终点。当溶液中Cl−恰好完全沉淀(浓度等于1.0×10−5 mol·L−1)时,溶
液中c(Ag+)为_______ mol·L−1,此时溶液中c(CrO 2−)等于__________ mol·L−1。(已知Ag CrO 、
4 2 4
AgCl的K 分别为2.0×10−12和2.0×10−10)。
sp
【答案】
(3) 2.0×10-5 ;5×10-3;
【解析】
试题分析: (3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10−5 mol·L−1,根据溶度积常数
K (AgCl)=2.0×10−10,可得溶液中c(Ag+)=K (AgCl)÷c(Cl-)=2.0×10−10÷(1.0×10−5 mol·L−1)=2.0×10-5
sp spmol·L−1;则此时溶液中c(CrO 2−)=K (Ag CrO)/c2(Ag+)=2.0×10−12÷(2.0×10-5 mol·L−1)=5×10-3mol·L−1;
4 sp 2 4
8.【2016年高考新课标Ⅱ卷】联氨(又称联肼,NH,无色液体)是一种应用广泛的化工原料,可用作
2 4
火箭燃料,回答下列问题:
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨
可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O kg;与
2
使用NaSO 处理水中溶解的O 相比,联氨的优点是 。
2 3 2
【答案】
(5)固体逐渐变黑,并有气泡产生 1 NH 的用量少,不产生其他杂质(还原产物为N 和
2 4 2
HO,而NaSO 产生NaSO
2 2 3 2 4
【解析】
(5)联氨是一种常用的还原剂,AgBr 具有弱氧化性,两者发生氧化还原反应,化学方程式为
4AgBr+NH= 4Ag+N↑+4HBr,所以向装有少量AgBr的试管中加入联氨溶液,可观察到固体逐渐
2 4 2
变黑,并有气泡产生;联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀,发生的反应为
NH+O =N +2H O,理论上1kg的联氨可除去水中溶解的氧气为1kg÷32g/mol×32g/moL=1kg;与
2 4 2 2 2
使用NaSO 处理水中溶解的O 相比,联氨的优点是NH 的用量少,不产生其他杂质,而NaSO
2 3 2 2 4 2 3
的氧化产物为NaSO ,易生成硫酸盐沉淀,影响锅炉的安全使用。
2 4
9.【2016年高考上海卷】(本题共14分)
CO 是重要的化工原料,也是应用广发的化工产品。CO 与过氧化钠或超氧化钾反应可产生氧气。
2 2
完成下列计算:
(1)CO 通入氨水生成NH HCO ,NH HCO 很容易分解。2.00 mol NH HCO 完全分解,分解产物经
2 4 3 4 3 4 3
干燥后的体积为_________L(标准状况)。
(2)某H 中含有2.40 molCO ,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH
2 2
完全反应,该NaOH溶液的浓度为_______。
(3)CO 和KO 有下列反应:
2 2
4KO +2CO →2KCO+3O
2 2 2 3 2
4KO +4CO +2H O→4KHCO+3O
2 2 2 3 2
若9 mol CO 在密封舱内和KO 反应后生成9 mol O ,则反应前密封舱内HO的量应该是多少?列
2 2 2 2
式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH+H O CO+3H
4 2 2
已知:CO+2H CHOH CO +3H CHOH+H O
2 3 2 2 3 2
300 mol CH 完全反应后的产物中,加入100 mol CO 后合成甲醇。若获得甲醇350 mol,残留氢气
4 2
120 mol,计算CO 的转化率。
2
【答案】(本题共14分)
(1)89.6
(2)2.4 mol/L≥c≥1.2 mol/L(3)
n(H O)=(9/6)×2=3(mol)
2
(4)300 mol CH 完全反应产生H 900mol
4 2
设CO 转化率为α,CO转化率为β
2
300β+100α=350 600β+300α=900-120
α=80%
或设CO 转化率为α 900−350×2−100α=120 α=80/100=80%
2
【解析】
(1)碳酸氢铵分解的化学方程式为:NH HCO HO+NH ↑+CO ↑,从方程式可以看出,分解产物经干
4 3 2 3 2
燥后,所得气体为NH 和CO ,且n(NH )+ n(CO)=2n(NH HCO )=2×2.00mol=4.00mol,则V(混合气
3 2 3 2 4 3
体)=4.00mol×22.4L/mol=89.6L,即分解产物经干燥后的体积为89.6L。
(2)根据题意要求,2.40 molCO 被完全吸收,NaOH也完全反应,则反应的产物可能是NaCO (此时
2 2 3
NaOH的浓度最大)或NaHCO (此时NaOH的浓度最小)或NaCO 和NaHCO 的混合物。用极值思
3 2 3 3
想分析两个特殊情况:
①CO+NaOH=NaHCO ,n(NaOH)= n(CO)=2.40mol,则c(NaOH)= =1.20mol/L;
2 3 2
②CO+2NaOH=Na CO,n(NaOH)=2n(CO)=4.80mol,则c(NaOH)= =2.40mol/L;
2 2 3 2
综合①、②可知,NaOH溶液的浓度应该1.20mol/L≤c(NaOH)≤2.40mol/L。
(3)法一:
依题意,9 mol CO 在密封舱内和KO 反应后生成9 mol O ,即n(CO)∶n(O )=1∶1,通过观察题给两个方
2 2 2 2 2
程式可知,当把两个方程式相加时正好符合题目要求:
8KO +6CO +2H O→2K CO+4KHCO +6O
2 2 2 2 3 3 2
所以有n(H O)= n(CO)= ×9mol=3mol,即反应前密封舱内HO的物质的量为3mol。
2 2 2
法二:
设反应前密封舱内HO的物质的量为n
2
4KO + 4CO + 2H O → 4KHCO + 3O
2 2 2 3 2
2n n 1.5n
4KO + 2CO → 2K CO + 3O
2 2 2 3 2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
HO的物质的量为3mol。
2
(4)法一:
CH + H O → CO + 3H
4 2 2
300mol 300mol 900mol
设CO 的转化率为α,CO的转化率为β
2CO + 2H → CH OH CO + 3H → CH OH + H O
2 3 2 2 3 2
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-350mol,所以有
600βmol+300αmol=900mol-350mol--------②式
由①②式可得α=0.8,即设CO 的转化率为80%。
2
法二:
在合成甲醇的反应中,氢元素在生成物中有两种存在形式,一是存在于甲醇中,二是存在于水中,设 CO
2
的转化率为α
CH + H O → CO + 3H
4 2 2
300mol 900mol
CO + 3H → CH OH + H O
2 2 3 2
100αmol 100αmol
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-350mol,根据反应中氢元素的守恒
可有:900mol-120mol=350mol×2+100αmol,解得α=0.8,即设CO 的转化率为80%。
2
10.【2014年高考上海卷第十(52~55)题】(本题共14分)
硫有多种含氧酸,亚硫酸(HSO )、硫酸(HSO )、焦硫酸(HSO ·SO )、硫代硫酸(HSO )等等,
2 3 2 4 2 4 3 2 2 3
其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(HSO ·SO )溶于水,其中的SO 都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫
2 4 3 3
酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的HSO ·H O计算,250g质量分数为98%的硫酸能吸收多少g水?
2 4 2
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS+8O→Fe O+6SO 4FeS +11 O →2Fe O+8SO
2 2 3 4 2 2 2 2 3 2
若48mol FeS 完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe O 与Fe O 物质的量之比。
2 3 4 2 3
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(HS、HO、N )在空气中完全燃烧,若空气过量77%,计
2 2 2
算产物气体中SO 体积分数(水是气体)。(已知空气组成:N 体积分数0.79、O 体积分数
2 2 2
0.21)
【答案】(1)1.25 (2)250×98%÷98×16=40g
(3)2934.4÷22.4=131mol 设Fe O amol Fe O bmol
3 4 2 3
3a+2b=48 8a+11÷2b=131 a=4 b=18
n (Fe O):n(Fe O)=2:9
3 4 2 3
(4)设混合气为1体积,0.84体积硫化氢完全燃烧生成0.84体积二氧化硫和0.84体积水,消耗1.26
体积氧气。所需空气为1.26÷0.21×1.77=10.62
体积 =0.84÷(10.62-1.26+1.84)=0.075
【解析】(1)445g焦硫酸的物质的量=445g÷178g/mol=2.5mol,其中硫酸和三氧化硫均是2.5mol,2.5mol 三氧化硫又产生 2.5mol 硫酸,则溶液中硫酸的物质的量是 5.0mol,浓度是 5.0mol÷4L=
1.25mol/L。
(2)250g质量分数为98%的硫酸中硫酸的质量是250g×98%=245g,其中溶剂水是5g,硫酸的物质
的量是245g÷98g/mol=2.5mol,可以结合水的物质的量是2.5mol,质量是2.5mol×18g/mol=45g,
因此还可以吸收水的质量是45g-5g=40g。
(3)设Fe O 的物质的量是amol,Fe O 的物质的量是bmol
3 4 2 3
反应中消耗氧气的物质的量是2934.4L÷22.4L/mol=131mol
则根据方程式可知3a+2b=48、8a+11÷2b=131
解得a=4、b=18
则n (Fe O):n(Fe O)=2:9
3 4 2 3
(4)设混合气为1体积,根据氯化氢完全燃烧的方程式2HS+3O———→2SO +2HO 可知,0.84
2 2 2 2
体积硫化氢完全燃烧生成0.84体积二氧化硫和0.84体积水,消耗1.26体积氧气。反应中空气过
量77%,因此所需空气为×1.77=10.62,则二氧化硫体积分数 ==0.075
11.【2015上海化学】(本题共14分)
氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
(1)CaCO 质量分数为0.90的石灰石100 kg完成分解产生CO
3 2
L(标准状况)。
石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO 29120 L(标准状况),
2
如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为
mol。
(2)已知粗盐水含MgCl 6.80 mol/m3,含CaCl 3.00mol/m3。
2 2
向粗盐水中加入Ca(OH) 除镁离子:MgCl + Ca(OH) → Mg(OH) ↓ + CaCl
2 2 2 2 2
然后加入NaCO 除钙离子。
2 3
处理上述粗盐水10 m3,至少需要加NaCO
2 3
g。
如果用碳酸化尾气(含NH 体积分数为0.100、CO 体积分数0.040)代替碳酸钠,发生如下反应:
3 2
Ca2+ + 2NH + CO + H O → CaCO ↓ + 2NH+
3 2 2 3 4
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070
kg。列式计算:
①过滤后溶液中氯化钠的质量。
②析出的碳酸氢钠晶体的质量。
【答案】(1)20160L;400。
(2)10388;54880L。
(3)①351kg;②1680kg。
【解析】(1)CaCO 分解的反应方程式是:CaCO CaO+CO ↑,根据方程式可知每1mol CaCO 反应会产生
3 3 2 3
1mol CO,质量分数为0.90的石灰石100 kg物质的量是n(CaCO)=
2 3
(1.0×105g×0.90)÷100g/mol=900mol,则石灰石完成分解产生标准状况下的CO 的体积是
2
V(CO )=n∙Vm=900mol×22.4L/mol=20160L。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生标
2
准状况下CO 29120 L,如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭燃
2
烧产生的CO 的体积是V(CO )=V(总)-V(石灰石)= 29120 L-20160L=8960L,则其物质的量是
2 2
n(CO)= V(CO ) ÷Vm=8960L÷22.4L/mol=400mol。根据碳元素守恒,可知焦炭的物质的量与产生
2 2
的物质的量CO 相等,也是400mol。
2
(2)10 m3粗盐水中含有的MgCl 、CaCl 物质的量是:n(MgCl )= 6.80 mol/m3×10 m3=68mol;
2 2 2
n(CaCl )= 3.00mol/m3×10 m3=30mol。根据反应方程式MgCl + Ca(OH) → Mg(OH) ↓ + CaCl 可知
2 2 2 2 2
1mol MgCl 发生反应被除去时引入1mol CaCl .则向粗盐水中加入Ca(OH) 除镁离子后得到的溶液
2 2 2
中含有的CaCl 的物质的量是:68mol+30mol=98mol,根据反应方程式:NaCO+
2 2 3
CaCl =CaCO ↓+2NaCl可知反应消耗NaCO 的物质的量与CaCl 的物质的量相等,则其质量是
2 3 2 3 2
m(Na CO)=nM=98mol×106g/mol=10388g。根据反应方程式Ca2+ + 2NH + CO + H O → CaCO ↓
2 3 3 2 2 3
+ 2NH +可知反应消耗的氨气与CO2的物质的量的比是2:1,而混合气体中含NH 体积分数为
4 3
0.100、CO 体积分数0.040,说明NH 过量,不能完全反应,应该以不足量的CO 为标准进行计
2 3 2
算,而n(Ca2+)=n(CO ),n(Ca2+)=98mol,则需要n(CO)= 98mol,混合气体的物质的量是n(混合)=
2 2
98mol÷0.04=2450mol,其在标准状况下的体积是V(混合)=nVm= 2450mol×22.4L/mol=54880L。
(3)①n(NaCl)(总)=m÷M=1521000g÷58. 5g/mol=26000mol,反应产生的NH Cl的物质的量是
4
n(NH Cl)= m÷M=1070 000g÷53. 5g/mol=20000mol,根据氯元素守恒可知,在溶液中含有的NaCl
4
的物质的量是n(NaCl)= n(NaCl)(总)- n(NH Cl)= 26000mol-20000mol=6000mol,其质量是
4
m(NaCl)=n∙M=6000mol×58. 5g/mol=351000g=351kg。
②氨盐水中发生反应根据反应方程式:NaCl+CO +NH+H O= NaHCO↓+NHCl。产生的NaHCO 的物
2 3 2 3 4 3
质的量与NH Cl的物质的量相等,则析出的碳酸氢钠晶体的质量是
4
m(NaHCO )=n∙M=20000mol×84g/mol=1680000g=1680kg。
3
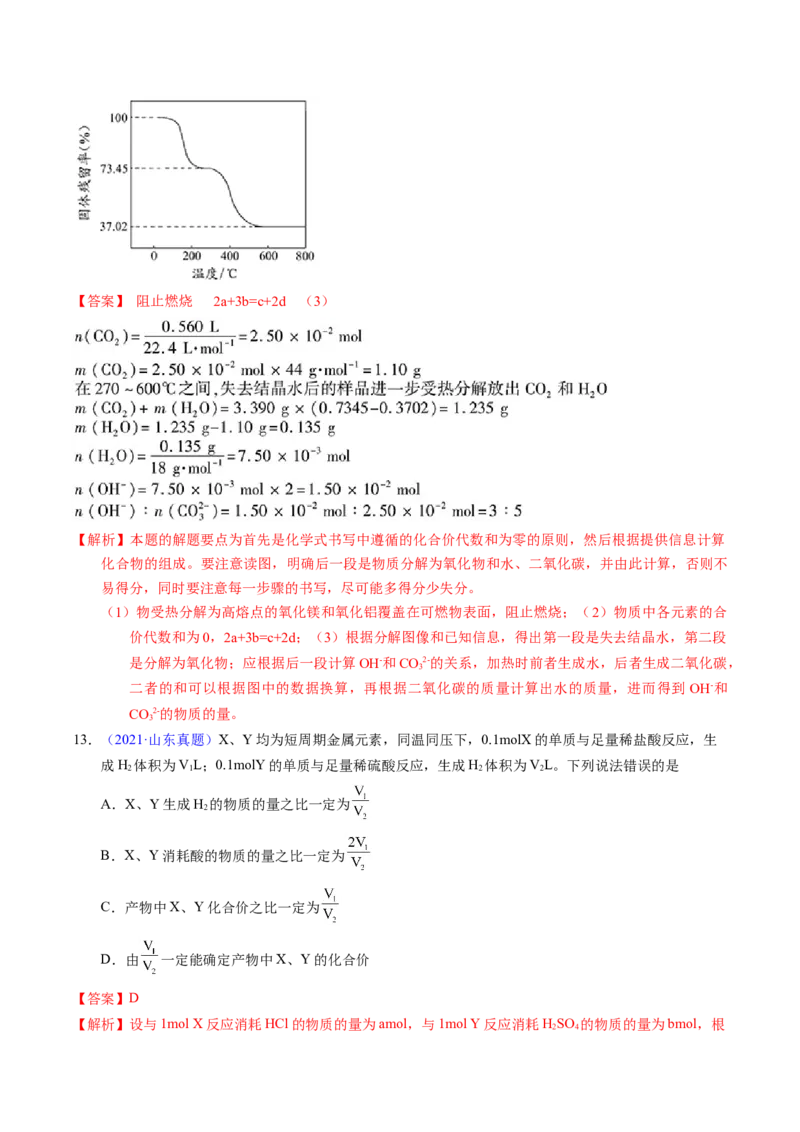
12.【2014年高考江苏卷第18题】(12分)碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·x HO]常用作塑料阻燃剂
2
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和 。
(2)MgaAlb(OH)c(CO3)d·x HO中a、b、c、d的代数关系式为 。
2
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390g样品与足量稀盐酸充分反应,生成CO0.560L(已换算成标准状况下)。②另取一
2
定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)
随温度的变化如右图所示(样品在2700C时已完全失去结晶水,6000C以上残留固体为金属氧化
物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-): n(CO2-)(写出计算过程)。
3【答案】 阻止燃烧 2a+3b=c+2d (3)
【解析】本题的解题要点为首先是化学式书写中遵循的化合价代数和为零的原则,然后根据提供信息计算
化合物的组成。要注意读图,明确后一段是物质分解为氧化物和水、二氧化碳,并由此计算,否则不
易得分,同时要注意每一步骤的书写,尽可能多得分少失分。
(1)物受热分解为高熔点的氧化镁和氧化铝覆盖在可燃物表面,阻止燃烧;(2)物质中各元素的合
价代数和为0,2a+3b=c+2d;(3)根据分解图像和已知信息,得出第一段是失去结晶水,第二段
是分解为氧化物;应根据后一段计算OH-和CO2-的关系,加热时前者生成水,后者生成二氧化碳,
3
二者的和可以根据图中的数据换算,再根据二氧化碳的质量计算出水的质量,进而得到 OH-和
CO2-的物质的量。
3
13.(2021·山东真题)X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生
成H 体积为VL;0.1molY的单质与足量稀硫酸反应,生成H 体积为VL。下列说法错误的是
2 1 2 2
A.X、Y生成H 的物质的量之比一定为
2
B.X、Y消耗酸的物质的量之比一定为
C.产物中X、Y化合价之比一定为
D.由 一定能确定产物中X、Y的化合价
【答案】D
【解析】设与1mol X反应消耗HCl的物质的量为amol,与1mol Y反应消耗HSO 的物质的量为bmol,根
2 4据转移电子守恒以及H原子守恒可知 、 。A.同温同压
下,气体体积之比等于其物质的量之比,因此X、Y生成H 的物质的量之比一定为 ,故A正确;
2
B. X、Y反应过程中消耗酸的物质的量之比为 ,因 ,因此 ,故B正确;C.
产物中X、Y化合价之比为 ,由B项可知 ,故C正确;D.因短周期金属单质与盐酸或稀
硫酸反应时,生成的盐中金属元素化合价有+1、+2、+3三种情况,因此存在a=1,2,3,b=0.5,1的
多种情况,由 可知,当a=1,b=0.5时, =1,当a=2,b=1时, =1,两种情况下X、Y的
化合价不同,因此根据 可能无法确定X、Y的化合价,故D错误;综上所述,错误的D项,故答
案为D。
14.【2016年高考上海卷】某铁的氧化物(Fe O)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下
x
112mlCl ,恰好将Fe2+完全氧化。x值为( )
2
A.0.80 B.0.85 C.0.90 D.0.93
【答案】A
【解析】根据电子守恒可知,Fe O被氧化为Fe3+转移的电子数和Cl 转移的电子数相等。标准状况下
x 2
112mL Cl 转移电子数为0.01mol。则有:×(3-)×x=0.01,解得x=0.8。故选项A正确。
2
15.【2016年高考上海卷】称取(NH )SO 和NH HSO 混合物样品7.24g,加入含0.1molNaOH的溶液,完
4 2 4 4 4
全反应,生成NH 1792ml(标准状况),则(NH )SO 和NH HSO 的物质的量比为( )
3 4 2 4 4 4
A.1:1 B.1:2 C.1.87:1 D.3.65:1
【答案】C
【解析】利用极值法分析,可知0.1mol氢氧化钠不足,故先将NH HSO 反应完,再反应(NH )SO ,因共生
4 4 4 2 4
成NH 0.08mol,故与H+反应的氢氧化钠为0.02mol,则可知道NH HSO 为0.02mol,则(NH )SO 质量
3 4 4 4 2 4
为7.24g-115g/mol×0.02mol=4.94g,(NH )SO 的物质的量为可得答案为4.94g ÷132g/mol=0.0374mol。
4 2 4
因此(NH )SO 与NH HSO 物质的量之比为:1.87:1 ,故选C。
4 2 4 4 4
16.【2015上海化学】将O 和NH 的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量
2 3
的水,最终收集到44.8mL气体。原混合气体中O 的体积可能是(假设氨全部被氧化;气体体积均已
2
换算成标准状况)( )
A.231.5mL B.268.8mL C.287.5mL D.313.6mL
【答案】C、D
【解析】将O 和NH 的混合气体通过加热的三氧化二铬,发生反应:4NH +5O 4NO+6H O。充分
2 3 3 2 2
反应后,再通过足量的水,发生反应:4NO+3O +2H O=4HNO ,将两个方程式叠加,可得总反应方程
2 2 3式:NH +2O = HNO+H O,若最后得到的气体是NO,则发生4NH +5O 4NO+6H O消耗的氧
3 2 3 2 3 2 2
气的体积是V(O )=5/4V(NO)= 5/4×44.8mL=56ml,消耗的总体积是V(总)= V(O )+V(NH )=9
2 2 3
/4×44.8mL=100.8ml,其余的气体体积是448mL-100.8ml=347.2ml,发生反应:NH +2O = HNO+H O,
3 2 3 2
反应消耗的氧气体积是:V(O )=2/3V(剩余)= 2/3×347.2ml=231. 5ml,则其中的氧气的总体积是:V(O )
2 2
(总)= 56ml+ 231. 5ml =287.5mL。若最后剩余的气体是O,则O 应该是发生总反应NH +2O =
2 2 3 2
HNO+H O消耗的和剩余的氧气两部分,氧气的体积是:V(O )= (448mL -44.8mL )×2/3+44.8mL
3 2 2
=313.6mL。故答案是选项C、D。
17.【2013年高考上海卷第22题】一定量的CuS和Cu S的混合物投入足量的HNO 中,收集到气体VL
2 3
(标准状况),向反应后的溶液中(存在Cu2+和SO 2-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,
4
灼烧,得到CuO12.0g,若上述气体为NO和NO 的混合物,且体积比为1﹕1,则V可能为( )
2
A.9.0L B.13.5L C.15.7L D.16.8L
【答案】A
【解析】若混合物全是 CuS,其物质的量为 12/80=0.15mol,根据得失电子数相等:0.15×(6+2)
=×22.4×3+ ×22.4×1,V=13.44L,若混合物全是Cu S,其物质的量为=0.075mol,根据得失电子数相等
2
0.075×10=×22.4×3+ ×22.4×1,V=8.4L,因此选A。
18.【2013年高考上海卷第15题】N 代表阿伏伽德罗常数。已知C H 和C H 的混合物的质量为ag,则
A 2 4 3 6
该混合物( )
A.所含共用电子对数目为(a/7+1)N B.所含碳氢键数目为aN /7
A A
C.燃烧时消耗的O 一定是33.6a/14L D.所含原子总数为aN /14
2 A
【答案】B
【解析】1个C H 分子中含共用电子对数目为6对,碳氢键数目为4个,1个C H 分子中含共用电子对数
2 4 3 6
目为9对,碳氢键数目为6个,则A错误(应该为3aN /14);B正确;C项没有给氧气的状态,D项
A
含原子总数为3aN /14,因此选B。
A
19.(2009·海南高考真题)用足量的CO还原13.7 g某铅氧化物,把生成的CO 全部通入到过量的澄清
2
石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是:
A.PbO B.Pb O C.Pb O D.PbO
2 3 3 4 2
【答案】C
【解析】设此铅氧化物的化学式Pb O,
x y
Pb O—— y[O]—— yCO—— y CO —— yCaCO
x y 2 3
16y 100y
m(O) 8.0g
m(O)= =1.28g,
所以m(Pb) =13.7g- 1.28g = 12.42gx∶y = ∶ = : =0.06:0.08=3∶4,则化学式为Pb O,
3 4
答案选C。
20.(2012·全国高考真题)在常压和500℃条件下,等物质的量的Ag O、Fe(OH)、NH HCO 、
2 3 4 3
NaHCO 完全分解,所得气体体积依次为V、V、V、V,体积大小顺序正确的是( )
3 1 2 3 4
A.V>V>V>V B.V>V>V>V C.V>V>V>V D.V>V>V>V
3 2 4 1 3 4 2 1 3 2 1 4 2 3 1 4
【答案】A
【解析】四种物质的受热分解化学方程式为:A、2Ag O=4Ag+O↑ B、2Fe(OH) =Fe O+3H O↑ C、
2 2 3 2 3 2
NH HCO =NH↑+H O↑+CO↑ D、2NaHCO =Na CO+CO ↑+H O↑ 所以,等物质的量的四种物质完全分
4 3 3 2 2 3 2 3 2 2
解所放气体体积大小依次为V>V>V>V
3 2 4 1