文档内容
武汉外国语学校 2024-2025 学年度上学期 10 月阶段性诊断考试
高三化学试卷
命题教师:高三化学组 审题教师:高三化学组
考试时间:2024年10月10日 考试时长:75分钟 试卷满分:100分
★祝考试顺利★
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Fe 56 Se
79
一、选择题:本题共15小题,每小题3分,共45分。在每小题所给出的四个选项中,只有一项是符
合题目要求的。
1.国家最高科学技术奖是我国国家科学技术奖中最高等级的奖项。下列获奖科学家中在稀土元素的
分离及应用中作出了重要贡献的是
A.袁隆平 B.徐光宪 C.屠呦呦 D.李德仁
2.2023年11月15日,亚洲最深井“深地一号”成功开井,获得高产油气流。我国科研人员采用高
温石英(主要成分SiO)、钛合金等航天耐高温材料,实现了地下近万米深度指哪打哪,通过在钻
2
井液中加入竹纤维,在钻井壁上迅速形成一层保护膜,驯服了有很多微小裂缝的二叠系地层。
下列说法不正确的是
A.所获得的油气流是混合物
B.SiO 是一种共价晶体
2
C.竹纤维属于无机非金属材料
D.钛合金强度高、耐蚀性好、耐热性高
3.下列化学用语或图示表达正确的是
A.HClO的电子式为
3d 4s
B.基态 Cr原子的价层电子轨道表示式为 ↑ ↑ ↑ ↑ ↑↓
24
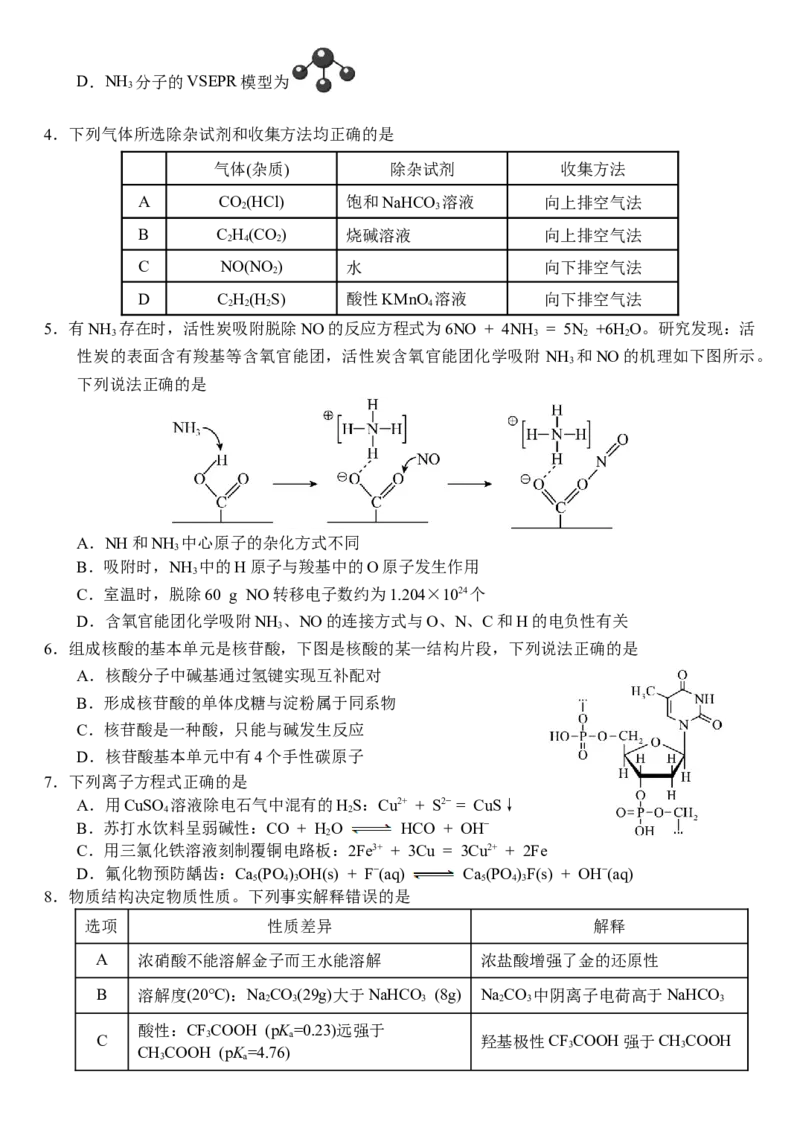
C. 的名称为1−氨基−2−丙醇D.NH 分子的VSEPR模型为
3
4.下列气体所选除杂试剂和收集方法均正确的是
气体(杂质) 除杂试剂 收集方法
A CO(HCl) 饱和NaHCO 溶液 向上排空气法
2 3
B C H(CO) 烧碱溶液 向上排空气法
2 4 2
C NO(NO ) 水 向下排空气法
2
D C H(H S) 酸性KMnO 溶液 向下排空气法
2 2 2 4
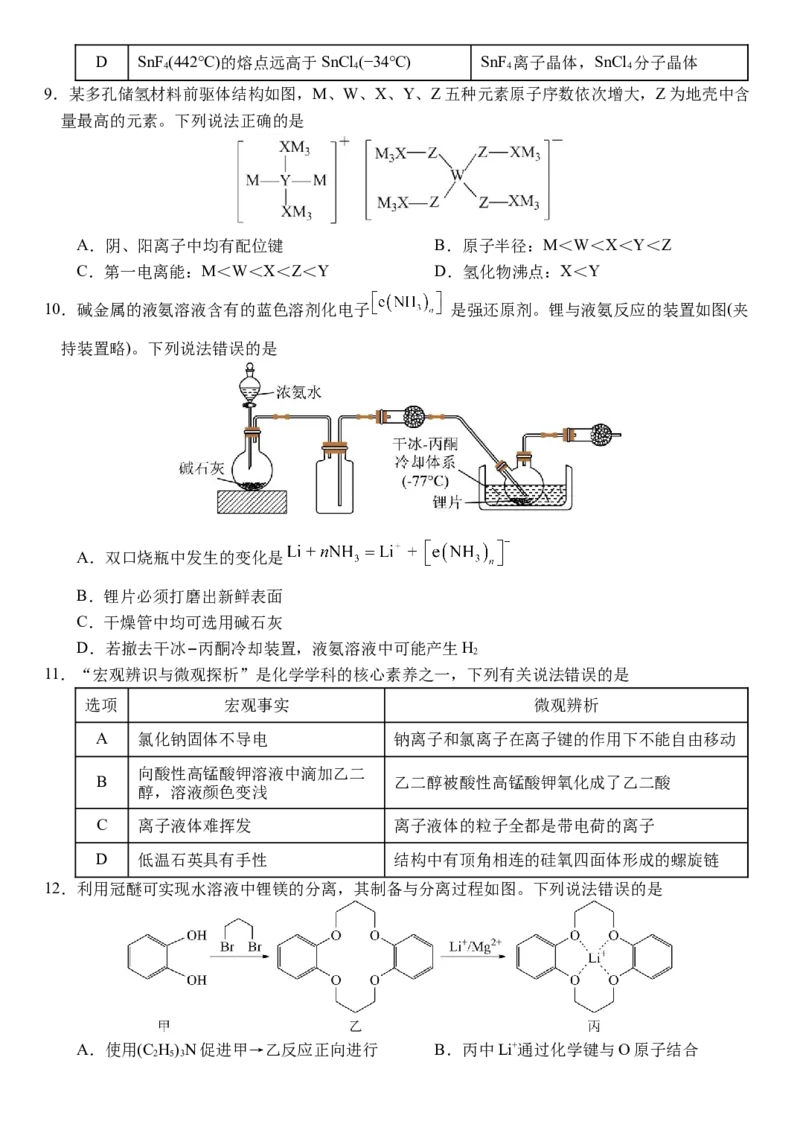
5.有NH 存在时,活性炭吸附脱除NO的反应方程式为6NO + 4NH = 5N +6H O。研究发现:活
3 3 2 2
性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附 NH 和NO的机理如下图所示。
3
下列说法正确的是
A.NH和NH 中心原子的杂化方式不同
3
B.吸附时,NH 中的H原子与羧基中的O原子发生作用
3
C.室温时,脱除60 g NO转移电子数约为1.204×1024个
D.含氧官能团化学吸附NH 、NO的连接方式与O、N、C和H的电负性有关
3
6.组成核酸的基本单元是核苷酸,下图是核酸的某一结构片段,下列说法正确的是
A.核酸分子中碱基通过氢键实现互补配对
B.形成核苷酸的单体戊糖与淀粉属于同系物
C.核苷酸是一种酸,只能与碱发生反应
D.核苷酸基本单元中有4个手性碳原子
7.下列离子方程式正确的是
A.用CuSO 溶液除电石气中混有的HS:Cu2+ + S2− = CuS↓
4 2
B.苏打水饮料呈弱碱性:CO + HO HCO + OH−
2
C.用三氯化铁溶液刻制覆铜电路板:2Fe3+ + 3Cu = 3Cu2+ + 2Fe
D.氟化物预防龋齿:Ca (PO )OH(s) + F−(aq) Ca (PO )F(s) + OH−(aq)
5 4 3 5 4 3
8.物质结构决定物质性质。下列事实解释错误的是
选项 性质差异 解释
A 浓硝酸不能溶解金子而王水能溶解 浓盐酸增强了金的还原性
B 溶解度(20℃):NaCO(29g)大于NaHCO (8g) NaCO 中阴离子电荷高于NaHCO
2 3 3 2 3 3
酸性:CFCOOH (pK=0.23)远强于
C 3 a 羟基极性CFCOOH强于CHCOOH
CHCOOH (pK=4.76) 3 3
3 aD SnF (442℃)的熔点远高于SnCl (−34℃) SnF 离子晶体,SnCl 分子晶体
4 4 4 4
9.某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,Z为地壳中含
量最高的元素。下列说法正确的是
A.阴、阳离子中均有配位键 B.原子半径:M<W<X<Y<Z
C.第一电离能:M<W<X<Z<Y D.氢化物沸点:X<Y
10.碱金属的液氨溶液含有的蓝色溶剂化电子 是强还原剂。锂与液氨反应的装置如图(夹
持装置略)。下列说法错误的是
A.双口烧瓶中发生的变化是
B.锂片必须打磨出新鲜表面
C.干燥管中均可选用碱石灰
D.若撤去干冰−丙酮冷却装置,液氨溶液中可能产生H
2
11.“宏观辨识与微观探析”是化学学科的核心素养之一,下列有关说法错误的是
选项 宏观事实 微观辨析
A 氯化钠固体不导电 钠离子和氯离子在离子键的作用下不能自由移动
向酸性高锰酸钾溶液中滴加乙二
B 乙二醇被酸性高锰酸钾氧化成了乙二酸
醇,溶液颜色变浅
C 离子液体难挥发 离子液体的粒子全都是带电荷的离子
D 低温石英具有手性 结构中有顶角相连的硅氧四面体形成的螺旋链
12.利用冠醚可实现水溶液中锂镁的分离,其制备与分离过程如图。下列说法错误的是
A.使用(C H)N促进甲→乙反应正向进行 B.丙中Li+通过化学键与O原子结合
2 5 3C.甲、乙、丙中仅有一种物质属于超分子 D.通过空间结构和作用力协同实现锂镁分离
13.(Li Fe OH)FeSe晶体结构由铁硒层和锂铁氢氧层交替堆垛而成。晶胞中铁硒层在yz、xz和xy
0.8 0.2
平面投影如图,1号Fe原子的原子坐标为 。下列说法错误的是
的
A.铁硒层中Fe 配位数为4
B.1个晶胞中含有2个Se原子
C.2号Fe原子的原子坐标为
D.晶体密度为
14.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段
时间后发现液滴覆盖的圆圈中心区(a)变暗,在液
滴外沿形成棕色环(b),如图所示。下列说法正确
的是
A.铁片发生还原反应而被腐蚀
B.液滴边缘是负极区,发生的电极反应为:Fe – 2e– = Fe2+
C.铁片腐蚀最严重区域应该是生锈最多的区域
D.导致现象的主要原因是液滴之下氧气含量比边缘处少
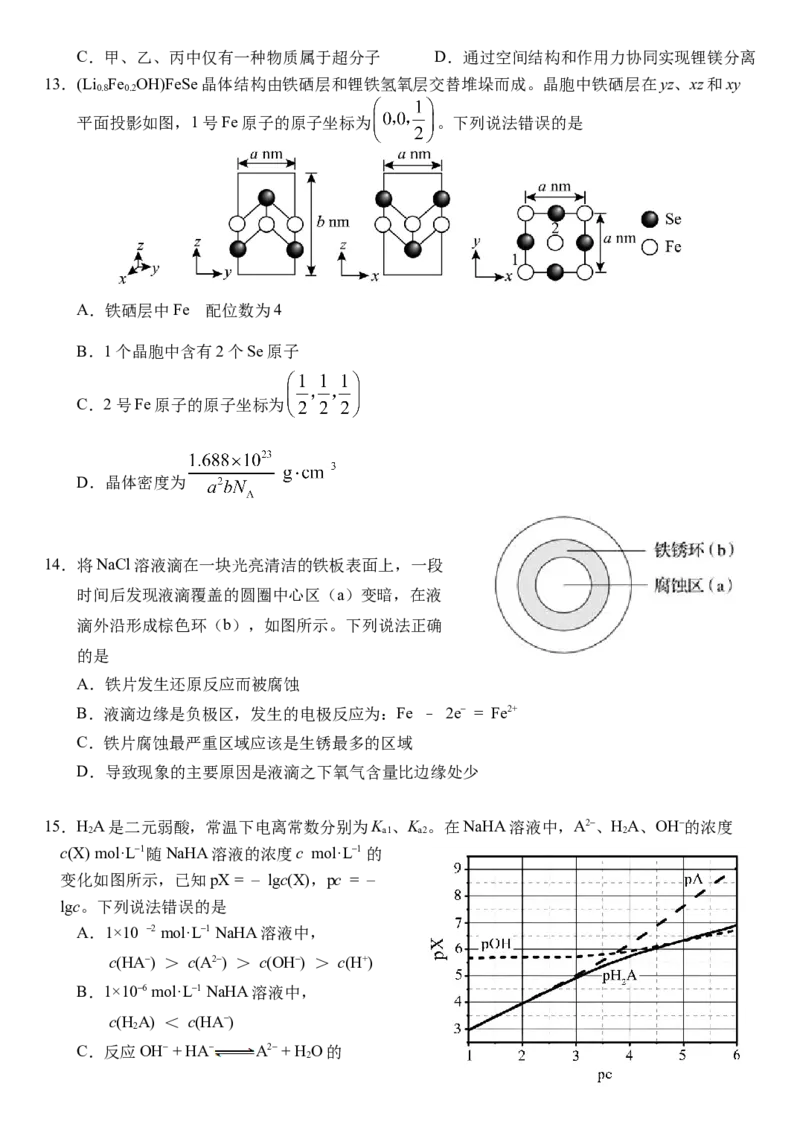
15.HA是二元弱酸,常温下电离常数分别为K 、K 。在NaHA溶液中,A2–、HA、OH–的浓度
2 a1 a2 2
c(X) mol·L–1随NaHA溶液的浓度c mol·L–1 的
变化如图所示,已知pX = – lgc(X),pc = –
lgc。下列说法错误的是
A.1×10 –2 mol·L–1 NaHA溶液中,
c(HA–) > c(A2–) > c(OH–) > c(H+)
B.1×10–6 mol·L–1 NaHA溶液中,
c(H A) < c(HA–)
2
C.反应OH– + HA– A2– + H O的
2K = K /K
w a2
D.pOH = pA时,c(H+) ≈
二、非选择题:本题共4小题,共55分。
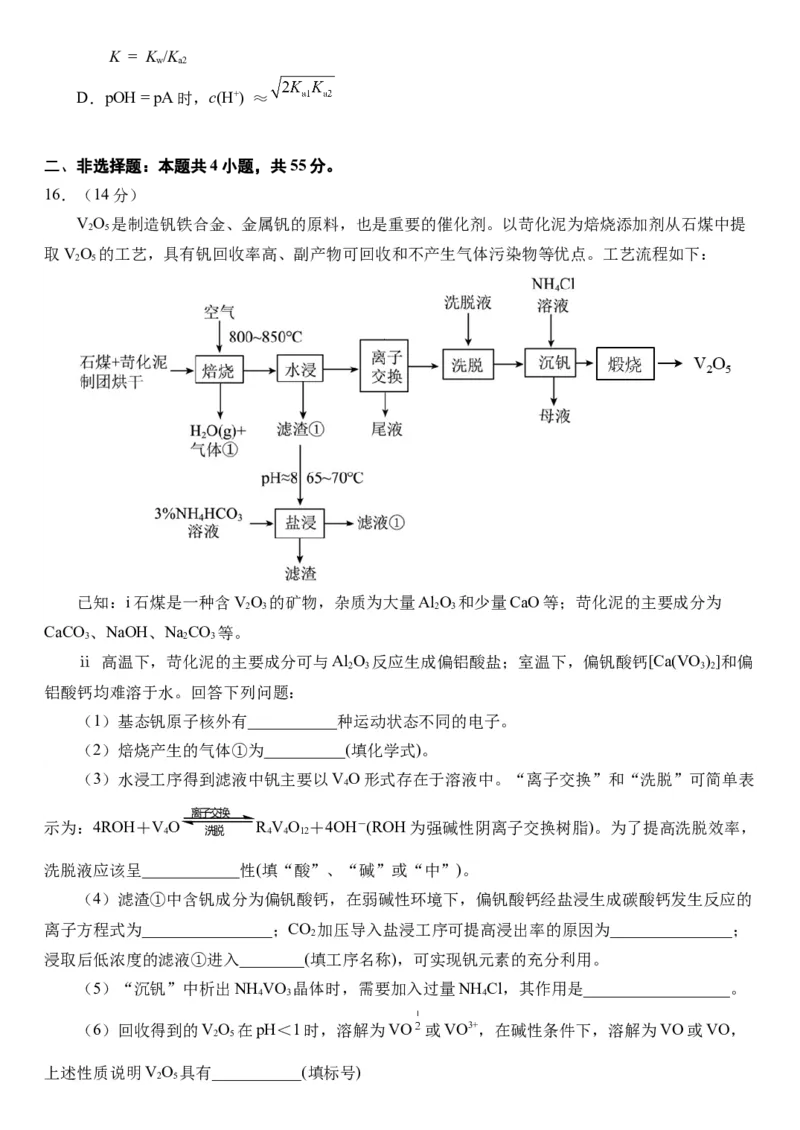
16.(14分)
VO 是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提
2 5
取VO 的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下:
2 5
已知:i石煤是一种含VO 的矿物,杂质为大量Al O 和少量CaO等;苛化泥的主要成分为
2 3 2 3
CaCO 、NaOH、NaCO 等。
3 2 3
ⅱ 高温下,苛化泥的主要成分可与Al O 反应生成偏铝酸盐;室温下,偏钒酸钙[Ca(VO )]和偏
2 3 3 2
铝酸钙均难溶于水。回答下列问题:
(1)基态钒原子核外有___________种运动状态不同的电子。
(2)焙烧产生的气体①为__________(填化学式)。
(3)水浸工序得到滤液中钒主要以VO形式存在于溶液中。“离子交换”和“洗脱”可简单表
4
离子交换
示为:4ROH+VO R VO +4OH-(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,
4 洗脱 4 4 12
洗脱液应该呈____________性(填“酸”、“碱”或“中”)。
(4)滤渣①中含钒成分为偏钒酸钙,在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的
离子方程式为________________;CO 加压导入盐浸工序可提高浸出率的原因为_______________;
2
浸取后低浓度的滤液①进入________(填工序名称),可实现钒元素的充分利用。
(5)“沉钒”中析出NH VO 晶体时,需要加入过量NH Cl,其作用是__________________。
4 3 4
(6)回收得到的VO 在pH<1时,溶解为VO 或VO3+,在碱性条件下,溶解为VO或VO,
2 5
上述性质说明VO 具有___________(填标号)
2 5a.酸性 b.碱性 c.两性
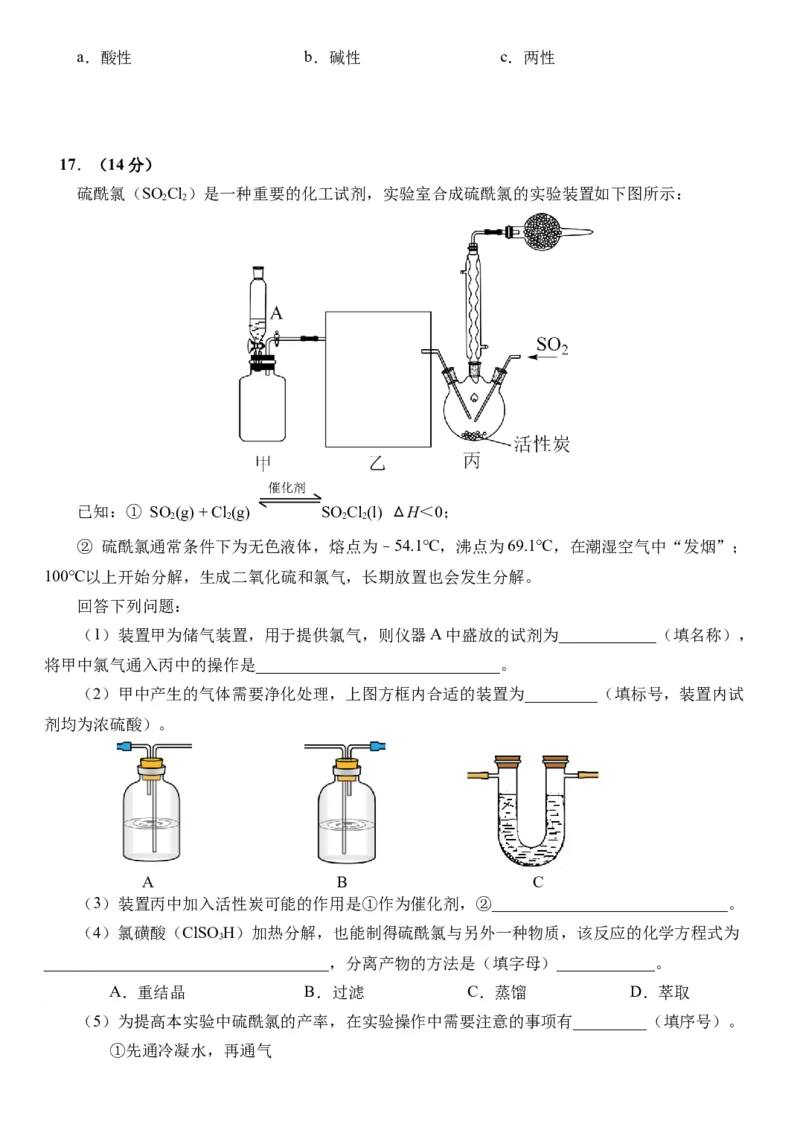
17.(14分)
硫酰氯(SO Cl)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:
2 2
催化剂
已知:① SO (g) + Cl (g) SO Cl(l) ΔH<0;
2 2 2 2
② 硫酰氯通常条件下为无色液体,熔点为–54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为____________(填名称),
将甲中氯气通入丙中的操作是______________________________。
(2)甲中产生的气体需要净化处理,上图方框内合适的装置为_________(填标号,装置内试
剂均为浓硫酸)。
A B C
(3)装置丙中加入活性炭可能的作用是①作为催化剂,②_____________________________。
(4)氯磺酸(ClSOH)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为
3
___________________________________,分离产物的方法是(填字母)____________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_________(填序号)。
①先通冷凝水,再通气②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温
④加热三颈烧瓶
(6)干燥管中试剂的作用为___________________、____________________。
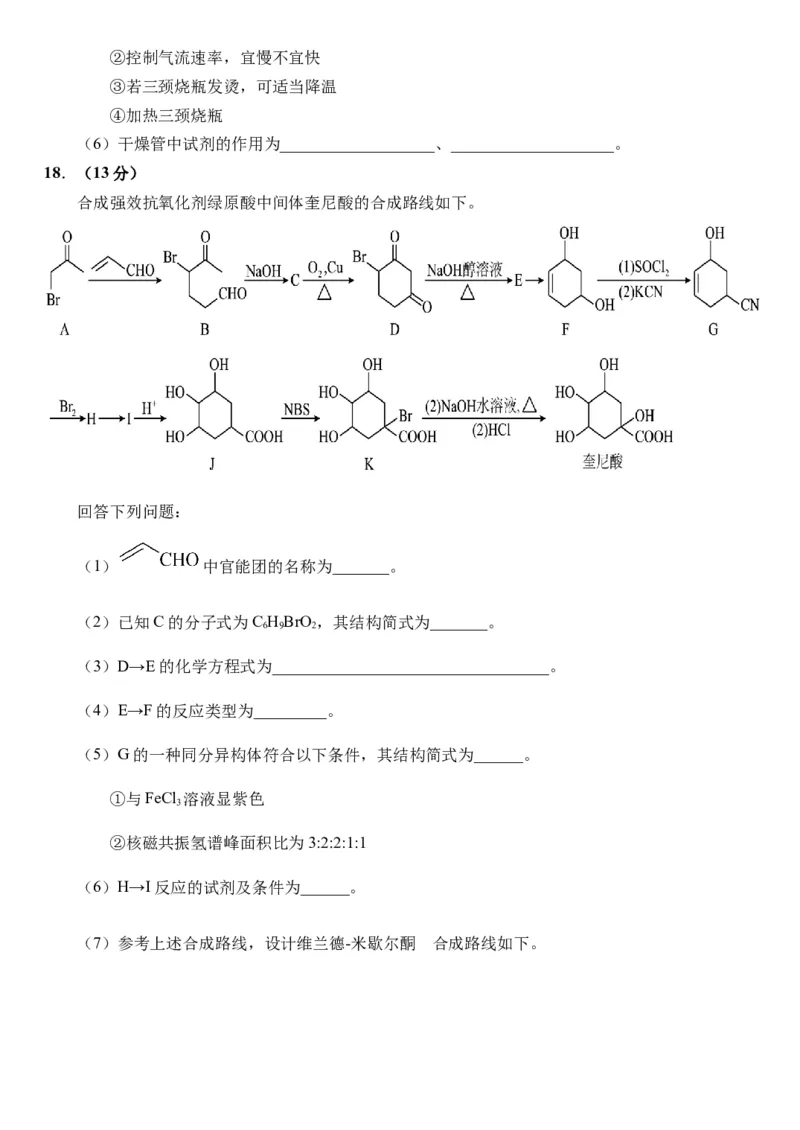
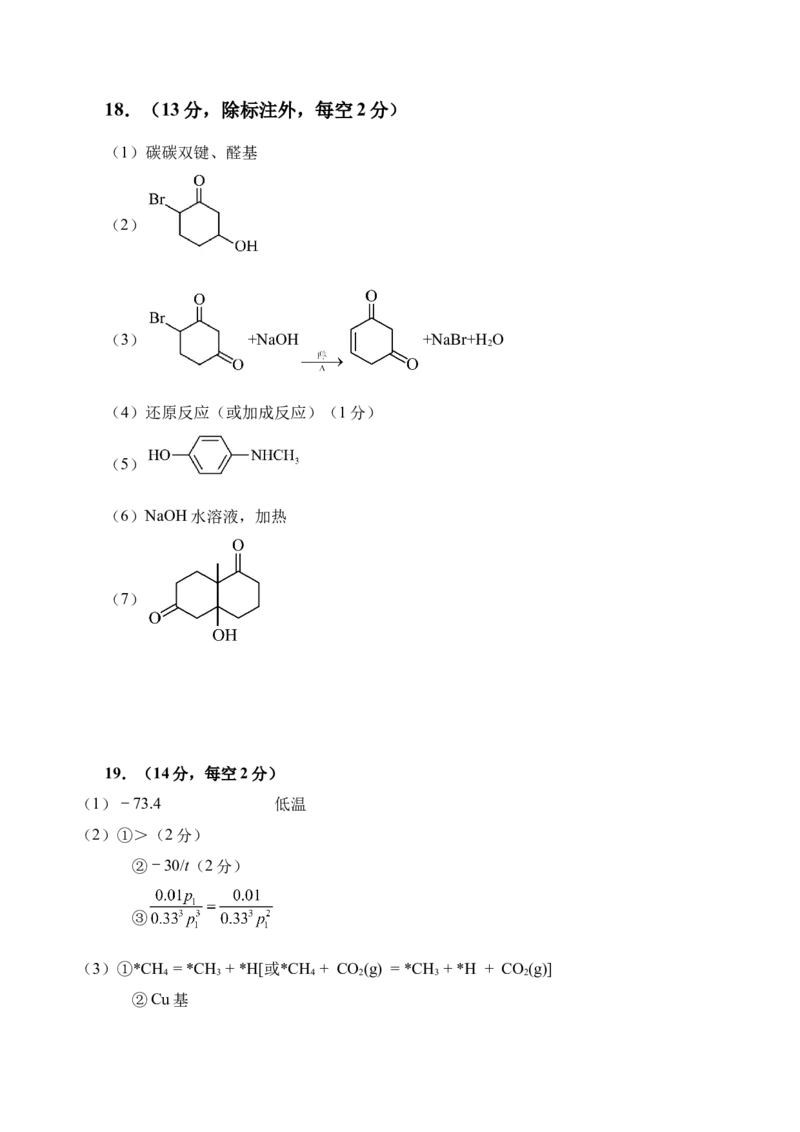
18.(13分)
合成强效抗氧化剂绿原酸中间体奎尼酸的合成路线如下。
回答下列问题:
(1) 中官能团的名称为_______。
(2)已知C的分子式为C HBrO,其结构简式为_______。
6 9 2
(3)D→E的化学方程式为__________________________________。
(4)E→F的反应类型为_________。
(5)G的一种同分异构体符合以下条件,其结构简式为______。
①与FeCl 溶液显紫色
3
②核磁共振氢谱峰面积比为3:2:2:1:1
(6)H→I反应的试剂及条件为______。
的
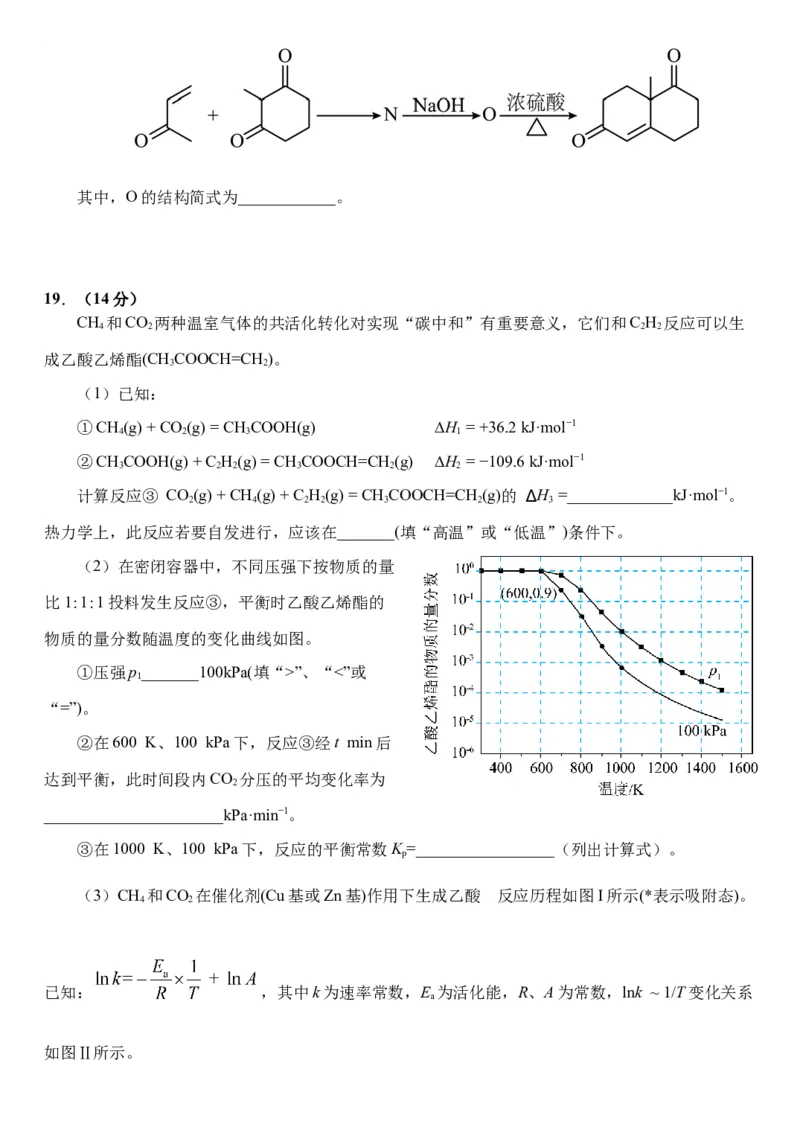
(7)参考上述合成路线,设计维兰德-米歇尔酮 合成路线如下。其中,O的结构简式为____________。
19.(14分)
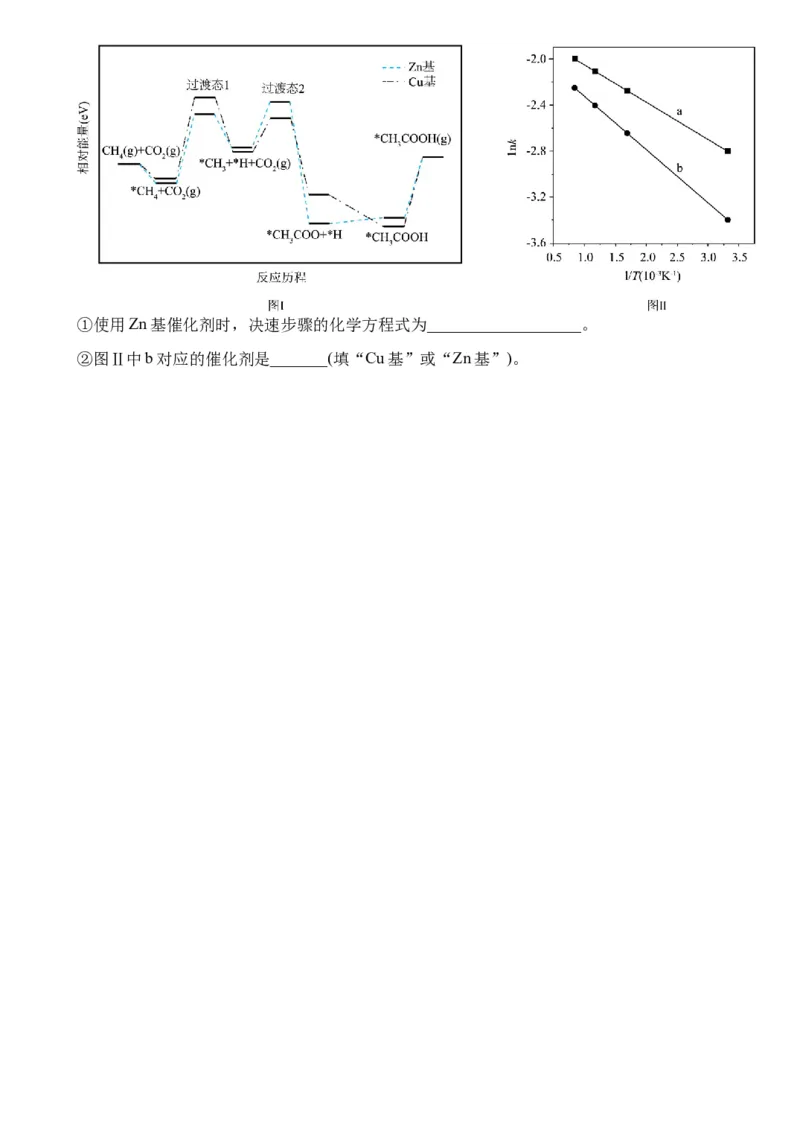
CH 和CO 两种温室气体的共活化转化对实现“碳中和”有重要意义,它们和C H 反应可以生
4 2 2 2
成乙酸乙烯酯(CHCOOCH=CH )。
3 2
(1)已知:
①CH(g) + CO (g) = CH COOH(g) ∆H = +36.2 kJ·mol−1
4 2 3 1
②CHCOOH(g) + C H(g) = CH COOCH=CH (g) ∆H = −109.6 kJ·mol−1
3 2 2 3 2 2
计算反应③ CO(g) + CH (g) + C H(g) = CH COOCH=CH (g)的 ∆H =_____________kJ·mol−1。
2 4 2 2 3 2 3
热力学上,此反应若要自发进行,应该在_______(填“高温”或“低温”)条件下。
(2)在密闭容器中,不同压强下按物质的量
比1:1:1投料发生反应③,平衡时乙酸乙烯酯的
物质的量分数随温度的变化曲线如图。
①压强p_______100kPa(填“>”、“<”或
1
“=”)。
②在600 K、100 kPa下,反应③经t min后
达到平衡,此时间段内CO 分压的平均变化率为
2
______________________kPa·min−1。
③在1000 K、100 kPa下,反应的平衡常数K =_________________(列出计算式)。
p
的
(3)CH 和CO 在催化剂(Cu基或Zn基)作用下生成乙酸 反应历程如图I所示(*表示吸附态)。
4 2
已知: ,其中k为速率常数,E 为活化能,R、A为常数,lnk ~ 1/T变化关系
a
如图Ⅱ所示。①使用Zn基催化剂时,决速步骤的化学方程式为___________________。
②图Ⅱ中b对应的催化剂是_______(填“Cu基”或“Zn基”)。武汉外国语学校 2024-2025 学年度上学期 10 月阶段性诊断考试
高三化学参考答案
2024年10月10日
一、选择题(3分×15=45分)
题 1 1 1 1 1 1
1 2 3 4 5 6 7 8 9
号 0 1 2 3 4 5
答
B C C A D A D B A C B B D D C
案
16.(14分,除标注外,每空2分)
(1)23
(2)CO (1分)
2
(3)碱(1分)
(4)
提高溶液中HCO浓度,促使偏钒酸钙转化为碳酸钙,释放VO
离子交换
(5)(利用同离子效应,)促进NH VO 尽可能析出完全
4 3
(6)c
17.(14分,除标注外,每空2分)
(1)饱和氯化钠溶液(1分)
取下滴液漏斗(分液漏斗)上面的玻璃塞,再旋开旋塞
(2)B
(3)吸附二氧化硫和氯气,作为反应载体。
△
(4)2ClSO H SO Cl + H SO C(1分)
3 2 2 2 4
(5)①②③
(6)吸收二氧化硫和氯气,防止污染空气;防止水蒸气进入18.(13分,除标注外,每空2分)
(1)碳碳双键、醛基
(2)
(3) +NaOH +NaBr+H O
2
(4)还原反应(或加成反应)(1分)
(5)
(6)NaOH水溶液,加热
(7)
19.(14分,每空2分)
(1)-73.4 低温
(2)①>(2分)
②-30/t(2分)
③
(3)①*CH = *CH + *H[或*CH + CO (g) = *CH + *H + CO (g)]
4 3 4 2 3 2
②Cu基