文档内容
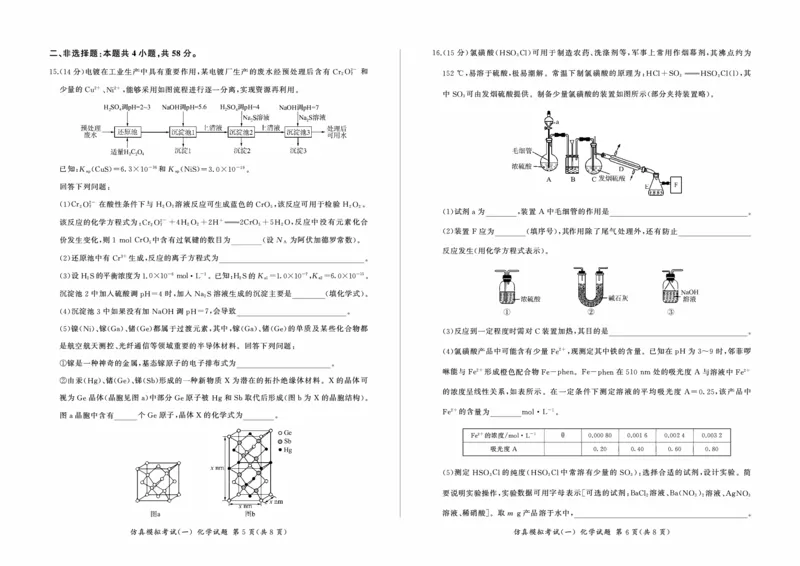
2025届高三仿真模拟考试(一) 4.氮及其化合物的重要转化关系如图所示,下列说法正确的是
化学试题 N2—心 e::._ ) NH3一 @) NO—3 =+- N02一 @ HN03
I A + 1
注意事项: @ @
L答卷前,考生务必将自己的姓名、准考证号填写在答题卡上; A.反应@@@是工业生产HN03的主要反应
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案字母涂黑,如需改动,用橡皮
B.反应心@均需要使用催化剂,以提高反应物的平衡转化率
擦干净后,再选涂其他答案字母;回答非选择题时,将答案写在答题卡上,写在本试卷上无效;
3.考试结束后,将本试卷和答题卡一并交回。
C.将N0 2通入H心中发生反应@,生成2 mo! HN0 3,同时生成22.4 L NO
考试时间75分钟,满分100分 D.实验室用浓硝酸与铜通过反应@制取N02 时,得到的气体中可能含有NO
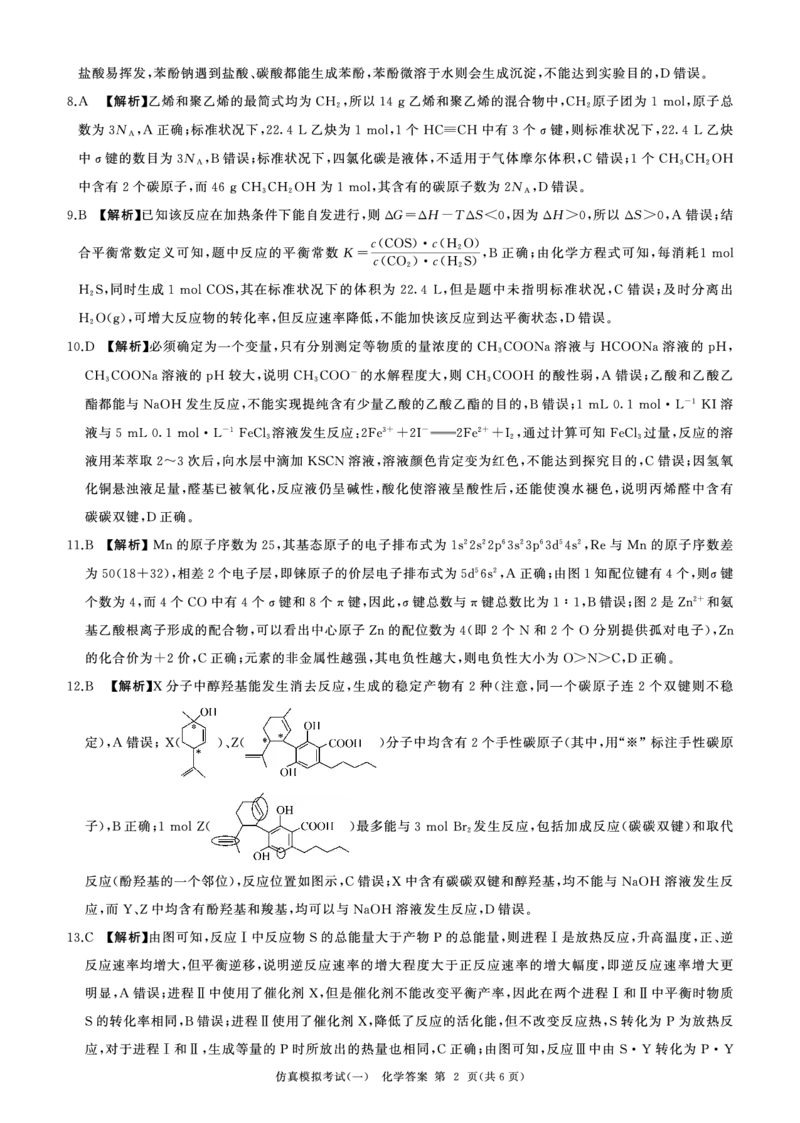
5.实验室模拟制取Na 2 C0 3,下列使用的装置能达到实验目的的是
— — — —
可能用到的相对原子质量:H 1 C 12 0 16 S 32
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只
有一项是符合题目要求的。
1.科学的发展离不开材料的不断更新和优化。下列有关说法错误的是
图1 图2 图4
A.“天问一号“火星车使用的热控保温材料纳米气凝胶可产生丁达尔效应
B.“嫦娥五号“采集的月壤里含有结晶程度高的石墨烯,石墨烯与金刚石互为同素异形体
A.用图1装置制取CO 2气体
B.用图2装置制取NH 3,试剂X为氢氧化钙与氯化按的混合物
C.北斗导航卫星所使用的高性能计算机芯片的主要成分是二氧化硅
D.“嫦娥六号“五星红旗采用来自太行山的玄武岩为主的复合材料制造
C.用图3装置制取NaHC0
3
,a管先通入CO2,然后b管通入NH
3
2.下列化学用语正确的是
D.用图4装置加热分解制取Na2 C0
3
6.下列方程式能正确解释相应事实的是
A.二氯化二硫CS
2
Cl 2)的电子式为:Cl: S:: S: Cl:
电解 t t
A.用Cu作电极电解饱和食盐水:2c1-+ZH
2
0�H
2
+Cl
2
+zoH-
B.AgCl溶于过量氨水:Ag++2NH
3
• H心 [Ag(NH
3
) 2丁+2H心
B.一元弱酸H
3
P0
2
的结构式为HO—P—H
C碱性条件下,C几燃料电池的负极反应:CH
4
—Se-+soH-=C0
2
t +6H心
凡0
ID D.1—漠丙烧在碱性条件下水解:CH
3
CH
2
C H
2
B r+ Na OH �
乙
CH
3
CH
2
C H
2
O H+ NaBr
C基态22兀的价层电子的轨道表示式为巨且巨工
4s 4p
7.下列实验方案能达到实验目的的是
H
c
\ b... 选项 A B D
D.邻轻基苯甲醒分子内的氢键示意图为(X �c/ H
比较乙醇分子和水分 1 探究化学反应速率 1 证明苯酚的酸性小
目的I除去甲烧中的乙烯
子中氢原子的活泼性I的影响因素 于碳酸
3.B
A
e
.
C
Be
l
C
2的
l2属
化
千
学性
非
质
电
与
解
A
质
I
,
C
熔
l3
融
的
态
相
不
似
导
,熔
电
点较低、易升华。下列说法正确的是
混 气 合 体 _ 飞 /
-
2 盐 3 mL mOl 酸 t T 2 盐 0 mL Sm 酸 。 L l
[f 、[
B.Be位千元素周期表的p区
实验
们
二
]
三
C.BeCl 2可在水中发生水解反应:BeCl 2 +2H 2 0�2HCl+Be(OH) 2 方案 酸 酸 性 钾溶 高猛 液 �镁片铁片;
`面积大致相同
D.Be(OH)z与NaOH溶液不反应
仿真模拟考试(一)化学试题第1页(共8页) 仿真模拟考试(一)化学试题第2页(共8页)
{#{QQABIYCQoggAQAJAAQgCQQHgCgCQkhEAAQgGhAAAIAAACBNABAA=}#}8.用NA 代表阿伏加德罗常数的值。下列说法正确的是 A.4来
(75Re)
的价电子排布与猛相似,则铢的价电子排布为
5d
5
6s
2
co
A.14 g乙烯和聚乙烯的混合物中所含原子总数为3NA B.图(1)是Ni与 形成的配合物Ni(C0)4,该分子中叶建与六键的个数 比为1 : 2
B.标准状况下,22.4L乙快中所含 6键的数目为NA C.锌又称 “ 聪明元素 " ,图(2)是一种很好的补锌剂,其中Zn的配位数为4
C.标准状况下,11.2 L四氯化碳中含有的氯原子数为2NA D.图(3)是铢形成的一种配位化合物(X表示卤素原子),其中电负性大小为O>N>C
D.46 g CH3CH20H中含有的碳原子数为NA 12.以有机物X、Y为起始原料可以合成药物Z。下列说法正确的是
9.已知 H2S和CO2反应生成的碳基硫(COS)用于粮食熏蒸,能防止某些昆虫 、线虫和真菌的危
了
HO
害。反应原理为:CO2(g) + H2 S(g)�COS(g)+H心(g) t:;.H>O。
下列说法正确的是
z
A.已知该反应在加热条件下能自发进行,则其t:;.SI
C 溶液,充分反应后用苯萃取2~3次,取水层,并滴加KSCN溶液,
C.进程I、II生成等量的 P时,产生的能量也相同
反应有一定限度
观察溶液颜色变化
D.反应进程中催化效率:ill>II
向丙烯醒中加入足盘新制氢氧化铜悬浊液,加热至不再生成砖红
说明丙烯醒中含有碳碳双键 14.H3A是一种多元酸,向10mL 1 mol • L-1(pH=l. 75)的 H3A溶液中逐滴加入1mol • L-1
色沉淀,静置,取上层清液酸化后,再滴加漠水,漠水褪色
NaOH溶液至过量,滴加过程中各种含 A微粒的物质的量分数8随溶液pH的变化曲线如
11.2024年6月25日,"嫦娥六号 “ 探测器成功完成了月球探索之旅。铢铢合金是制造探测器发
图所示。下列叙述正确的是
动机燃烧室、涡轮叶片的重要材料;铢( 被誉为21世纪的超级金属, 的金属单质的
75Re) 75Re -----
A.H3A是三元弱酸
0
-- -
熔点仅次于鸽,地壳中铢的含量极低,多半来自铜、锌等矿物中。下列说法错误的是 09
B.Na2HA溶液中存在: 08
0
简 o 2c(H人)+c(比A-)+c(H+)=c(OH-) 06 --- V ( 58 5, 05、`
C ',平,,\ ^ 丿 N 厂 A 丿
。芦 / 心 \产 � o O C 夕 二二: N --t i三 0 co 。人 0 H 一 怼 〉 气 NH ° 2 产 N _ / \ Rec
5
c Ol汃 C. c N ( a N H a 2 勹 A > 溶 c 液 CH 中 2 存 A 在 -)> : c( H3A)>c( HA2-) I I5 ' , 6 p H
(1) (2) D当V(NaOH溶液)=15 mL时,pH=5.85
仿真模拟考试(一)化学试题第3页(共8页) 仿真模拟考试(一)化学试题第4页(共8页)
图
图 图
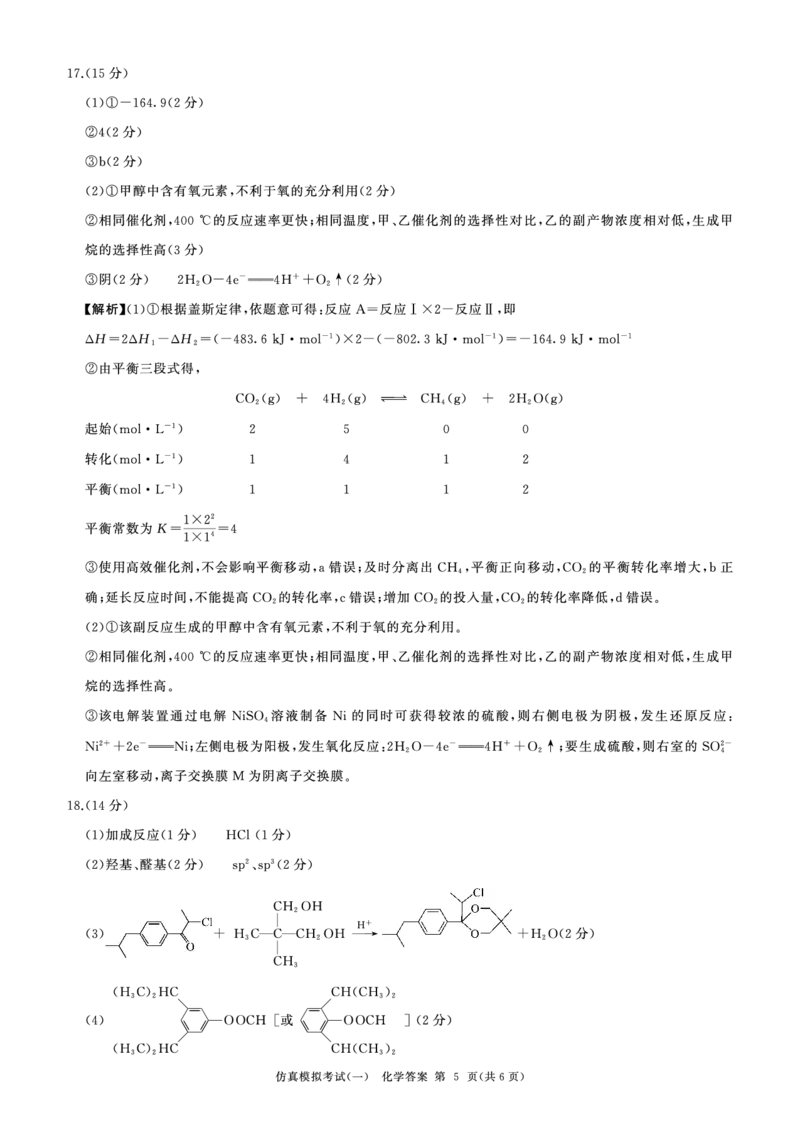
{#{QQABIYCQoggAQAJAAQgCQQHgCgCQkhEAAQgGhAAAIAAACBNABAA=}#}二、非选择题:本题共4小题,共58分。 16.(15分)氯磺酸(HS03 Cl)可用于制造农药、洗涤剂等,军事上常用作烟幕剂,其沸点约为
一
15.(14分)电锁在工业生产中具有重要作用,某电锁厂生产的废水经预处理后 含有Cr20孚 和 152 °C,易溶于硫酸,极易潮解。 常温下 制氯磺酸的原理为:HCl+so 3 =HS0 3Cl(l),其
少最的Cu2+、 N尸,能够采用如图流程进行逐一分离,实现资源再利用。
中so3可由发烟硫酸提供。 制备少量氯磺酸的装置如图所示(部分夹持装置略)。
HS0调pH=2~3 NaOH调pH=5.6 凡S0调pH=4 NaOH调pH=7
2 4 4
l
N吓S溶液
预处理 处理后
废水 可用水
适量H凸0 毛细管
4
已知:K,
p
(CuS)=6.3Xl0-36和K, p(NiS)=3.ox10-19
0
浓硫酸
回答下列问题:
(l)Cr20了在酸性条件下与H心2溶液反应可生成蓝色的Cr0 5,该反应可用千检验H
2
02
(1) 试剂a为 ,装置A中毛细管的作用是
该反应的化学方程式为:Cr20务 - +4H2 0 2 +zH+=2Cr05 +5H20,反应中没有元素 化合
(2)装置F应为 (填序号),其作用除了尾气处理外,还有防止
价发生变化,则1 mol Cr0 5中含有过氧键的数目为 (设NA为阿伏加德罗常 数)。
反应发生(用化学方程式表示)。
(2)还原池中有Crs+生成,反应的离子方程式为
了 京
(3)设H2S的平衡浓度为1.OXl0-6 mol • L一 ]。 已知:凡S的K.1=L ox10-7,K
a2
=6. ox10-15
0
沉淀池2中加入硫酸调pH=4时,加入Na2 S溶液生成的沉淀主要是 (填化学式)。 国
浓硫酸 碱石灰
宣
麟
aOH
(4) 沉淀池3中如果没有加NaOH调pH=7,会导致 @
(5)铢(Ni入稼(Ga)、绪(Ge)都属于过渡元素,其中,稼(Ga)、销(Ge)的单质及某些化合物都
(3)反应到一定程度时需对C装置加热,其目的是
是航空航天测控、光纤通信等领域重要的半导体材料。 回答下列问题:
(4)氯磺酸产品中可能 含有少量Fe2十,现测定其中铁的含量。 已知在pH为3~9时,邻菲暇
心稼是一种神奇的金属,基态稼原子的电子排布式为
琳能与Fe2十形成橙色配合物Fe—phen。 Fe—phen 在 510 nm处的吸光度A与溶液中Fe2+
@由采(Hg)、错(Ge)、梯(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。 X的晶体可
的浓度呈线性关系,如表所示。 在一定条件下测定溶液的平均吸光度A=O.25,该产品中
视为Ge 晶体(晶胞见图a)中部分Ge原子被Hg和Sb取代后形成(图b为X的晶胞结构)。
图a 晶胞中含有 个Ge原子, 晶体 X的化学式为 。 Fe2十的含量为 mol • L -i o
。。
1 ° 1 ° 1 °
oGe
oSb Fe 2十的浓度/ mo!• L-1 0 000 80 001 6 002 4 003 2
•Hg 吸光度A 0.20 I 0.40 I 0.60 I 0.80
(5)测定 HS03 Cl的纯度 (HS0 3 Cl中常溶有少量的so3):选择合适的试剂,设计实验。 简
霆
要说明实验操作,实验数据可用字母表示[可选的试剂:BaCl2溶液、 Ba(N03)2溶液、AgN03
图 溶液、稀硝酸]。 取mg产品溶于水中,
a
仿真模拟考试(一)化学试题第5页(共8页) 仿真模拟考试(一)化学试题第6页(共8页)
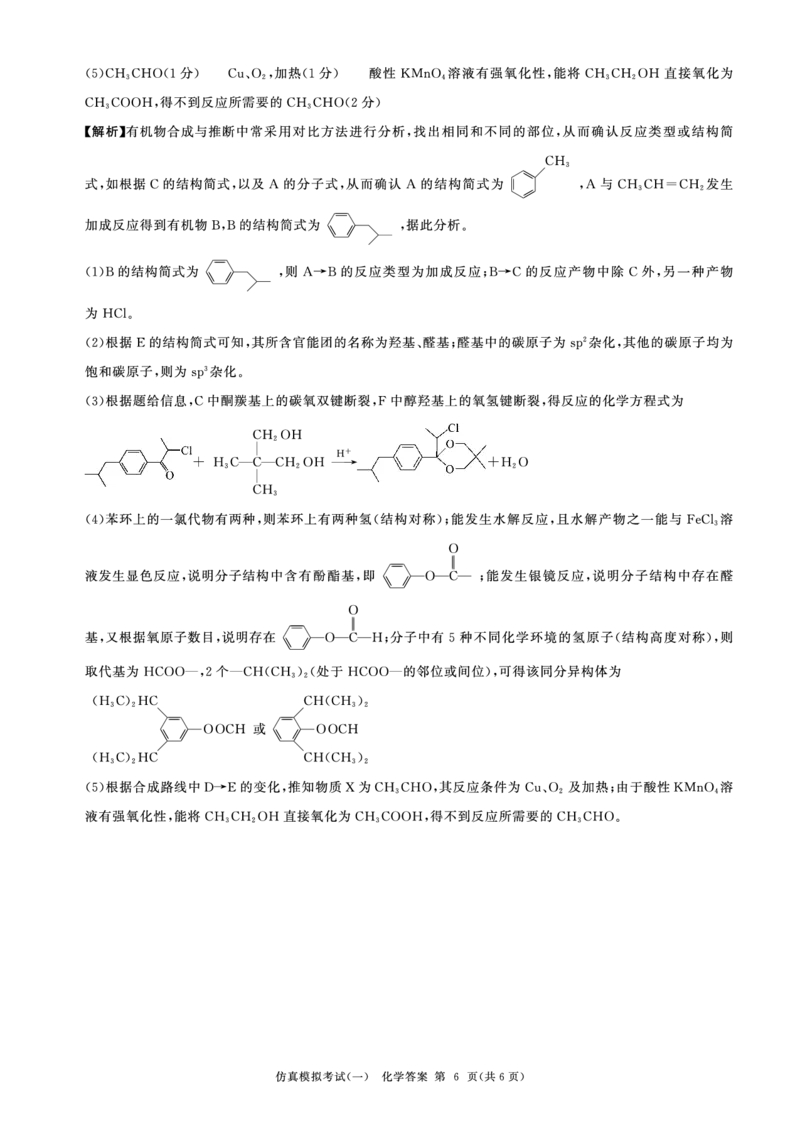
{#{QQABIYCQoggAQAJAAQgCQQHgCgCQkhEAAQgGhAAAIAAACBNABAA=}#}17.(15分)回收利用CO2解决空间站供氧问题,其物质转化如图所示。 18.(14分)以有机物A为原料合成 H
:二
的路线如下。
勹
H
2
CO Cl
呼吸 2-....___ 反应A Cl—
( \
。
CH (暂未利用)
4
H0
2 2
>三
CH0H CHOH
反应A为CO2 (g+) 4H 2 (g)� 比 C 电 H 解 4 ( / g 光 +) 解 ZH 2 0(g) i::;.H,是回收利用CO2的关键步骤。 CH广y C H H 一 3 CHO显 稀Na 荨 OH 凡C — 丿 I - 2 CHO』 催化剂 凡C —丿 如 - 2 CH 2 OH OH
(1已) 知反应: 溶液 CH 3 �
D E F
反应l : 2H2 (g)+0 2 (g)� 2H心(g) /::;.H I =— 483. 6 kJ • mol-1 H
反应II : CH4 (g) +20 2 (g)�C0 2 (g)+ZH 2 0(g) /::;.Hz=— 802. 3 kJ • mol-1 o CH 2 OH H + R O—CH 2
|| + | - \C/ |+HO
叩反应A的�H= kJ • mol-1 o 已知: R—C—R' CH 2 OH R'/ \O—CH 2 2
@某温度下,向体积为2L的某恒容密闭容器中充入 4molC O2 和10mol H
2
,5 min时反应
回答下列问题:
达到平衡,CO2的平衡转化率为50%,则反应A的平衡常数K值为
(l )A-B的反应类型为 ;B-C的反应产物中除C外,另一种产物为
@有利于提高体系中CO2平衡转化率的措施是 (填字母)。
(填化学式)。
a.使用高效催化剂 b.及时分离出CH
4
(g)
(2) 有机物E中官能团的名称为 ,碳原子的杂化方式为
c.延长反应时间 d.增加CO2的投入最
(3)写出C与F反应生成G的化学方程式:
(2)相同条件下,CO2与比还会发生副反应:CO2 (g+) 3H
2
(g)�CH
3
0H(g)十几O(g)
(4)写出同时满足下列条件的有机物 H的一种同分异构体的结构简式:
心该副反应的发生不利于氧循环,原因是
CD苯环上有三个取代基,苯环上的一氯代物有两种,且分子中有5种不同化学环境的氢原子;
@在不同温度、不同催化剂条件下,在反应器中按 C