文档内容
开远市第一中学校 2024 届高三上学期开学考试 3. 设N 为阿伏加德罗常数的值。下列叙述正确的是
A
A. 标准状况下,11.2LCH 与11.2LCl 在光照下充分反应后,气体分子数为N
4 2 A
化 学
B. 46g乙醇中含有的C-H键的数目为5N
A
C. 1mol·L-1的NaClO溶液中含有的ClO-数目小于N
A
D. 1molAl3+完全转化为AlO- 转移电子数为4N
2 A
2023.08
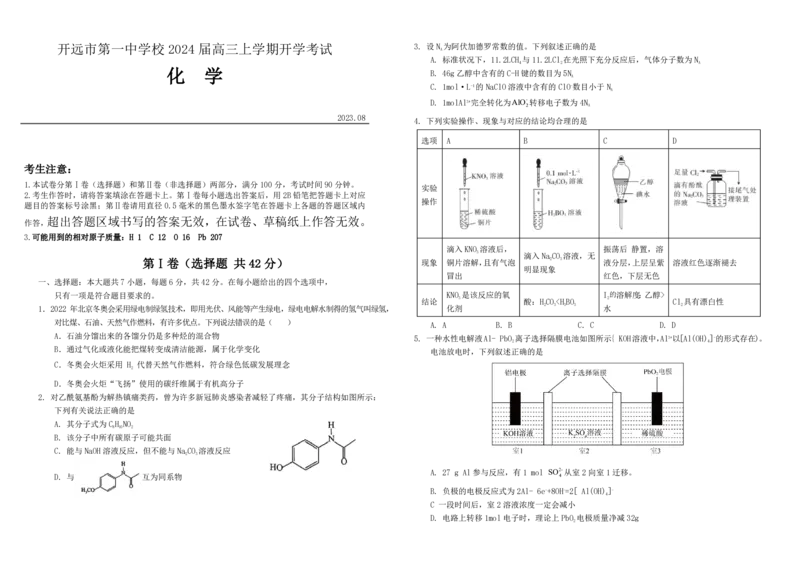
4. 下列实验操作、现象与对应的结论均合理的是
选项 A B C D
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
实验
2.考生作答时,请将答案填涂在答题卡上。第Ⅰ卷每小题选出答案后,用2B铅笔把答题卡上对应
操作
题目的答案标号涂黑;第Ⅱ卷请用直径 0.5 毫米的黑色墨水签字笔在答题卡上各题的答题区域内
超出答题区域书写的答案无效,在试卷、草稿纸上作答无效。
作答,
3.可能用到的相对原子质量:H 1 C 12 O 16 Pb 207
滴入KNO 溶液后, 振荡后 静置,溶
3
滴入NaCO 溶液,无
第Ⅰ卷(选择题 共 42 分) 现象 铜片溶解,且有气泡 2 3 液分层,上层呈紫 溶液红色逐渐褪去
明显现象
冒出 红色,下层无色
一、选择题:本大题共7小题,每题6分,共42分。在每小题给出的四个选项中,
只有一项是符合题目要求的。 KNO 是该反应的氧 I 的溶解度:乙醇>
3 2
结论 酸:HCOY>X>R (2) 写 出 该 实 验 中 制 备 过 氧 乙 酸 的 化 学 反 应 方 程 式 。
B. 电负性:Z> Y> X (3) 步 骤 ① 中 30% 的 双 氧 水 “ 缓 缓 加 入 ” 的 目 的 是 。
C. 原子半径:X>Y> Z> R (4) 实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。
D. M是含极性键和非极性键的共价化合物 反应时间
7. 常温下,向10 mL0.1 mol·L-1NaXO 溶液中滴加0.1 mol·L-1盐酸,溶液的pH与盐酸体积(V)的关 反应物比例
2 3 0.5h 1h 3h 5h 7h
系如图所示。下列叙述正确的是 CHCOOH/HO
3 2 2
2∶1 7.38% 8.46% 9.42% 11.26% 13.48%
1∶1 10.56% 12.92% 13.54% 20.72% 20.80%
1∶2 6.14% 7.10% 7.96% 10.38% 12.36%
由表中数据可知,制备过氧乙酸的最佳反应物比例和反应时间为 。
A. 0.1 mol·L-1NaXO 溶液中:c(Na+)>c(XO2)>c(HXO)>c(OH -1 -)>c(H+) (5)过氧乙酸样品中常含有残留的 H
2
O
2
。样品中过氧乙酸的浓度为 C
0
mol·L 时,发生如下反
2 3 3 3
应:
B. 当溶液pH=7时,溶液中存在:c(Na+)=c(HXO)+c(XO2)+c(Cl-)
3 3
C. 常温下,HXO 的K 小于1.0×10-7
2 3 a2
D. b点溶液中:c(Cl-)=c(HXO)+c(HXO)+c(XO2)
2 3 3 3
-1 ⅰ.取 V mL 待测液并用硫酸酸化,再用 C mol·L-1 的 KMnO 标准溶液滴定待测液至溶液呈粉
第Ⅱ卷(非选择题 共 58 分) 0 1 4
红色,消耗 V mLKMnO 标准溶液。
二、非选择题:本大题共4小题,共58分。 1 4
-1
ⅱ.另取 VmL(V≠V)待测液,加入过量的KI 溶液和几滴淀粉,并用硫酸酸化,再用Cmol·L 的
2 2 0 2
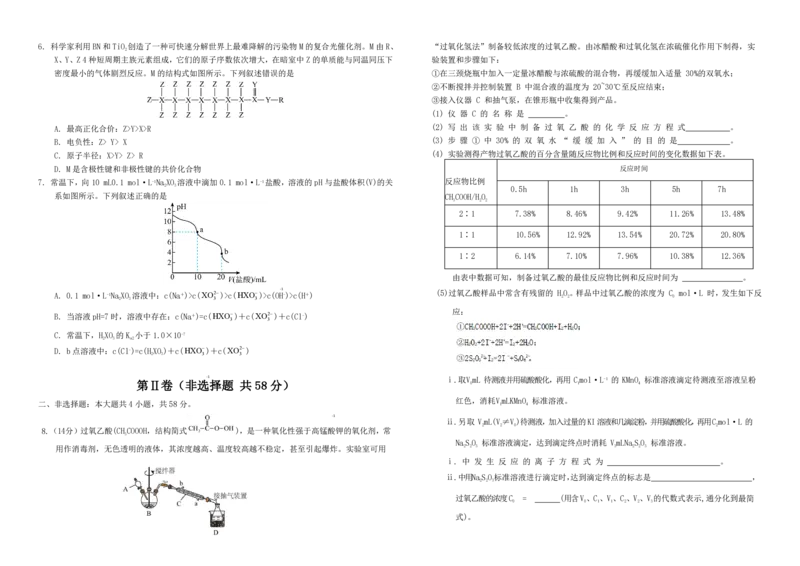
8.(14 分)过氧乙酸(CH COOOH,结构简式 ),是一种氧化性强于高锰酸钾的氧化剂,常
3
NaSO 标准溶液滴定,达到滴定终点时消耗 V mLNa SO 标准溶液。
用作消毒剂,无色透明的液体,其浓度越高、温度较高越不稳定,甚至引起爆炸。实验室可用 2 2 3 3 2 2 3
ⅰ. 中 发 生 反 应 的 离 子 方 程 式 为 。
ⅱ.中用 NaSO 标准溶液进行滴定时,达到滴定终点的标志是 ,
2 2 3
-1 -1
过氧乙酸的浓度 C = (用含 V 、C、V、C、V、V 的代数式表示,通分化到最简
0 0 1 1 2 2 3
式)。(6)当其他操作均正确时,下列实验操作可能使测定结果偏高的是 (填标号)。
A.NaOH 溶 液 B.HSO 溶 液 C.ZnSO 溶 液
2 4 4
A.配制 NaSO 标准溶液时,容量瓶中还有少量的水
2 2 3
2
(6)丁二酮肟( )是检验 Ni 的灵敏试剂,1mol 丁二酮肟分子含有 σ 键数目为
B.盛装 NaSO 标准溶液的滴定管没有用标准液润洗
2 2 3
C.用 NaSO 标准溶液滴定完成后,俯视滴定管读数
2 2 3
D.用NaSO 标准溶液滴定的过程中振荡锥形瓶的时间过长
2 2 3 ( NA 是阿伏加德罗常数的值)。 从 NiSO 溶液中获得精制硫酸镍 NiSO(s)所需采取的
4 4
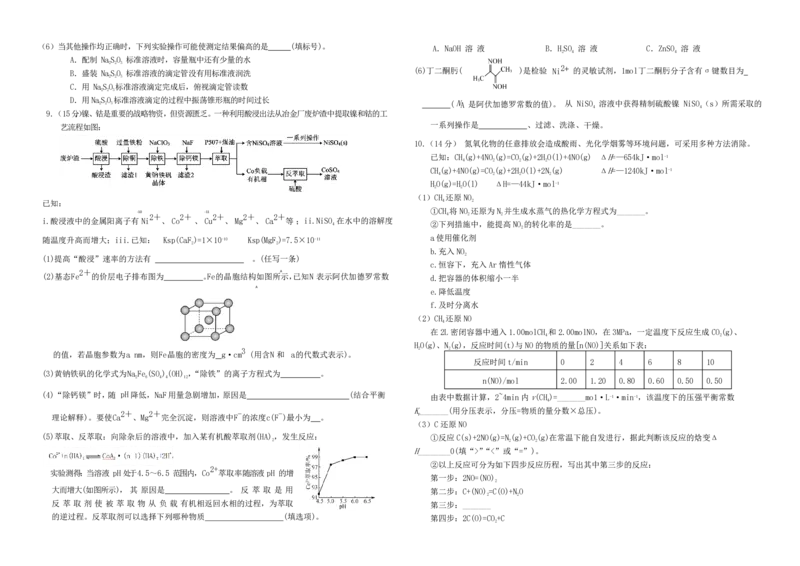
9.(15 分.)镍、钴是重要的战略物资,但资源匮乏。一种利用酸浸出法从冶金厂废炉渣中提取镍和钴的工
艺流程如图:
一系列操作是 、过滤、洗涤、干燥。
10.(14分) 氮氧化物的任意排放会造成酸雨、光化学烟雾等环境问题,可采用多种方法消除。
已知:CH(g)+4NO(g)=CO(g)+2HO(l)+4NO(g) ΔH=—654kJ·mol-1
4 2 2 2
CH(g)+4NO(g)=CO(g)+2HO(l)+2N(g) ΔH=—1240kJ·mol-1
4 2 2 2
HO(g)=HO(l) ΔH=—44kJ·mol-1
2 2
(1)CH 还原NO
已知: 4 2
①CH 将NO 还原为N 并生成水蒸气的热化学方程式为_______。
-10 2+ 2+ -11 2+ 2+ 2+ 4 2 2
i.酸浸液中的金属阳离子有 Ni 、 Co 、 Cu 、 Mg 、 Ca 等 ;ii.NiSO 在水中的溶解度
4 ②下列措施中,能提高NO 的转化率的是_______。
2
a使用催化剂
随温度升高而增大;iii.已知: Ksp(CaF)=1×10-10 Ksp(MgF)=7.5×10-11
2 2
b.充入NO
2
(1)提高“酸浸”速率的方法有 。(任写一条)
c.恒容下,充入Ar惰性气体
2+ A
(2)基态 Fe 的价层电子排布图为 。Fe 的晶胞结构如图所示,已知 N 表示阿伏加德罗常数 d.把容器的体积缩小一半
A
e.降低温度
f.及时分离水
(2)CH 还原NO
4
在2L密闭容器中通入1.00molCH 和2.00molNO,在3MPa,一定温度下反应生成CO(g)、
4 2
HO(g)、N(g),反应时间(t)与NO的物质的量[n(NO)]关系如下表:
3 2 2
的值,若晶胞参数为 a nm,则 Fe 晶胞的密度为 g·cm (用含 N 和 a 的代数式表示)。
反应时间t/min 0 2 4 6 8 10
(3)黄钠铁矾的化学式为 Na Fe(SO)(OH) ,“除铁”的离子方程式为 。
2 6 4 4 12
n(NO)/mol 2.00 1.20 0.80 0.60 0.50 0.50
(4)“除钙镁”时,随 pH 降低, NaF 用量急剧增加,原因是 (结合平衡
由表中数据计算,2~4min内v(CH)=_______mo1·L-1·min-1,该温度下的压强平衡常数
4
K_______(用分压表示,分压=物质的量分数×总压)。
2+ 2+ - - p
理论解释)。要使 Ca 、Mg 完全沉淀,则溶液中 F 的浓度 c(F )最小为 。
(3)C还原NO
(5)萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂(HA),发生反应: ①反应C(s)+2NO(g)=N(g)+CO(g)在常温下能自发进行,据此判断该反应的焓变Δ
2 2 2
H________0(填“>”“<”或“=”)。
②以上反应可分为如下四步反应历程,写出其中第三步的反应:
2+
实验测得:当溶液 pH 处于 4.5~6.5 范围内,Co 萃取率随溶液 pH 的增
第一步:2NO=(NO)
2
大而增大(如图所示), 其 原因是 。 反 萃 取 是 用 第二步:C+(NO)=C(O)+NO
2 2
反 萃 取 剂 使 被 萃 取 物 从 负 载 有机相返回水相的过程,为萃取 第三步:_______
的逆过程。反萃取剂可以选择下列哪种物质 (填选项)。 第四步:2C(O)=CO+C
2(4)除上述方法外,还可用电解法将NO转变为NHNO,其工作原理如图,N极的电极反应式为 机试剂任选)_______。
4 3
_______,通入NH 的主要原因是_______。
3
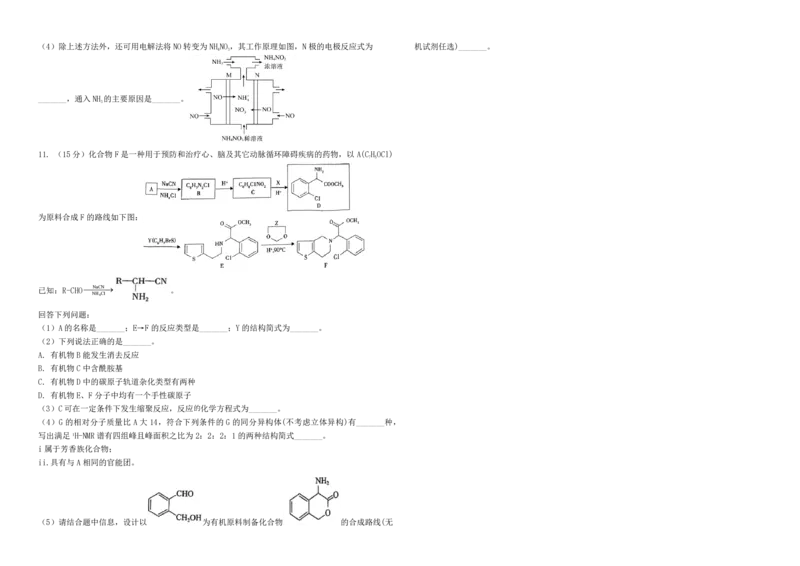
11. (15分)化合物F是一种用于预防和治疗心、脑及其它动脉循环障碍疾病的药物,以A(CHOCl)
7 5
为原料合成F的路线如下图:
已知:R-CHONaCN 。
NH Cl
4
回答下列问题:
(1)A的名称是_______;E→F的反应类型是_______;Y的结构简式为_______。
(2)下列说法正确的是_______。
A. 有机物B能发生消去反应
B. 有机物C中含酰胺基
C. 有机物D中的碳原子轨道杂化类型有两种
D. 有机物E、F分子中均有一个手性碳原子
(3)C可在一定条件下发生缩聚反应,反应的化学方程式为_______。
(4)G 的相对分子质量比 A 大 14,符合下列条件的 G 的同分异构体(不考虑立体异构)有_______种,
写出满足1H-NMR谱有四组峰且峰面积之比为2:2:2:1的两种结构简式_______。
i属于芳香族化合物;
ii.具有与A相同的官能团。
(5)请结合题中信息,设计以 为有机原料制备化合物 的合成路线(无