文档内容
五年(2019-2023)年高考真题分项汇编
专题 09 化学反应速率与化学平衡
〖2023年高考真题〗
考点一 化学反应速率计算与影响因素分析
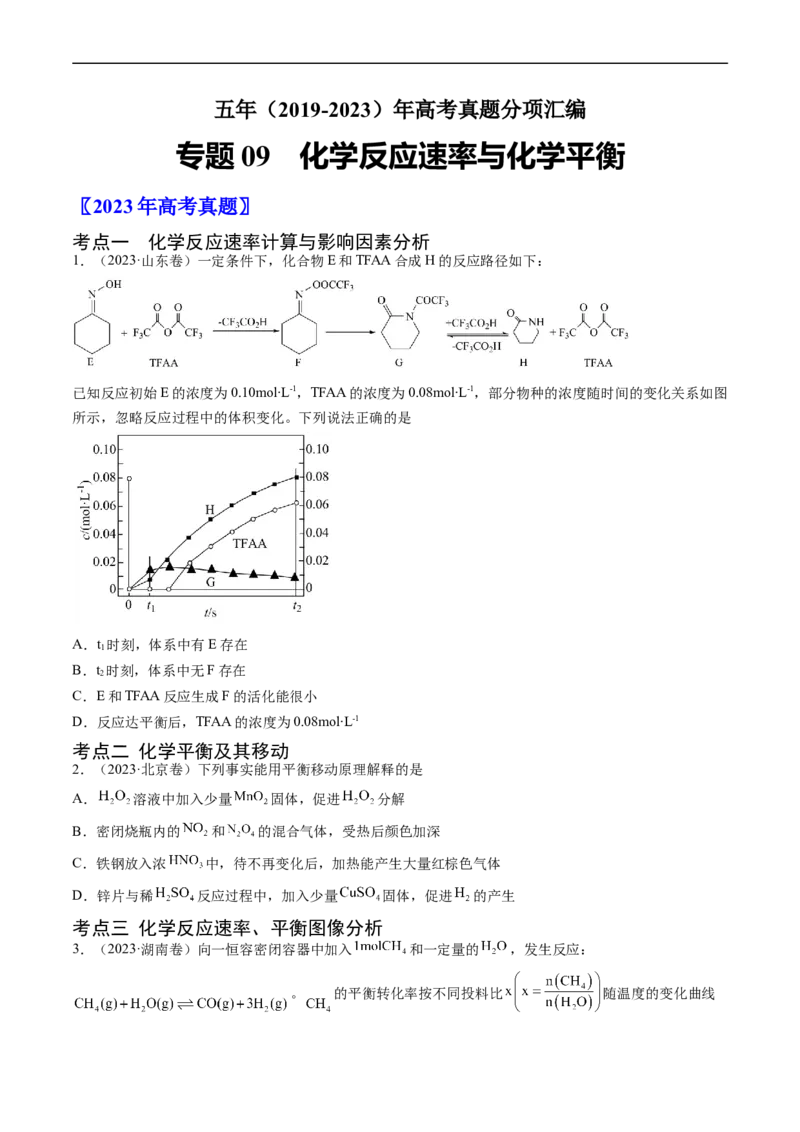
1.(2023·山东卷)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10mol∙L-1,TFAA的浓度为0.08mol∙L-1,部分物种的浓度随时间的变化关系如图
所示,忽略反应过程中的体积变化。下列说法正确的是
A.t 时刻,体系中有E存在
1
B.t 时刻,体系中无F存在
2
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08mol∙L-1
考点二 化学平衡及其移动
2.(2023·北京卷)下列事实能用平衡移动原理解释的是
A. 溶液中加入少量 固体,促进 分解
B.密闭烧瓶内的 和 的混合气体,受热后颜色加深
C.铁钢放入浓 中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀 反应过程中,加入少量 固体,促进 的产生
考点三 化学反应速率、平衡图像分析
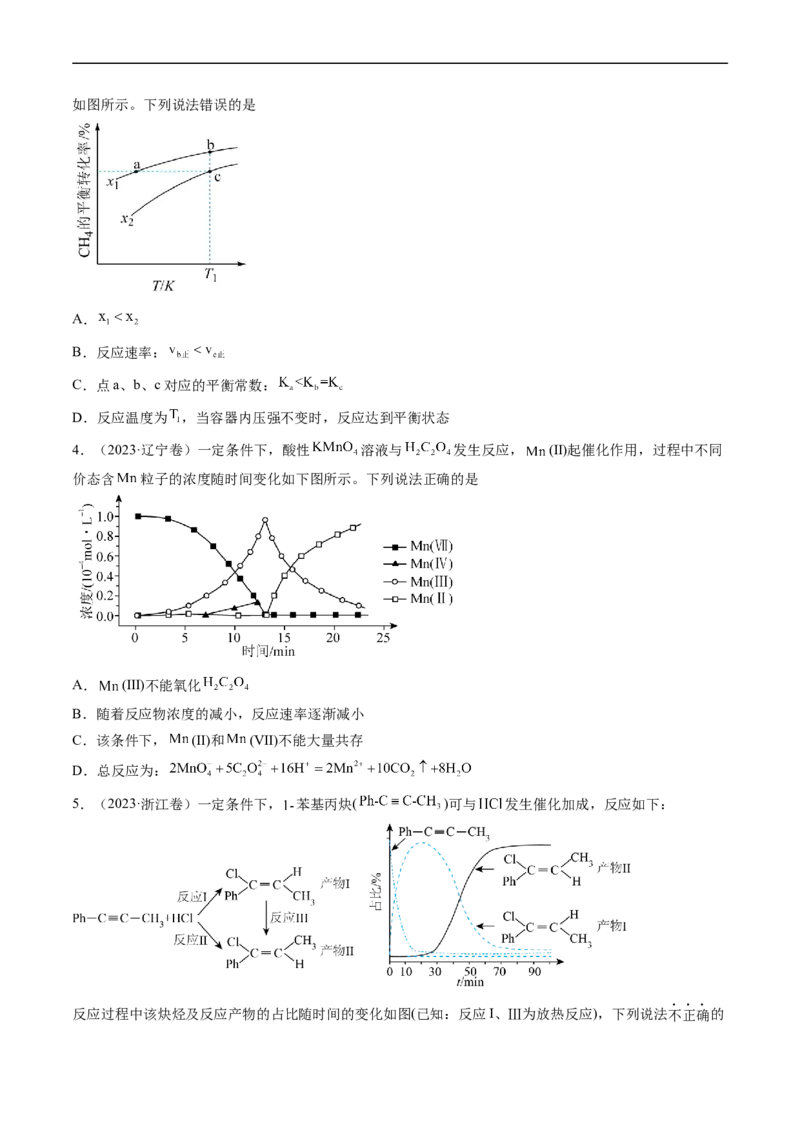
3.(2023·湖南卷)向一恒容密闭容器中加入 和一定量的 ,发生反应:
。 的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是
A.
B.反应速率:
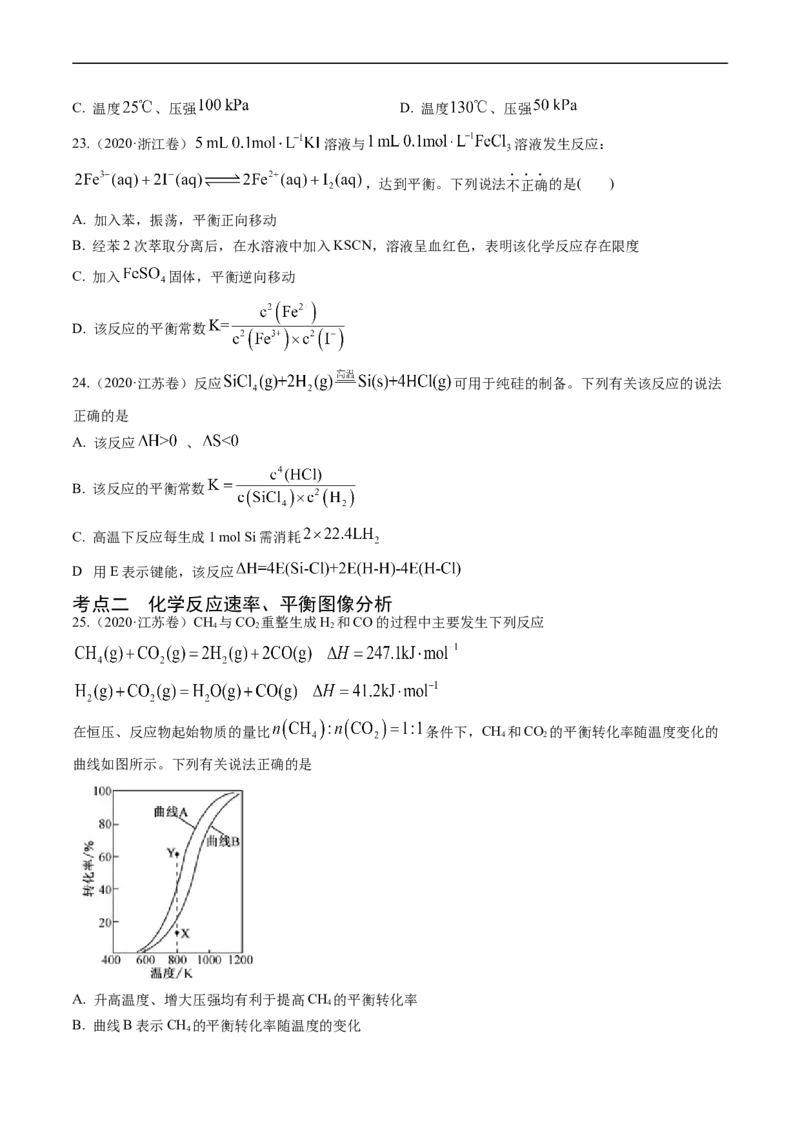
C.点a、b、c对应的平衡常数:
D.反应温度为 ,当容器内压强不变时,反应达到平衡状态
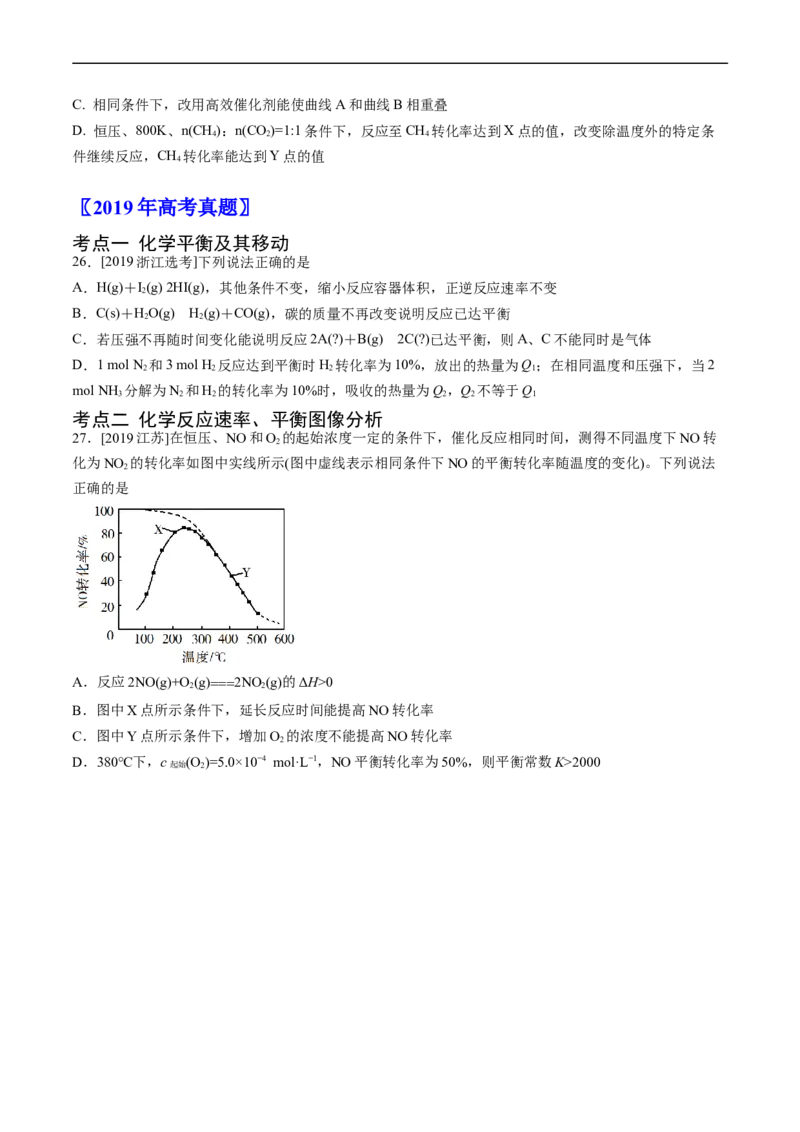
4.(2023·辽宁卷)一定条件下,酸性 溶液与 发生反应, (Ⅱ)起催化作用,过程中不同
价态含 粒子的浓度随时间变化如下图所示。下列说法正确的是
A. (Ⅲ)不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下, (Ⅱ)和 (Ⅶ)不能大量共存
D.总反应为:
5.(2023·浙江卷)一定条件下, 苯基丙炔( )可与 发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应I、Ⅲ为放热反应),下列说法不正确的是
A.反应焓变:反应I>反应Ⅱ
B.反应活化能:反应I<反应Ⅱ
C.增加 浓度可增加平衡时产物Ⅱ和产物I的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
〖2022年高考真题〗
考点一 化学平衡及其移动
6.(2022·天津卷)向恒温恒容密闭容器中通入2mol 和1mol ,反应
达到平衡后,再通入一定量 ,达到新平衡时,下列有关判断错误的是
A. 的平衡浓度增大 B.反应平衡常数增大
C.正向反应速率增大 D. 的转化总量增大
7.(2022·重庆卷)两种酸式碳酸盐的分解反应如下。某温度平衡时总压强分别为p1和p2。
反应1:NH HCO (s) NH (g)+HO(g)+CO(g) p=3.6×104Pa
4 3 3 2 2 1
反应2:2NaHCO (s) NaCO(s)+HO(g)+CO(g) p=4×103Pa
3 2 3 2 2 2
该温度下,刚性密闭容器中放入NH HCO 和NaCO 固体,平衡后以上3种固体均大量存在。下列说法错
4 3 2 3
误的是
A.反应2的平衡常数为4×106Pa2 B.通入NH ,再次平衡后,总压强增大
3
C.平衡后总压强为4.36×105Pa D.缩小体积,再次平衡后总压强不变
8.(2022·江苏卷)用尿素水解生成的 催化还原 ,是柴油机车辆尾气净化的主要方法。反应为
,下列说法正确的是
A.上述反应
B.上述反应平衡常数
C.上述反应中消耗 ,转移电子的数目为
D.实际应用中,加入尿素的量越多,柴油机车辆排放的尾气对空气污染程度越小
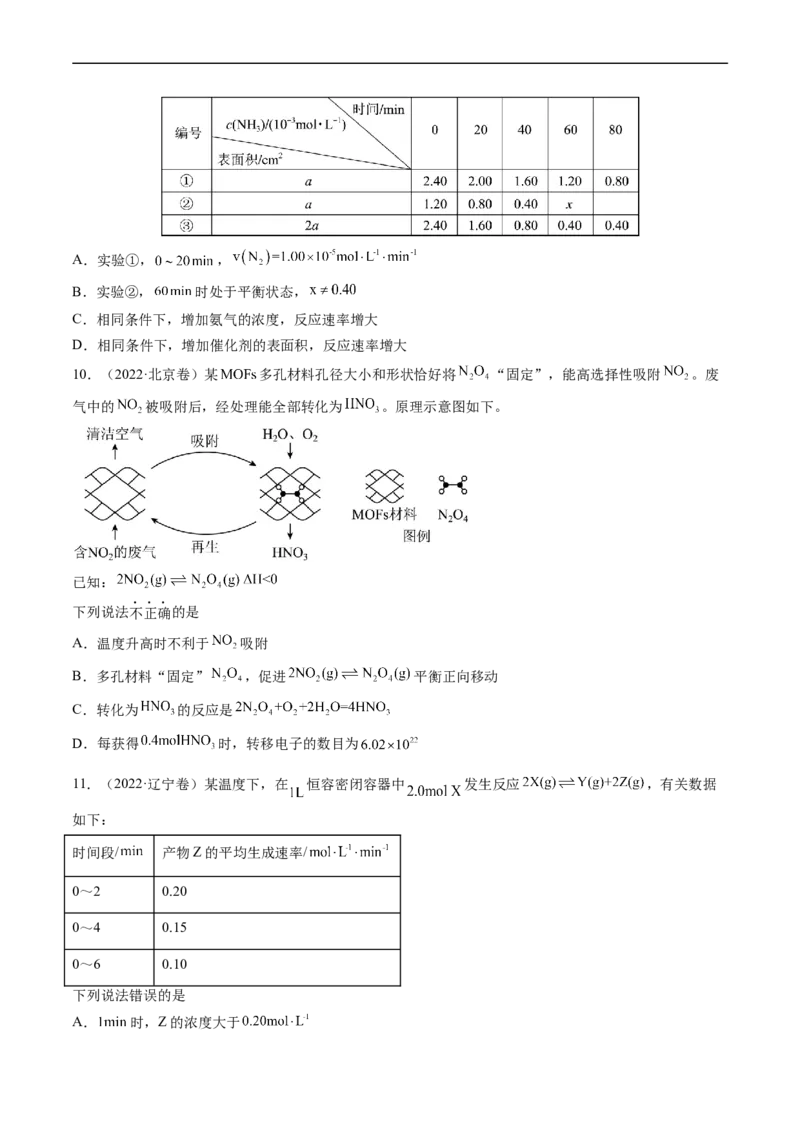
9.(2022·浙江卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:
,测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下
列说法不正确的是A.实验①, ,
B.实验②, 时处于平衡状态,
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
10.(2022·北京卷)某 多孔材料孔径大小和形状恰好将 “固定”,能高选择性吸附 。废
气中的 被吸附后,经处理能全部转化为 。原理示意图如下。
已知:
下列说法不正确的是
A.温度升高时不利于 吸附
B.多孔材料“固定” ,促进 平衡正向移动
C.转化为 的反应是
D.每获得 时,转移电子的数目为
11.(2022·辽宁卷)某温度下,在 恒容密闭容器中 发生反应 ,有关数据
如下:
时间段/ 产物Z的平均生成速率/
0~2 0.20
0~4 0.15
0~6 0.10
下列说法错误的是
A. 时,Z的浓度大于B. 时,加入 ,此时
C. 时,Y的体积分数约为33.3%
D. 时,X的物质的量为
考点三 化学反应速率、平衡图像分析
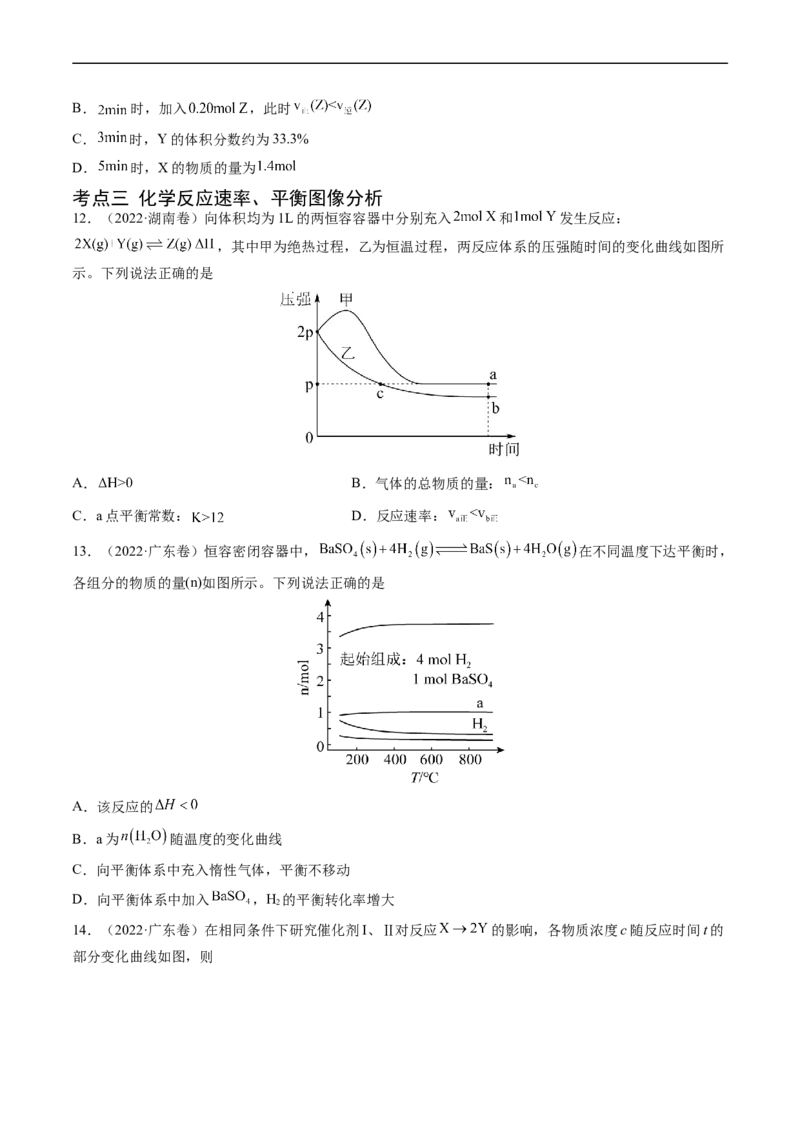
12.(2022·湖南卷)向体积均为1L的两恒容容器中分别充入 和 发生反应:
,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所
示。下列说法正确的是
A. B.气体的总物质的量:
C.a点平衡常数: D.反应速率:
13.(2022·广东卷)恒容密闭容器中, 在不同温度下达平衡时,
各组分的物质的量(n)如图所示。下列说法正确的是
A.该反应的
B.a为 随温度的变化曲线
C.向平衡体系中充入惰性气体,平衡不移动
D.向平衡体系中加入 ,H 的平衡转化率增大
2
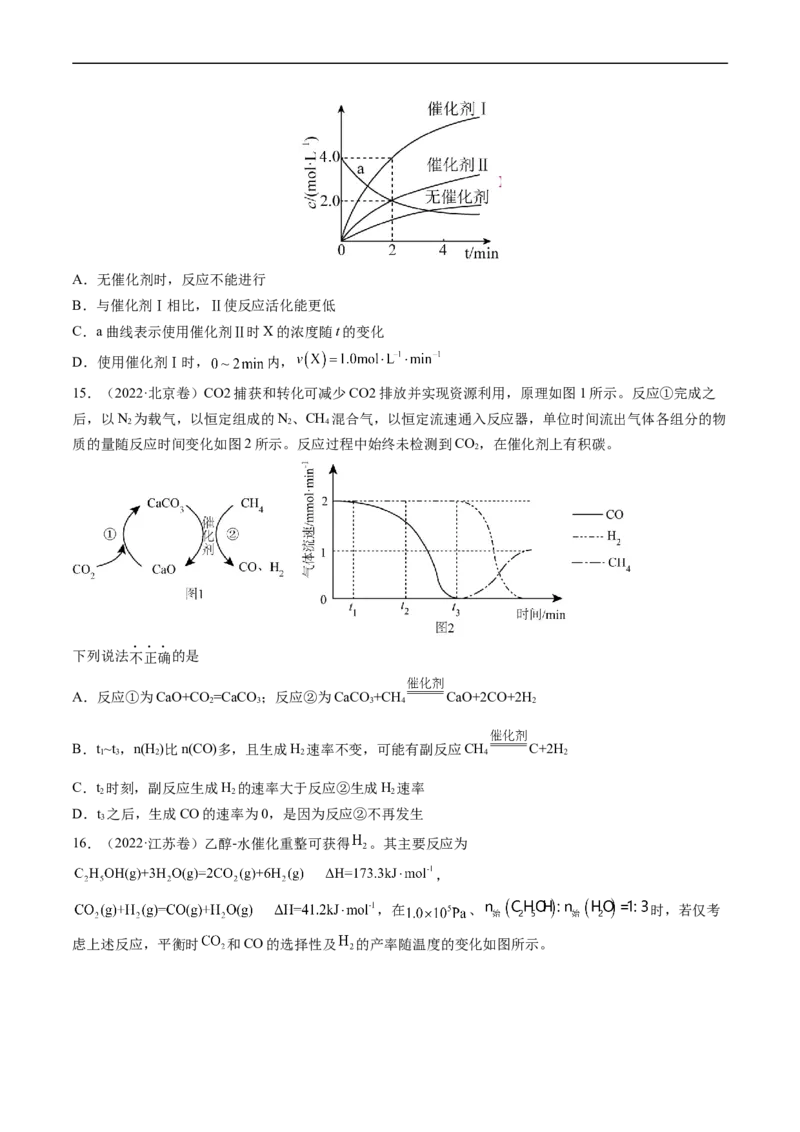
14.(2022·广东卷)在相同条件下研究催化剂I、Ⅱ对反应 的影响,各物质浓度c随反应时间t的
部分变化曲线如图,则A.无催化剂时,反应不能进行
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
D.使用催化剂Ⅰ时, 内,
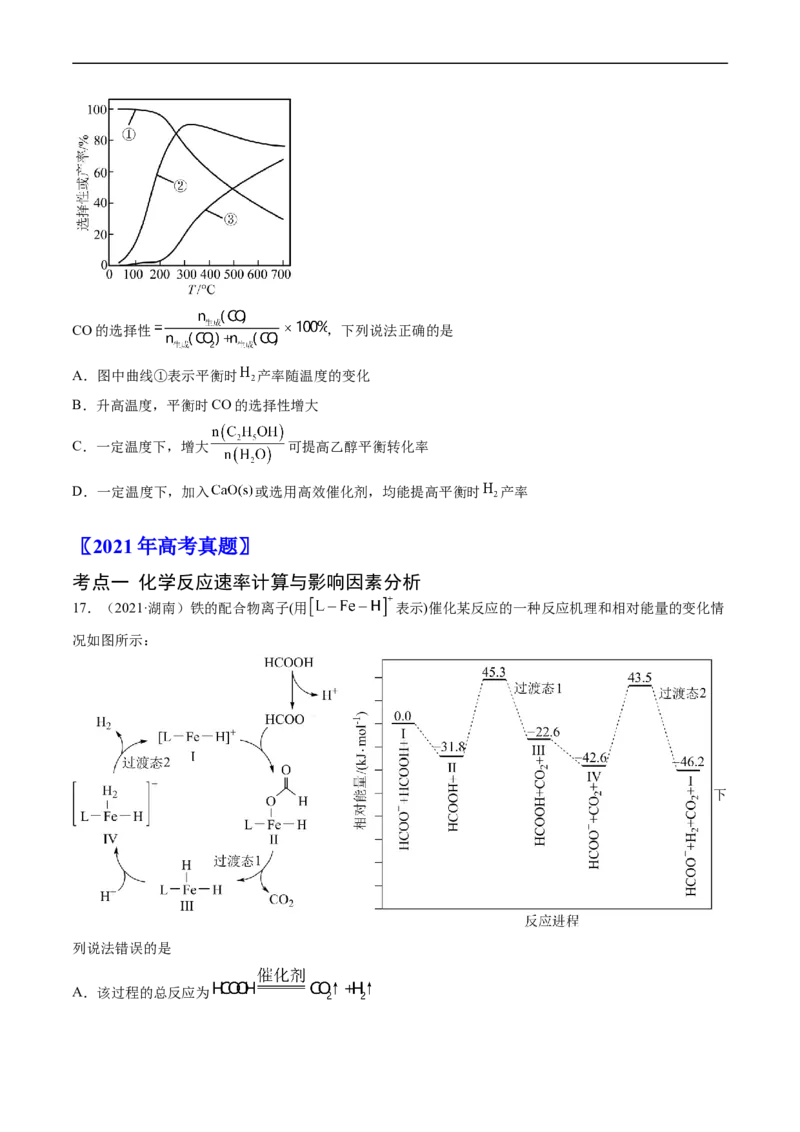
15.(2022·北京卷)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。反应①完成之
后,以N 为载气,以恒定组成的N、CH 混合气,以恒定流速通入反应器,单位时间流出气体各组分的物
2 2 4
质的量随反应时间变化如图2所示。反应过程中始终未检测到CO,在催化剂上有积碳。
2
下列说法不正确的是
A.反应①为CaO+CO =CaCO ;反应②为CaCO +CH CaO+2CO+2H
2 3 3 4 2
B.t~t,n(H )比n(CO)多,且生成H 速率不变,可能有副反应CH C+2H
1 3 2 2 4 2
C.t 时刻,副反应生成H 的速率大于反应②生成H 速率
2 2 2
D.t 之后,生成CO的速率为0,是因为反应②不再发生
3
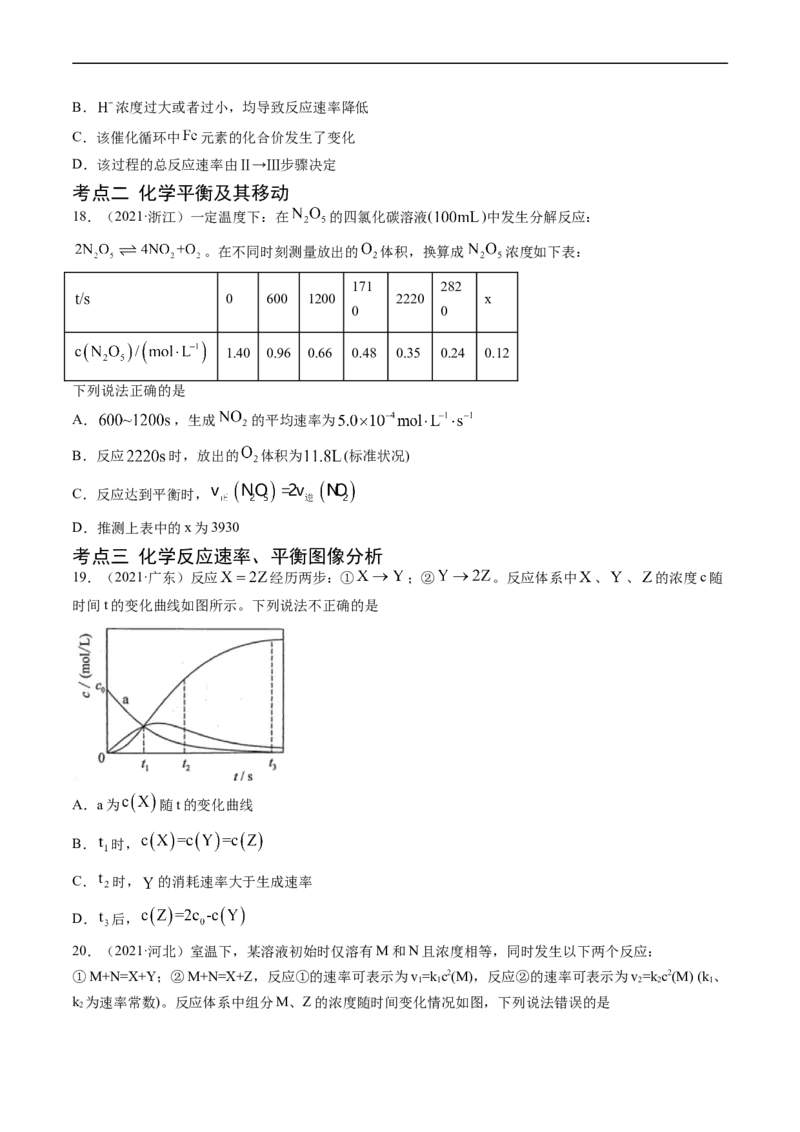
16.(2022·江苏卷)乙醇-水催化重整可获得 。其主要反应为
,
,在 、 时,若仅考
虑上述反应,平衡时 和CO的选择性及 的产率随温度的变化如图所示。CO的选择性 ,下列说法正确的是
A.图中曲线①表示平衡时 产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大 可提高乙醇平衡转化率
D.一定温度下,加入 或选用高效催化剂,均能提高平衡时 产率
〖2021年高考真题〗
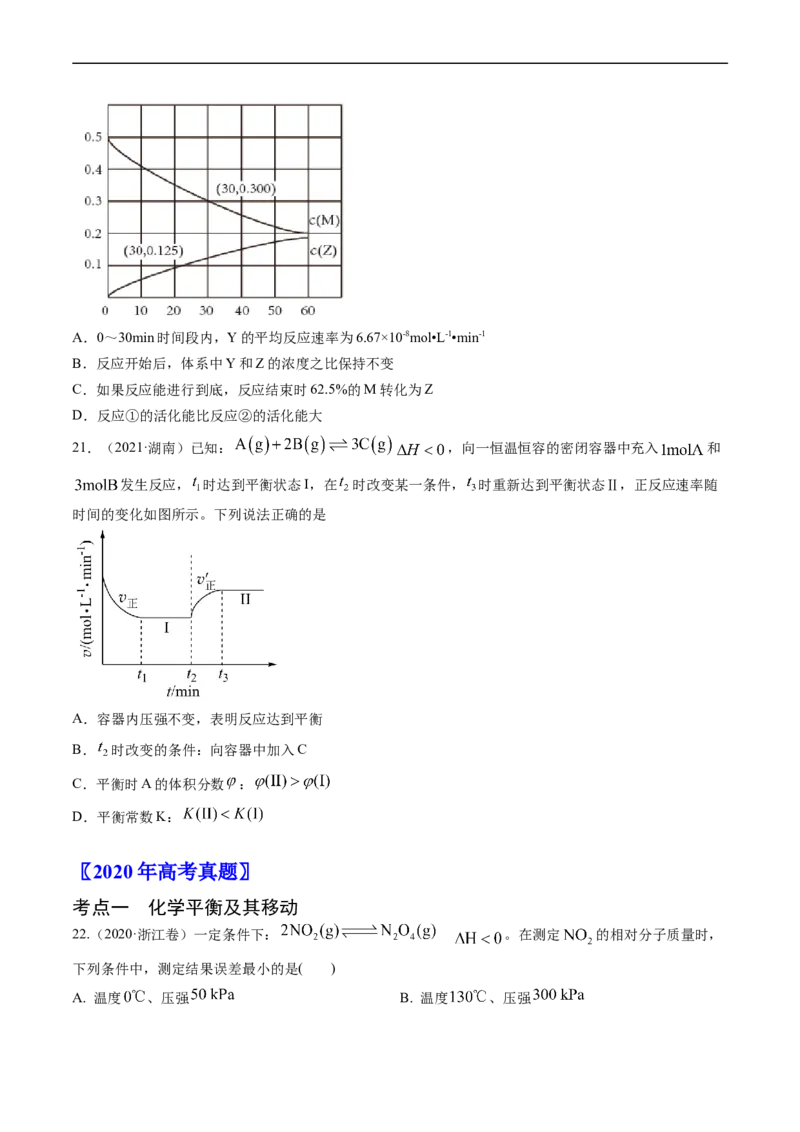
考点一 化学反应速率计算与影响因素分析
17.(2021·湖南)铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情
况如图所示:
下
列说法错误的是
A.该过程的总反应为B. 浓度过大或者过小,均导致反应速率降低
C.该催化循环中 元素的化合价发生了变化
D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定
考点二 化学平衡及其移动
18.(2021·浙江)一定温度下:在 的四氯化碳溶液( )中发生分解反应:
。在不同时刻测量放出的 体积,换算成 浓度如下表:
171 282
0 600 1200 2220 x
0 0
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是
A. ,生成 的平均速率为
B.反应 时,放出的 体积为 (标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
考点三 化学反应速率、平衡图像分析
19.(2021·广东)反应 经历两步:① ;② 。反应体系中 、 、 的浓度c随
时间t的变化曲线如图所示。下列说法不正确的是
A.a为 随t的变化曲线
B. 时,
C. 时, 的消耗速率大于生成速率
D. 后,
20.(2021·河北)室温下,某溶液初始时仅溶有M和N且浓度相等,同时发生以下两个反应:
①M+N=X+Y;②M+N=X+Z,反应①的速率可表示为v=kc2(M),反应②的速率可表示为v=kc2(M) (k 、
1 1 2 2 1
k 为速率常数)。反应体系中组分M、Z的浓度随时间变化情况如图,下列说法错误的是
2A.0~30min时间段内,Y的平均反应速率为6.67×10-8mol•L-1•min-1
B.反应开始后,体系中Y和Z的浓度之比保持不变
C.如果反应能进行到底,反应结束时62.5%的M转化为Z
D.反应①的活化能比反应②的活化能大
21.(2021·湖南)已知: ,向一恒温恒容的密闭容器中充入 和
发生反应, 时达到平衡状态I,在 时改变某一条件, 时重新达到平衡状态Ⅱ,正反应速率随
时间的变化如图所示。下列说法正确的是
A.容器内压强不变,表明反应达到平衡
B. 时改变的条件:向容器中加入C
C.平衡时A的体积分数 :
D.平衡常数K:
〖2020年高考真题〗
考点一 化学平衡及其移动
22.(2020·浙江卷)一定条件下: 。在测定 的相对分子质量时,
下列条件中,测定结果误差最小的是( )
A. 温度 、压强 B. 温度 、压强C. 温度 、压强 D. 温度 、压强
23.(2020·浙江卷) 溶液与 溶液发生反应:
,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯2次萃取分离后,在水溶液中加入KSCN,溶液呈血红色,表明该化学反应存在限度
C. 加入 固体,平衡逆向移动
D. 该反应的平衡常数
24.(2020·江苏卷)反应 可用于纯硅的制备。下列有关该反应的说法
正确的是
A. 该反应 、
B. 该反应的平衡常数
C. 高温下反应每生成1 mol Si需消耗
.
D 用E表示键能,该反应
考点二 化学反应速率、平衡图像分析
25.(2020·江苏卷)CH 与CO 重整生成H 和CO的过程中主要发生下列反应
4 2 2
在恒压、反应物起始物质的量比 条件下,CH 和CO 的平衡转化率随温度变化的
4 2
曲线如图所示。下列有关说法正确的是
A. 升高温度、增大压强均有利于提高CH 的平衡转化率
4
B. 曲线B表示CH 的平衡转化率随温度的变化
4C. 相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D. 恒压、800K、n(CH):n(CO)=1:1条件下,反应至CH 转化率达到X点的值,改变除温度外的特定条
4 2 4
件继续反应,CH 转化率能达到Y点的值
4
〖2019年高考真题〗
考点一 化学平衡及其移动
26.[2019浙江选考]下列说法正确的是
A.H(g)+I(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2
B.C(s)+HO(g) H (g)+CO(g),碳的质量不再改变说明反应已达平衡
2 2
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N 和3 mol H 反应达到平衡时H 转化率为10%,放出的热量为Q;在相同温度和压强下,当2
2 2 2 1
mol NH 分解为N 和H 的转化率为10%时,吸收的热量为Q,Q 不等于Q
3 2 2 2 2 1
考点二 化学反应速率、平衡图像分析
27.[2019江苏]在恒压、NO和O 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转
2
化为NO 的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法
2
正确的是
A.反应2NO(g)+O (g)===2NO (g)的ΔH>0
2 2
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O 的浓度不能提高NO转化率
2
D.380℃下,c (O )=5.0×10−4 mol·L−1,NO平衡转化率为50%,则平衡常数K>2000
起始 2