文档内容
2024—2025 学年度第一学期高三年级第一次调研测试
化学试题 2024.11
注意事项考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共8页,满分为100分,考试时间为75分钟。考试结束后,请将答题卡交回。
2.答题前,请你务必将自己的姓名、学校、考试号等用0.5毫米黑色墨水签字笔填写在答题
卡上规定的位置。
3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号和本人是否相符。
4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡
皮擦干净后,再选涂其他答案。作答非选择题,必须用 0.5毫米黑色墨水签字笔在答题卡上
的指定位置作答,在其他位置作答一律无效。
可能用到的相对原子质量:H-1 C-12 N-14 Mo-96 O-16 Na-23 S-32
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.工业上常用明矾 作净水剂。按物质组成分类, 属于
( )
A.酸 B.碱 C.盐 D.混合物
2.反应 可用于制备氧气。下列说法不正确的是( )
A. 的结构示意图为 B. 中既含离子键又含共价键
C. 中C元素的化合价为+4 D. 的空间构型为直线形
3.实验室用含有炭粉的铜制备硝酸铜,下列装置不能达到实验目的的是( )
A.用装置甲溶解铜粉
B.用装置乙吸收尾气
C.用装置丙分离炭粉和硝酸铜溶液
D.用装置丁蒸干硝酸铜溶液制
4.元素C、N、O位于周期表中第二周期。下列说法正确的是( )
A.原子半径: B.酸性:
学科网(北京)股份有限公司C.第一电离能: D.沸点:
阅读下列资料,完成5~7题:氯气与碱反应可以得到次氯酸盐、氯酸盐等含氧酸盐,次
氯酸盐应用广泛。通过KClO溶液在碱性条件下与 溶液反应制备高效水处理剂
, 在强碱性溶液中稳定;通过KClO溶液在碱性条件下与尿素 水溶液
制备 , 的燃烧热为642kJ·mol-1,具有强还原性,能与KClO剧烈反应生成 ;通过KClO
溶液与Ag反应可以回收光盘金属层中的少量Ag,其反应产物为AgCl、KOH和 ;通过KClO溶液在碱性条
件下与 反应可制得电极材料 。
5.下列说法正确的是( )
A.32g 中含5molσ键 B.基态 的核外三个电子能层均充满电子
C. 与 的键角相等 D. 与 固态时晶体类型均为共价晶体
6.下列化学反应表示正确的是( )
A.KClO溶液与Ag反应:
B.KClO碱性溶液与 溶液反应:
C.尿素与过量的KClO溶液反应:
D. 的燃烧: kJ·mol-1
7.下列相关元素及其化合物的结构与性质或性质与用途具有对应关系的是( )
A.Ag具有较好的延展性,可用于在铁表面镀银
B. 具有还原性,可用于电极材料 的制备
C. 中N原子能与 形成配位键, 的水溶液呈酸性
D. 中 具有正四面体结构, 具有强氧化性
8.通过如下反应可合成一种中间体:
学科网(北京)股份有限公司下列说法正确的是( )
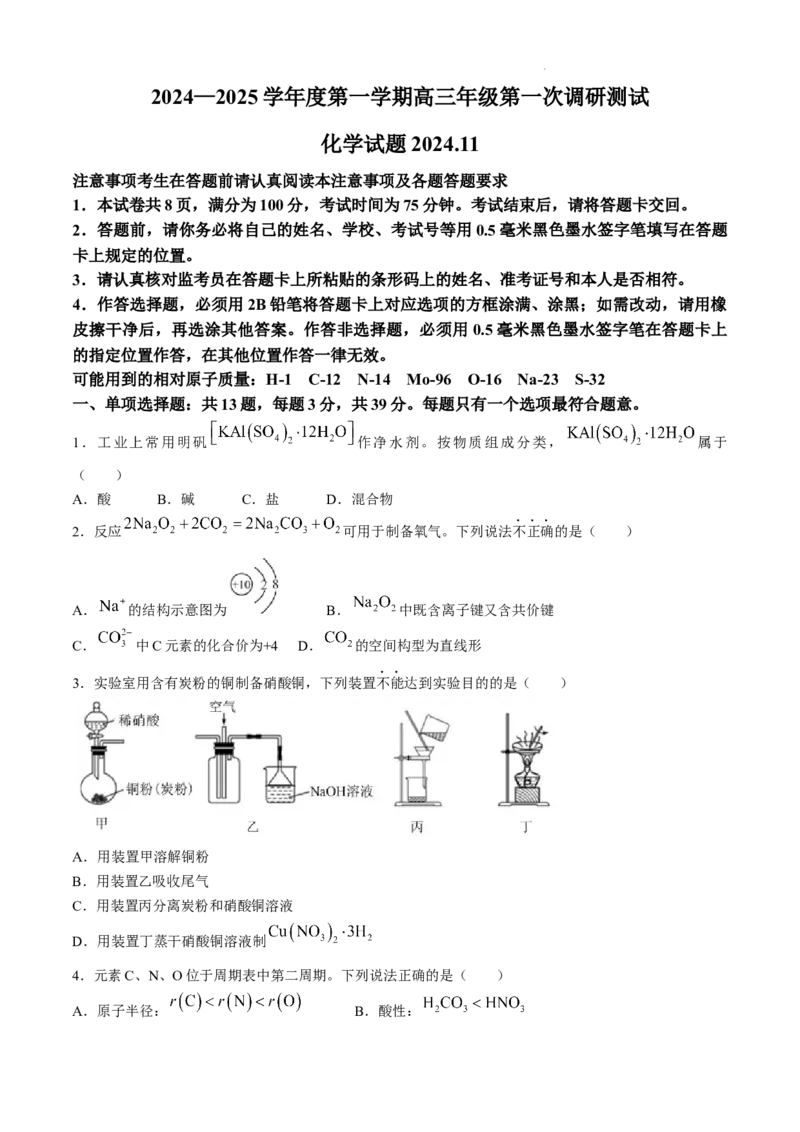
A.2-环己烯酮中所有的原子可能共平面
B.苯甲醛分子中所有碳原子杂化方式相同
C.可用酸性高锰酸钾溶液鉴别中间体和2-环己烯酮
D.中间体与足量 加成后所得分子中含有4个手性碳原子
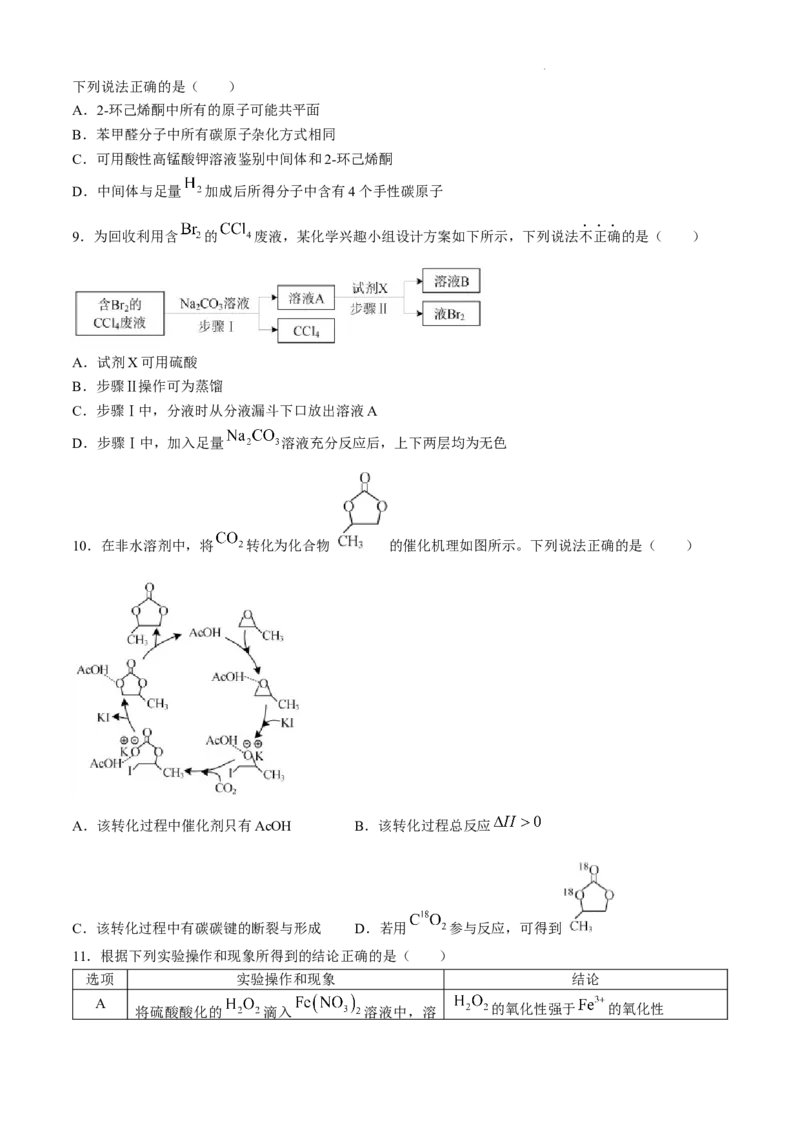
9.为回收利用含 的 废液,某化学兴趣小组设计方案如下所示,下列说法不正确的是( )
A.试剂X可用硫酸
B.步骤Ⅱ操作可为蒸馏
C.步骤Ⅰ中,分液时从分液漏斗下口放出溶液A
D.步骤Ⅰ中,加入足量 溶液充分反应后,上下两层均为无色
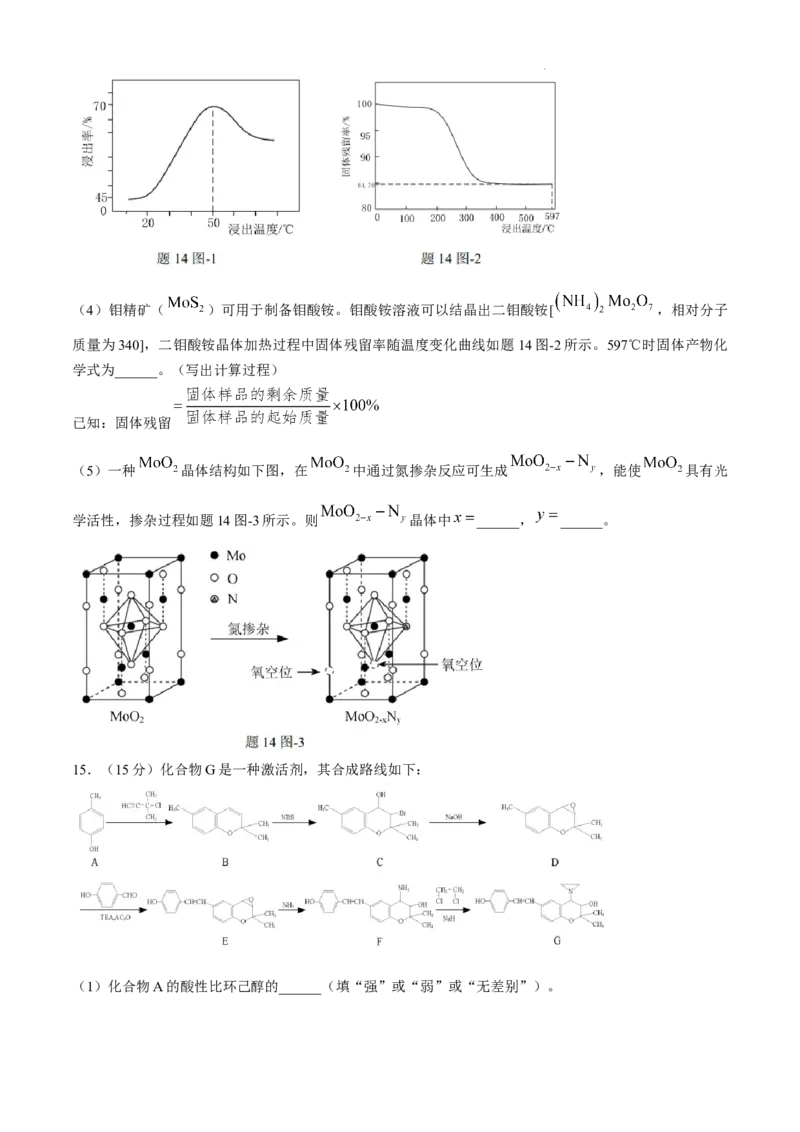
10.在非水溶剂中,将 转化为化合物 的催化机理如图所示。下列说法正确的是( )
A.该转化过程中催化剂只有AcOH B.该转化过程总反应
C.该转化过程中有碳碳键的断裂与形成 D.若用 参与反应,可得到
11.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A
将硫酸酸化的 滴入 溶液中,溶 的氧化性强于 的氧化性
学科网(北京)股份有限公司液变黄色
向 NaCl、NaI 的混合稀溶液中滴入少量稀
B
溶液,有黄色沉淀生成
稀释可以破坏 之间的氢键,使得
C
将1.0mol·L-1 溶液加少量水稀释,测溶
液的pH升高
增大,碱性增强
用电导率传感器分别测定等浓度的醋酸溶液和盐
D HCl为强电解质
酸的电导率,盐酸的导电性强
12.室温下,通过下列实验探究 及部分硫化物的性质。已知: 饱和溶液浓度约为0.1mol·L-1,
, , ;反应平衡常数K大于 时认为反应完
全。
实验1:向20mL0.1mol·L-1 溶液中加入20mL0.1mol·L-1NaOH溶液;
实验2:向实验1所得溶液中继续加入20mL0.1mol·L-1NaOH溶液;
实验3:向0.1mol·L-1 溶液中通入少量氯气,有淡黄色沉淀产生;
实验4:向 mol·L-1的盐溶液中通入 气体至饱和。
下列说法正确的是( )
A.实验1溶液中存在:
B.实验2溶液中存在:
C.实验3中反应的离子方程式:
D.实验4所得溶液中:
13.在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行:
反应Ⅰ: 反应Ⅱ:
如题13图-1所示;各物质的起始加入量为: 、 和HI均为4.0mol, 为6.5mol, 为2.0mol,设
为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔
板恰好处于正中位置;反应Ⅱ中 与 起始物质的量之比一定条件下,不同温度时 转化率如题13
图-2所示(图中虚线表示相同条件下 的平衡转化率随温度的变化)。
学科网(北京)股份有限公司下列说法不正确的是( )
A.反应Ⅱ正反应活化能小于逆反应的活化能
B.欲使反应Ⅱ起始时向正反应方向进行,x的最大取值应小于7.0
C.在x分别为4.5和5.0这两种情况下,当反应达平衡时, 的物质的量相等
D.保持温度不变, ℃时改变 与 起始物质的量的比值, 的转化率可能从a点的值升至b点
的值
二、非选择题:共4题,共61分。
14.(15分)以钼精矿(主要成分 ,其中S为-1价,还含少量钙、镁等元素)为原料制备
得到的钼单质及其它化合物用于炼钢、电子工业。
(1)钼精矿( )焙烧可以制备 、 。焙烧炉中还会发生 与 反应生成
和 。
①理论上完全反应消耗的 ______。
②在焙烧时通常会加入碳酸钙,其目的是____________。
(2) 与Li可形成一种可充放电电池,电解质溶液由锂盐溶解在一定的非水、非质子性的有机溶剂
中制成的,其工作原理为: ,则该电池放电时正极的电极反应式为
____________。
(3)钼精矿( )碱浸制钼酸钠( )。直接向粉碎后的钼精矿中加入 NaOH 溶液和
NaClO溶液可得到钼酸钠,同时生成硫酸盐。
①反应的离子方程式为____________。
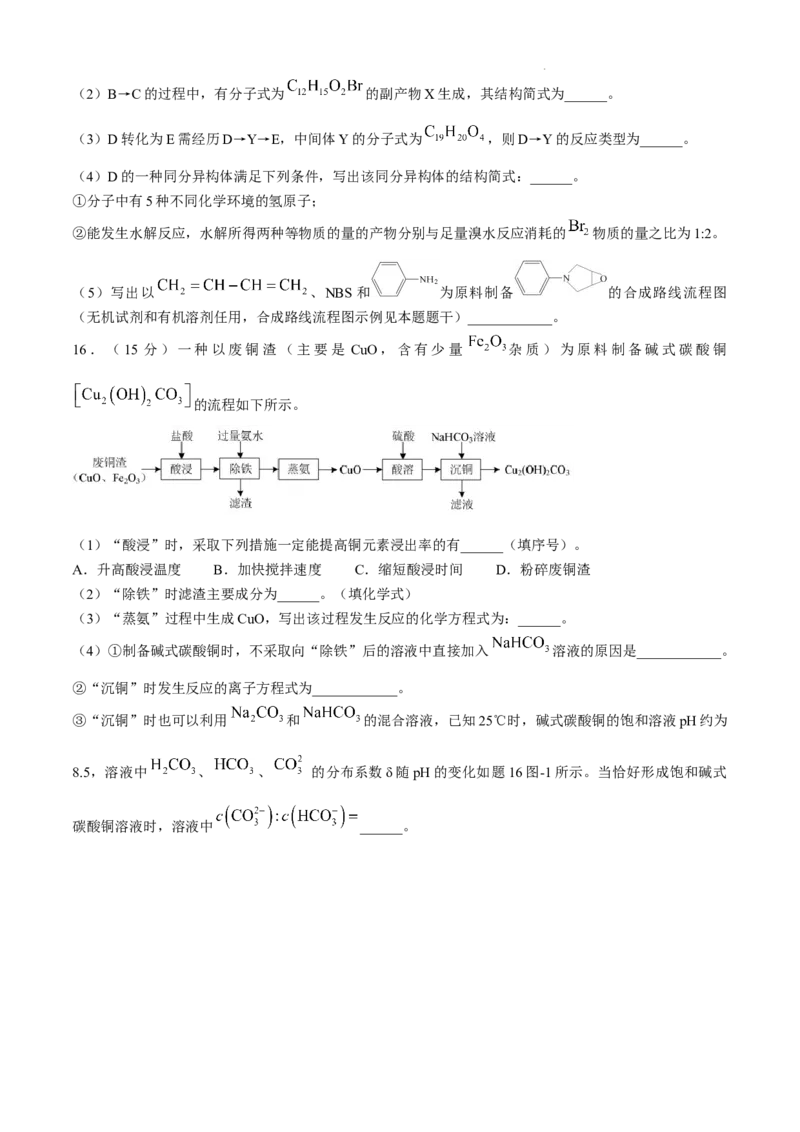
②钼的浸出率随着温度变化如题14图-1,当温度高于50℃后浸出率降低的可能原因是____________。
学科网(北京)股份有限公司(4)钼精矿( )可用于制备钼酸铵。钼酸铵溶液可以结晶出二钼酸铵[ ,相对分子
质量为340],二钼酸铵晶体加热过程中固体残留率随温度变化曲线如题14图-2所示。597℃时固体产物化
学式为______。(写出计算过程)
已知:固体残留
(5)一种 晶体结构如下图,在 中通过氮掺杂反应可生成 ,能使 具有光
学活性,掺杂过程如题14图-3所示。则 晶体中 ______, ______。
15.(15分)化合物G是一种激活剂,其合成路线如下:
(1)化合物A的酸性比环己醇的______(填“强”或“弱”或“无差别”)。
学科网(北京)股份有限公司(2)B→C的过程中,有分子式为 的副产物X生成,其结构简式为______。
(3)D转化为E需经历D→Y→E,中间体Y的分子式为 ,则D→Y的反应类型为______。
(4)D的一种同分异构体满足下列条件,写出该同分异构体的结构简式:______。
①分子中有5种不同化学环境的氢原子;
②能发生水解反应,水解所得两种等物质的量的产物分别与足量溴水反应消耗的 物质的量之比为1:2。
(5)写出以 、NBS和 为原料制备 的合成路线流程图
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)____________。
16.(15 分)一种以废铜渣(主要是 CuO,含有少量 杂质)为原料制备碱式碳酸铜
的流程如下所示。
(1)“酸浸”时,采取下列措施一定能提高铜元素浸出率的有______(填序号)。
A.升高酸浸温度 B.加快搅拌速度 C.缩短酸浸时间 D.粉碎废铜渣
(2)“除铁”时滤渣主要成分为______。(填化学式)
(3)“蒸氨”过程中生成CuO,写出该过程发生反应的化学方程式为:______。
(4)①制备碱式碳酸铜时,不采取向“除铁”后的溶液中直接加入 溶液的原因是____________。
②“沉铜”时发生反应的离子方程式为____________。
③“沉铜”时也可以利用 和 的混合溶液,已知25℃时,碱式碳酸铜的饱和溶液pH约为
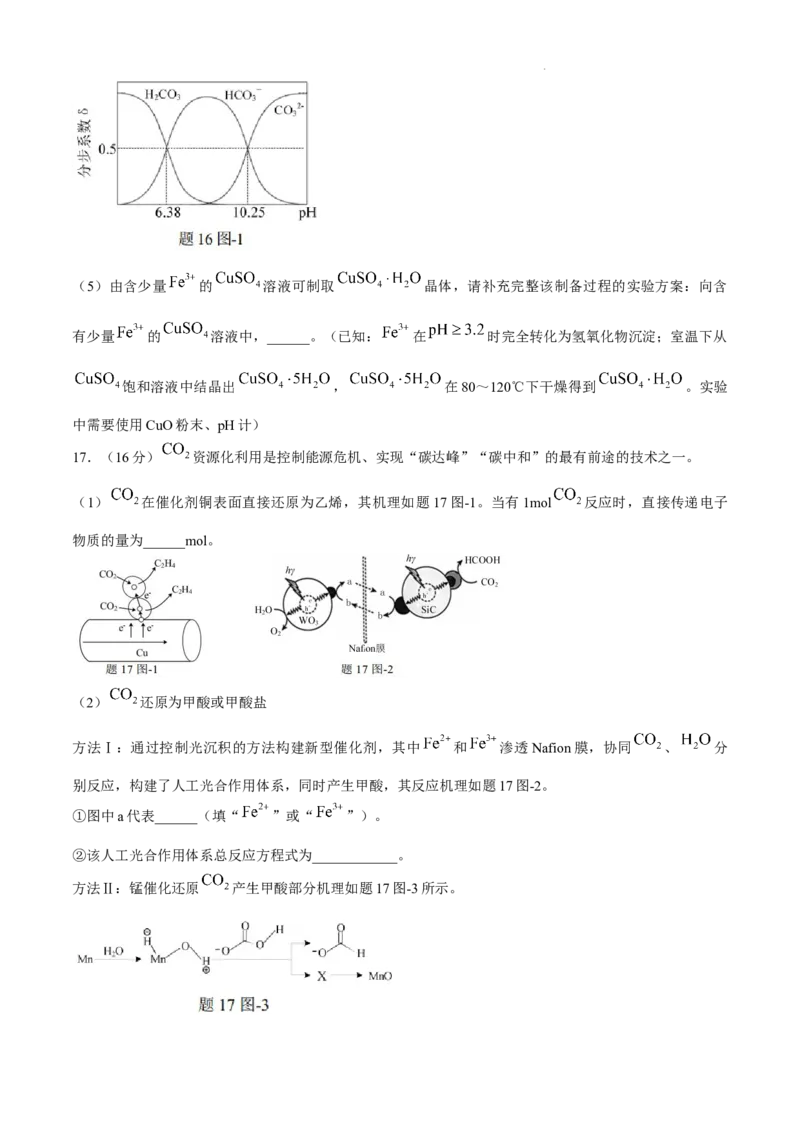
8.5,溶液中 、 、 的分布系数δ随pH的变化如题16图-1所示。当恰好形成饱和碱式
碳酸铜溶液时,溶液中 ______。
学科网(北京)股份有限公司(5)由含少量 的 溶液可制取 晶体,请补充完整该制备过程的实验方案:向含
有少量 的 溶液中,______。(已知: 在 时完全转化为氢氧化物沉淀;室温下从
饱和溶液中结晶出 , 在80~120℃下干燥得到 。实验
中需要使用CuO粉末、pH计)
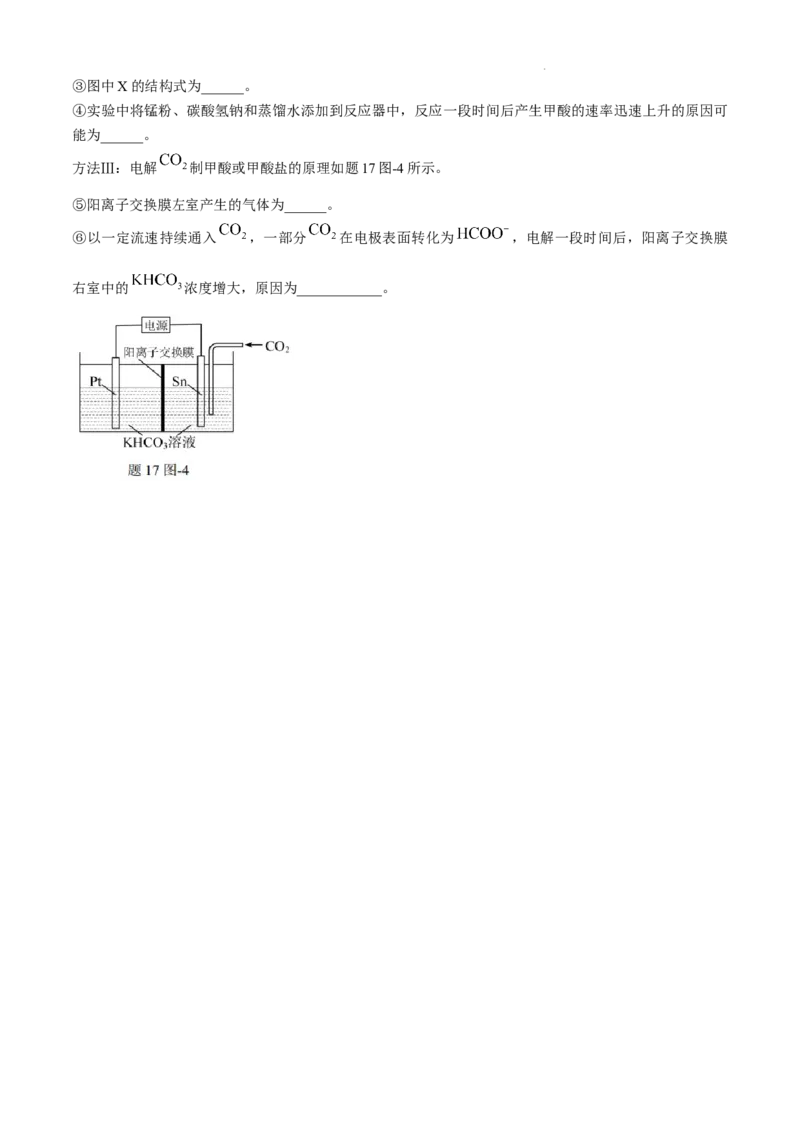
17.(16分) 资源化利用是控制能源危机、实现“碳达峰”“碳中和”的最有前途的技术之一。
(1) 在催化剂铜表面直接还原为乙烯,其机理如题17图-1。当有1mol 反应时,直接传递电子
物质的量为______mol。
(2) 还原为甲酸或甲酸盐
方法Ⅰ:通过控制光沉积的方法构建新型催化剂,其中 和 渗透Nafion膜,协同 、 分
别反应,构建了人工光合作用体系,同时产生甲酸,其反应机理如题17图-2。
①图中a代表______(填“ ”或“ ”)。
②该人工光合作用体系总反应方程式为____________。
方法Ⅱ:锰催化还原 产生甲酸部分机理如题17图-3所示。
学科网(北京)股份有限公司③图中X的结构式为______。
④实验中将锰粉、碳酸氢钠和蒸馏水添加到反应器中,反应一段时间后产生甲酸的速率迅速上升的原因可
能为______。
方法Ⅲ:电解 制甲酸或甲酸盐的原理如题17图-4所示。
⑤阳离子交换膜左室产生的气体为______。
⑥以一定流速持续通入 ,一部分 在电极表面转化为 ,电解一段时间后,阳离子交换膜
右室中的 浓度增大,原因为____________。
学科网(北京)股份有限公司