文档内容
2024—2025 学年第一学期高三年级第一次联考
化学试卷
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Zn 65
一、单项选择题:共13题,每题3分, 共39分。每题只有一个选项最符合题意。
1.淮安十四五规划提出建设“美丽淮安”。下列做法不应该提倡的是
A.大力发展化石能源经济 B.积极鼓励植树造林
C.将二氧化碳转化为化工产品 D.养成低碳生活习惯
2.反应 CHCOO[Cu(NH )]+NH+CO = CHCOO[Cu(NH )CO] 可用于除去 H 中的
3 3 2 3 3 3 3 2
CO。下列说法正确的是
A.NH 的空间构型为平面三角形 B.CHCOOH中既有离子键又有共价
3 3
键
C.1mol[Cu(NH )CO]+中σ键数目为10mol D.[Cu(NH )]+中Cu元素的化合价为+1
3 3 3 3
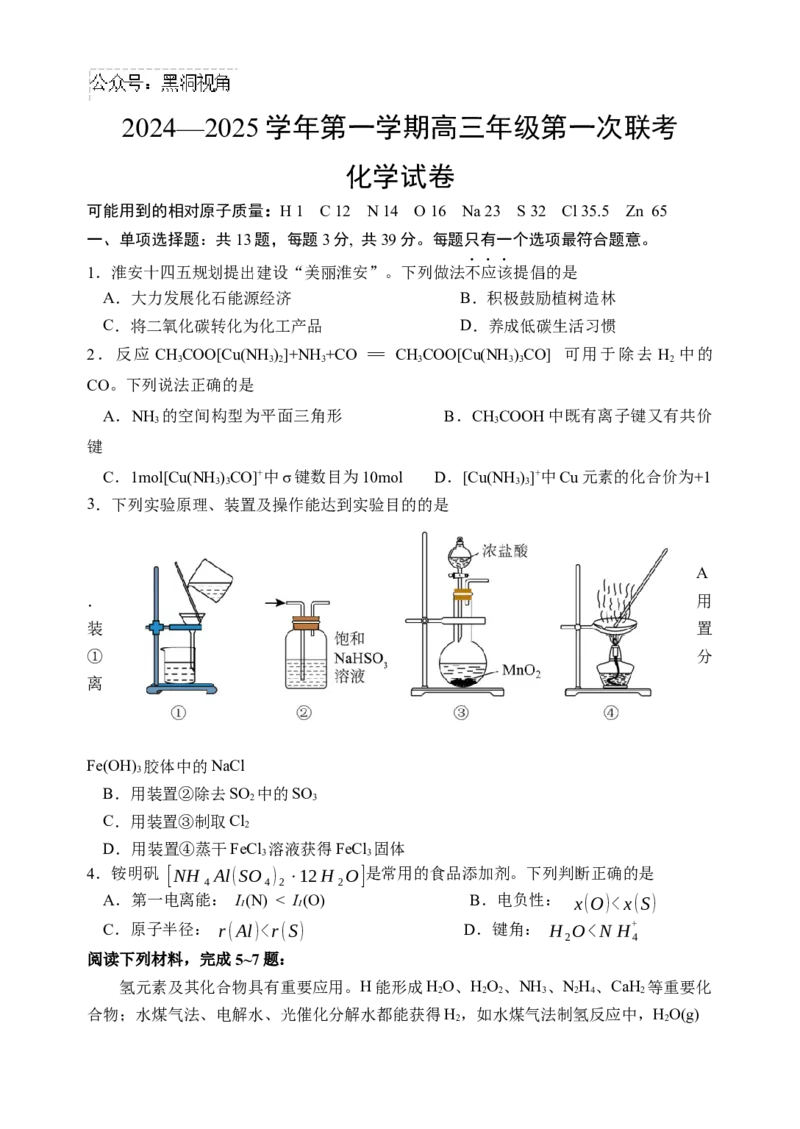
3.下列实验原理、装置及操作能达到实验目的的是
A
. 用
装 置
① 分
离
Fe(OH) 胶体中的NaCl
3
B.用装置②除去SO 中的SO
2 3
C.用装置③制取Cl
2
D.用装置④蒸干FeCl 溶液获得FeCl 固体
3 3
4.铵明矾 [NH₄Al(SO₄)₂⋅12H₂O]是常用的食品添加剂。下列判断正确的是
A.第一电离能: I₁(N) < I₁(O) B.电负性: x(O)c(H C O)
2 2 4 2 4 2 2 4
B.“酸化溶解”后的溶液中存在:2c(Fe2+) +
c(NH+
) =
2c(SO2-
)+c(OH-)
4 4
C.室温时,反应Fe2+ + HC O = FeC O ↓ + 2H+的平衡常数K=40
2 2 4 2 4
D.室温时,“沉铁”后的上层清液中:c(Fe2+)·c(C O2- )>2.1×10-7
2 413.乙醇-水催化重整可获得H 。其主要反应为
2
反应Ⅰ:C HOH(g) + 3H O(g) =2CO(g) + 6H(g) ΔH=173.3kJ·mol-1
2 5 2 2 2
反应Ⅱ:CO(g) + H(g) =CO(g) + H O(g) ΔH=41.2kJ·mol-1
2 2 2
在1.0×105Pa,n (H O)﹕n (C HOH)=3﹕1时,若仅考虑上述反应,平衡时CO 和CO的
始 2 始 2 5 2
选择性及H 的产率随温度的变化如图所示。
2
CO的选择性
下列说法正确的是
A.图中曲线③表示平衡时H 的产率随温度的变
2
化
B.平衡时C HOH的转化率与 H₂O的转化率相等
2 5
n(H O)
2
C.一定温度下,增大 可提高乙醇平衡转化率
n(C H OH)
2 5
D.一定温度下,降低体系压强,反应I的平衡常数减小
非选择题(共61分)
14.(15分)吸收工厂烟气中的SO ,能有效减少SO 对空气的污染。用ZnO浆料吸收
2 2
烟气中SO 后经O 催化氧化,可得到硫酸盐。
2 2
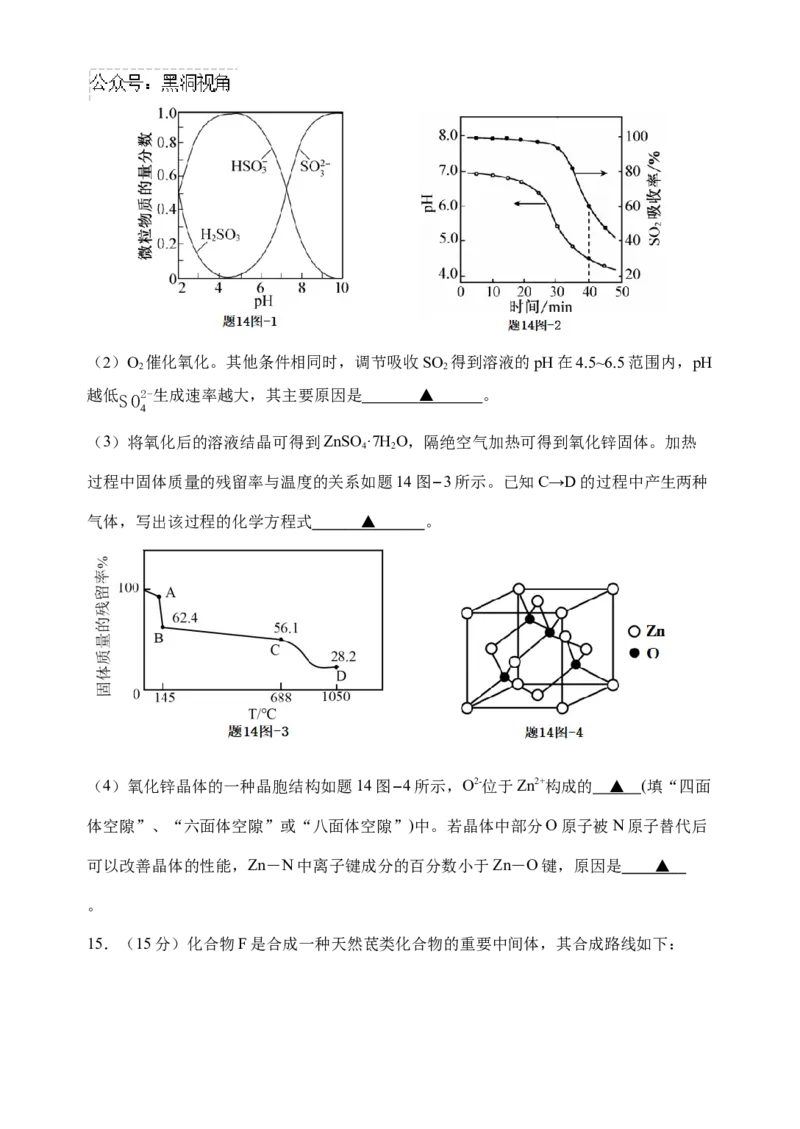
已知:室温下,ZnSO 微溶于水,Zn(HSO ) 易溶于水;溶液中HSO 、HSO-、SO2-的物
3 3 2 2 3
3 3
质的量分数随pH的分布如题14图−1所示。
(1)搅拌下向氧化锌浆料中匀速缓慢通入SO 气体。
2
①下列操作一定能提高氧化锌浆料吸收SO 效率的有 ▲ (填序号)。
2
A.水浴加热氧化锌浆料 B.加快搅拌
C.降低通入SO 气体的速率 D.通过多孔球泡向氧
2
化锌浆料中通SO
2
②在开始吸收的40 min内,SO 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化
2
(见题14图−2)。溶液pH几乎不变阶段,主要产物是 ▲ (填化学式);
SO 吸收率迅速降低阶段,主要反应的离子方程式为 ▲ 。
2(2)O 催化氧化。其他条件相同时,调节吸收SO 得到溶液的pH在4.5~6.5范围内,pH
2 2
越低SO2-生成速率越大,其主要原因是 ▲ 。
4
(3)将氧化后的溶液结晶可得到ZnSO·7H O,隔绝空气加热可得到氧化锌固体。加热
4 2
过程中固体质量的残留率与温度的关系如题14图−3所示。已知C→D的过程中产生两种
气体,写出该过程的化学方程式 ▲ 。
(4)氧化锌晶体的一种晶胞结构如题14图−4所示,O2-位于Zn2+构成的 ▲ (填“四面
体空隙”、“六面体空隙”或“八面体空隙”)中。若晶体中部分O原子被N原子替代后
可以改善晶体的性能,Zn-N中离子键成分的百分数小于Zn-O键,原因是 ▲
。
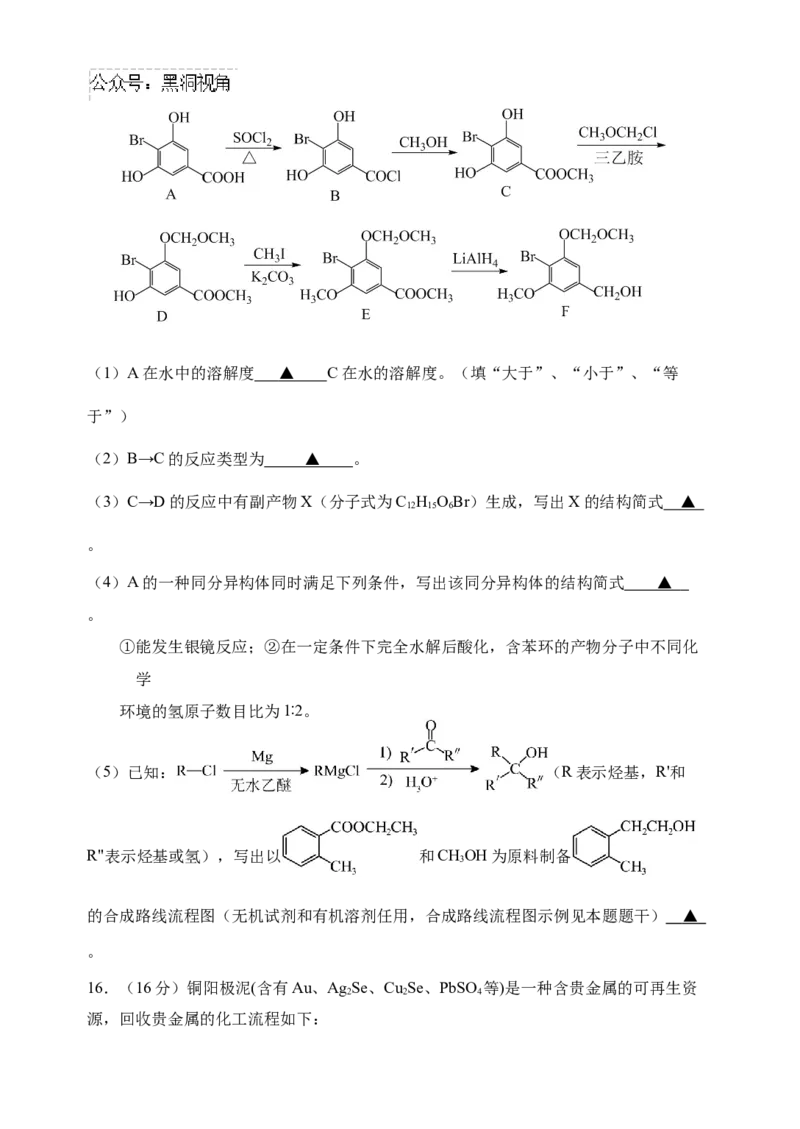
15.(15分)化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:(1)A在水中的溶解度 ▲ C在水的溶解度。(填“大于”、“小于”、“等
于”)
(2)B→C的反应类型为 ▲ 。
(3)C→D的反应中有副产物X(分子式为C H OBr)生成,写出X的结构简式 ▲
12 15 6
。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式 ▲
。
①能发生银镜反应;②在一定条件下完全水解后酸化,含苯环的产物分子中不同化
学
环境的氢原子数目比为1∶2。
(5)已知: (R表示烃基,R'和
R"表示烃基或氢),写出以 和CHOH为原料制备
3
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) ▲
。
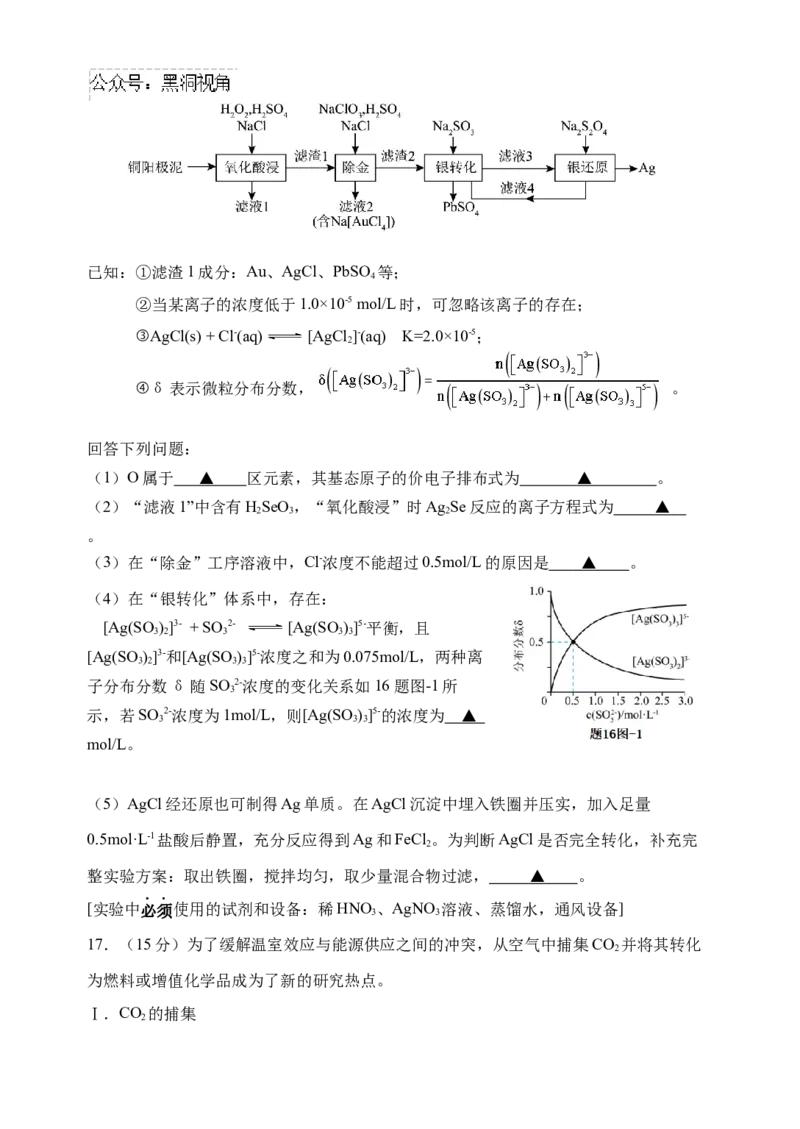
16.(16分)铜阳极泥(含有Au、Ag Se、Cu Se、PbSO 等)是一种含贵金属的可再生资
2 2 4
源,回收贵金属的化工流程如下:已知:①滤渣1成分:Au、AgCl、PbSO 等;
4
②当某离子的浓度低于1.0×10-5 mol/L时,可忽略该离子的存在;
③AgCl(s) + Cl-(aq) [AgCl ]-(aq) K=2.0×10-5;
2
④δ表示微粒分布分数, 。
回答下列问题:
(1)O属于 ▲ 区元素,其基态原子的价电子排布式为 ▲ 。
(2)“滤液1”中含有HSeO,“氧化酸浸”时Ag Se反应的离子方程式为 ▲
2 3 2
。
(3)在“除金”工序溶液中,Cl-浓度不能超过0.5mol/L的原因是 ▲ 。
(4)在“银转化”体系中,存在:
[Ag(SO)]3- + SO 2- [Ag(SO)]5-平衡,且
3 2 3 3 3
[Ag(SO)]3-和[Ag(SO)]5-浓度之和为0.075mol/L,两种离
3 2 3 3
子分布分数δ随SO 2-浓度的变化关系如16题图-1所
3
示,若SO 2-浓度为1mol/L,则[Ag(SO)]5-的浓度为 ▲
3 3 3
mol/L。
(5)AgCl经还原也可制得Ag单质。在AgCl沉淀中埋入铁圈并压实,加入足量
0.5mol·L-1盐酸后静置,充分反应得到Ag和FeCl 。为判断AgCl是否完全转化,补充完
2
整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤, ▲ 。
[实验中必须使用的试剂和设备:稀HNO、AgNO 溶液、蒸馏水,通风设备]
3 3
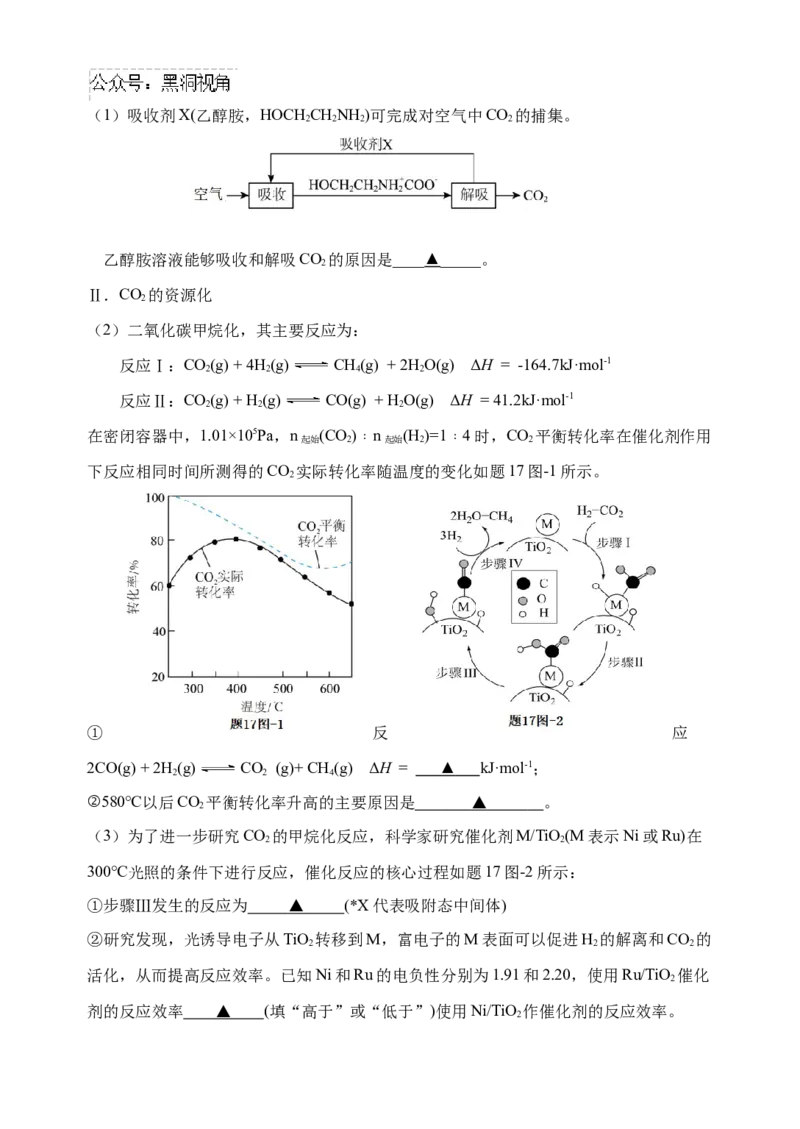
17.(15分)为了缓解温室效应与能源供应之间的冲突,从空气中捕集CO 并将其转化
2
为燃料或增值化学品成为了新的研究热点。
Ⅰ.CO 的捕集
2(1)吸收剂X(乙醇胺,HOCH CHNH )可完成对空气中CO 的捕集。
2 2 2 2
乙醇胺溶液能够吸收和解吸CO 的原因是____▲_____。
2
Ⅱ.CO 的资源化
2
(2)二氧化碳甲烷化,其主要反应为:
反应Ⅰ:CO(g) + 4H(g) CH(g) + 2H O(g) ΔH = -164.7kJ·mol-1
2 2 4 2
反应Ⅱ:CO(g) + H(g) CO(g) + H O(g) ΔH = 41.2kJ·mol-1
2 2 2
在密闭容器中,1.01×105Pa,n (CO)﹕n (H )=1﹕4时,CO 平衡转化率在催化剂作用
起始 2 起始 2 2
下反应相同时间所测得的CO 实际转化率随温度的变化如题17图-1所示。
2
① 反 应
2CO(g) + 2H (g) CO (g)+ CH(g) ΔH = ▲ kJ·mol-1;
2 2 4
②580℃以后CO 平衡转化率升高的主要原因是 ▲ 。
2
(3)为了进一步研究CO 的甲烷化反应,科学家研究催化剂M/TiO(M表示Ni或Ru)在
2 2
300℃光照的条件下进行反应,催化反应的核心过程如题17图-2所示:
①步骤Ⅲ发生的反应为 ▲ (*X代表吸附态中间体)
②研究发现,光诱导电子从TiO 转移到M,富电子的M表面可以促进H 的解离和CO 的
2 2 2
活化,从而提高反应效率。已知Ni和Ru的电负性分别为1.91和2.20,使用Ru/TiO 催化
2
剂的反应效率 ▲ (填“高于”或“低于”)使用Ni/TiO 作催化剂的反应效率。
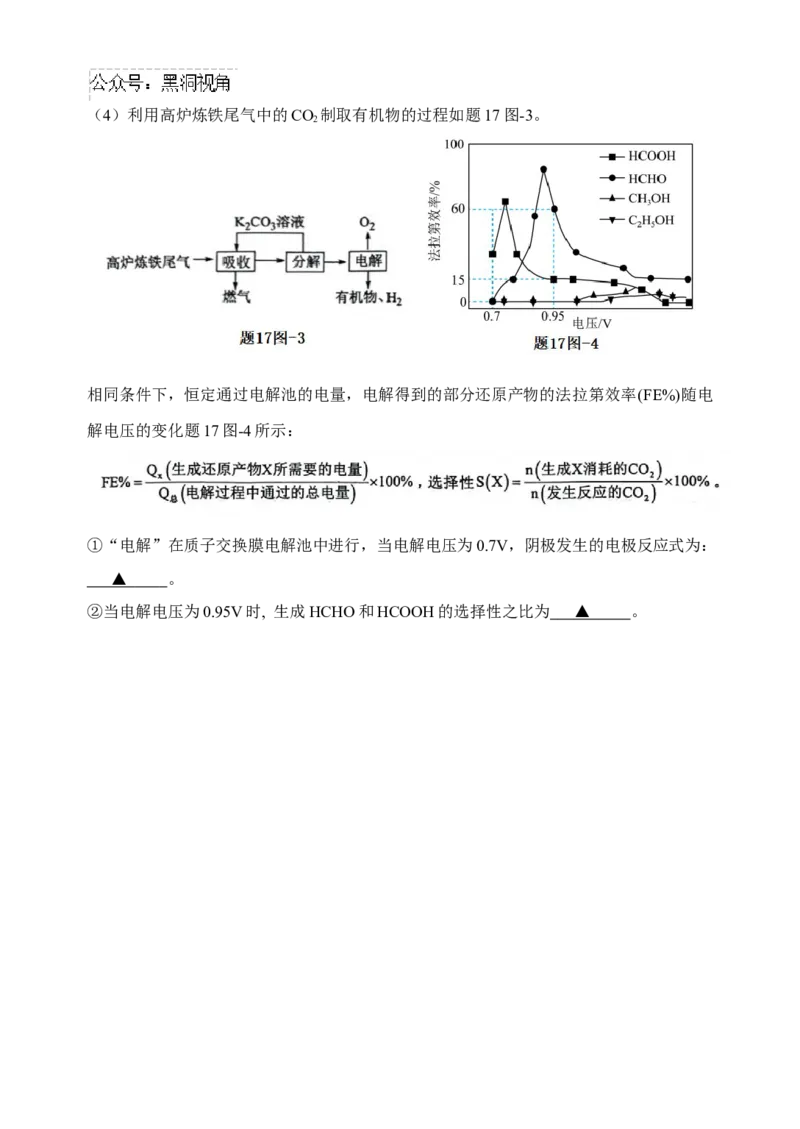
2(4)利用高炉炼铁尾气中的CO 制取有机物的过程如题17图-3。
2
相同条件下,恒定通过电解池的电量,电解得到的部分还原产物的法拉第效率(FE%)随电
解电压的变化题17图-4所示:
①“电解”在质子交换膜电解池中进行,当电解电压为0.7V,阴极发生的电极反应式为:
▲ 。
②当电解电压为0.95V时, 生成HCHO和HCOOH的选择性之比为 ▲ 。2024—2025 学年第一学期高三年级第一次联考
化学答案
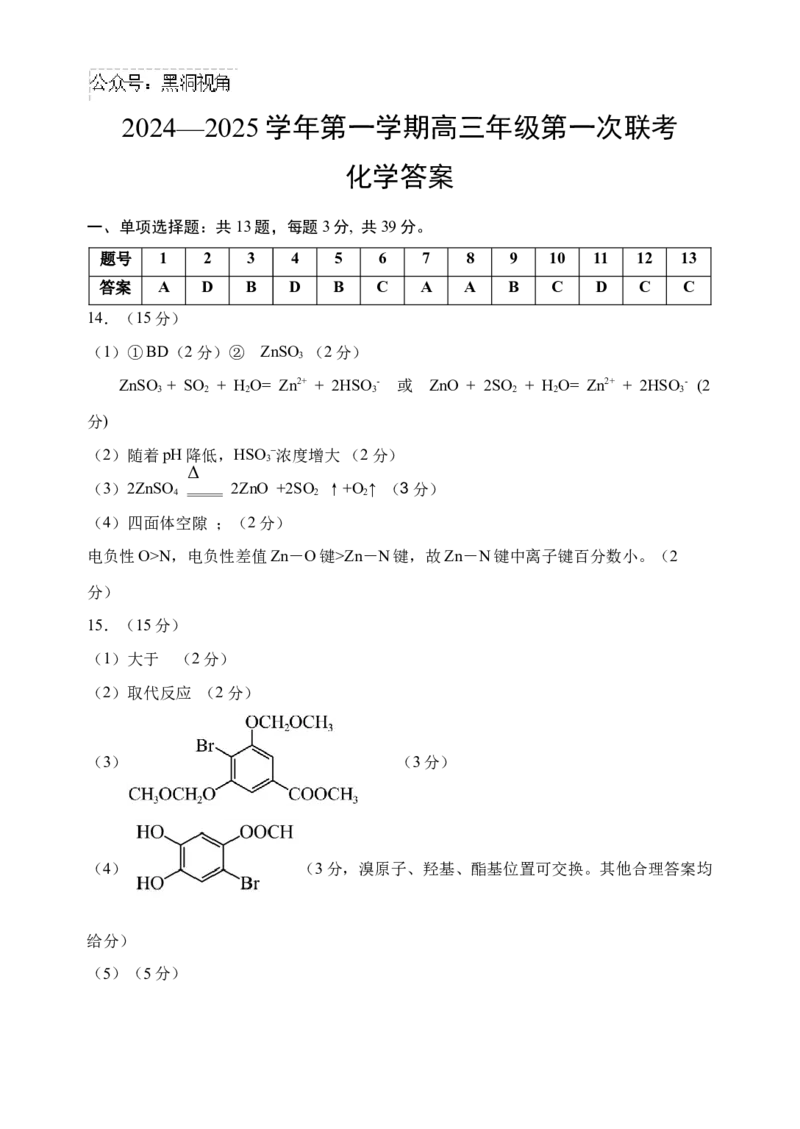
一、单项选择题:共13题,每题3分, 共39分。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 A D B D B C A A B C D C C
14.(15分)
(1)①BD(2分)② ZnSO (2分)
3
ZnSO + SO + HO= Zn2+ + 2HSO - 或 ZnO + 2SO + HO= Zn2+ + 2HSO - (2
3 2 2 3 2 2 3
分)
(2)随着pH降低,HSO −浓度增大(2分)
3
Δ
(3)2ZnSO 2ZnO +2SO ↑+O ↑ (3分)
4 2 2
(4)四面体空隙 ;(2分)
电负性O>N,电负性差值Zn-O键>Zn-N键,故Zn-N键中离子键百分数小。(2
分)
15.(15分)
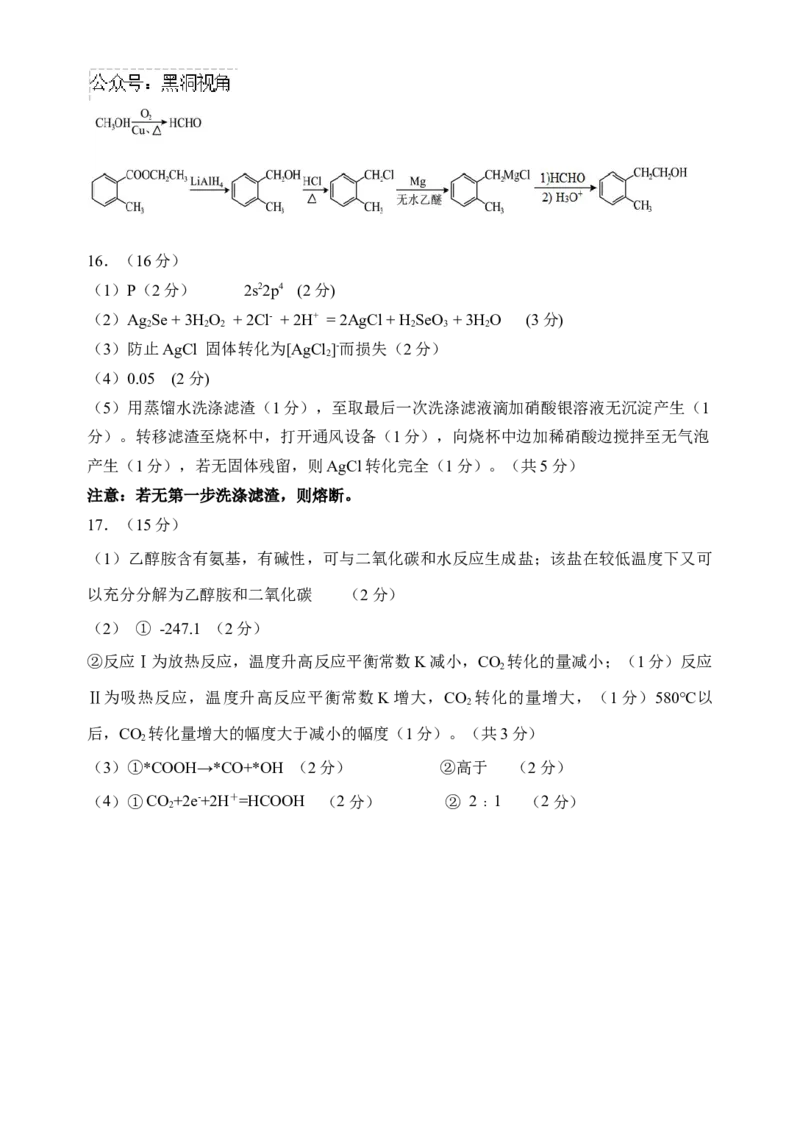
(1)大于 (2分)
(2)取代反应 (2分)
(3) (3分)
(4) (3分,溴原子、羟基、酯基位置可交换。其他合理答案均
给分)
(5)(5分)16.(16分)
(1)P(2分) 2s22p4 (2分)
(2)Ag Se + 3H O + 2Cl- + 2H+ = 2AgCl + H SeO + 3H O (3分)
2 2 2 2 3 2
(3)防止AgCl 固体转化为[AgCl ]-而损失(2分)
2
(4)0.05 (2分)
(5)用蒸馏水洗涤滤渣(1分),至取最后一次洗涤滤液滴加硝酸银溶液无沉淀产生(1
分)。转移滤渣至烧杯中,打开通风设备(1分),向烧杯中边加稀硝酸边搅拌至无气泡
产生(1分),若无固体残留,则AgCl转化完全(1分)。(共5分)
注意:若无第一步洗涤滤渣,则熔断。
17.(15分)
(1)乙醇胺含有氨基,有碱性,可与二氧化碳和水反应生成盐;该盐在较低温度下又可
以充分分解为乙醇胺和二氧化碳 (2分)
(2) ① -247.1 (2分)
②反应Ⅰ为放热反应,温度升高反应平衡常数K减小,CO 转化的量减小;(1分)反应
2
Ⅱ为吸热反应,温度升高反应平衡常数K增大,CO 转化的量增大,(1分)580℃以
2
后,CO 转化量增大的幅度大于减小的幅度(1分)。(共3分)
2
(3)①*COOH→*CO+*OH (2分) ②高于 (2分)
(4)①CO+2e-+2H+=HCOOH (2分) ② 2﹕1 (2分)
2