文档内容
海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
海南中学 2024-2025 学年度第一学期期中考试
高二化学试题
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Na-23 Mg-24
第I卷 选择题(共40分)
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1. 我国力争在2060年前实现碳中和,下列说法错 . 误 . 的是
A. 可利用副产品CaO捕集废气中的CO
2
B. 鼓励植树造林,吸收过多排放的CO
2
C. 将CO 转化为CH OH,实现CO 的资源化利用
2 3 2
D. 研发新型催化剂将CO 分解为C和O ,并放出热量
2 2
2. 下列有关物质的用途的描述,错 . 误 . 的是
A.Na CO 用做治疗胃酸过多药物的主要成分 B.KAl(SO ) ·12H O用作净水剂
2 3 4 2 2
C.FeCl 溶液用来制氢氧化铁胶体 D.氯化铵溶液用来除锈
3
3.下列事实不
.
能
.
证明一水合氨是弱碱的是
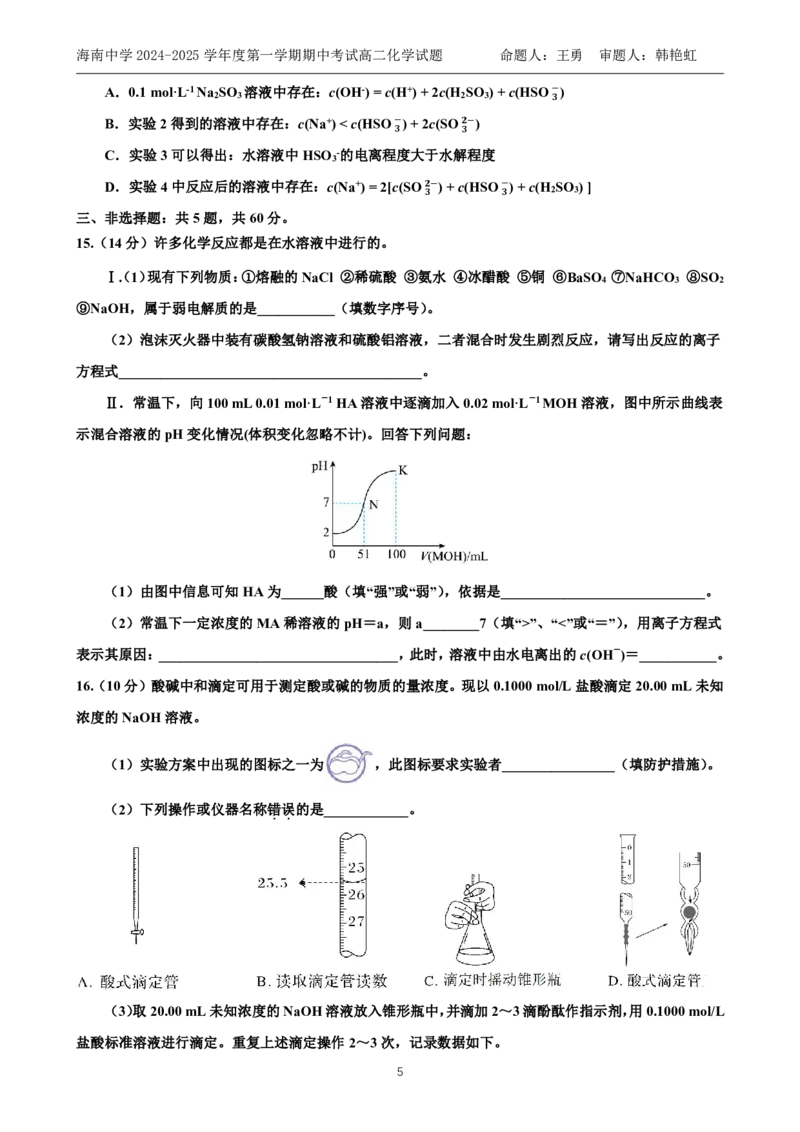
A.氯化铵溶液呈酸性 B.pH=12的氨水稀释到100倍,溶液的10”、“<”或“=”),用离子方程式
表示其原因:__________________________________,此时,溶液中由水电离出的c(OH-)=___________。
16.(10分)酸碱中和滴定可用于测定酸或碱的物质的量浓度。现以0.1000mol/L盐酸滴定20.00mL未知
浓度的NaOH溶液。
(1)实验方案中出现的图标之一为 ,此图标要求实验者________________(填防护措施)。
(2)下列操作或仪器名称错
.
误
.
的是____________。
(3)取20.00mL未知浓度的NaOH溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用0.1000mol/L
盐酸标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
5海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
实验编号 盐酸(mol/L) 滴定完成时,消耗盐酸的体积(mL) 待测NaOH溶液的体积(mL)
1 0.1000 25.59 20.00
2 0.1000 25.61 20.00
3 0.1000 25.60 20.00
①滴定达到终点的现象是__________________________________________。
②根据上述数据,可计算出该NaOH溶液的浓度约为________mol/L(保留四位有效数字)。
③在上述实验中,其他操作正确,下列操作会造成测定结果偏高的有________(填字母序号)。
A. 滴定终点读数时俯视
B. 锥形瓶水洗后未干燥
C. 酸式滴定管使用前,水洗后未用盐酸润洗
D. 碱式滴定管尖嘴放液前无气泡,放液后有气泡
17.(12分)化学上把外加少量酸、碱,而pH基本不变的溶液,称为缓冲溶液。
Ⅰ.现有25℃时,浓度均为0.10mol/L的CH COOH和CH COONa的缓冲溶液,pH=4.76,回答下
3 3
列问题:[25℃时K (CH COOH)=1.75×10-5,K 为盐的水解常数]。
a 3 h
(1)25℃时,K (CH COO-)=____________(保留三位有效数字)。
h 3
(2)该缓冲溶液中离子浓度由大到小的顺序是_________________________________。
(3)向1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),反应后溶液中c(H+)约
为__________mol/L。
c(CH COO-)
(4)改变下列条件,能使CH COONa稀溶液中 3 保持增大的是____________。
3 c(OH-)
a. 升温 b. 加入NaOH固体 c. 稀释 d. 加入CH COONa固体
3
H CO
Ⅱ.人体血液里主要通过碳酸氢盐缓冲体系( 2 3 )维持pH稳定。已知正常人体血液在正常体温时,
HCO-
3
H CO 的一级电离常数K =1.0×10-6.1, c(HCO- 3 ) ≈ 20 ,lg2=0.3。由题给数据可算得正常人体血液的pH
2 3 a1
c(H CO ) 1
2 3
c(HCO-)
约为____,当过量的酸进入血液中时,血液缓冲体系中 3 的值将_____(填“变大”“变小”或“不变”)。
c(H CO )
2 3
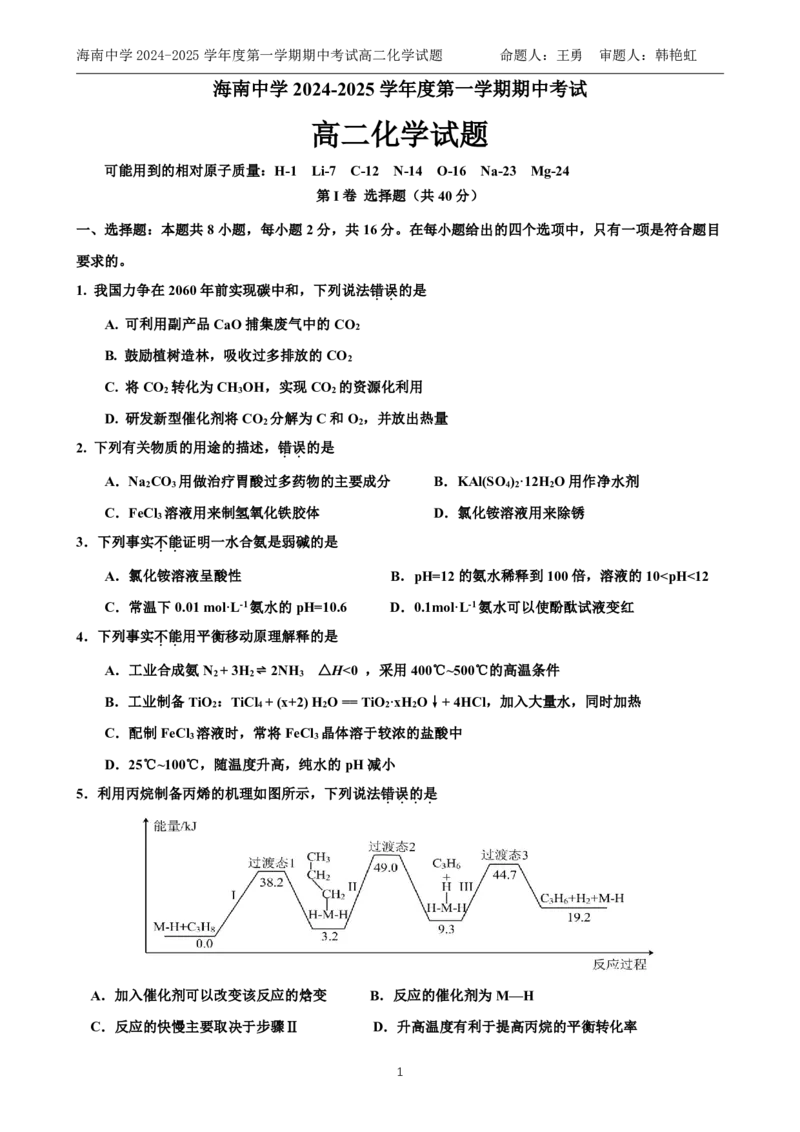
18.(12分)氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氨气直接合成氨。
(1)固氮一直是科学家致力研究的重要课题,有关热力学数据如下:
反应 大气固氮 N (g)+O (g)⇌ 2NO(g) 工业固氮 N (g)+3H (g)⇌ 2NH (g)
2 2 2 2 3
温度/℃ 25 2000 25 350 400 450
平衡常数K 3.84×10-31 0.1 5×10-8 1.847 0.507 0.152
6海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
常温下,大气固氮的倾向________工业固氮(填“大于”或“小于”)。
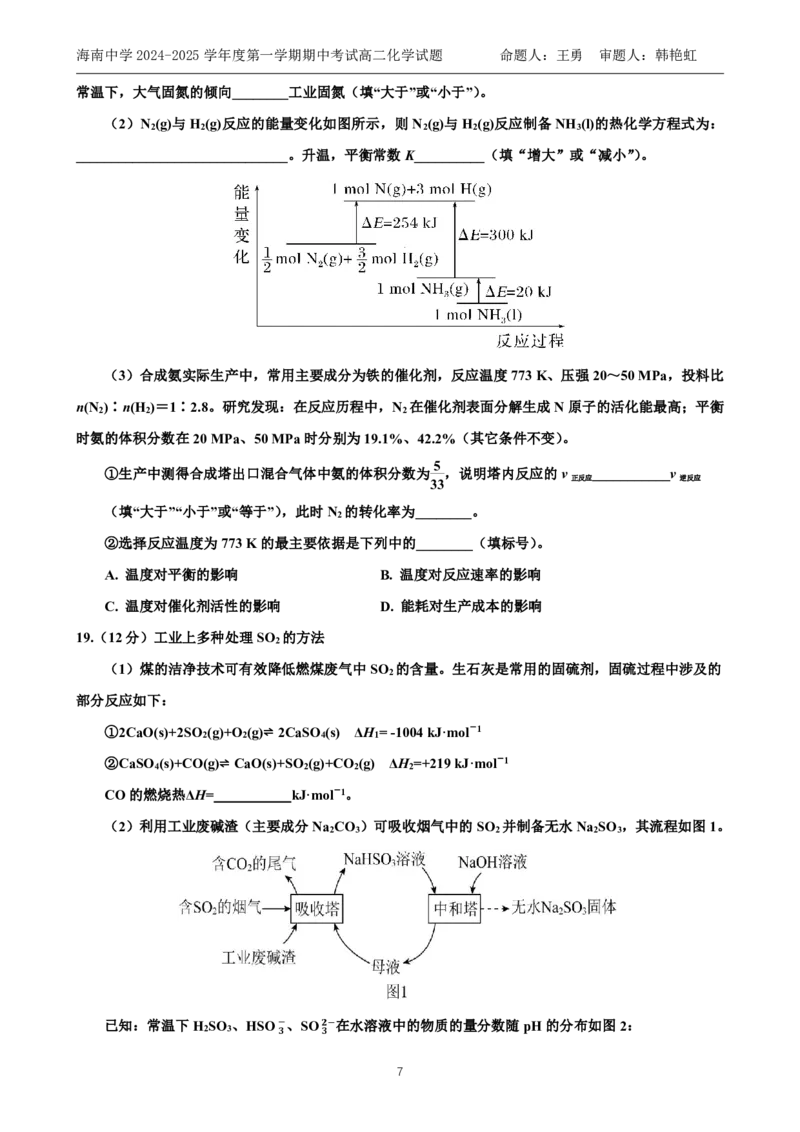
(2)N (g)与H (g)反应的能量变化如图所示,则N (g)与H (g)反应制备NH (l)的热化学方程式为:
2 2 2 2 3
______________________________。升温,平衡常数K__________(填“增大”或“减小”)。
(3)合成氨实际生产中,常用主要成分为铁的催化剂,反应温度773K、压强20~50MPa,投料比
n(N )∶n(H )=1∶2.8。研究发现:在反应历程中,N 在催化剂表面分解生成N原子的活化能最高;平衡
2 2 2
时氨的体积分数在20MPa、50MPa时分别为19.1%、42.2%(其它条件不变)。
5
①生产中测得合成塔出口混合气体中氨的体积分数为 ,说明塔内反应的v ___________v
正反应 逆反应
33
(填“大于”“小于”或“等于”),此时N 的转化率为________。
2
②选择反应温度为773K的最主要依据是下列中的________(填标号)。
A. 温度对平衡的影响 B. 温度对反应速率的影响
C. 温度对催化剂活性的影响 D. 能耗对生产成本的影响
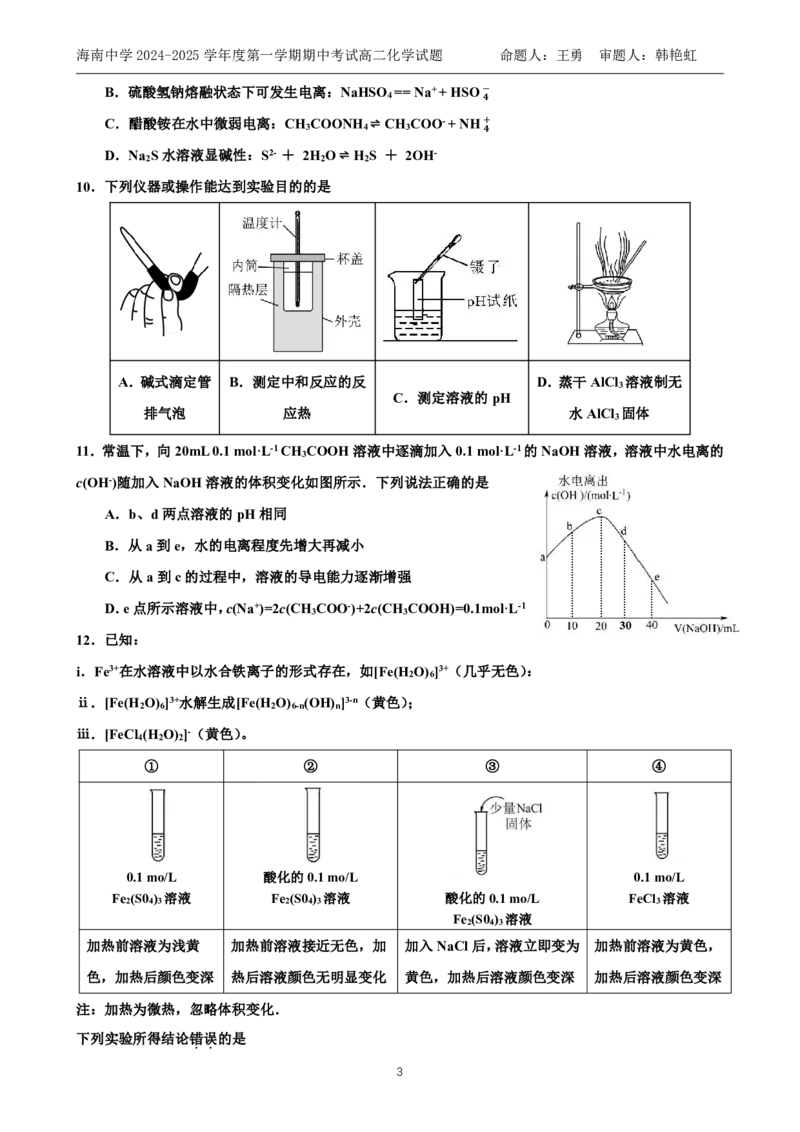
19.(12分)工业上多种处理SO 的方法
2
(1)煤的洁净技术可有效降低燃煤废气中SO 的含量。生石灰是常用的固硫剂,固硫过程中涉及的
2
部分反应如下:
①2CaO(s)+2SO (g)+O (g)⇌ 2CaSO (s) ΔH =-1004kJ·mol-1
2 2 4 1
②CaSO (s)+CO(g)⇌ CaO(s)+SO (g)+CO (g) ΔH =+219kJ·mol-1
4 2 2 2
CO的燃烧热ΔH= kJ·mol-1。
(2)利用工业废碱渣(主要成分Na CO )可吸收烟气中的SO 并制备无水Na SO ,其流程如图1。
2 3 2 2 3
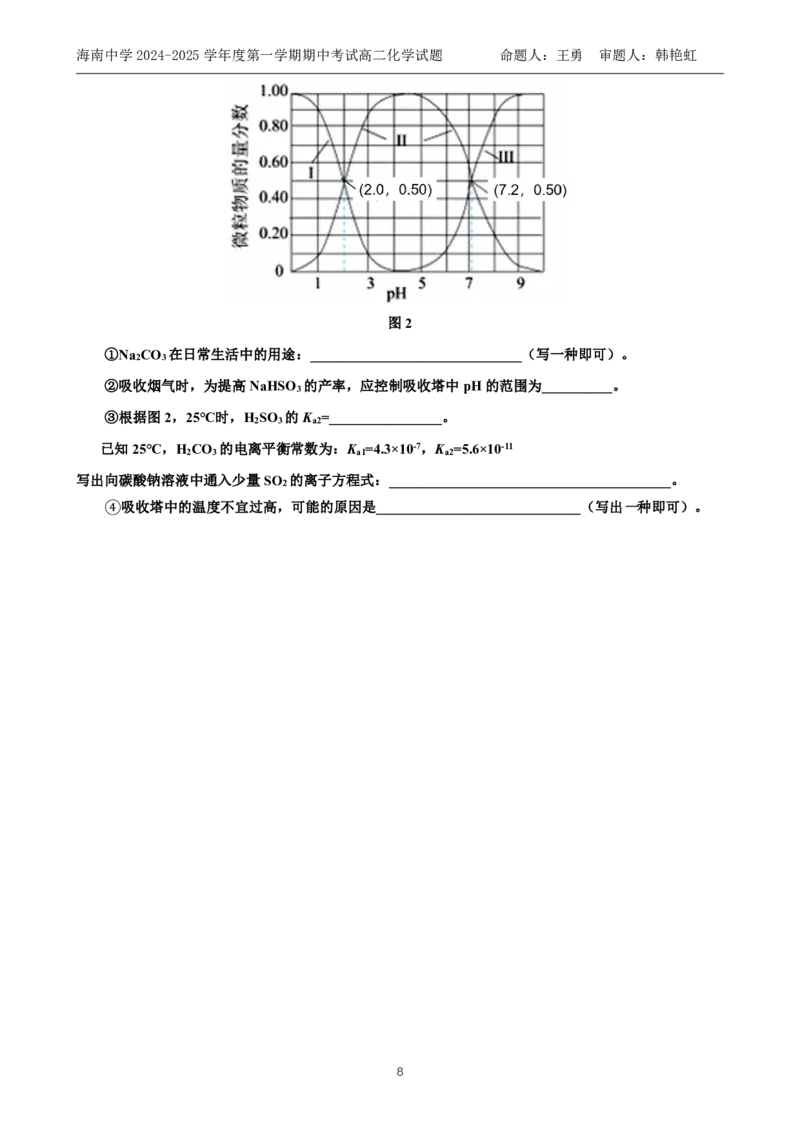
已知:常温下H SO 、HSO 、SO 在水溶液中的物质的量分数随pH的分布如图2:
2 3
− −
7海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
图2
①Na CO 在日常生活中的用途:______________________________(写一种即可)。
2 3
②吸收烟气时,为提高NaHSO 的产率,应控制吸收塔中pH的范围为__________。
3
③根据图2,25℃时,H SO 的K =________________。
2 3 a2
已知25℃,H CO 的电离平衡常数为:K =4.3×10-7,K =5.6×10-11
2 3 a1 a2
写出向碳酸钠溶液中通入少量SO 的离子方程式:________________________________________。
2
吸收塔中的温度不宜过高,可能的原因是_____________________________(写出一种即可)。
④
8海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
海南中学 2024-2025学年度第一学期期中考试
高二化学试题参考答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
D A D A A B C D AB A BC D AC BD
注:每空2分
15.(14分)
Ⅰ.(1)④ (2)Al3++3HCO ==Al(OH) ↓+3CO ↑
3 2
−
Ⅱ.(1)强 0.01mol·L-1HA溶液 中c(H+)=0.01mol·L-1(或常温下0.01mol·L-1HA溶液pH=2)
(2)< M+ + H O ⇌ MOH + H+ 1×10-amol·L-1
2
16.(10分)
(1)佩戴护目镜 (2)BD
(3)①最后加入半滴盐酸后,溶液由粉红色恰好变成无色,且半分钟内不变色 ②0.1280 ③CD
17.(12分)
Ⅰ.(1)5.71×10-10 (2)c(CH COO-)>c(Na+)>c(H+)>c(OH-) (3)1.0×10-4.76 (4)d
3
Ⅱ.7.4 变小
18.(12分)
(1)小于
(2)N (g) + 3H (g)⇌ 2NH (l) ΔH=-132kJ/mol 减小
2 2 3
(3)①大于 25% ②C
19.(12分)
(1)-283
(2)①发面、油污的清洁等
②4~5 ③1.0×10-7.2 SO +2CO +H O==2HCO +SO
2 2
− − −
④防止SO 的溶解度下降;防止HSO 的氧化速率加快等
2
−
9海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
部分题目解析:
17.解析
Ⅰ.(1)25℃时醋酸根离子水解的离子方程式是CH COO-+H O⇌ CH COOH+OH-,
3 2 3
c(CH COOH)·c(OH-)
常数K (CH COO-)= 3 ,
h 3 c(CH COO-)
3
K (CH COO-)= c(CH 3 COOH)·c(OH-) = c(CH 3 COOH)·c(OH-)·c(H+) = K W= 10-14
h 3 c(CH
3
COO-) c(CH
3
COO-)·c(H+) K
a
1.75×10-5
=5.71×10-10;
(2)浓度均为0.10mol/L的CH COOH和CH COONa的缓冲溶液,pH=4.76,溶液呈酸性,说明醋酸
3 3
电离大于醋酸钠水解,该缓冲溶液中离子浓度由大到小的顺序是c(CH COO-)>c(Na+)>c(H+)>c(OH-);
3
(3)向1.0L上述缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),pH几乎不变,反应后溶液
中c(H+)=1×10-4.76mol/L;
(4)a.升温,CH COO-+H O⇌ CH COOH+OH-平衡正向移动,c(CH COO-) 减小、c(OH-) 增大,但
3 2 3 3
c(CH COO-)
3 减小;b.加入NaOH固体,c(OH-)增大,CH COO-+H O⇌ CH COOH+OH-平衡逆向
c(OH-) 3 2 3
c(CH COO-) c(CH COO-)
移动,c(CH COOH)减小, 3 不变,所以 3 减小;c.稀释,
3 c(OH-)·c(CH COOH) c(OH-)
3
c(CH COO-) c(CH COO-)
c(CH COOH)减小, 3 不变,所以 3 减小;d.加入CH COONa固
3 c(OH-)·c(CH COOH) c(OH-) 3
3
体,c(CH COO-) 增大,CH COO-+H O⇌ CH COOH+OH-平衡正向移动,c(CH COOH)增大,
3 3 2 3 3
c(CH COO-) c(CH COO-)
3 不变,所以 3 增大;选d。
c(OH-)·c(CH COOH) c(OH-)
3
Ⅱ.K = c(HCO- 3 )·c(H+) =10-6.1, c(HCO- 3 ) ≈ 20 ,20×c(H+)=10-6.1,c(H+)= 10-6.1 ,则正常人体血液
a1
c(H CO ) c(H CO ) 1 20
2 3 2 3
c(HCO-)·c(H+)
的pH约为7.4,当过量的酸进入血液中时, 3 不变,氢离子浓度增大,所以血液缓冲
c(H CO )
2 3
c(HCO-)
体系中 3 的值将变小。
c(H CO )
2 3
18.解析
(1)根据表格数据可知:在相同温度下,大气固氮平衡常数远小于工业固氮,化学平衡常数越大,说明
反应正向进行的程度越大,因此常温下,大气固氮的倾向小于工业固氮;
(2)根据图示可知反应物总能量比生成物总能量高,因此该反应为放热反应,0.5molN 完全反应变为
2
NH (l)时放出热量为Q=300kJ+20kJ-254kJ=66kJ,故该反应的热化学方程式可表示为:N (g)+3H (g)
3 2 2
⇌ 2NH (l) ΔH=-132kJ/mol; 升温,平衡逆向移动,K减小。
3
5
(2)①生产中测得合成塔出口混合气体中氨的体积分数为 ≈15.2%<19.1%,氨的体积分数小于平衡时的
33
体积分数,反应正向进行,v >v ;
正反应 逆反应
10海南中学2024-2025学年度第一学期期中考试高二化学试题 命题人:王勇 审题人:韩艳虹
设N 的转化率为x,根据三段式可知:
2
2x 5
= ,解得x=0.25,②A.合成氨反应放热,若考虑温度对平衡的影响应选择低温,且
1-x+2.8-3x+2x 33
实际生产中合成塔中的反应并未达到平衡,故选择773K 并不是依据温度对平衡的影响,选项A错误;B.
若考虑温度对反应速率的影响应选择高温,选项B错误;C.合成氨实际生产中未反应的氮气、氢气可以循
环利用,则应考虑对反应速率的影响,再依据:在反应历程中,N 在催化剂表面分解生成N原子的活化
2
能最高,选择773K可推断是该温度下所用催化剂的活性较强,故最主要依据是温度对催化剂活性的影响,
选项C正确;D.若考虑能耗对生产效益的影响,则能耗应尽可能低(包括反应温度应尽可能低),故选择
773K的最主要依据不是能耗的影响,选项D错误。
11