文档内容
届高三二轮复习联考 二
2024 ( )
理综化学参考答案及评分意见
【解析】燃料电池是将化学能转化为电能的装置 错误 航空发动机陶瓷基复合材料的主要成分是 具
7.A ,A ; SiC,
有硬度大 耐高温 耐腐蚀等特性 正确 射线衍射实验可用于测定晶体的结构 包括键长 键角等 正确 空
、 、 ,B ;X , 、 ,C ;
气为分散剂时 属于气溶胶 正确
, ,D .
【解析】由题图中 和 的结构简式可知 的反应为取代反应 正确 分子中存在多个饱和碳原子
8.B X Y ,X→Y ,A ;Z ,
分子中所有碳原子不可能共平面 错误 酯基消耗 水解消耗 得到
,B ;1mol 1molNaOH,1mol-Cl 1molNaOH,
酚羟基 酚羟基消耗 共 正确 五元环酯结构有 种 即 苯
,1mol 1molNaOH, 3mol,C ; 3 , ,
环上只有 个取代基 故 原子的位置在五元酯环结构上 每种五元酯环上都存在 种氯原子的取代位置 所以
1 , Cl , 3 ,
符合条件的同分异构体共有 种 正确
9 ,D .
【解析】 与浓盐酸生成 的反应需要加热 题图中没有加热装置 则固体粉末甲一定不是 错
9.D MnO2 Cl2 , , MnO2,A
误 鲜花褪色是 溶解于鲜花的汁液中生成的 使鲜花褪色 错误 受气体冲击 溶液右移至玻璃泡 容
; Cl2 HClO ,B ; , ,
积突然变大 液柱分散回落 可起到防止液体冲出的作用 但不能防止倒吸 错误 碱液吸收 没有来得及吸
, , , ,C ; Cl2,
收的 会被气球收集 正确
Cl2, ,D .
【解析】 时 的 溶液中c
- -2 -1
由于溶液体积未知 无法计算
10.D 25℃ ,pH=12 Ba(OH)2 (OH )=10 molL , ,
的数目 项错误 标准状况下 为固态 不能利用气体摩尔体积计算所含分子数 项错误 个
- -
OH ,A ; ,SO3 , ,B ;1 NH2
中的质子数为 电子数为
-
的物质的量为32 则
-
中含有的电子数和质
9, 10,32gNH2 mol=0.2mol, 32gNH2
16
子数不同 项错误 的物质的量为 为乙醇或乙醚 一个 分子中含有的
,C ;46gC2H6O 01mol,C2H6O , C2H6O σ
键数均为 则 中含有的 键数均为 N 项正确
8, 01molC2H6O σ 8 A,D .
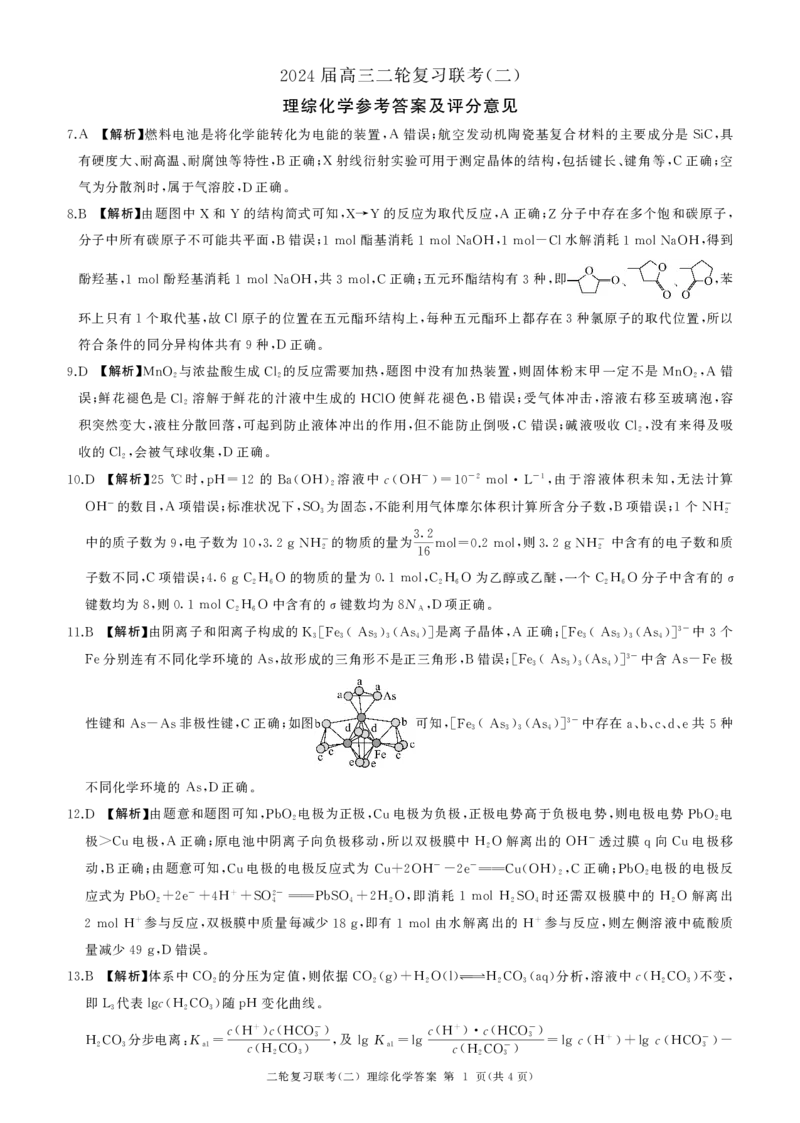
【解析】由阴离子和阳离子构成的 是离子晶体 正确 中 个
3-
11.B K3[Fe3(As3)3(As4)] ,A ;[Fe3(As3)3(As4)] 3
分别连有不同化学环境的 故形成的三角形不是正三角形 错误 中含 极
3-
Fe As, ,B ;[Fe3(As3)3(As4)] As-Fe
性键和 非极性键 正确 如图 可知 中存在 共 种
3-
As-As ,C ; ,[Fe3(As3)3(As4)] a、b、c、d、e 5
不同化学环境的 正确
As,D .
【解析】由题意和题图可知 电极为正极 电极为负极 正极电势高于负极电势 则电极电势 电
12.D ,PbO2 ,Cu , , PbO2
极 电极 正确 原电池中阴离子向负极移动 所以双极膜中 解离出的 透过膜 向 电极移
-
>Cu ,A ; , H2O OH q Cu
动 正确 由题意可知 电极的电极反应式为 正确 电极的电极反
- -
,B ; ,Cu Cu+2OH -2e Cu(OH)2,C ;PbO2
应式为 即消耗 时还需双极膜中的 解离出
- + 2-
PbO2+2e +4H +SO4 PbSO4+2H2O, 1molH2SO4 H2O
参与反应 双极膜中质量每减少 即有 由水解离出的 参与反应 则左侧溶液中硫酸质
+ +
2molH , 18g, 1mol H ,
量减少 错误
49g,D .
【解析】体系中 的分压为定值 则依据 分析 溶液中c 不变
13.B CO2 , CO2(g)+H2O(l)H2CO3(aq) , (H2CO3) ,
即 代表 c 随 变化曲线
L3 lg(H2CO3) pH .
c +c - c + c -
分步电离 K (H )(HCO3)及 K (H ) (HCO3) c + c -
H2CO3 : a1= c (H2CO3) , lg a1=lg c (H2CO3 - ) =lg (H )+lg (HCO3 )-
二轮复习联考 二 理综化学答案 第 页 共 页
( ) 1 ( 4 )
{#{QQABIYCQogAAAoBAABgCUQGwCgEQkACACIoGwEAMIAABSRFABAA=}#}c 则 c - c + c K c K 即
lg (H2CO3), lg (HCO3 )=-lg (H )+lg (H2CO3)+lg a1=pH+[lg (H2CO3)+lg a1],
c + c 2- c2 + c 2-
c - 随 变化曲线的斜率为 又因K (H ) (CO3 )所以K K (H ) (CO3 )
lg(HCO3) pH 1, a2= c (HCO3 - ) , a1 a2= c (H2CO3) ,
即 K K c + c 2- c 则 c 2- c + c
lg a1 a2=2lg (H )+lg (CO3 )-lg (H2CO3), lg (CO3 )=-2lg (H )+lg (H2CO3)+
K K c K K c 2- 随 变化曲线的斜率为 易判断 代表
lg a1 a2=2pH+[lg (H2CO3)+lg a1 a2],lg (CO3 ) pH 2, L1
c - 变化 代表 c 2- 变化 时 根据图像易判断c - c c 2-
lg (HCO3) ,L2 lg (CO3 ) .pH=7 , (HCO3 )> (H2CO3)> (CO3 ),
错误 时c - c K c + -64 时c - c 2- K
A ;pH=64 ,(HCO3 )= (H2CO3),a1= (H )=10 ,pH=103 ,(HCO3 )= (CO3 ), a2=
c + -103 时c - c 2+ -32 由K 可求c 2- -53 则K
(H )=10 .pH=82 ,(HCO3)= (M )=10 , a2 (CO3 )=10 , sp(MCO3)=
K
-53 -32 -85c 2- c 2+ -54 则K -54 -54 -108 则 sp(MCO3)
10 ×10 =10 ;(CO3 )= (N )=10 , sp(NCO3)=10 ×10 =10 ; K =
sp(NCO3)
2.3 正确p 不变 由 原子来源分析c 2+ c - c c 2- 不成立 错误
10 ,B ;(CO2) , C ,(M )= (HCO3 )+ (H2CO3)+ (CO3 ) ,C ;
c c 2- 时 1 K K 错误
(H2CO3)= (CO3 ) ,pH=- (lg a1+lg a2)=835,D .
2
分
27.(14 )
分
(1)PbSO4(1 )
硫酸浓度过高时 生成致密的难溶物包裹高砷烟尘 导致浸出率降低 分
(2) , , (1 )
分 分
2+ +
(3)3Zn +As2S3+6H2O3ZnS+2H3AsO3+6H (2 ) 15(1 )
分
+ 2-
(4)H3AsO4+H2O+SO2H3AsO3+2H +SO4 (2 )
升温至 一段时间 降温 分
(5) 90℃~95℃ , (1 )
分 分
2+ 3+ -
(6)Fe (1 ) In +3e In(1 )
23
分 9.72×10 分
(7)2CuCl2+5H2S+2InCl32CuInS2+S↓+10HCl(2 ) a2bd (2 )
【解析】 根据流程及信息 是最终产物 硫酸铁 硫酸锌是易溶的 则滤渣是难溶物
(1) ,In , 、 , PbSO4.
硫酸浓度过高时 生成致密的难溶物包裹高砷烟尘 导致浸出率降低
(2) , , .
根据流程判断产物还有 则离子方程式为 根据
2+ +
(3) ZnS, 3Zn +As2S3+6H2O3ZnS+2H3AsO3+6H ;
K -24 可求当溶液中c 2+ -6 -1 时c 2- -18 -1 则根据
sp(ZnS)=16×10 (Zn )=16×10 mol•L ,(S )=10 mol•L ,
K c2 +c 2- -22 求得c + -2 -1 已知
= (H )(S )=9×10 (H )=3×10 mol•L , lg3=05,pH=2-lg3=15
高压酸浸 时通入 在氧化性环境中生成 还原 时 将 氧化为 使酸性增
(4)“ ” O2, H3AsO4,“ ” H3AsO4 SO2 H2SO4,
强
+ 2-
:H3AsO4+H2O+SO2H3AsO3+2H +SO4
根据信息 在 易分解为 难溶于水 则操作为升温至 一段时
(5) H3AsO3 90℃~95℃ As2O3,As2O3 , 90℃~95℃
间 降温 再过滤可得
, , .
高压酸浸 时铁元素变为 还原 时 将 还原为 根据信息电解 溶液得金属铟
3+ 3+ 2+
(6)“ ” Fe ,“ ” SO2 Fe Fe ; In2(SO4)3 ,
则 在阴极放电
3+ 3+ -
In :In +3e In.
由题给晶胞结构利用均摊法计算可得硫化铟铜的化学式为 其中 为 价 为 价 故反应中
(7) CuInS2, Cu +1 ,S -2 ,
价 被还原 且部分 被氧化为 故化学方程式是
+2 Cu , H2S S, 2CuCl2+5H2S+2InCl3 2CuInS2+S↓+
个晶胞的体积V a2b 3 a2b -21 3 个晶胞的质量m 4(64+115+32×2)
10HCl.1 = nm = ×10 cm ,1 = N A g,
972
密度d
N Ag
故阿伏加德罗常数的值N 9.72×10
23
=a2b -21 3 , A = a2bd .
×10 cm
二轮复习联考 二 理综化学答案 第 页 共 页
( ) 2 ( 4 )
{#{QQABIYCQogAAAoBAABgCUQGwCgEQkACACIoGwEAMIAABSRFABAA=}#}分
28.(14 )
排净空气 分 关闭 分
(1) (2 ) K1(2 )
恒压分液漏斗 分 浓硫酸 分 吸收尾气 分
(2) (2 ) (2 ) NO(2 )
V
2- 2+ + 3+ 3+
分 16.4(5-3 ) 分
(3)Cr2O7 +6Fe +14H 2Cr +6Fe +7H2O(2 ) 1- m %(2 )
3
【解析】 利用 制备 易被空气中氧气氧化 故先通入氮气排净空气 制备 前需关闭
(1) NO Ca(NO2)2,NO , ; NO K1.
仪器 是恒压分液漏斗 防止水分进入 中盛有浓硫酸 酸性 溶液能将 氧化为 作用是
-
(2) a ; ,D ; K2Cr2O7 NO NO3 ,
吸收尾气
NO.
将 氧化为 本身被还原为 还原 时加入硫酸 溶液呈酸性 故离子方程式为
2- 2+ 3+ 3+ -
(3)Cr2O7 Fe Fe , Cr ,“ NO3 ” , ,
2- 2+ + 3+ 3+
Cr2O7 +6Fe +14H 2Cr +6Fe +7H2O;
根据 2- 2+ 可求剩余n 2+ V -3 V -4
Cr2O7 ~6Fe , (Fe )=01× ×10 ×6=6 ×10 mol,
则还原 - 消耗的n 2+ -3 V -4 V -4
NO3 (Fe )=(01×10×10 -6 ×10 )mol=(10-6 )×10 mol
则依据 - 2+ 可求 溶液中n - 1 V -4
NO3 ~3Fe , 25mL (NO3)= (10-6 )×10 mol,
3
V -4 V -3
即m 样品中n 1 (10-6 )×10 (5-3 )×10
g [Ca(NO3)2]= × ×10mol= mol
2 3 3
V -3 V
即 的纯度为 (5-3 )×10 ×164 (5-3 )×16.4
Ca(NO2)2 1- m ×100%=1- m %.
3 3
分
29.(15 )
分
(1)-2061(2 )
甲 分 降低温度或增大压强 分
(2)① (2 ) (3 )
分 分
②032(2 ) 04(2 )
分 分
(3)6(2 ) CO2+3H2CH3OH+H2O(2 )
【解析】 根据燃烧热定义 求得反应 的焓变
(1) , CO(g)+3H2(g)CH4(g)+H2O(l)
H -1 -1 -1 -1
Δ =-2830kJmol +(-2858kJmol ×3)-(-8903kJmol )=-2501kJmol ,
根据 转变为 放热
1molH2O(g) 1molH2O(l) 440kJ,
求得反应 H -1 -1 -1
CO(g)+3H2(g)CH4(g)+H2O(g) Δ 1=(-2501kJmol +44kJmol )=-2061kJmol ,
n n
随 (H2)增大 的转化率一直变大 即曲线乙表示 转化率 当 (H2)增大时 根据反应 分析
(2)① n ,CO , CO ;n , ⅰ、ⅲ ,
(CO) (CO)
n
选择性变大 当 (H2)足够大时 选择性基本不变 故曲线甲代表 选择性 选择性曲线甲由
CH4 ,n ,CH4 , CH4 ;CH4 B
(CO)
点到 点 即选择性变大 依据燃烧热可求
A , ,
H -1 H -1
Δ 2=-412kJmol ,Δ 3=-164.9kJmol ,
温度对反应 影响更大 降温利于 生成 加压对生成的 无影响 而有利于生成 故条件为降温
ⅰ、ⅲ , CH4 ; CO2 , CH4,
或加压
;
n
根据图像 (H2) 时 平衡时 转化率为 选择性为 则平衡时
② ,n =3 , CO 40%,CH4 90%, :
(CO)
n n n
(CO)=06mol,(CH4)=04×09=036mol,(CO2)=04×01=004mol,
根据氧原子守恒可得n
(H2O)=1×0.4mol-0.04×2mol=0.32mol;
根据氢原子守恒可得n
(H2)=3mol-0.32mol-0.36×2mol=1.96mol
二轮复习联考 二 理综化学答案 第 页 共 页
( ) 3 ( 4 )
{#{QQABIYCQogAAAoBAABgCUQGwCgEQkACACIoGwEAMIAABSRFABAA=}#}气体总物质的量为
06mol+036mol+004mol+196mol+032mol=328mol;
恒温恒容下 气体的压强之比等于物质的量之比 则平衡时压强为3.28 反应 的
, , ×10Mpa=8.2Mpa; ⅱ
4
0.04 1.96
p p ×8.2× ×8.2
K CO2 H2 3.28 3.28
p=p p = =0.4.
CO H2O 0.6 0.32
×8.2× ×8.2
3.28 3.28
根据循环图易判断中间体为 种 根据循环图 催化加氢制甲醇 产物有 故总反应的化学方程式
(3) 6 ; ,CO2 , H2O,
为
CO2+3H2CH3OH+H2O
分
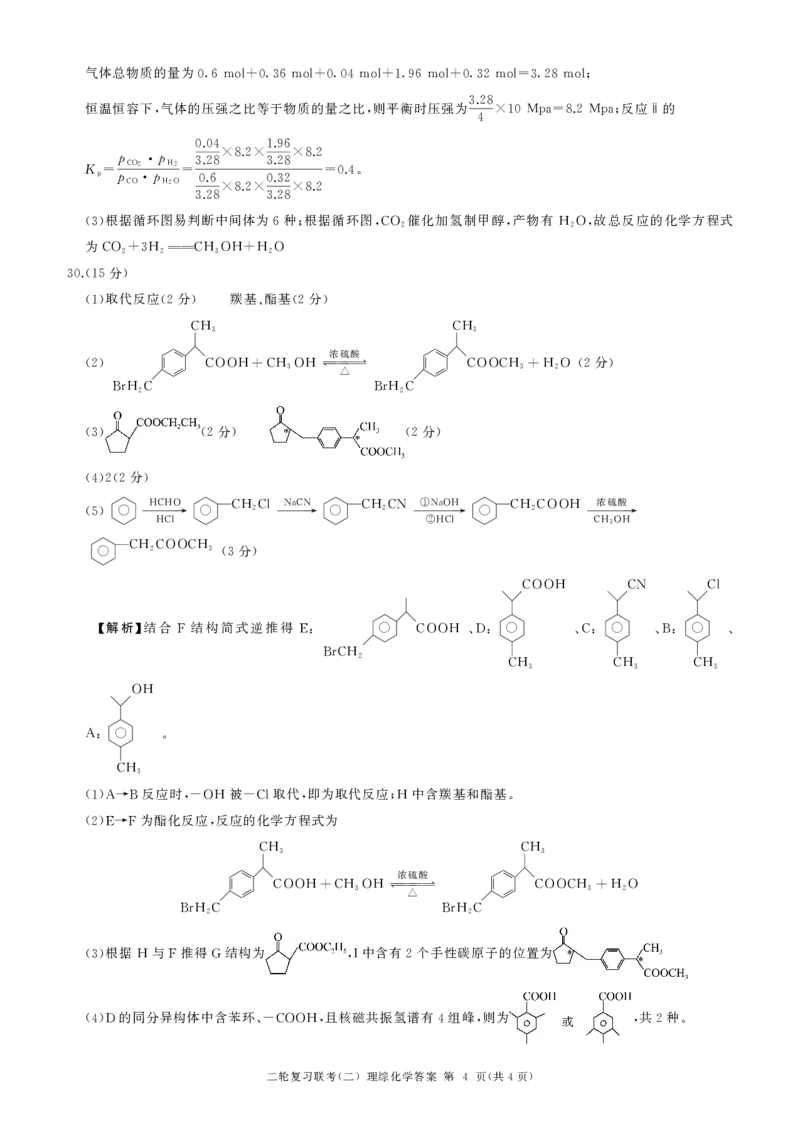
30.(15 )
取代反应 分 羰基 酯基 分
(1) (2 ) 、 (2 )
(2)
二轮复习联考 二 理综化学答案 第 页 共 页
( ) 4 ( 4 )
CH3
浓硫酸
COOH+CH3OH
△
BrH2C
CH3
分
COOCH3+H2O (2 )
BrH2C
分 分
(3) (2 ) (2 )
分
(4)2(2 )
浓硫酸
HCHO CH2Cl NaCN CH2CN ①NaOH CH2COOH
(5) → → → →
HCl ②HCl CH3OH
分
CH2COOCH3
(3 )
COOH CN Cl
【解析】结合 结构简式逆推得
F E: COOH 、D: 、C: 、B: 、
BrCH2
CH3 CH3 CH3
OH
A: .
CH3
反应时 被 取代 即为取代反应 中含羰基和酯基
(1)A→B ,-OH -Cl , ;H .
为酯化反应 反应的化学方程式为
(2)E→F ,
CH3
浓硫酸
COOH+CH3OH
△
BrH2C
CH3
COOCH3+H2O
BrH2C
根据 与 推得 结构为 中含有 个手性碳原子的位置为
(3) H F G ,I 2
的同分异构体中含苯环 且核磁共振氢谱有 组峰 则为 共 种
(4)D 、-COOH, 4 , , 2 .
{#{QQABIYCQogAAAoBAABgCUQGwCgEQkACACIoGwEAMIAABSRFABAA=}#}