文档内容
宁波市 2023 学年第二学期期末考试
高二化学试卷
考生须知:
1.本卷试题分为选择题和非选择题两部分,共8页,满分100分,考试时间90分钟。
2.本卷答题时不得使用计算器,不得使用修正液(涂改液)、修正带。
3.答题时将答案均填在答卷相应题号的位置,不按要求答题无效。
4.可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Si 28 Cl 35.5 K 39
Mn 55
选择题部分
一、选择题(本大题共14小题,每小题2分,共28分。每小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分。)
1.下列物质不属于合成高分子材料的是( )
A.石墨烯 B.顺丁橡胶 C.涤纶 D.酚醛树脂
2.下列物质属于弱电解质的是( )
A.KOH B. C. D.
3.下列物质对应的水溶液因水解而呈酸性的是( )
A. B. C. D.
4.下列说法正确的是( )
A.基态 价层电子的轨道表示式:
B. 的名称:2-乙基丁烷
C. 的VSEPR模型:
D. 的电子式:
5.下列各组比较不正确的是( )
A.丙烯中键长: B.键角:
C.沸点: D.水中溶解度:
6.工业上电解熔融 和冰晶石( )的混合物可制得铝。下列说法正确的是( )
学科网(北京)股份有限公司A.O、F、Na、Al四种元素都位于p区 B. 属于分子晶体
C. 中的配位体是F D.离子半径:
7.下列有机反应中, 键没有发生断裂的是( )
A.溴乙烷与NaOH溶液混合加热 B.乙醇与浓硫酸共热至170℃
C.甲苯硝化生成TNT D.光照下三氯甲烷与氯气反应
8.下列说法不正确的是( )
A.可用浓溴水鉴别乙酸、乙醛、苯酚三种溶液
B.攀登高山时需要防晒护目,是为了防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤
C.核酸是由多种氨基酸通过肽键形成的一类生物大分子
D.聚丙烯酸钠( )中含有强亲水基团,可作高吸水性树脂
9.下列关于热化学反应的描述正确的是( )
A. ,则含1mol 的溶液与含1mol
NaOH的稀溶液混合,放出热量为57.3kJ
B . 甲 烷 的 燃 烧 热 , 则
C.500℃、30MPa下, ,将1.5mol 和过量的
在此条件下充分反应,放出热量46.2kJ
D.同温同压下, 在光照或点燃条件下的 的数值相同
10.下列化学用语不正确的是( )
A.碳酸氢钠水解的离子方程式:
B.合成聚对苯二甲酸乙二酯的化学方程式:
C.向氯化银悬浊液中加入氨水的化学方程式:
学科网(北京)股份有限公司D.向乙酰胺中加入盐酸并加热的离子方程式:
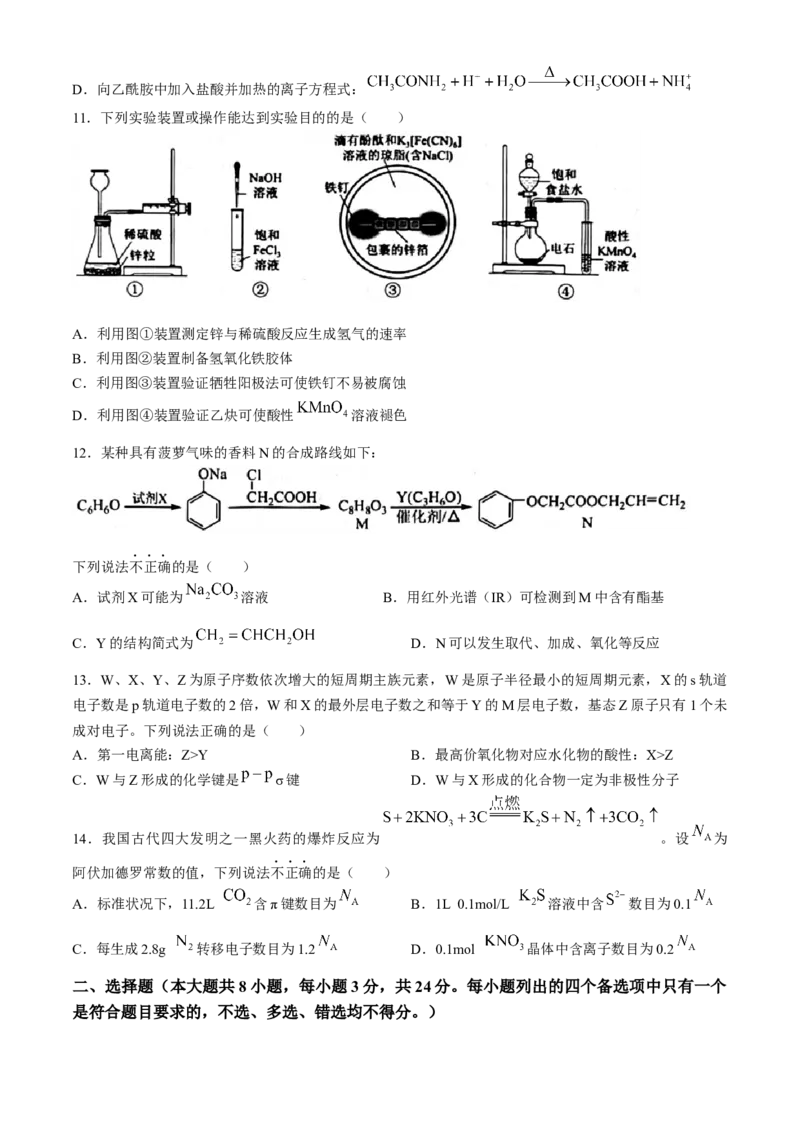
11.下列实验装置或操作能达到实验目的的是( )
A.利用图①装置测定锌与稀硫酸反应生成氢气的速率
B.利用图②装置制备氢氧化铁胶体
C.利用图③装置验证牺牲阳极法可使铁钉不易被腐蚀
D.利用图④装置验证乙炔可使酸性 溶液褪色
12.某种具有菠萝气味的香料N的合成路线如下:
下列说法不正确的是( )
A.试剂X可能为 溶液 B.用红外光谱(IR)可检测到M中含有酯基
C.Y的结构简式为 D.N可以发生取代、加成、氧化等反应
13.W、X、Y、Z为原子序数依次增大的短周期主族元素,W是原子半径最小的短周期元素,X的s轨道
电子数是p轨道电子数的2倍,W和X的最外层电子数之和等于Y的M层电子数,基态Z原子只有1个未
成对电子。下列说法正确的是( )
A.第一电离能:Z>Y B.最高价氧化物对应水化物的酸性:X>Z
C.W与Z形成的化学键是 σ键 D.W与X形成的化合物一定为非极性分子
14.我国古代四大发明之一黑火药的爆炸反应为 。设 为
阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,11.2L 含π键数目为 B.1L 0.1mol/L 溶液中含 数目为0.1
C.每生成2.8g 转移电子数目为1.2 D.0.1mol 晶体中含离子数目为0.2
二、选择题(本大题共8小题,每小题3分,共24分。每小题列出的四个备选项中只有一个
是符合题目要求的,不选、多选、错选均不得分。)
学科网(北京)股份有限公司15.下列说法正确的是( )
A.将1mL pH=3的盐酸和醋酸分别稀释100倍后,醋酸的pH大于盐酸
B.中和等体积、等pH的盐酸和醋酸,醋酸所需NaOH的物质的量多于盐酸
C.25℃时,向醋酸溶液中加入一定量的盐酸, 的电离常数减小
D.分别向等体积、等物质的量浓度的盐酸和醋酸中滴加 NaOH浴液至溶液呈中性,反应后的溶液中
16.乙醛与苯甲醛反应机理如下图所示:
下列说法不正确的是( )
A.此反应可用氢氧化钠作催化剂 B . 反 应 产 物 中 可 能 含 有 副 产 物
C.反应过程中包含了加成反应和消去反应 D. 存在2个手性碳原子
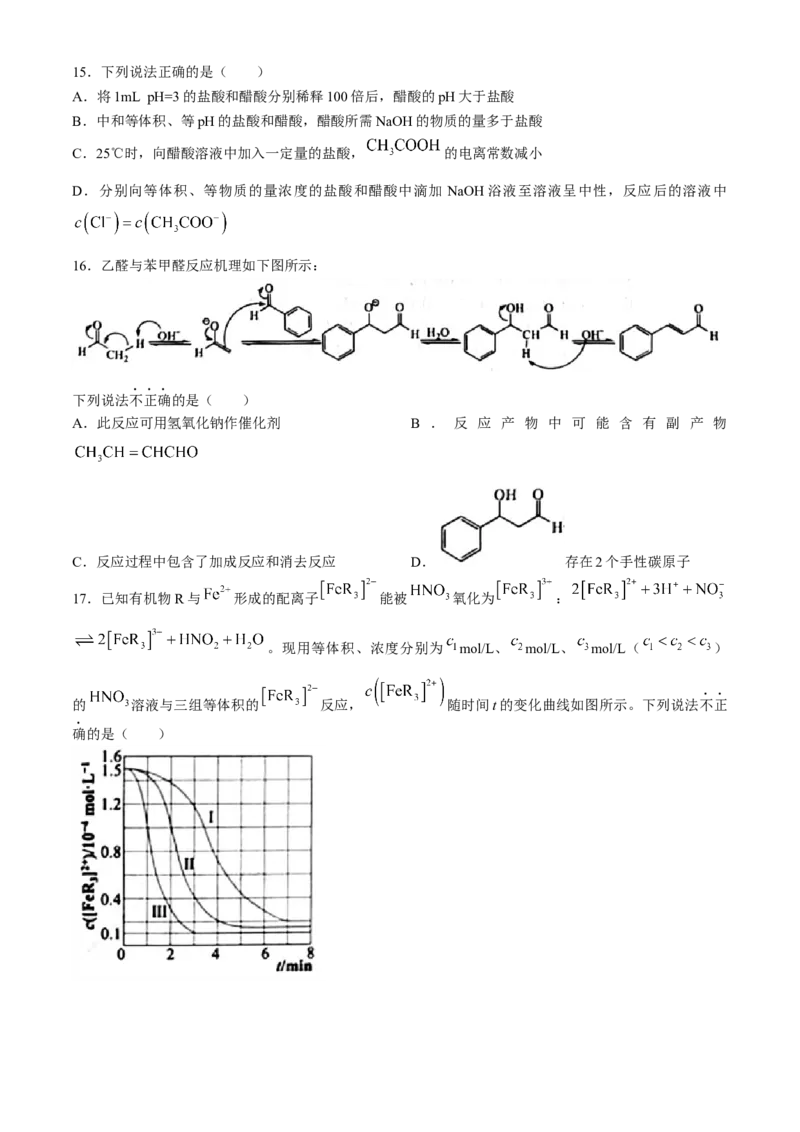
17.已知有机物R与 形成的配离子 能被 氧化为 :
。现用等体积、浓度分别为 mol/L、 mol/L、 mol/L( )
的 溶液与三组等体积的 反应, 随时间t的变化曲线如图所示。下列说法不正
确的是( )
学科网(北京)股份有限公司A.曲线Ⅰ对应的 溶液浓度为 mol/L
B.硝酸浓度为 mol/L时,0~2min内, mol/(L·min)
C.平衡后加水稀释, 减小
D.三组实验中的反应速率都是先增大后减小
18.科学家正在研究--种可植入体内的燃料电池,它可以将人体内多余的葡萄糖转化为葡萄糖酸(
)。该葡萄糖燃料电池以Pt作为两极,其工作原理如图所示。下列说法不正确的是( )
A.此电池可用于糖尿病患者,能降低其体内血糖
B.若有1.92g氧气参与电池反应,则可消耗葡萄糖1.80g
C.电极A上发生还原反应
D.负极的电极反应为:
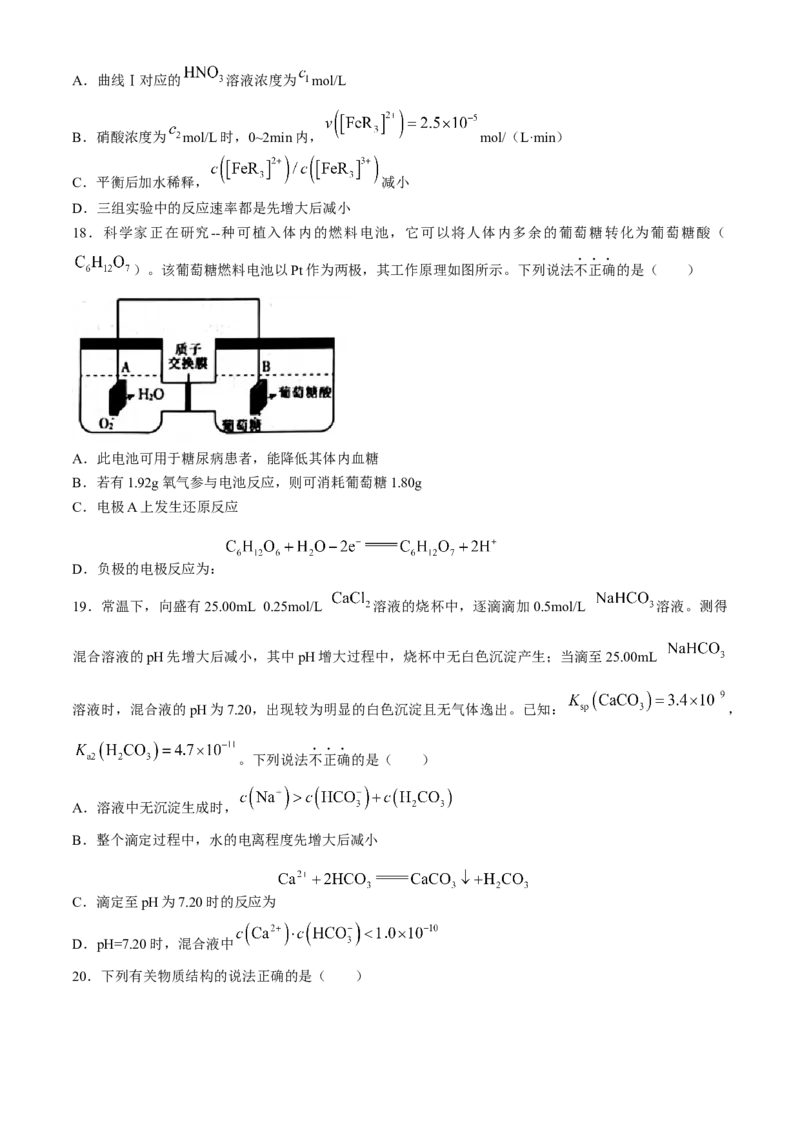
19.常温下,向盛有25.00mL 0.25mol/L 溶液的烧杯中,逐滴滴加0.5mol/L 溶液。测得
混合溶液的pH先增大后减小,其中pH增大过程中,烧杯中无白色沉淀产生;当滴至25.00mL
溶液时,混合液的pH为7.20,出现较为明显的白色沉淀且无气体逸出。已知: ,
。下列说法不正确的是( )
A.溶液中无沉淀生成时,
B.整个滴定过程中,水的电离程度先增大后减小
C.滴定至pH为7.20时的反应为
D.pH=7.20时,混合液中
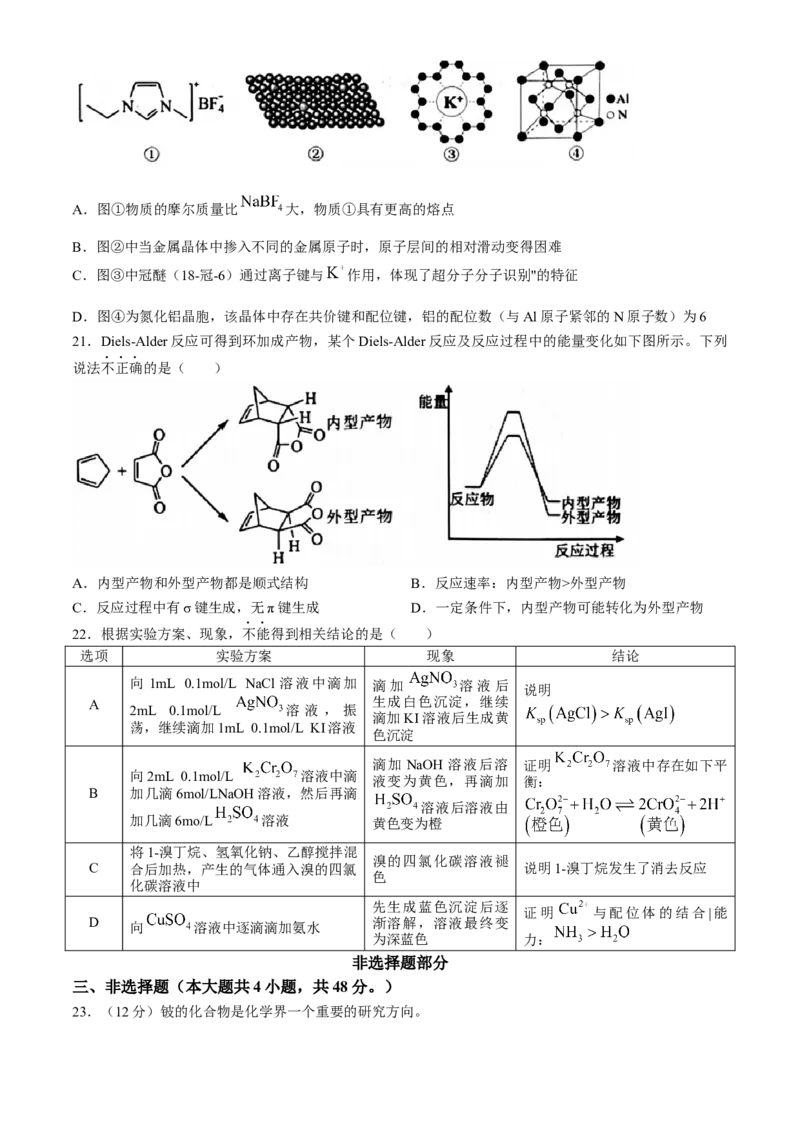
20.下列有关物质结构的说法正确的是( )
学科网(北京)股份有限公司A.图①物质的摩尔质量比 大,物质①具有更高的熔点
B.图②中当金属晶体中掺入不同的金属原子时,原子层间的相对滑动变得困难
C.图③中冠醚(18-冠-6)通过离子键与 作用,体现了超分子分子识别"的特征
D.图④为氮化铝晶胞,该晶体中存在共价键和配位键,铝的配位数(与Al原子紧邻的N原子数)为6
21.Diels-Alder反应可得到环加成产物,某个Diels-Alder反应及反应过程中的能量变化如下图所示。下列
说法不正确的是( )
A.内型产物和外型产物都是顺式结构 B.反应速率:内型产物>外型产物
C.反应过程中有σ键生成,无π键生成 D.一定条件下,内型产物可能转化为外型产物
22.根据实验方案、现象,不能得到相关结论的是( )
选项 实验方案 现象 结论
向 1mL 0.1mol/L NaCl 溶液中滴加 滴加 溶液后
说明
A 生成白色沉淀,继续
2mL 0.1mol/L 溶 液 , 振
滴加KI溶液后生成黄
荡,继续滴加1mL 0.1mol/L KI溶液
色沉淀
滴加 NaOH 溶液后溶 证明 溶液中存在如下平
向2mL 0.1mol/L 溶液中滴
液变为黄色,再滴加 衡:
B 加几滴6mol/LNaOH溶液,然后再滴
溶液后溶液由
加几滴6mo/L 溶液 黄色变为橙
将1-溴丁烷、氢氧化钠、乙醇搅拌混
溴的四氯化碳溶液褪
C 合后加热,产生的气体通入溴的四氯 说明1-溴丁烷发生了消去反应
色
化碳溶液中
先生成蓝色沉淀后逐
证明 与配位体的结合|能
D 渐溶解,溶液最终变
向 溶液中逐滴滴加氨水
为深蓝色 力:
非选择题部分
三、非选择题(本大题共4小题,共48分。)
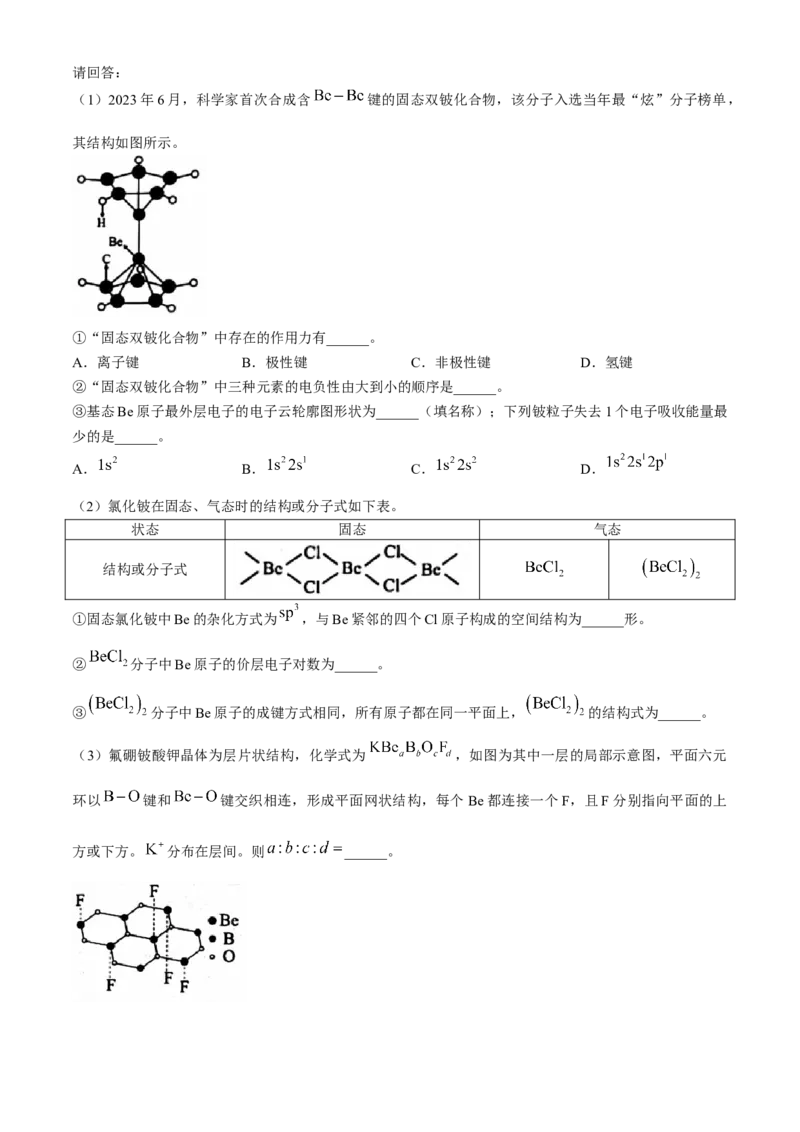
23.(12分)铍的化合物是化学界一个重要的研究方向。
学科网(北京)股份有限公司请回答:
(1)2023年6月,科学家首次合成含 键的固态双铍化合物,该分子入选当年最“炫”分子榜单,
其结构如图所示。
①“固态双铍化合物”中存在的作用力有______。
A.离子键 B.极性键 C.非极性键 D.氢键
②“固态双铍化合物”中三种元素的电负性由大到小的顺序是______。
③基态Be原子最外层电子的电子云轮廓图形状为______(填名称);下列铍粒子失去1个电子吸收能量最
少的是______。
A. B. C. D.
(2)氯化铍在固态、气态时的结构或分子式如下表。
状态 固态 气态
结构或分子式
①固态氯化铍中Be的杂化方式为 ,与Be紧邻的四个Cl原子构成的空间结构为______形。
② 分子中Be原子的价层电子对数为______。
③ 分子中Be原子的成键方式相同,所有原子都在同一平面上, 的结构式为______。
(3)氟硼铍酸钾晶体为层片状结构,化学式为 ,如图为其中一层的局部示意图,平面六元
环以 键和 键交织相连,形成平面网状结构,每个Be都连接一个F,且F分别指向平面的上
方或下方。 分布在层间。则 ______。
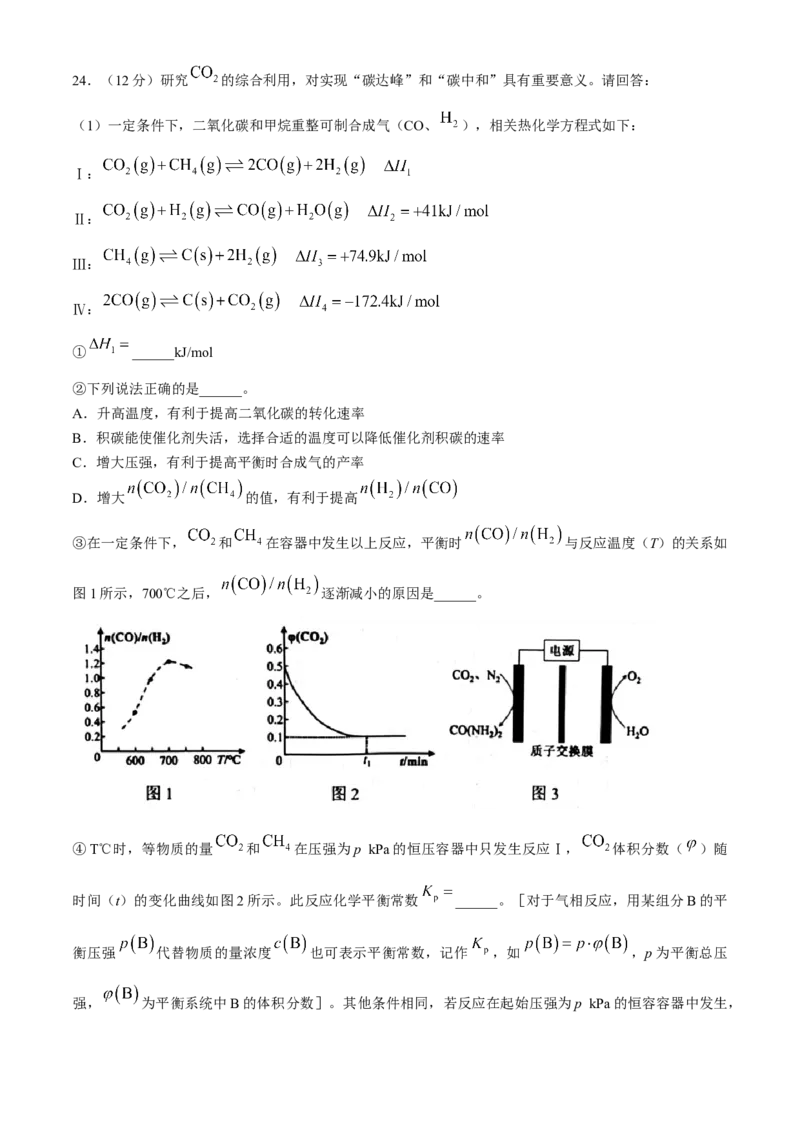
学科网(北京)股份有限公司24.(12分)研究 的综合利用,对实现“碳达峰”和“碳中和”具有重要意义。请回答:
(1)一定条件下,二氧化碳和甲烷重整可制合成气(CO、 ),相关热化学方程式如下:
Ⅰ:
Ⅱ:
Ⅲ:
Ⅳ:
① ______kJ/mol
②下列说法正确的是______。
A.升高温度,有利于提高二氧化碳的转化速率
B.积碳能使催化剂失活,选择合适的温度可以降低催化剂积碳的速率
C.增大压强,有利于提高平衡时合成气的产率
D.增大 的值,有利于提高
③在一定条件下, 和 在容器中发生以上反应,平衡时 与反应温度(T)的关系如
图1所示,700℃之后, 逐渐减小的原因是______。
④T℃时,等物质的量 和 在压强为p kPa的恒压容器中只发生反应Ⅰ, 体积分数( )随
时间(t)的变化曲线如图2所示。此反应化学平衡常数 ______。[对于气相反应,用某组分B的平
衡压强 代替物质的量浓度 也可表示平衡常数,记作 ,如 ,p为平衡总压
强, 为平衡系统中B的体积分数]。其他条件相同,若反应在起始压强为p kPa的恒容容器中发生,
学科网(北京)股份有限公司请在图2中画出 体积分数(q)随时间()的变化曲线______(只作定性描述,无需计算平衡时
体积分数)。
(2)研究表明,利用电催化技术,在常温下可以将 和 转化为尿素,电解原理如图3所示,阴极的
电极反应式是______。
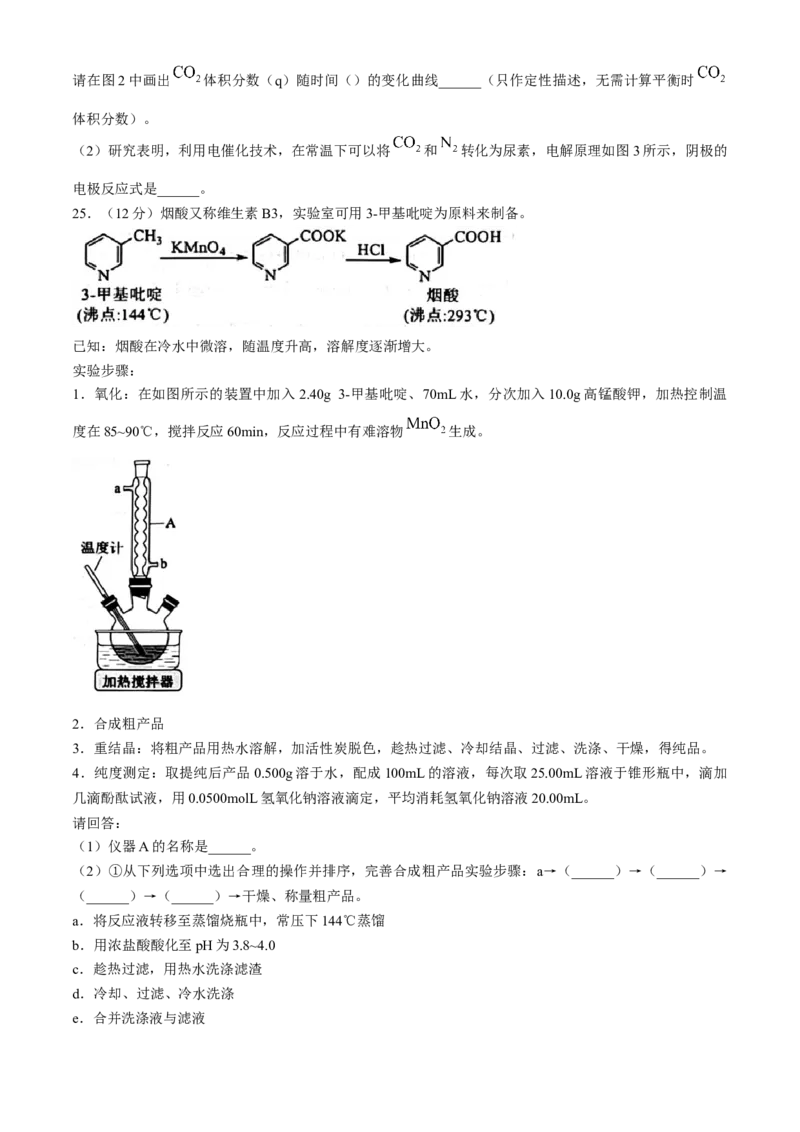
25.(12分)烟酸又称维生素B3,实验室可用3-甲基吡啶为原料来制备。
已知:烟酸在冷水中微溶,随温度升高,溶解度逐渐增大。
实验步骤:
1.氧化:在如图所示的装置中加入2.40g 3-甲基吡啶、70mL水,分次加入10.0g高锰酸钾,加热控制温
度在85~90℃,搅拌反应60min,反应过程中有难溶物 生成。
2.合成粗产品
3.重结晶:将粗产品用热水溶解,加活性炭脱色,趁热过滤、冷却结晶、过滤、洗涤、干燥,得纯品。
4.纯度测定:取提纯后产品0.500g溶于水,配成100mL的溶液,每次取25.00mL溶液于锥形瓶中,滴加
几滴酚酞试液,用0.0500molL氢氧化钠溶液滴定,平均消耗氢氧化钠溶液20.00mL。
请回答:
(1)仪器A的名称是______。
(2)①从下列选项中选出合理的操作并排序,完善合成粗产品实验步骤:a→(______)→(______)→
(______)→(______)→干燥、称量粗产品。
a.将反应液转移至蒸馏烧瓶中,常压下144℃蒸馏
b.用浓盐酸酸化至pH为3.8~4.0
c.趁热过滤,用热水洗涤滤渣
d.冷却、过滤、冷水洗涤
e.合并洗涤液与滤液
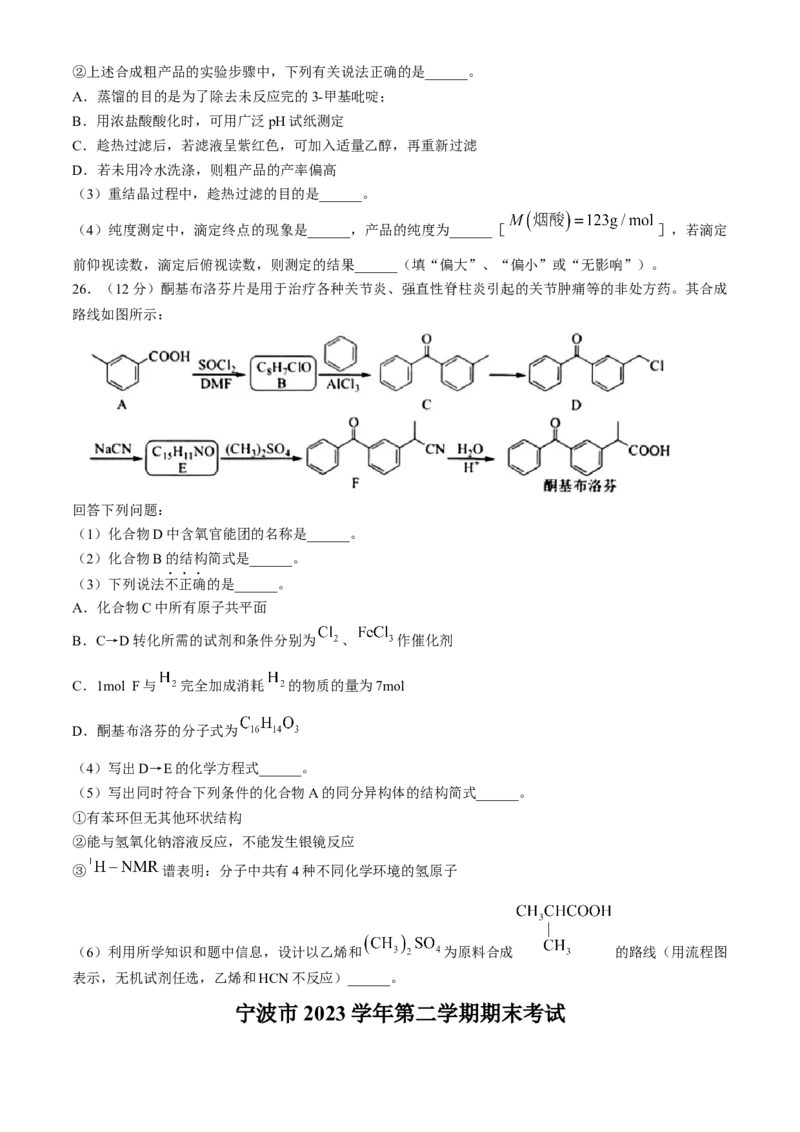
学科网(北京)股份有限公司②上述合成粗产品的实验步骤中,下列有关说法正确的是______。
A.蒸馏的目的是为了除去未反应完的3-甲基吡啶;
B.用浓盐酸酸化时,可用广泛pH试纸测定
C.趁热过滤后,若滤液呈紫红色,可加入适量乙醇,再重新过滤
D.若未用冷水洗涤,则粗产品的产率偏高
(3)重结晶过程中,趁热过滤的目的是______。
(4)纯度测定中,滴定终点的现象是______,产品的纯度为______[ ],若滴定
前仰视读数,滴定后俯视读数,则测定的结果______(填“偏大”、“偏小”或“无影响”)。
26.(12分)酮基布洛芬片是用于治疗各种关节炎、强直性脊柱炎引起的关节肿痛等的非处方药。其合成
路线如图所示:
回答下列问题:
(1)化合物D中含氧官能团的名称是______。
(2)化合物B的结构简式是______。
(3)下列说法不正确的是______。
A.化合物C中所有原子共平面
B.C→D转化所需的试剂和条件分别为 、 作催化剂
C.1mol F与 完全加成消耗 的物质的量为7mol
D.酮基布洛芬的分子式为
(4)写出D→E的化学方程式______。
(5)写出同时符合下列条件的化合物A的同分异构体的结构简式______。
①有苯环但无其他环状结构
②能与氢氧化钠溶液反应,不能发生银镜反应
③ 谱表明:分子中共有4种不同化学环境的氢原子
(6)利用所学知识和题中信息,设计以乙烯和 为原料合成 的路线(用流程图
表示,无机试剂任选,乙烯和HCN不反应)______。
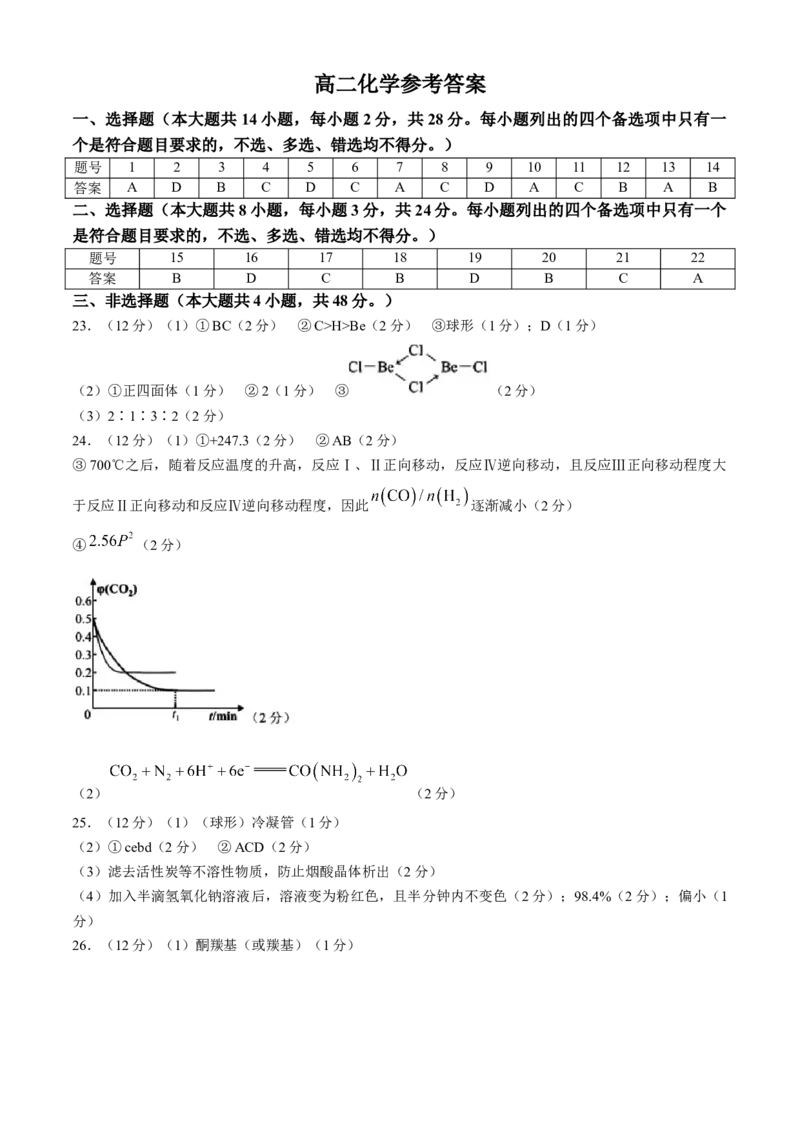
宁波市 2023 学年第二学期期末考试
学科网(北京)股份有限公司高二化学参考答案
一、选择题(本大题共 14小题,每小题2分,共28分。每小题列出的四个备选项中只有一
个是符合题目要求的,不选、多选、错选均不得分。)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 A D B C D C A C D A C B A B
二、选择题(本大题共8小题,每小题3分,共24分。每小题列出的四个备选项中只有一个
是符合题目要求的,不选、多选、错选均不得分。)
题号 15 16 17 18 19 20 21 22
答案 B D C B D B C A
三、非选择题(本大题共4小题,共48分。)
23.(12分)(1)①BC(2分) ②C>H>Be(2分) ③球形(1分);D(1分)
(2)①正四面体(1分) ②2(1分) ③ (2分)
(3)2∶1∶3∶2(2分)
24.(12分)(1)①+247.3(2分) ②AB(2分)
③700℃之后,随着反应温度的升高,反应Ⅰ、Ⅱ正向移动,反应Ⅳ逆向移动,且反应Ⅲ正向移动程度大
于反应Ⅱ正向移动和反应Ⅳ逆向移动程度,因此 逐渐减小(2分)
④ (2分)
(2) (2分)
25.(12分)(1)(球形)冷凝管(1分)
(2)①cebd(2分) ②ACD(2分)
(3)滤去活性炭等不溶性物质,防止烟酸晶体析出(2分)
(4)加入半滴氢氧化钠溶液后,溶液变为粉红色,且半分钟内不变色(2分);98.4%(2分);偏小(1
分)
26.(12分)(1)酮羰基(或羰基)(1分)
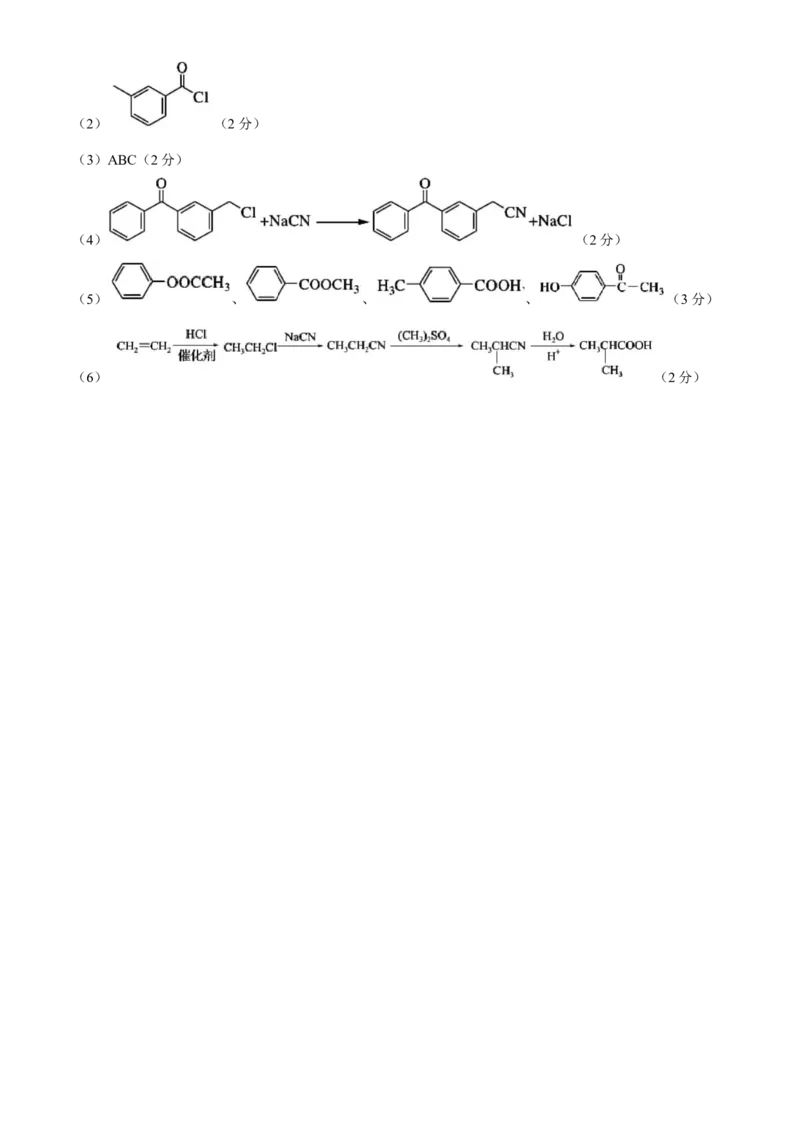
学科网(北京)股份有限公司(2) (2分)
(3)ABC(2分)
(4) (2分)
(5) 、 、 、 (3分)
(6) (2分)
学科网(北京)股份有限公司