文档内容
第五章 化工生产中的重要非金属元素
第2节 氮及其化合物
(第2课时 氨和铵盐)
一、选择题
1.在NO 与水的反应中( )
2
A.氮元素的化合价不发生变化 B.NO 只是氧化剂
2
C.NO 只是还原剂 D.NO 既是氧化剂又是还原剂
2 2
【答案】D
【详解】
NO 和水反应的方程式为3NO+HO=2HNO+NO,在反应中2mol被氧化生成2mol硝酸,
2 2 2 3
1mo被还原,生成NO,即NO 既是氧化剂,又是还原剂。答案选D。
2
2.用下面实验方案进行离子检验,方案设计不严密的是
A.检验试液中的 :试液 无色无味气体 先变浑浊后澄清
B.检验试液中的 :试液 无沉淀 白色沉淀
C.检验试液中的 :试液 火焰颜色为黄色
D.检验试液中的 :试液 刺激性气味气体 试纸变蓝
色
【答案】A
【详解】
A.试液中加入稀盐酸有无色无味气体生成,可能是CO ,也可能是HCO ,A符合题意;
B.在SO 的检验过程中,试液中加入稀盐酸无沉淀生成,排除CO 、SO 、Ag+等的存
在,再加入BaCl 溶液,有沉淀生成,确定有SO ,B不符合题意;
2
C. 元素的焰色为黄色,C不符合题意;
D.能使湿润的红色试纸变蓝的气体一定是碱性气体,能与OH-反应生成碱性气体的只能是
学科网(北京)股份有限公司NH ,D不符合题意;
故选A。
3.下列说法正确的是
A.浓硫酸具有强氧化性,常温下可与铁单质剧烈反应
B.SO 能杀菌消毒防腐,常用作食品添加剂
2
C.氨气因有刺激性气味,因此不用来作制冷剂
D.所有铵盐受热均可以分解,产物均有NH
3
【答案】B
【详解】
A.浓硫酸具有强氧化性,常温下可将铁表面氧化产生一层致密的氧化物保护膜,阻止金
属进一步氧化,即发生钝化现象,因而不能与铁单质剧烈反应,A错误;
B.SO 能够使细菌、病毒的蛋白质变性而失去其生理活性,故能杀菌消毒防腐,因此只要
2
SO 气体的使用量在合适的范围,可以用作食品添加剂,B正确;
2
C.氨气易液化,液氨气化时会从周围环境中吸收大量的热量,导致环境温度降低,故液
氨常用作制冷剂,C错误;
D.所有铵盐都不稳定,受热均可以分解,但分解产物不一定都有NH 产生,如NH NO
3 4 3
NO↑+2H O,反应产物无NH 生成,D错误;
2 2 3
故合理选项是B。
4.将导出的氨气接近下列物质时,不会产生白烟的是
A.氯气 B.浓 HSO C.浓 HCl D.浓 HNO
2 4 3
【答案】B
【详解】
A.氯气能与氨气反应生成N 和NH Cl,能产生白烟,故A正确;
2 4
B.浓硫酸无挥发性,氨气靠近浓硫酸不可能产生白烟,故B错误;
C.浓 HCl挥发出的HCl气体遇氨气生成NH Cl,能产生白烟,故C正确;
4
D.浓 HNO 挥发出的HNO 遇氨气生成NH NO ,能产生白烟,故D正确;
3 3 4 3
故答案为B。
5.下列有关NH 两个实验说法中正确的是
3
学科网(北京)股份有限公司A.两个实验均表现了NH 易溶于水 B.两个实验均表现了NH 易挥发
3 3
C.两个实验均表现了NH 是碱性气体 D.两个实验均表现了NH 是还原性气体
3 3
【答案】C
【详解】
A.实验一体现了NH 易溶于水和氨气的水溶液呈碱性,实验二体现了氨气的挥发性而没
3
有体现氨气易溶于水的性质,故A错误;
B.实验一体现了NH 易溶于水,没有体现氨气的挥发性,故B错误;
3
C.实验一证明氨气极易溶于水,溶于水形成一水合氨弱碱溶液,滴加酚酞的溶液变红色,
证明氨气是碱性气体;实验二证明浓氨水易挥发,氨气遇到氯化氢发生反应生成氯化铵,
证明氨气是碱性气体,所以两个实验均表现了NH 是碱性气体,故C正确;
3
D.两个实验中都未发生氧化还原反应,没有体现氨气的还原性,故D错误。
故选C。
6.下列关于铵盐的叙述中正确的是
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐都是离子化合物
⑤铵盐都能与碱反应,不能与酸反应
A.①③④ B.②③④
C.①②③④ D.①②③④⑤
【答案】B
【详解】
①所有铵盐中,氮元素化合价不一定都是-3价,如NHNO 中,N的化合价除了-3,还有
4 3
+5,①错;
②所有铵盐都溶于水,②对;
③NH +会和OH-结合生成NH ·HO,一水合氨不稳定,易分解生成NH ,降低肥效,③
4 3 2 3
学科网(北京)股份有限公司对;
④铵盐,一般由铵根离子和酸根阴离子构成,含有离子键,是离子化合物,④对;
⑤铵盐中的NH +,可以与OH-结合,因此都可以与碱反应,但是某些铵盐也可以与酸反
4
应,如NH HCO ,可与酸反应,⑤错;
4 3
综上②③④对,答案选B。
7.为检验一种氮肥的成分,某学习小组同学进行了以下实验:①加热氮肥样品生成气体,
其中一种气体能使湿润的红色石蕊试纸变蓝,另一种无色无味气体能使澄清石灰水变浑浊。
②取少量该氮肥样品溶于水,并加入少量BaCl 溶液,没有明显变化。由此可知该氮肥的
2
主要成分是
A.NH HCO B.NH Cl C.(NH)CO D.NH NO
4 3 4 4 2 3 4 3
【答案】A
【详解】
气体能使湿润的红色石蕊试纸变蓝,说明该气体是氨气,即该氮肥中含有 ;另一种气
体能使澄清石灰水变浑浊,说明该气体是CO;说明该氮肥中含有 或 ,取少量
2
该氮肥样品溶于水,并加入少量氯化钡溶液,没有明显变化,说明该氮肥中没有 ,因
此该氮肥应该是碳酸氢铵, A正确。
故选A。
8.针对如图所示的实验室制取氨气,下列说法正确的是
A.发生装置与用 KClO 制取O 的装置相同
3 2
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐不能是 NH NO ,所用的碱可以是 NaOH
4 3
【答案】A
学科网(北京)股份有限公司【解析】
A.实验室制取氧气,可以用加热氯酸钾或高锰酸钾的方法,要使用加热固体反应物的装
置,实验室制取氨气也是氯化铵晶体与氢氧化钙固体反应,需要加热,二者气体制取实验
装置相同,故A正确;
B.氨气是碱性气体,可以用碱石灰干燥,但无水氯化钙可与氨气反应,不能用于干燥氨
气,故B错误;
C.用单孔橡皮塞代替棉花,导致试管内密封,无法收集氨气,故C错误;
D.NH NO 属于硝酸盐,不稳定受热易分解产生氮氧化物,使制取的气体不纯,NaOH是
4 3
强碱,可与玻璃中的二氧化硅反应,腐蚀实验装置,故D错误;
答案选A。
9.关于氨的喷泉实验形成的原理解释正确的是
A.氨水呈碱性 B.氨气极易溶于水,烧瓶内外形成压强差
C.氨气易液化 D.氨气溶于水后形成的溶液易挥发
【答案】B
【详解】
氨的喷泉实验说明氨气极易溶于水,使烧瓶内外产生极大的压强差导致水进入烧瓶。
A.氨水呈碱性与能否形成喷泉无关系,故A错误;
B.极易溶于水的气体能形成压强差而产生喷泉实验,由于氨气极易溶于水,因此氨气能
形成喷泉实验,故B正确;
C.氨气易液化说明氨气的沸点低,氨气易液化与能否形成喷泉无关系,故C错误;
D.氨气溶于水后形成的溶液易挥发是氨水的性质,与能否形成喷泉无关系,故D错误;
答案选B。
10.下列气体中不能用浓硫酸干燥。但能用碱石灰干燥的是
A. B. C. D.
【答案】B
【详解】
A.碱石灰的主要成分是CaO和NaOH, 能与碱石灰反应,不能用碱石灰干燥,故A不
符合题意;
B. 是碱性气体,能与硫酸反应不与碱石灰反应,能用碱石灰干燥,故B符合题意;
学科网(北京)股份有限公司C. 属于酸性氧化物,能与碱石灰反应,不能用碱石灰干燥,故C不符合题意;
D. 属于酸,能与碱石灰反应,不能用碱石灰干燥,故D不符合题意;
答案选B。
11.固体NH NO 受热分解的产物较复杂,分解时发生的反应遵循守恒,从得失电子守恒
4 3
和元素守恒方面分析,对NH NO 热分解的产物猜想不正确的是( )
4 3
A.N、HNO 、HO B.NO、HO
2 3 2 2 2
C.NO 、NO、HO D.NH 、HNO
2 2 2 3 3
【答案】C
【详解】
A.如生成N,N元素化合价分别由+5价、-1价变为0价,NO -过量,则同时生成
2 3
HNO,发生反应 ,A选项正确;
3
B.NH NO 若生成N O、H O,氮元素-3价升高到+1价,硝酸根离子中+5价降低到+1价,
4 3 2 2
符合电子守恒,B选项正确;
C.如生成NO、NO ,元素化合价应由-3价→+1价,+5价→+4价,NH +过量,NH +应同
2 2 4 4
时生成NH ,C选项错误;
3
D.生成NH 、HNO 符合分解反应,为化合价不变的反应,D选项正确;
3 3
答案选C。
12.氢化铵(NHH)与氯化铵结构相似,又已知NH H与水反应有氢气产生,下列叙述中不
4 4
正确的是( )
A.NH H是由NH +和H-构成的
4 4
B.NH H固体投入少量水中,有两种气体产生
4
C.NH H中的H-半径比锂离子半径大
4
D.NH H溶于水后,形成的溶液显酸性
4
【答案】D
【详解】
A.NH H是离子化合物,由NH +和H-构成,正确,A不选;
4 4
B.NH H固体投入少量水中,可生成NH 和H,正确,B不选;
4 3 2
C.H-离子与锂离子电子层结构相同,核电荷数越大,离子半径越小,所以H-离子半径比
锂离子半径大,正确,C不选;
学科网(北京)股份有限公司D.NH H溶于水后,生成NH ·H O的溶液显碱性,错误,D选。
4 3 2
答案为D。
二、非选择题
13.A是一种酸式盐,它与NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的气
体B,按如图所示装置进行喷泉实验,挤压胶头滴管,可得到蓝色喷泉。若向A中加入稀
盐酸,产生的无色气体C能使品红溶液褪色。
请回答下列问题:
(1)A的化学式为_______。
(2)可用于除去B中水分的干燥剂是_______,收集气体B的方法是_______。
(3)写出反应A→C的离子方程式:_______。
(4)A与过量NaOH溶液共热反应的离子方程式为_______。
【答案】(1)NH HSO (2)碱石灰 向下排空气法 (3)
4 3
(4)
【解析】根据无色气体B能使石蕊溶液变为蓝色,推知B为NH ;根据无色气体C能使品
3
红溶液褪色,推知C为SO ;因为A为酸式盐,所以进一步推知A为NH HSO 。
2 4 3
(1)根据分析,物质A的化学式为NH HSO ;
4 3
(2)气体B为氨气,具有碱性,应用碱性干燥剂干燥,选用的干燥剂为碱石灰;氨气易用于
水但密度比空气小,可以选用向下排空气法收集氨气;
(3)反应A→C的离子方程式为 ;
(4) 与过量NaOH溶液共热时能发生反应
学科网(北京)股份有限公司。
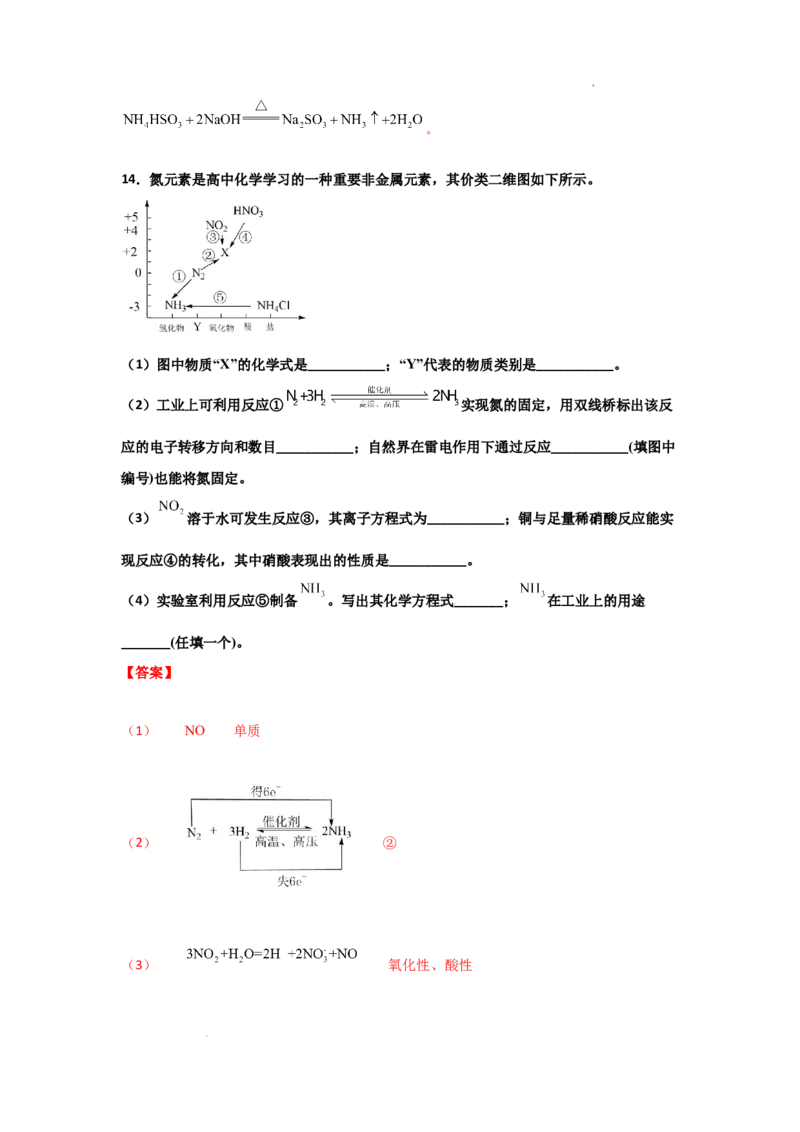
14.氮元素是高中化学学习的一种重要非金属元素,其价类二维图如下所示。
(1)图中物质“X”的化学式是___________;“Y”代表的物质类别是___________。
(2)工业上可利用反应① 实现氮的固定,用双线桥标出该反
应的电子转移方向和数目___________;自然界在雷电作用下通过反应___________(填图中
编号)也能将氮固定。
(3) 溶于水可发生反应③,其离子方程式为___________;铜与足量稀硝酸反应能实
现反应④的转化,其中硝酸表现出的性质是___________。
(4)实验室利用反应⑤制备 。写出其化学方程式_______; 在工业上的用途
_______(任填一个)。
【答案】
(1) NO 单质
(2) ②
(3) 氧化性、酸性
学科网(北京)股份有限公司(4) 制化肥(或制纯碱、制硝酸、作制
冷剂等)
【解析】
(1)图中物质“X”中N为+2价且对应氧化物,X化学式是NO;“Y”对应氮气代表的物质
类别是单质;
(2)N由0价变为-3价,H由0价变为+1价,双线桥表示为: ;
自然固氮,为氮气与氧气、氢气在雷电作用下生成NO、NH ,故对应②反应;
3
(3) 溶于水可发生反应③生成硝酸和NO,其离子方程式为
;铜与足量稀硝酸反应生成NO与硝酸铜,N元素化合价有一
部分降低,其中硝酸表现出的性质是氧化性、酸性;
(4)实验室利用氯化铵与氢氧化钙反应制备 。其化学方程式
; 在工业上的用途:制化肥(或制纯碱、制硝
酸、作制冷剂等)。
学科网(北京)股份有限公司学科网(北京)股份有限公司