文档内容
第五章 化工生产中的重要非金属元素
一、硫及其化合物
1,硫
物理性质:俗称硫黄,硫磺、黄色晶体、质脆,易研成粉末。难溶于水,微溶于酒精(可用酒
精提高硫在水中的溶解度),易溶于二硫化碳(CS :难溶于水的有机试剂)。
2
注意:存在形式:自然界中主要以化合态存在,在火山口地壳中有少量游离态存在。
化学性质:(1)与金属单质(铁或铜)反应生成低价硫化物
Fe+S== FeS Cu+S==CuS
(2)与非金属单质(氢气或氧气)反应
点燃 点燃
S+O ==SO S+H = = H S(臭鸡蛋味气体)
2 2 2 2
硫的用途:做火柴、火药的原料。
2、SO
2
物理性质:无色、有刺激性气味的有毒气体,
密度比空气大(用向上排空气法收集),易溶于水(1:40)。
化学性质:(1)SO 是酸性氧化物
2
SO +H O H SO (可逆反应)
2 2 2 3
SO +Na O == Na SO
2 2 2 3
SO +NaOH == Na SO +H O
2 2 3 2
(2)与氧气反应
高温高压
SO 2 +O 2⇌== 催 ⇌ 化 S 剂 O 3 (可逆反应)
(3)二氧化硫与硫化氢反应(体现SO 的氧化性)
2
SO +2H S==3S + 2H O
2 2 2
漂白性:SO 能漂白纸浆、毛、丝等;能使品红溶液褪色。
2
特别注意:(1)二氧化硫的漂白性原理是发生了短暂的化合反应,并且时间一长
或者加热就会恢复物质原来的颜色。
(2)区分氯气和二氧化硫通入石蕊试剂和品红溶液的现象变化。
石蕊 石蕊试剂变红(石蕊不褪色)
SO
2
品红 品红溶液褪色,加热后品红恢复原来的颜色
溶液变为红色(品红不褪色)
石蕊 石蕊试剂先变红,后褪色
Cl
2
品红 品红溶液褪色,加热后品红不会恢复颜色
用 途 : 工 业 制 硫 酸;食品添加剂(葡萄酒和干果蜜饯)
注意:区分三种漂白剂的原理。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能逆反应方向进行的反应。
正反应:向生成物方向进行的反应
1
学科网(北京)股份有限公司逆反应: 向反应物方向进行的反应
还原性:可与酸性高锰酸钾(溴水,氯水,碘水等强氧化剂)反应;
5SO +2KMnO +2H O===K SO +2MnSO +2H SO —书写其离子方程式
2 4 2 2 4 4 2 4
SO₂+Br₂+ 2H O ===H SO₄+2HBr —书写其离子方程式
2 2
鉴别:SO ,CO 的常用方法,(1)用品红检测,
2 2
(2)用酸性高锰酸钾溶液(或溴水,氯水,碘水等强氧化剂)
(3)用H S溶液鉴别:出现淡黄色浑浊的是SO
2 2
3、SO
3
物理性质:通常状况下为油状液体、标况下为固态、易升华
化学性质:SO 是酸性氧化物
3
SO +H O==H SO
3 2 2 4
SO +Na O==Na SO SO +NaOH==Na SO +H O
3 2 2 4 3 2 4 2
工业制法;二氧化硫的催化氧化
1. H SO
2 4
回收工业废气生产制备硫酸:
硫
矿
磺或黄铁 燃烧
SO 2
400-500℃
SO 3
93%的浓硫酸吸收
H 2 SO 4
VO /催化剂
2 5
空气
2
学科网(北京)股份有限公司2. 化学性质:
稀H SO (酸性)
2 4
什么是酸性?
是指一种物质在溶剂中能向
其他物质提供氢离子的能力。
浓H SO 的特性:
2 4
(1)吸水性
吸收水分子(包括气态水、液态水和结晶水)
(2)脱水性
以氢氧元素2:1的比率除去(如蔗糖的碳化)
(3)强氧化性(与不活泼金属或非金属在加热条件下反应)
2H SO +Cu==CuSO +SO +2H O (H SO 既表现酸性又表现强氧化
2 4 4 2 2 2 4
性)
2H SO +C==CO +SO +2H O (H SO 表现强氧化性)
2 4 2 2 2 2 4
注意;Fe,Al在冷的或室温下与浓硫酸发生钝化。
用途:硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类等。
常见硫酸盐;石膏(CaSO ▪ 2H O)、熟石膏(2CaSO ▪ H O)、重晶石又称钡餐(BaSO ),
4 2 4 2 4
胆矾(蓝矾):(CuSO ),明矾(KAl(SO ) ▪12H O)、绿矾(Fe(SO ) ▪7H O)
4 4 2 2 4 2 2
3. 硫酸根离子的检验
先滴加稀盐酸酸化,排除杂质离子干扰,再滴加氯化钡溶液,产生白色沉淀,则溶液中存
在硫酸根离子。
注意;加稀盐酸酸化的目的;①排除Ag+等的干扰。②排除CO 2-,SO 2-,PO 3-等的干扰
3 3 4
3
学科网(北京)股份有限公司6,粗盐提纯及物质分离和提纯“三必须,四原则”;
口诀;氯化钡加在碳酸盐之前,盐酸加最后
7.不同价态含硫物质的转化。
-2 0 +2 +4 +6
S S S S S
书写各步化学反应方程式
二、氮及其化合物
1. N
2
物理性质:无色无味气体,密度比空气略小。难溶于水。
化学性质:性质稳定(固高能条件下才能固氮)
(1)氮气与镁反应
点燃
Mg+N ====Mg N
2 3 2
4
学科网(北京)股份有限公司(2)氮气与氧气反应(高能固氮)
高温或放电
N +O ========2NO
2 2
(3)工业合成氨(人工固氮)
高温高压
N +3H =====2NH
2 2 3
催化剂
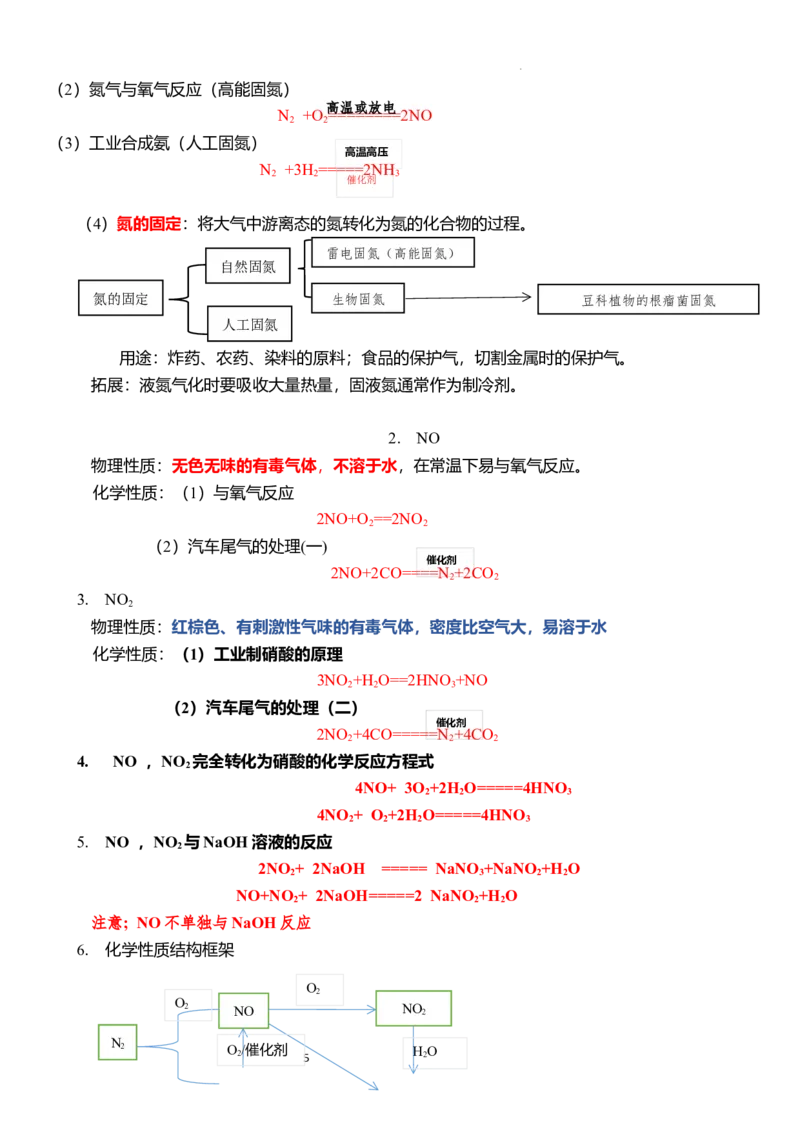
(4)氮的固定:将大气中游离态的氮转化为氮的化合物的过程。
雷电固氮(高能固氮)
自然固氮
氮的固定 生物固氮 豆科植物的根瘤菌固氮
人工固氮
用途:炸药、农药、染料的原料;食品的保护气,切割金属时的保护气。
拓展:液氮气化时要吸收大量热量,固液氮通常作为制冷剂。
2. NO
物理性质:无色无味的有毒气体,不溶于水,在常温下易与氧气反应。
化学性质:(1)与氧气反应
2NO+O ==2NO
2 2
(2)汽车尾气的处理(一)
催化剂
2NO+2CO====N +2CO
2 2
3. NO
2
物理性质:红棕色、有刺激性气味的有毒气体,密度比空气大,易溶于水
化学性质:(1)工业制硝酸的原理
3NO +H O==2HNO +NO
2 2 3
(2)汽车尾气的处理(二)
催化剂
2NO +4CO=====N +4CO
2 2 2
4. NO ,NO 完全转化为硝酸的化学反应方程式
2
4NO+ 3O +2H O=====4HNO
2 2 3
4NO + O +2H O=====4HNO
2 2 2 3
5. NO ,NO 与NaOH溶液的反应
2
2NO + 2NaOH ===== NaNO +NaNO +H O
2 3 2 2
NO+NO + 2NaOH=====2 NaNO +H O
2 2 2
注意; NO不单独与NaOH反应
6. 化学性质结构框架
O
2
O
2 NO NO 2
N
2 O/催化剂 HO
2 5 2
学科网(北京)股份有限公司O/H O
2 2
H NH
2 3 HNO
3
7. NH
3
物理性质:无色、有刺激性气味的气体,密度比空气的小。
化学性质:
(1)氨与酸反应(注意与可挥发性酸的反应现象)
NH +HCl==NH Cl(产生白烟)
3 4
(2)氨的催化氧化(工业制硝酸的第一步)
催化剂
4NH +5O =====4NO+6H O
3 2 2
(3)实验室制氨气
2NH Cl+Ca(OH) ====CaCl +2NH +2H O
4 2 2 3 2
(4)工业合成氨
高温高
N +3H ====压==2NH
2 2 3
催化剂
铵根离子的检验
取少量待测液与试管中,滴加氢氧化钠溶液,加热产生使湿润的石蕊试剂变蓝的气体
(或取少量待测液与试管中,滴加氢氧化钠溶液加热,用沾有浓盐酸的玻璃棒靠近试管口,产
生大量白烟)
应用:制化肥或硝酸的原料;氨易液化,氨气化时需要吸收大量热,故液氨经常用作制冷剂。
8. NH +(铵盐) :铵盐三解:热解,碱解,溶解
4
1. 受热易分解:
NH Cl ==== NH + HCl
4 3
NH NO ==== N O + 2H O
4 3 2 2
2. 与碱反应
Ca(OH) +2NH Cl====CaCl +2H O+2NH ↑
2 4 2 2 3
9. HNO (浓硝酸和稀硝酸都有强氧化性)
3
物理性质:无色、易挥发、有刺激性气味的液体。
化学性质:(1)浓硝酸的分解
4HNO ====4NO + O +2H O
3 或光照 2 2 2
(2)浓硝酸与不活泼金属反应
4HNO (浓)+Cu==Cu(NO ) +2NO +2H O
3 3 2 2 2
6
学科网(北京)股份有限公司(3)稀硝酸与不活泼金属反应
8HNO (稀)+3Cu==3Cu(NO ) +2NO +4H O
3 3 2 2
(4)浓硝酸(或浓硫酸)在常温下与金属铝或铁发生钝化现象。
用途:制化肥、炸药和化工的原料
酸雨:PH<5.6的降水,主要来源是化石燃料的燃烧。
三、硅及其化合物(拓展、新教材已经删减大部分,但建议理科生掌握)
1. Si
物理性质:黑色晶体(自然界中不存在游离态的硅单质)
化学性质:(1)与氢氟酸反应(与其他酸都不反应)
Si+4HF==SiF +2H
4 2
(2)与强碱反应
Si+2NaOH+H O==Na SiO +2H
2 2 3 2
应用:良好的半导体材料,应用于太阳能电池和计算机芯片。
2. SiO
2
物理性质:固体,不溶于水也不和水反应。
化学性质:(1)酸性氧化物
SiO +Na O==Na SiO
2 2 2 3
SiO +2NaOH==Na SiO +H O
2 2 3 2
(2)与氢氟酸反应(雕刻玻璃的原理)(不与其他酸反应)
SiO +4HF==SiF +5H O
2 4 2
(3)高温下与碳酸钙反应
高温
SiO +CaCO ==CaSiO +CO
2 3 3 2
应用:良好的材料,是水晶,玛瑙,石英,光导纤维的主要成分。
3. H SiO
2 3
物理性质:白色絮状沉淀,不溶于水。
4. 化学性质:(1)弱酸性,比碳酸酸性还弱(制备H SiO )
2 4
Na SiO +CO +H O==Na CO +H SiO
2 3 2 2 2 3 2 3
(2)与碱性氧化物(或碱)反应
H SiO +Na O==Na SiO +H O
2 3 2 2 3 2
H SiO +2NaOH==Na SiO +2H O
2 3 2 3 2
(3)受热分解
H SiO ==SiO +2H O
2 3 2 2
注意:不能用二氧化硅与水反应直接制得硅酸。
应用:常用作干燥剂。
7
学科网(北京)股份有限公司5. SiO 2-(硅酸钠为例)
4
物理性质:硅酸盐材料具有耐高温、抗腐蚀、硬度高等特点
结构:硅氧四面体结构。
应用:常用作防火涂料;三大硅酸盐材料(玻璃、陶瓷、水泥)的主要成分。
四、无机非金属材料
1 .传统无机非金属材料:玻璃、陶瓷、水泥
玻璃:纯碱、石灰石、石英砂为原料。
陶瓷:以黏土为主要原料高温烧结而成的
水泥:黏土和石灰石为主要原料。
2.新型无机非金属材料:硅和二氧化硅、新型陶瓷(碳化硅、氮化硅)、碳纳米材料(富勒烯、
石墨烯、碳纳米管)
第六章 化学反应与能量
一、化学反应与能量变化
1. 化学反应与热能
(1)化学反应一定伴随着能量的变化。
化学反应过程中能量变化的主要原因:化学键的断裂与形成。
(2)化学键角度看:反应物断键吸热,生成物成键放热。
注意;键能越大物质越稳定,反之键能越小越不稳定。
(2)物质自身的能量角度:
反应物总能量大于生成物总能量----放热反应,
反应物总能量小于生成物总能量-------吸热反应。
注意:物质自身具有的能量越高越不稳定,反之物质能量越低越稳定。
(3)物质稳定与自身具有的能量和化学键的关系:
物质键能越大,破坏化学键所需能量就越高,物质越稳定,则物质自身具有的能量就越
低;反之物质键能越小,破坏化学键所需能量就越低,物质越不稳定,则物质自身具有的能
量就越高)
(5)常见的吸热反应:
①二氧化碳与碳的反应
高温
CO +C== 2CO
2
②铵盐的反应
2NH Cl+Ca(OH) ==CaCl +2NH +2H O
4 2 2 3 2
③大多数分解反应
NH Cl==NH +HCl
4 3
④ 水煤气的制备
C + H O ==== CO + H
2 (g) 2
⑤ 一般用C、CO、H2还原金属的反应
(6)常见的放热反应:
8
学科网(北京)股份有限公司①所有的燃烧反应
②酸碱中和反应
NaOH+HCl==NaCl+H O
2
③活泼金属与酸或碱或水的反应(酸性氧化物或碱性氧化物与水的反应也是放热反应)
2Na+2H O==2NaOH+H
2 2
❹大多数化合反应
高温
CaO+CO ==CaCO
2 3
⑤ 缓慢的氧化反应
注:强酸强碱的稀释都是放热的过程(但不是放热反应)--------物理现象
2. 化学反应与电能(原电池)
(1)构成原电池的条件。
活泼性不同的两个电极、电解质溶液、形成闭合回路、自发的氧化还原反应(本质)
(2)能量转化形式
化学能转化为电能
(3)发生的反应
负极(失电子)发生氧化反应;正极(得电子)发生还原反应。
(4)电子、电流、离子移动的方向(记住电子不入水、离子不上岸)
电子:负极经导线流向正极
电流:正极流向负极
离子:阴离子移向负极;阳离子移向正极。
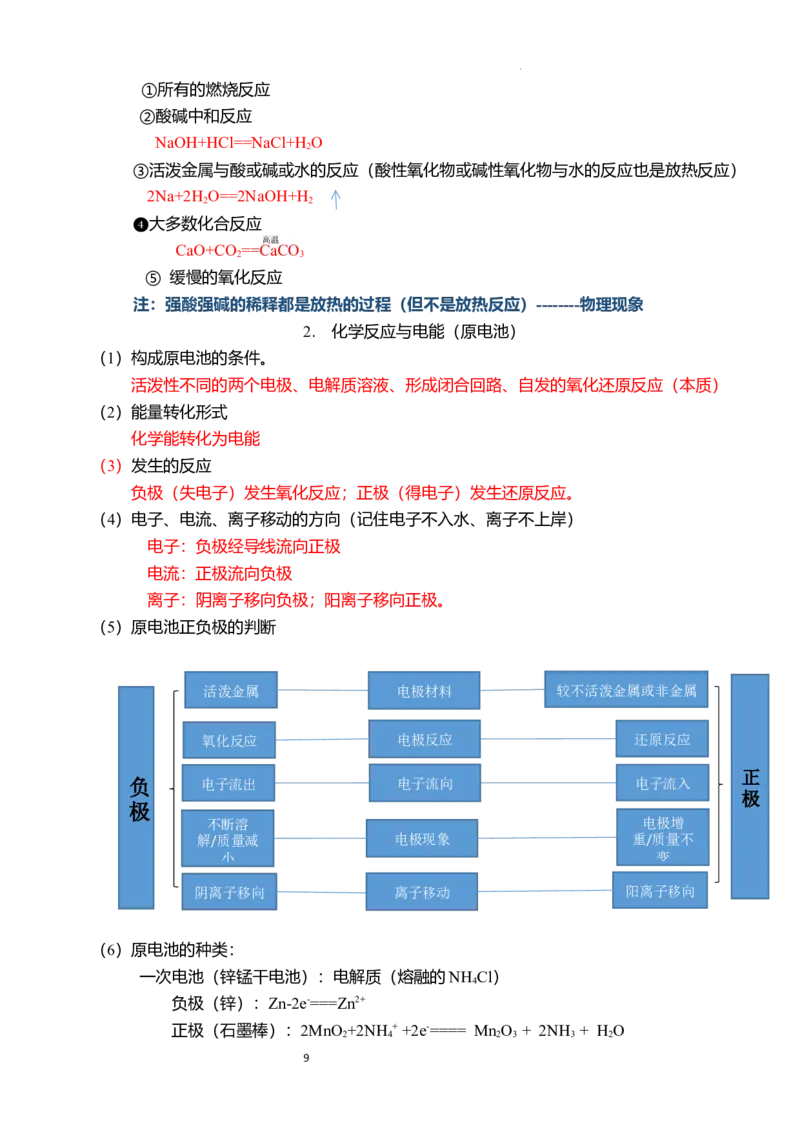
(5)原电池正负极的判断
活泼金属 电极材料 较不活泼金属或非金属
氧化反应 电极反应 还原反应
正
负 电子流出 电子流向 电子流入
极
极
不断溶 电极增
解/质量减 电极现象 重/质量不
小 变
阴离子移向 离子移动 阳离子移向
(6)原电池的种类:
一次电池(锌锰干电池):电解质(熔融的NH Cl)
4
负极(锌):Zn-2e-===Zn2+
正极(石墨棒):2MnO +2NH + +2e-==== Mn O + 2NH + H O
2 4 2 3 3 2
9
学科网(北京)股份有限公司总反应;Zn+2MnO +2NH +====Zn2++Mn O + 2NH + H O
2 4 2 3 3 2
二次电池又称为充电电池(铅蓄电池):电解质(稀H SO )
2 4
正极(Pb): Pb-2e-+SO 2-===PbSO
4 4
负极(PbO):PbO +2e-+4H++SO 2===PbSO +2H O
2 4 4 2
总反应:Pb+PbO +2H SO ===2PbSO +2H O
2 2 4 4 2
燃料电池:(记住燃料作负极,氧气或空气一极作正极)
氢氧燃料电池:
(酸性电解质)负极(燃料):2H - 4e- === 4H+
2
正极(氧气):O + 4e- + 4H+ === 2H O
2 2
总反应:2H + O === 2H O
2 2 2
(碱性电解质)负极(燃料):2H - 4e- + 4OH- === 2H O
2 2
正极(氧气):O + 4e- + 2H O == 4OH-
2 2
总反应:2H + O == 2H O
2 2 2
(中性电解质)负极(燃料):2H - 4e- == 4H+
2
正极(氧气):O + 4e-+ 2H O == 4OH-
2 2
总反应:2H + O == 2H O
2 2 2
甲烷燃料电池:
(酸性电解质)总反应:CH +2O ==== CO + 2H O ——①
4 2 2 2
正极(氧气):2O + 8e- + 8H+ === 4H O ——②
2 2
①减② =负极(燃料): CH - 8e-+2H O === CO + 8H+
4 2 2
(碱性电解质)总反应:CH + 2O + 2NaOH ═══ Na CO + 3H O ——①
4 2 2 3 2
正极(氧气):2O + 4H O + 8e- ═══ 8OH- ——②
2 2
①减② =负极(燃料): CH + 10OH-- 8e- ═══ CO 2- + 7H O
4 3 2
(固态电解质)总反应:CH +2O ==== CO + 2H O ——①
4 2 2 2
正极(氧气):2O +8e- ═══ 4O2- ——②
2
①减② =负极(燃料): CH +4O2-- 8e- ═══ CO +2H O
4 2 2
(熔融碳酸盐(如:熔融K2C03)环境下)总反应:CH +2O ==== CO + 2H O ——①
4 2 2 2
正极(氧气):2O +4CO +8e-═══ 4CO 2- ——②
2 2 3
①减② =负极(燃料): CH +4CO 2--8e- ═══ 5CO +2H O
4 3 2 2
二、化学反应速率与限度
1. 化学反应速率
(1)公式: V = C/t
10
学科网(北京)股份有限公司单位:mol/(L·min),mol/(L·s) ,mol/(L·h)
(2)化学反应速率之比等于化学计量数之比。
(3)影响化学反应速率的因素
温度:温度越高,化学反应速率越快。
浓度:反应物浓度越大,化学反应速率越快。
催化剂:高效催化剂能增大反应速率,但是不能增大转化率。
(有气体参与或生成的反应)压强:越强越大,化学反应速率越大(压强对化学反应速
率的影响实质上是对物质浓度的影响)
其它:如增大反应物接触面积等
2. 化学反应的限度
(1)化学反应的限度
逆:研究的对象是可逆反应
等:平衡时正逆反应速率相等(但是不等于0)
动:平衡时保持动态平衡(反应并没有停止)
定:平衡时各物质浓度保持不变
变:改变外界条件时将打破平衡建立新的平衡。
(2)化学计算中的三段式
(反应中物质的量的变化量之比或浓度的变化量之比等于化学计量数之比)
A + 2 B == C + 2 D
反应开始: xmol ymol 0 0
变化 :amol 2amol amol 2amol
平衡时: x-a mol y-2mol amol 2amol
(4)转化率和产率计算公式
转化率=(转化的量)/(起始量)--------(单位要一致)
产率=(实际产生量)/(理论产量) --------(单位要一致)
3、化学平衡的判断方法;
(1) 任何情况下均可作为标志的;
① 对于同一物质:该物质的生成速率=消耗速率,即V =V 。
(正) (逆)
② 对于不同物质;某反应物的消耗(生成)速率:某生成物的消耗(生成)速率=化学计量数
之比。
③ 各组分含量(百分含量,物质的量,物质的量浓度,质量)不随时间改变。
(2) 在一定条件下可作为标志的;
① 对于有色物质参加的可逆反应:颜色不变,则平衡
② 对于有气体物质参加的可逆反应;若反应前后气体的物质的量变化不为 0,混合气体平均相
11
学科网(北京)股份有限公司对分子质量M和反应总压强P不变(恒温恒压)时,反应平衡。
③ 对于绝热系统:温度不变,则平衡。
第七章 有机化合物
一、有机物及其性质
1.认识有机物及概念
(1)有机物中的碳成键形式:
每个碳原子有4个共价键、H有1个共价键、O有两个共价键
(2)有机物的结构:
结构式、结构简式、分子式、最简式(或实验室)——四式、
球棍模型、空间充填模型(最能反应分子的真实情况)——两模型。
(2)有机物的熔沸点:
除了新戊烷是气体,一般含碳量小于等于4的为气态,大于4的液态
含碳量越多,熔沸点越高;
链状烷烃支链越多熔沸点越低;对于脂肪酸不饱和键越多熔沸点越低。
(5)大多数有机物都能燃烧(氧化反应)
(6)烃:只含碳氢两种元素的有机化合物。
(7)烃的衍生物:烷烃中氢原子(或原子团)被原子或原子团所取代后形成的有机物。
(8)同分异构体:分子式相同,结构式不同的有机物。
(9)同系物:结构像是,相差一个或多个—CH 原子团的有机化合物。
2
(判别同系物:原子相同,官能团相同且相等,相差一个或多个CH 原子团。)
2
2.各类有机化合物的性质
(1)烷烃(甲烷为例)
① 甲烷的燃烧
点燃
CH +2O ==CO +2H O
4 2 2 2
烃的燃烧通式; C H + (x +(y/4))O ==== xCO2 + y/2 H O
x y 2 2
② 与氯气光照条件下反应(取代反应;一上一下,逐级取代,同时发生)
光照
CH +Cl ==CH Cl+HCl
4 2 3
光照
CH Cl+Cl ==CH Cl +HCl
3 2 2 2
光照
CH Cl +Cl ==CHCl +HCl
2 2 2 3
光照
CHCl +Cl ==CCl +HCl
3 2 4
注意:一氯甲烷是气体,其余皆是液体
烷烃不能和强酸强碱、强氧化剂(高锰酸钾)反应。
(3)烯烃(乙烯为例)
① 乙烯的燃烧
点燃
12
学科网(北京)股份有限公司C H +3O ==2CO +2H O
2 4 2 2 2
② 乙烯使溴水褪色(加成反应; 断不饱和键)
C H +Br ==CH BrCH Br(1,2-二溴乙烷-----液体)
2 4 2 2 2
乙烯水化法制乙醇
催化剂
C H +H O ===== CH CH OH
2 4 2 3 2
乙烯制氯乙烷
C H +HCl==CH CH Cl
2 4 3 2
乙烯制聚乙烯
nC H === —CH —CH —
2 4 2 2 n
注:乙烯有碳碳双键,所以有还原性,能被高锰酸钾等强氧化剂氧化。
(3)炔烃(拓展)(乙炔为例)
① 乙炔的燃烧:
点燃
2CH≡CH+3O ====2CO +2H O
2 2 2
② 加成反应如下
乙炔使溴水褪色:CH≡CH + Br ===== CHBr=CHBr
2
CHBr=CHBr + Br ===== CH(Br) CH(Br)
2 2 2
乙炔制氯乙炔(加成反应):
nCH≡CH === —CH=CH—
n
注:乙炔有碳碳三键,所以有还原性,能被高锰酸钾等强氧化剂氧化。
(4)乙醇
点燃
乙醇的燃烧:CH CH OH + 3O →→→ 2CO +3H O
3 2 2 2 2
Cu/Ag
乙醇的催化氧化:CH CH O-H + 3O →→→ CH CHO(乙醛)+ H O
3 2 2 3 2
△
现象:红色光亮的铜丝灼烧变黑,趁热插入乙醇,铜丝恢复原色,反复多次,液体有刺激性气味。
乙醇与钠反应:2Na+2CH CH OH→→→2CH CH ONa +H ↑
3 2 3 2 2
现象;Na沉在试管底部,无响声,有气泡产生,
(注意和钠与水反应的现象对比)
KMnO (H+, aq)
乙醇被酸性高锰酸钾(或重铬酸钾)氧化:CH CH OH→→→→4 →→→→→CH COOH
3 2 3
或 KCr O(H+, aq)
2 2 7
注:乙醇不会与氢氧化钠反应。
(5)乙酸
点燃
乙酸的燃烧:CH COOH + 2O →→→ 2CO +2H O
3 2 2 2
乙酸和钠反应:2Na+2CH COOH→→→2CH CH ONa +H ↑
3 3 2 2
浓硫酸
乙酸和乙醇的反应:CH 3 CH 2 -O-H + CH 3 COOH ⇌⇌⇌⇌ CH 3 COOCH 2 CH 3 + H 2 O
△
注:乙酸是有机酸,是弱酸,但是比碳酸酸性强。
二、有机高分子材料
三大合成材料:塑料、合成纤维、合成橡胶
1.塑料:主要成分是合成树脂;合成树脂+添加剂=塑料
13
学科网(北京)股份有限公司2.橡胶:天然橡胶的主要成分是聚异戊二烯。
合成橡胶:硫化橡胶:更好的强度、韧性、弹性和化学稳定性。
氟橡胶:耐热、耐酸碱腐蚀
特种橡胶(硅橡胶):耐高温和严寒,特种橡胶在航天航空和国防尖端技术领域中发挥着重
要的作用。
3.纤维: 天然纤维:棉花、羊毛、蚕丝和麻等。
合成纤维:以煤、石油、天然气为原料经聚合反应生产合成纤维。
三、基本营养物质(包括:糖类、蛋白质、油脂、维生素、无机盐和水)
1.糖类
组成元素:C、H、O
(1)单糖:葡萄糖和果糖(是同分异构体)
分子式:C H O
6 12 6
检验葡萄糖(还原糖)的方法:
1. 与新制氢氧化铜反应:
先加过量氢氧化钠溶液使溶液显碱性,再硫酸铜溶液,煮沸后观察到砖红色沉淀产生。
2. 银镜反应:
先加过量氢氧化钠溶液使溶液显碱性,再加银氨溶液,水浴加热,观察到试管内壁有银镜生
成。
(2)二糖:蔗糖和麦芽糖(是同分异构体)
分子式:C H O
12 22 11
二糖水解的条件:浓硫酸,加热。
(3)多糖:淀粉和纤维素(不是同分异构体)
分子式:(C H O )
6 10 5 n
多糖水解的条件和最终产物:葡萄糖
检验淀粉的试剂:I
2
检验淀粉水解程度的实验:
取淀粉配置成溶液,滴加稀硫酸加热后加热,滴加碘水,观察现象 1;滴加过量氢氧化钠溶
液,加入银氨溶液,水浴加热,观察现象2。
现象1 现象2 淀粉水解程度
变蓝 无明显现象 淀粉未水解
变蓝 有银镜产生 淀粉部分水解
未变蓝 有银镜产生 淀粉全部水解
注:纤维素在人体内不能被水解
2.蛋白质
组成元素:C、H、O、N、P、S等
(1)蛋白质的性质
14
学科网(北京)股份有限公司蛋白质的变性:强酸、强碱、重金属的盐类都能使蛋白质变性;变性是不可逆的过程。
蛋白质的水解:蛋白质水解的最终产物是氨基酸。
颜色(显色)反应:蛋白质遇到浓硝酸会变黄色。
注:绝大多数酶也是蛋白质。
(2)氨基酸的性质(既有酸性,又有碱性)
注:我国科学家在世界上首次完成了具有生命活力的蛋白质——牛结晶胰岛素的全合成。
3.油脂(高级脂肪酸甘油酯)
组成元素:C、H、O
(1)定义:高级脂肪酸和甘油通过酯化反应得到的高级脂肪酸甘油酯。油脂是酯中的一类。
(2)高级脂肪酸的分类:
饱和脂肪酸:硬脂酸(C H COOH)和软脂酸(C H COOH)
17 35 15 31
不饱和脂肪酸:油酸(C H COOH)和亚油酸(C H COOH)
17 33 17 31
(3)油脂的性质:
油脂的水解的最终产物:高级脂肪酸和甘油
(皂化反应) 油脂在碱性条件下水解的产物:高级脂肪酸盐和甘油
油脂能够促进脂溶性维生素(A、D、E、K)的吸收。
(4)人造奶油(又称人造黄油):氢化植物油。
(5)注意:油脂属于小分子化合物。
第八章 化学与可持续发展
一、自然资源的开发利用
1.金属矿物的开发利用
(1)金属在自然界中的存在形式:化合态和游离态
(2)金属的冶炼方式
K Ca Na Mg Al :电解法
Zn Fe Sn Pb Cu :热还原法(或铝热法)
Hg Ag :热分解法
Pt Au :其它方法(富集法)
3. 海水资源的开发利用
15
学科网(北京)股份有限公司海水提碘
海水提镁
16
学科网(北京)股份有限公司3.煤、石油、天然气的开发利用(都是混合物)
(1)煤
组成:由有机物和少量无机物组成的复杂混合物,其主要以碳元素为主,还含有少量的氢、氧、
氮、硫等元素
综合利用
干馏;(化学变化)将煤隔绝空气加热使之分解的过程,工业上也叫煤的焦化。
高温
气化:(化学变化)将煤转化为可燃性气体的过程。C+H O==CO+H
2 2
液化:(化学变化)煤与氢气作用生成液体燃料。
(2)石油
组成:多种碳氢化合物组成的混合物,成分复杂。
综合利用
分馏:(物理变化)根据各组分沸点的不同,分馏后可以获得汽油、煤油、柴油含碳较少的轻
质油。
裂化:将重油裂化为汽油等物质。
裂解:裂化后进一步裂解可得到短链饱和和不饱和烃。
催化重整:使链状烃转化为环状烃。
(3)天然气
组成:
综合利用:作为清洁的化石燃料;化工原料主要用于合成氨和生成甲醇等。
二、化学品的合理使用
化学品分类
大宗化学品:乙烯、硫酸、纯碱和化肥等。
精细化学品:医药、农药、日用化学品、食品添加剂等。
1.农药
2.医药
(1)药物的分类:按照来源分为天然药物和合成药物
(2)阿司匹林:化学名称为乙酰水杨酸,具有解热镇痛的作用。
(3)处方药和非处方药的标识:
非处方药:OTC
处方药:R
3.食品添加剂
17
学科网(北京)股份有限公司(1)着色剂:
天然色素:红曲红、B-胡萝卜素、姜黄、叶绿素铜钠盐、焦糖色等
合成色素:芹菜红、柠檬黄、靛蓝等
(2)曾味剂:味精(化学名称为谷氨酸钠)
味精最早是海带中提取出来的,现在主要以淀粉为原料通过发酵法生产。
(3)膨松剂:碳酸氢铵、碳酸氢钠等。
(4)凝固剂:氯化镁、硫酸钙、葡萄糖酸- ᶞ-内脂等
(6)防腐剂:苯甲酸及其钠盐、山梨酸及其钾盐、亚硝酸钠
亚硝酸钠是防腐剂和护色剂。
(7)抗氧化剂:维生素C(又称抗坏血酸)
(8)营养强化剂:碘酸钾、碳酸钙、硫酸亚铁、硫酸锌、维生素等
三、绿色化学
1.三废:废气、废水、废渣
2.污水的处理
一级处理:通常采用物理方法,处理后达不到排放标准。
二级处理:常采用生物和化学方法,处理后达到排放标准。
三级处理:通常采用化学方法,处理后达到排放标准,通常用于绿化和景观用水等。
绿色化学:改变先污染后治理的观念和做法,减少或消除产品在生成和应用中涉及的有害物质,实
现从源头减少或消除环境污染。
4.开发和利用自然资源要遵循的原则减量化、再利用、再循环。:
18
学科网(北京)股份有限公司19
学科网(北京)股份有限公司