文档内容
5.对下列事实的解释或说法错误的是
(新教材)下学期高一期末备考金卷
A.浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定
化 学 B.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
C.分别蘸有浓氨水和浓盐酸的玻璃棒靠近但不接触,有白烟生成,说明氨气与HCl极易挥发
注意事项: D.硫化钠溶液中滴入足量酸性高锰酸钾溶液,试管口塞上浸有NaOH溶液的棉花团,目的是吸收
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴
反应生成的三氧化硫
在答题卡上的指定位置。 6.下列关于硅及其化合物的说法正确的是
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写
A.硅酸盐中的阴离子都是SiO
在试题卷、草稿纸和答题卡上的非答题区域均无效。 B.单质硅可用于制造光导纤维
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和 C.二氧化硅既可以与烧碱溶液反应又能与氢氟酸反应,故属于两性氧化物
答题卡上的非答题区域均无效。 D.NaSiO 是最简单的硅酸盐,其水溶液可用作木材防火剂
2 3
4.考试结束后,请将本试题卷和答题卡一并上交。 7.NF 是一种温室气体,其存储能量的能力是CO 的12000~20000倍,在大气中的寿命可长达740
3 2
相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 年,几种化学键的键能如表所示。
化学键 N≡N F—F N—F
一、选择题
键能/(kJ·mol−1) 946 154.8 283.0
1.材料是人类生存和发展的物质基础。下列说法不正确的是
下列说法正确的是
A.“山东舰”上的拦阻索是一种特种钢缆,属于新型无机非金属材料
A.过程N(g)=2N(g)释放能量
B.“玉兔二号”月球车的帆板太阳能电池的材料是硅 2
B.过程N(g)+3F(g)=NF (g)释放能量
C.天然橡胶是难降解材料,主要成分是聚异戊二烯 3
C.断裂1mol N—F键吸收的能量与形成1mol N—F键释放的能量不相同
D.铝锂合金,强度大,密度小,用于制造飞机可减轻机身重量
D.NF 吸收能量后,若没有化学键的断裂与形成,仍可能发生化学反应
2.在下列自然资源的开发利用中,不涉及化学变化的是 3
8.在恒容密闭容器中发生反应:3CO(g)+Fe O(s)=====3CO(g)+2Fe(s),下列说法不正确的是
A.用石油裂解生产乙烯 B.从海带灰中提取碘单质 2 3 2
A.将块状Fe O 改为粉末,反应速率加快
C.石油分馏 D.用煤干馏生产焦炭 2 3
B.升高温度,反应速率加快
3.全世界每年都会发生上万起火灾,为了预防火灾发生,现在很多商场、宾馆、办公楼都安装有烟雾
C.充入N 使压强增大,反应速率加快
2
报警器,这对预防火灾,减少火灾损失具有很大的现实意义。常用的烟雾报警器是一种电离式烟
D.使用催化剂,反应速率加快
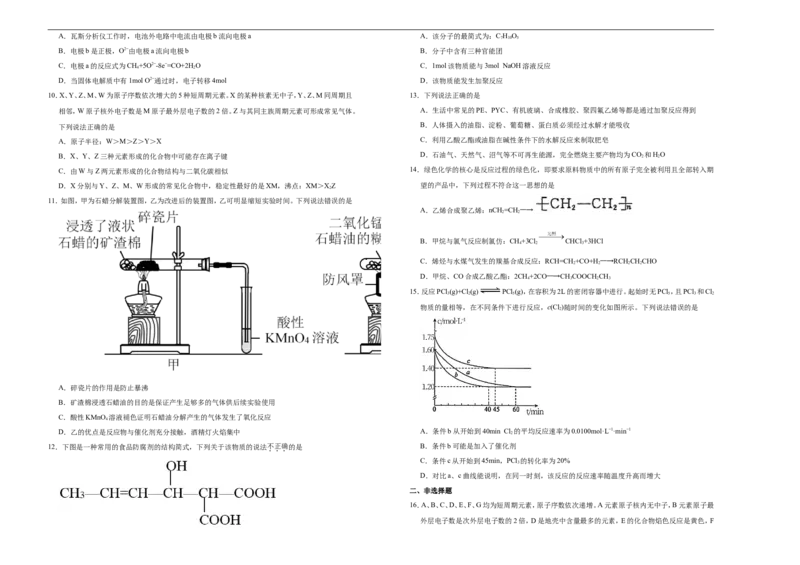
9.有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦
雾报警器,其主体是一个放有镅-241( Am)放射源的电离室, Am原子核内中子数与核外电
斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是 YO -
2 3
子数之差是
NaO,O2−可以在其中自由移动。
2
A.241 B.146 C.95 D.51
4.下列说法不正确的是
A.丙烷和丁烷互称为同系物
B.由在光照条件下CH 能与氯气发生取代反应,可推知CH 能使氯水褪色
4 4
C.沸点:正丁烷>异丁烷>丙烷
下列有关叙述正确的是
D.CHCHCHCH 和CHCH(CH) 互为同分异构体
3 2 2 3 3 3 2
封密不订装只卷此
号位座
号场考
号证考准
名姓
级班A.瓦斯分析仪工作时,电池外电路中电流由电极b流向电极a A.该分子的最简式为:C H O
7 10 5
B.电极b是正极,O2−由电极a流向电极b B.分子中含有三种官能团
C.电极a的反应式为CH+5O2−-8e−=CO+2HO C.1mol该物质能与3mol NaOH溶液反应
4 2
D.当固体电解质中有1mol O2−通过时,电子转移4mol D.该物质能发生加聚反应
10.X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的某种核素无中子,Y、Z、M同周期且 13.下列说法正确的是
相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族周期元素可形成常见气体。 A.生活中常见的PE、PYC、有机玻璃、合成橡胶、聚四氟乙烯等都是通过加聚反应得到
下列说法正确的是 B.人体摄入的油脂、淀粉、葡萄糖、蛋白质必须经过水解才能吸收
A.原子半径:W>M>Z>Y>X C.利用乙酸乙酯或油脂在碱性条件下的水解反应来制取肥皂
B.X、Y、Z三种元素形成的化合物中可能存在离子键 D.石油气、天然气、沼气等不可再生能源,完全燃烧主要产物均为CO 2 和H 2 O
C.由W与Z两元素形成的化合物结构与二氧化碳相似 14.绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点:XM>XZ 望的产品中,下列过程不符合这一思想的是
2
11.如图,甲为石蜡分解装置图,乙为改进后的装置图,乙可明显缩短实验时间。下列说法错误的是
A.乙烯合成聚乙烯:nCH=CH ――→
2 2
B.甲烷与氯气反应制氯仿:CH+3Cl CHCl +3HCl
4 2 3
C.烯烃与水煤气发生的羰基合成反应:RCH=CH+CO+H ――→RCHCHCHO
2 2 2 2
D.甲烷、CO合成乙酸乙酯:2CH+2CO――→CHCOOCH CH
4 3 2 3
15.反应PCl (g)+Cl (g) PCl (g),在容积为2L的密闭容器中进行。起始时无PCl ,且PCl 和Cl
3 2 5 5 3 2
物质的量相等,在不同条件下进行反应,c(Cl )随时间的变化如图所示。下列说法错误的是
2
A.碎瓷片的作用是防止暴沸
B.矿渣棉浸透石蜡油的目的是保证产生足够多的气体供后续实验使用
C.酸性KMnO 溶液褪色证明石蜡油分解产生的气体发生了氧化反应
4
D.乙的优点是反应物与催化剂充分接触,酒精灯火焰集中 A.条件b从开始到40min Cl 的平均反应速率为0.0100mol·L−1·min−1
2
12.下图是一种常用的食品防腐剂的结构简式,下列关于该物质的说法不正确的是 B.条件b可能是加入了催化剂
C.条件c从开始到45min,PCl 的转化率为20%
3
D.对比a、c曲线能说明,在同一时刻,该反应的反应速率随温度升高而增大
二、非选择题
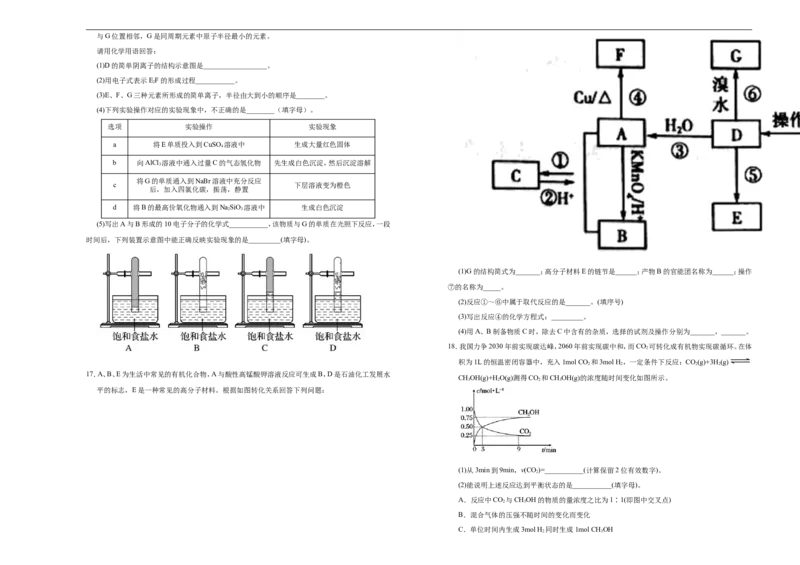
16.A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最
外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是__________________。
(2)用电子式表示EF的形成过程___________。
2
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是________。
(4)下列实验操作对应的实验现象中,不正确的是________(填字母)。
选项 实验操作 实验现象
a 将E单质投入到CuSO 溶液中 生成大量红色固体
4
b 向AlCl 溶液中通入过量C的气态氢化物 先生成白色沉淀,然后沉淀溶解
3
将G的单质通入到NaBr溶液中充分反应
c 下层溶液变为橙色
后,加入四氯化碳,振荡,静置
d 将B的最高价氧化物通入到NaSiO 溶液中 生成白色沉淀
2 3
(5)写出A与B形成的10电子分子的化学式___________,该物质与G的单质在光照下反应,一段
时间后,下列装置示意图中能正确反映实验现象的是_________(填字母)。
(1)G的结构简式为_______;高分子材料E的链节是______;产物B的官能团名称为______;操作
⑦的名称为_____。
(2)反应①~⑥中属于取代反应的是_______。(填序号)
(3)写出反应④的化学方程式:_________。
(4)用A、B制备物质C时,除去C中含有的杂质,选择的试剂及操作分别为_______,_______。
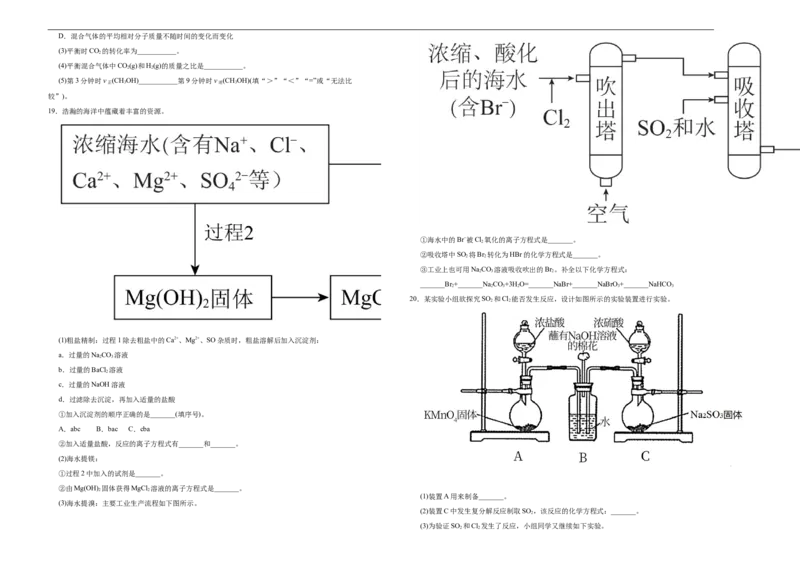
18.我国力争2030年前实现碳达峰,2060年前实现碳中和,而CO 可转化成有机物实现碳循环。在体
2
积为1L的恒温密闭容器中,充入1mol CO 和3mol H,一定条件下反应:CO(g)+3H(g)
2 2 2 2
17.A、B、E为生活中常见的有机化合物,A与酸性高锰酸钾溶液反应可生成B,D是石油化工发展水
CHOH(g)+H O(g)测得CO 和CHOH(g)的浓度随时间变化如图所示。
3 2 2 3
平的标志,E是一种常见的高分子材料。根据如图转化关系回答下列问题:
(1)从3min到9min,v(CO)=___________(计算保留2位有效数字)。
2
(2)能说明上述反应达到平衡状态的是___________(填字母)。
A.反应中CO 与CHOH的物质的量浓度之比为1∶1(即图中交叉点)
2 3
B.混合气体的压强不随时间的变化而变化
C.单位时间内生成3mol H 同时生成1mol CHOH
2 3D.混合气体的平均相对分子质量不随时间的变化而变化
(3)平衡时CO 的转化率为___________。
2
(4)平衡混合气体中CO(g)和H(g)的质量之比是___________。
2 2
(5)第3分钟时v (CHOH)___________第9分钟时v (CHOH)(填“>”“<”“=”或“无法比
正 3 逆 3
较”)。
19.浩瀚的海洋中蕴藏着丰富的资源。
①海水中的Br−被Cl 氧化的离子方程式是_______。
2
②吸收塔中SO 将Br 转化为HBr的化学方程式是_______。
2 2
③工业上也可用NaCO 溶液吸收吹出的Br 。补全以下化学方程式:
2 3 2
_______Br +_______Na CO+3H O=_______NaBr+_______NaBrO +_______NaHCO
2 2 3 2 3 3
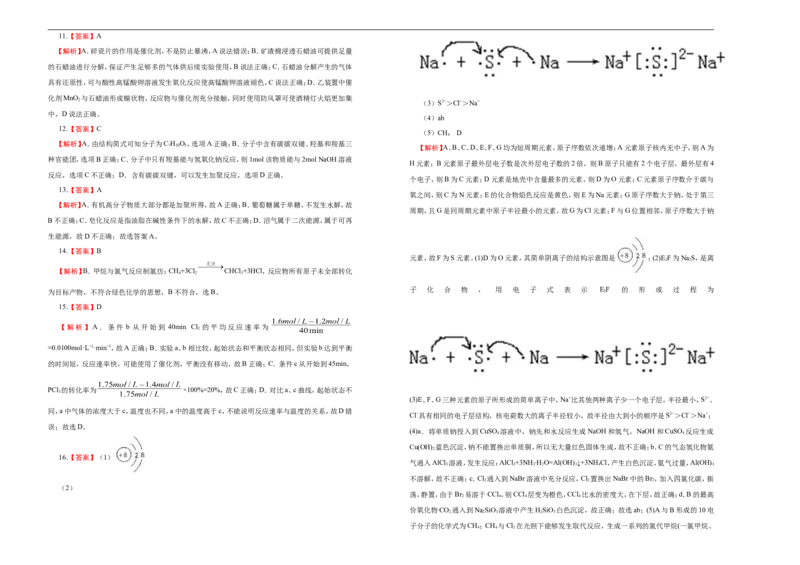
20.某实验小组欲探究SO 和Cl 能否发生反应,设计如图所示的实验装置进行实验。
2 2
(1)粗盐精制:过程1除去粗盐中的Ca2+、Mg2+、SO杂质时,粗盐溶解后加入沉淀剂:
a.过量的NaCO 溶液
2 3
b.过量的BaCl 溶液
2
c.过量的NaOH溶液
d.过滤除去沉淀,再加入适量的盐酸
①加入沉淀剂的顺序正确的是_______(填序号)。
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有_______和_______。
(2)海水提镁:
①过程2中加入的试剂是_______。
②由Mg(OH) 固体获得MgCl 溶液的离子方程式是_______。
2 2
(1)装置A用来制备_______。
(3)海水提溴:主要工业生产流程如下图所示。
(2)装置C中发生复分解反应制取SO ,该反应的化学方程式:_______。
2
(3)为验证SO 和Cl 发生了反应,小组同学又继续如下实验。
2 2①甲同学认为若SO 和Cl 反应,生成了Cl−,只要检验到生成的Cl-即可。
2 2
②乙同学认为甲同学的结论不合理,认为应该在装置A、B间增加一个洗气瓶,然后再按甲同学的
方法实验即可得到正确结论。洗气瓶中盛有试剂的名称是_______。
③丙同学认为按乙同学的建议改进实验也不合理,理由是:_______。
④丁同学则认为甲、乙同学的结论均不合理。丁同学取适量B中溶液于试管中,向其中滴加少量
溶液X,生成白色沉淀,得出结论:SO 与Cl 同时通入水中,可以发生反应。溶液X是_______(填选项
2 2
序号)。
a.BaCl 溶液 b.Ba(OH) 溶液 c.石蕊溶液
2 2
⑤SO 与Cl 同时通入水中反应的化学方程式是_______。
2 2子是SiO,故A错误;B.二氧化硅用于制作光导纤维,单质硅用做太阳能电池、硅芯片材料,故B错
(新教材)2020-2021 学年下学期高一期末备考金卷
误;C.二氧化硅只能和HF反应,和其它酸不反应,和酸的反应没有普遍性,所以不能说明其具有两
化学答案 性,二氧化硅属于酸性氧化物,故C错误;D.硅酸钠不燃烧,受热也不分解,其水溶液能作木材防火
剂,故D正确;答案选D。
1.【答案】A
7.【答案】B
【解析】A.钢缆属于合金,金属材料,A错误;B.太阳能电池的主要成分是硅,B正确;C.天然橡
【解析】A.化学键断裂吸收能量,即过程N(g)=2N(g)吸收能量,A错误;B.化学键形成释放能量,
2
胶是难降解材料,主要成分是有机高分子化合物聚异戊二烯,C正确;D.铝锂合金,强度大,密度小,
即过程N(g)+3F(g)=NF (g)释放能量,B正确;C.断裂1mol N—F键吸收的能量与形成1mol N—F键
3
用于制造飞机可减轻机身重量,D正确;答案选A。
释放的能量相同,都为283.0kJ,C错误;D.化学反应的实质是旧键的断裂和新键的形成,所以NF 吸
3
2.【答案】C
收能量后如果没有化学键的断裂与生成,则不可能发生化学反应,D错误;综上所述答案为B。
【解析】A.用石油裂解生产乙烯的过程中有新物质生成,属于化学变化,故A不符合题意;B.从
8.【答案】C
海带灰中提取碘单质的过程中有新物质生成,属于化学变化,故B不符合题意;C.石油分馏的过程
【解析】A.将块状Fe O 改为粉末,反应物的接触面积增大,反应速率加快,故A正确;B.升高温
2 3
中没有新物质生成,属于物理变化,不涉及化学变化,故C符合题意;D.用煤干馏生产焦炭的过程中
度,活化分子的数目增大,有效碰撞的次数增大,反应速率加快,故B正确;C.充入不参与反应的N,
2
有新物质生成,属于化学变化,故D不符合题意;故选C。
使恒容密闭容器中的压强增大,实际参加反应的气体浓度不变,反应速率不变,故C错误;D.使用催
3.【答案】D
化剂,能降低反应的活化能,活化分子的数目增大,有效碰撞的次数增大,反应速率加快,故D正确;
【解析】 Am质子数是95,质量数是241,则中子数是241-95=146。又因为质子数等于核外电子 故选C。
9.【答案】A
数,则原子核内中子数与核外电子数之差是146-95=51。答案选D。
【解析】A.电池外电路中电流由正极流向负极,氧气得电子,b极为正极,A正确;B.电极b氧气得
4.【答案】B
电子,生成O2−,O2−由正极(电极b)流向负极(电极a),B错误;C.甲烷所在电极a为负极,电极反应为
【解析】A.丙烷和丁烷都属于烷烃,二者结构相似,相差一个CH,互为同系物,A正确;B.CH 能
2 4
CH+4O2−-8e−=CO +2HO,C错误;D.1mol O 得4mol电子生成2mol O2−,故当固体电解质中有1mol
与纯净的氯气发生取代反应,与氯水不反应,故CH 不能使氯水褪色,B错误;C.烷烃沸点的比较:碳 4 2 2 2
4
O2−通过时,电子转移2mol,故D错误。答案选A。
原子数越多,沸点越高,碳原子数相同的烷烃,支链越多,沸点越低,故沸点:正丁烷>异丁烷>丙烷,C
10.【答案】B
正确;D.CHCHCHCH 和CHCH(CH) 的分子式相同,均为C H ,而结构式不同,二者互为同分异
3 2 2 3 3 3 2 4 10
【解析】X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的某种核素无中子,则X为氢
构体,D正确。答案选B。
(H);Z与其同主族的短周期元素可形成常见气体,则Z为氧(O);Y、Z、M同周期且相邻,则Y为氮
5.【答案】D
(N),M为氟(F);W原子核外电子数是M原子最外层电子数的2倍,则W为硅(Si),X、Y、Z、M、W分
【解析】A.浓硝酸受热或见光易分解生成二氧化氮、水和氧气,浓硝酸在光照下颜色变黄,是分解
别为H、N、O、F、Si。A.X、Y、Z、M、W分别为H、N、O、F、Si,氢原子位于第一周期,原子半径最小,
产生的二氧化氮在溶液中所致,故A正确;B.浓硫酸具有的特性:吸水性、脱水性、强氧化性,在蔗糖
N、O、F位于第二周期,半径逐渐减小,硅位于第三周期,五种元素中原子半径最大,原子半径:W>Y
中加入浓硫酸后出现发黑现象,体现了浓硫酸的脱水性,故B正确;C.氨气和氯化氢混合发生反应
>M>Z>X,故A错误;B.X、Y、Z三种元素分别为H、N、O,形成的化合物如果为NH NO ,存在离
生成氯化铵固体而冒白烟,因此分别蘸有浓氨水和浓盐酸的玻璃棒靠近但不接触,有白烟生成,说明 4 3
子键,故B正确;C.由W与Z两元素形成的化合物是二氧化硅,硅原子和氧原子之间存在共价键,二
氨气与HCl极易挥发,故C正确;D.硫化钠溶液中滴入足量酸性高锰酸钾溶液,硫化钠有可能被氧
氧化碳中含有二氧化碳分子,二氧化碳分子里存在共价键,结构与二氧化碳不相似,故C错误;D.H
化为二氧化硫,因此试管口塞上浸有NaOH溶液的棉花团,目的是吸收可能生成的二氧化硫,故D错
分别与N、O、F、Si形成的常见化合物中,F的非金属性最强,所以稳定性最好的是HF,虽然HO、HF
误;故选D。 2
分子间都能形成氢键,但常温下HO呈液态,而HF呈气态,所以沸点HO>HF,故D错误;答案选
6.【答案】D 2 2
B。
【解析】A.只有最简单的硅酸盐中的阴离子才是SiO,复杂的硅酸盐不一定,如镁橄榄石中的阴离11.【答案】A
【解析】A.碎瓷片的作用是催化剂,不是防止暴沸,A说法错误;B.矿渣棉浸透石蜡油可提供足量
的石蜡油进行分解,保证产生足够多的气体供后续实验使用,B说法正确;C.石蜡油分解产生的气体
具有还原性,可与酸性高锰酸钾溶液发生氧化反应使高锰酸钾溶液褪色,C说法正确;D.乙装置中催
化剂MnO 与石蜡油形成糊状物,反应物与催化剂充分接触,同时使用防风罩可使酒精灯火焰更加集
2 (3)S2−>Cl−>Na+
中,D说法正确。
(4)ab
12.【答案】C
(5)CH D
4
【解析】A.由结构简式可知分子为C H O,选项A正确;B.分子中含有碳碳双键、羟基和羧基三
7 10 5 【解析】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增;A元素原子核内无中子,则A为
种官能团,选项B正确;C.分子中只有羧基能与氢氧化钠反应,则1mol该物质能与2mol NaOH溶液
H元素;B元素原子最外层电子数是次外层电子数的2倍,则B原子只能有2个电子层,最外层有4
反应,选项C不正确;D.含有碳碳双键,可以发生加聚反应,选项D正确。
个电子,则B为C元素;D元素是地壳中含量最多的元素,则D为O元素;C元素原子序数介于碳与
13.【答案】A
氧之间,则C为N元素;E的化合物焰色反应是黄色,则E为Na元素;G原子序数大于钠,处于第三
【解析】A.有机高分子物质大部分都是加聚所得,故A正确;B.葡萄糖属于单糖,不发生水解,故
周期,且G是同周期元素中原子半径最小的元素,故G为Cl元素;F与G位置相邻,原子序数大于钠
B不正确;C.皂化反应是指油脂在碱性条件下的水解,故C不正确;D.沼气属于二次能源,属于可再
生能源,故D不正确;故选答案A。
14.【答案】B
元素,故F为S元素。(1)D为O元素,其简单阴离子的结构示意图是 ;(2)E F为NaS,是离
2 2
【解析】B.甲烷与氯气反应制氯仿:CH+3Cl CHCl +3HCl,反应物所有原子未全部转化
4 2 3
子 化 合 物 , 用 电 子 式 表 示 EF 的 形 成 过 程 为
为目标产物,不符合绿色化学的思想,B不符合,选B。 2
15.【答案】D
【解析】A.条件 b 从开始到 40min Cl 的平均反应速率为
2
=0.0100mol·L−1·min−1,故A正确;B.实验a、b相比较,起始状态和平衡状态相同,但实验b达到平衡
的时间短,反应速率快,可能使用了催化剂,平衡没有移动,故B正确;C.条件c从开始到45min,
PCl 的转化率为 ×100%=20%,故C正确;D.对比a、c曲线,起始状态不
3
(3)E、F、G三种元素的原子所形成的简单离子中,Na+比其他两种离子少一个电子层,半径最小,S2−、
同,a中气体的浓度大于c,温度也不同,a中的温度高于c,不能说明反应速率与温度的关系,故D错
Cl−具有相同的电子层结构,核电荷数大的离子半径较小,故半径由大到小的顺序是S2−>Cl−>Na+;
误;故选D。
(4)a.将单质钠投入到CuSO 溶液中,钠先和水反应生成NaOH和氢气,NaOH和CuSO 反应生成
4 4
Cu(OH) 蓝色沉淀,钠不能置换出单质铜,所以无大量红色固体生成,故不正确;b.C的气态氢化物氨
2
16.【答案】(1)
气通入AlCl 溶液,发生反应:AlCl+3NH∙H O=Al(OH) ↓+3NHCl,产生白色沉淀,氨气过量,Al(OH)
3 3 3 2 3 4 3
不溶解,故不正确;c.Cl 通入到NaBr溶液中充分反应,Cl 置换出NaBr中的Br ,加入四氯化碳,振
2 2 2
(2)
荡,静置,由于Br 易溶于CCl ,则CCl 层变为橙色,CCl 比水的密度大,在下层,故正确;d.B的最高
2 4 4 4
价氧化物CO 通入到NaSiO 溶液中产生HSiO 白色沉淀,故正确;故选ab;(5)A与B形成的10电
2 2 3 2 3
子分子的化学式为CH;CH 与Cl 在光照下能够发生取代反应,生成一系列的氯代甲烷(一氯甲烷、
4 4 2二氯甲烷、三氯甲烷、四氯化碳)及氯化氢,一氯甲烷为气体,二氯甲烷、三氯甲烷、四氯化碳均为难溶
化而变化时,说明平衡,故D正确;故选:BCD。(3)平衡时CO 的转化率为 ;
2
于水的油状液体,故试管内壁有油状液滴,氯气被消耗,因此气体颜色变浅,生成的氯化氢极易溶于
水,而使试管中的气压减小,饱和食盐水进入试管中,因此可以看到D装置的现象,答案选D。
(4)∆c(H )=3∆c(CO)=2.25mol/L , 则 平 衡 时 H 的 浓 度 为 3-2.25=0.75mol/L , H(g) 的 质 量
2 2 2 2
17.【答案】(1)CHBrCHBr 羧基 裂解 m=cVM=0.75mol/L×1L×2g/mol=1.5g,平衡时CO(g)质量为m=cVM=0.25 mol/L×1L×44g/mol=11g,则
2 2 2
质量比为11∶1.5=22∶3;(5)第9分钟时反应达平衡,则v (CHOH)=
(2)①② 逆 3
v (CHOH),第3分钟时甲醇的反应物浓度比第9分钟时的大,则v (CHOH)>v (CHOH)。
正 3 正 3 逆 3
(3)
19.【答案】(1)BC CO+2H+=H O+CO↑ OH−+H+=H O
2 2 2
(4)饱和碳酸钠溶液 分液 (2)CaO或石灰乳 Mg(OH) +2H+=Mg2++2H O
2 2
【解析】D是石油化工发展水平的标志,则D为CH=CH ,A、B、E是家庭中常见的有机物,D通过 (3)2Br−+Cl=Br +2Cl− SO +Br +2H O=HSO +2HBr
2 2 2 2 2 2 2 2 4
加聚反应得到常见的高分子材料E为聚乙烯;D与水发生加成反应生成A为C HOH,乙醇被酸性高 3Br +6Na CO+3H O=5NaBr+NaBrO +6NaHCO
2 5 2 2 3 2 3 3
锰酸钾氧化生成B为CH 3 COOH,乙酸与乙醇发生转化反应生成C为CH 3 COOCH 2 CH 3 ,乙醇发生催 【解析】(1)①粗盐精制过程1,加入Na 2 CO 3 除去Ca2+、加入NaOH溶液除去Mg2+、加入BaCl 2 溶液
化氧化生成F为CH 3 CHO,由操作⑧可知,为石油分馏,重油裂解得到乙烯。(1)G是乙烯和溴水发生 除去SO,同时需要Na 2 CO 3 溶液除去过量的Ba2+;所以加入BaCl 2 溶液后再加Na 2 CO 3 溶液,加入试剂
的顺序是NaOH溶液、BaCl 溶液、NaCO 溶液,或BaCl 溶液、NaCO 溶液、NaOH溶液,选BC;②加
2 2 3 2 2 3
加成反应生成的,其结构简式为CHBrCHBr;高分子材料E是聚乙烯,其链节是 ;产
2 2 入适量盐酸,剩余的碳酸钠和盐酸反应 CO+2H+=H O+CO↑、剩余的氢氧化钠和盐酸反应 H+
2 2
物B为CH 3 COOH,官能团名称为羧基;操作⑦得到乙烯,名称为裂解。(2)根据以上分析可知反应 +OH−=H 2 O;(2)过程2中加入CaO,CaO和水反应生成氢氧化钙,氢氧化钙和氯化镁反应生成氢氧化
①~⑥中属于取代反应的是①②。(3)反应④是乙醇的催化氧化,反应的化学方程式为 镁沉淀,或直接加入石灰乳沉淀镁离子;稀盐酸溶解氢氧化镁固体可以得到氯化镁溶液,离子方程式
为Mg(OH) +2H+=Mg2++2H O;(3)①海水中的Br−被Cl 氧化为溴单质,反应的离子方程式是2Br−
2 2 2
。(4)用乙醇、乙酸制备乙酸乙酯时,含有蒸发出的乙
+Cl=Br +2Cl−;②吸收塔中SO 和Br 反应生成HBr和硫酸,根据电子守恒SO 和Br 的系数之比为
2 2 2 2 2 2
酸、乙醇,用饱和碳酸钠溶液除去,再通过分液可以得到较纯的乙酸乙酯。 1∶1,再结合元素守恒可得化学方程式为SO 2 +Br 2 +2H 2 O=H 2 SO 4 +2HBr;③根据得失电子守恒、元素守
恒配平NaCO 溶液吸收吹出的Br 的化学方程式为:3Br +6Na CO+3H O=5
2 3 2 2 2 3 2
18.【答案】(1)
NaBr+NaBrO +6NaHCO。
3 3
(2)BCD
20.【答案】(1)氯气
(3)75%
(2)
(4)22∶3
(5)>
(3)饱和食盐水 氯气与水反应也会生成氯离子 a
【解析】(1)由图像知 ;(2)A.由图可知反 【解析】(1)在装置A高锰酸钾与浓盐酸发生氧化还原反应产生氯气,该反应的化学方程式是
应中CO 与CHOH的物质的量浓度之比为1∶1时,反应物的浓度还在变化,并未达到平衡状态,故 ;(2)在装置C浓硫酸与NaSO 发生复分解反应产
2 3 2 4
A错误;B.该反应前后气体分子数不相等,在恒温密闭容器中,压强和物质的量成正比,则混合气体
的压强不变时,反应平衡,故B正确;C.单位时间内生成3mol H 指逆反应方向,生成1mol CHOH 生SO ,该反应的化学方程式是 ;(3)②制备氯气中含有氯化氢和
2 3 2
指正反应方向,则两者速率相等,反应平衡,故C正确;D.该反应前后气体分子数不相等,即混合气
水蒸气,氯化氢进入B中溶于水也会生成氯离子,乙同学认为Cl 中混有的杂质是HCl,需要在A、B
2
体的物质的量在变化,密闭容器中气体的质量不变,则混合气体的平均相对分子质量不随时间的变
间增加一个洗气瓶,用饱和食盐水除去;②丙同学认为按乙同学的建议改进实验也不合理,理由是Cl 和水反应也会生成Cl−;③SO 被Cl 氧化为HSO ,结合硫酸根离子检验证明二氧化硫和氯气发
2 2 2 2 4
生了反应,丁同学取适量B中溶液于试管中,向其中滴加少量溶液X中含Ba2+,且不能和二氧化硫发
生反应,a.BaCl 溶液可以检验SO存在,证明SO 和Cl 发生了反应,a正确;b.Ba(OH) 和SO 反应
2 2 2 2 2
生成BaSO 沉淀,不能说明SO 和Cl 发生反应,b错误;c.无论氯气与SO 是否发生反应,二者溶于
3 2 2 2
水后的溶液显酸性,酸溶液能够使石蕊溶液变红色,所以不能确定SO 与Cl 是否反应,c错误;故合
2 2
理选项是a;④SO 与Cl 同时通入水中反应的化学方程式是:SO +Cl+2H O=2HCl+
2 2 2 2 2
HSO 。
2 4