文档内容
专题 04 化学反应与热能
专项训练
1.下列措施能使煤炭燃烧更充分,提高热能利用率的是( )
A.多加煤以使炉火更旺
B.在煤炭中加入生石灰
C.制蜂窝煤时常在煤中掺一些黄泥
D.把煤粉碎,在煤粉燃烧器中燃烧
【答案】D
【详解】
A.多加煤可导致燃烧不充分,浪费资源,A不符合题意;
B.在煤炭中加入生石灰的目的是脱硫,减少 的排放,与煤炭燃烧更充分无关,B不符合题意;
C.制蜂窝煤时常在煤中掺一些黄泥,主要目的是使煤炭易于成型,与煤炭燃烧更充分无关,C不符合题
意;
D.把煤粉碎能增加煤与空气中 的接触面积,使煤燃烧得更快、更充分,提高热能利用率,D符合题意;
故选D。
2.化学反应中往往伴随着能量的变化,下列反应既属于氧化还原反应,又属于放热反应的是
A.石灰石的分解反应 B.铝与稀盐酸反应
C.Ba(OH) ·8H O 与NH Cl反应 D.NaOH与稀硫酸反应
2 2 4
【答案】B
【解析】
分析:凡是有元素化合价升降的反应均是氧化还原反应,结合反应中的能量变化解答。
详解:A. 石灰石高温下分解生成氧化钙和二氧化碳,属于吸热的非氧化还原反应,A错误;
B. 铝与稀盐酸反应生成氢气和氯化铝,既属于氧化还原反应,又属于放热反应,B正确;
C. Ba(OH) ·8H O与NH Cl反应属于吸热的非氧化还原反应,C错误;
2 2 4
D. NaOH与稀硫酸反应生成硫酸钠和水,属于放热反应,但不是氧化还原反应,D错误。
答案选B。
3.下列说法正确的是( )
A.任何化学反应都伴随着能量的变化
B. ,该过程放出大量的热,所以该过程是放热反应C.化学反应中能量的变化都表现为热量的变化
D.如图所示,该反应是吸热反应
【答案】A
【详解】
A.一切化学变化过程中都伴随着能量的变化,故A正确;
B.物质的三态变化过程中,虽然存在能量变化,但不存在旧化学键的断裂与新化学键的形成,故不属于
化学变化,故B错误;
C.化学反应中能量变化的形式有多种,除热能外,还有光能、电能等,故C错误;
D.由题图知,该反应过程中反应物的总能量高于生成物的总能量,故该反应是放热反应,故D错误;
故选:A。
4.反应 (石墨) (金刚石)是吸热反应,下列说法不正确的是( )
A.金刚石和石墨是不同的单质
B.金刚石和石墨可以相互转化
C.石墨比金刚石更稳定
D.相同质量的石墨比金刚石的能量高
【答案】D
【详解】
A. 金刚石、石墨的结构不同,都是由碳元素组成的不同单质,A项正确;
B. 金刚石和石墨是不同的物质,二者在一定条件下可以相互转化,B项正确;
C. (石墨) (金刚石)是吸热反应,故相同质量的石墨比金刚石的能量低,即石墨比金刚石
稳定,C项正确;
D. 由C项分析知,相同质量的石墨比金刚石的能量低,D项错误;
故选D。
5.放热反应一定是( )
A.断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量多
B.贮存能量
C.反应物的总能量高于生成物的总能量
D.反应物的总能量低于生成物的总能量
【答案】C
【详解】
A.断开反应物中的化学键吸收的能量比形成生成物中的化学键放出的能量多,反应为吸热反应,故A错
误;
B.放热反应一定是释放能量的过程,故B错误;
C.放热反应一定是反应物的总能量高于生成物的总能量,故C正确;D.反应物的总能量低于生成物的总能量的反应为吸热反应,故D错误;
故选C。
6.下列说法中正确的是( )
A.放热反应在常温下就能发生,吸热反应必须加热才能进行
B.不需要加热就能发生的反应是放热反应
C.一定质量的硫在空气中完全燃烧比纯氧中燃烧放热要多
D.氯化钠晶体熔化时,离子键被破坏,吸收能量,属于吸热反应
【答案】C
【详解】
A.一个化学反应,是放热反应还是吸热反应不能用是否需要加热才能发生来判断, A错误;
B.有些放热反应如煤的燃烧、铝热反应都需要加热或高温才能进行,B错误;
C.硫在纯氧中燃烧产生的光能多,根据能量守恒,放出的热量就少,C正确;
D.吸热反应和放热反应指的是化学变化,而氯化钠晶体熔化属于物理变化,只能叫吸收能量的过程,不
能叫吸热反应,D错误;
故选C。
7.风力发电是崇明东滩湿地旅游区的一道独特景观,下列有关风力发电的叙述不正确的是
A.可节约大量煤、天然气、石油等燃料 B.有效减少二氧化碳,控制温室效应
C.风能是一种清洁的环保型能源 D.风力发电是化学能转变为电能
【答案】D
【详解】
A.风力发电可以减少热力发电的需要,从而节约大量煤、天然气、石油等燃料,故A正确;
B.风力发电过程中没有化石燃料的燃烧,且可以减少热力发电,有效减少二氧化碳,控制温室效应,故
B正确;
C.风力发电不会对环境造成污染,为清洁能源,故C正确;
D.风力发电是把风能转化为电能,故D错误;
综上所述答案为D。
8.下列说法不正确的是( )
①在高温、高压条件下发生的反应一定是吸热反应②在常温、常压下就能发生的反应一定是放热反应
③氧化还原反应都是放热反应,复分解反应除酸碱中和反应外都是吸热反应
④化合反应都是放热反应,分解反应都是吸热反应
A.②③ B.①②③
C.①③④ D.①②③④
【答案】D
【详解】
①反应 为放热反应,①错误;② 为吸热反应,②错误;
③
为吸热反应, 为放热反应,③错误;
④化合反应可能是吸热反应,如 ,分解反应可能是放热反应,如
,④错误;
故①②③④均错误,故D符合;
故选D。
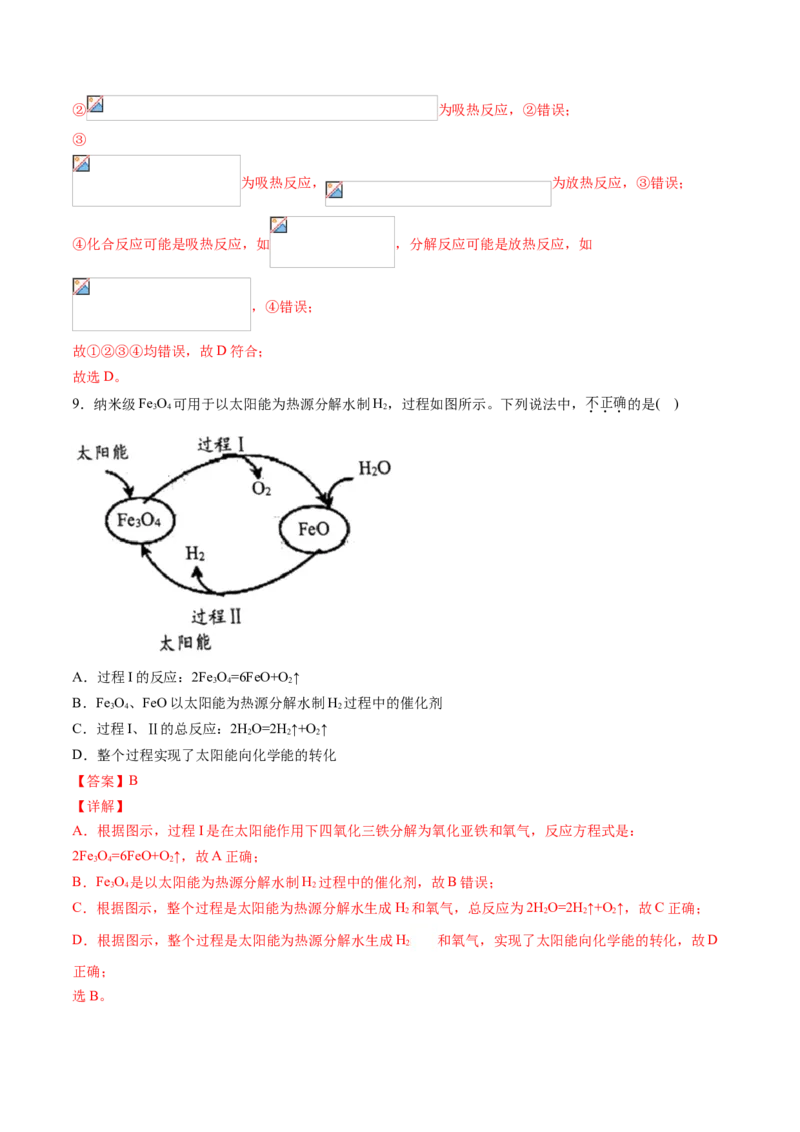
9.纳米级Fe O 可用于以太阳能为热源分解水制H,过程如图所示。下列说法中,不正确的是( )
3 4 2
A.过程I的反应:2Fe O=6FeO+O ↑
3 4 2
B.Fe O、FeO以太阳能为热源分解水制H 过程中的催化剂
3 4 2
C.过程I、Ⅱ的总反应:2HO=2H↑+O ↑
2 2 2
D.整个过程实现了太阳能向化学能的转化
【答案】B
【详解】
A.根据图示,过程I是在太阳能作用下四氧化三铁分解为氧化亚铁和氧气,反应方程式是:
2Fe O=6FeO+O ↑,故A正确;
3 4 2
B.Fe O 是以太阳能为热源分解水制H 过程中的催化剂,故B错误;
3 4 2
C.根据图示,整个过程是太阳能为热源分解水生成H 和氧气,总反应为2HO=2H↑+O ↑,故C正确;
2 2 2 2
D.根据图示,整个过程是太阳能为热源分解水生成H 和氧气,实现了太阳能向化学能的转化,故D
2
正确;
选B。10.N 和H 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、 、 分别表示
2 2
N、H、NH ,已知:N(g)+3H(g) 2NH (g) ,该反应属于放热反应。下列说法正确的是
2 2 3 2 2 3
⇌
A.催化剂仅起到吸附N 和H 的作用,对化学反应速率没有影响
2 2
B.②→③过程,是放热过程
C.③→④过程,N原子和H原子形成了含有非极性键的NH
3
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
【答案】D
【详解】
A. 由图知,通过催化剂的参与,N 和H 生成了NH ,催化剂通过改变反应条件而改变了反应速率, A
2 2 3
错误;
B. ②→③过程, 断裂为 ,H-H键断裂为两个H原子,均为吸热过程,B错误;
C. ③→④过程, N原子和H原子通过共用电子对形成NH ,N-H是极性键,C错误;
3
D. 合成氨为放热反应,反应物断键吸收能量小于生成物形成新键释放的能量,D正确。
答案选D。
11.科学家已获得了气态 分子,其结构为正四面体形(如图所示)。已知断裂1mol 键吸收193kJ
能量,断裂1mol 键吸收946kJ能量,下列说法正确的是( )
A. 属于一种新型的化合物
B. 的过程中释放1002kJ能量
C.1mol 转化为 时要吸收734kJ能量
D. 和 互为同素异形体, 转化为 属于化学变化
【答案】D
【详解】
A. 属于一种新型的单质,A项错误;
B. 的过程中吸收的能量为 ,B项错误;C. 1mol 转化为 时的能量变化为 ,即放出734kJ能量,C项错误;
D. 和 均为氮元素形成的单质,互为同素异形体, 转化为 属于化学变化,D项正确;
故选D。
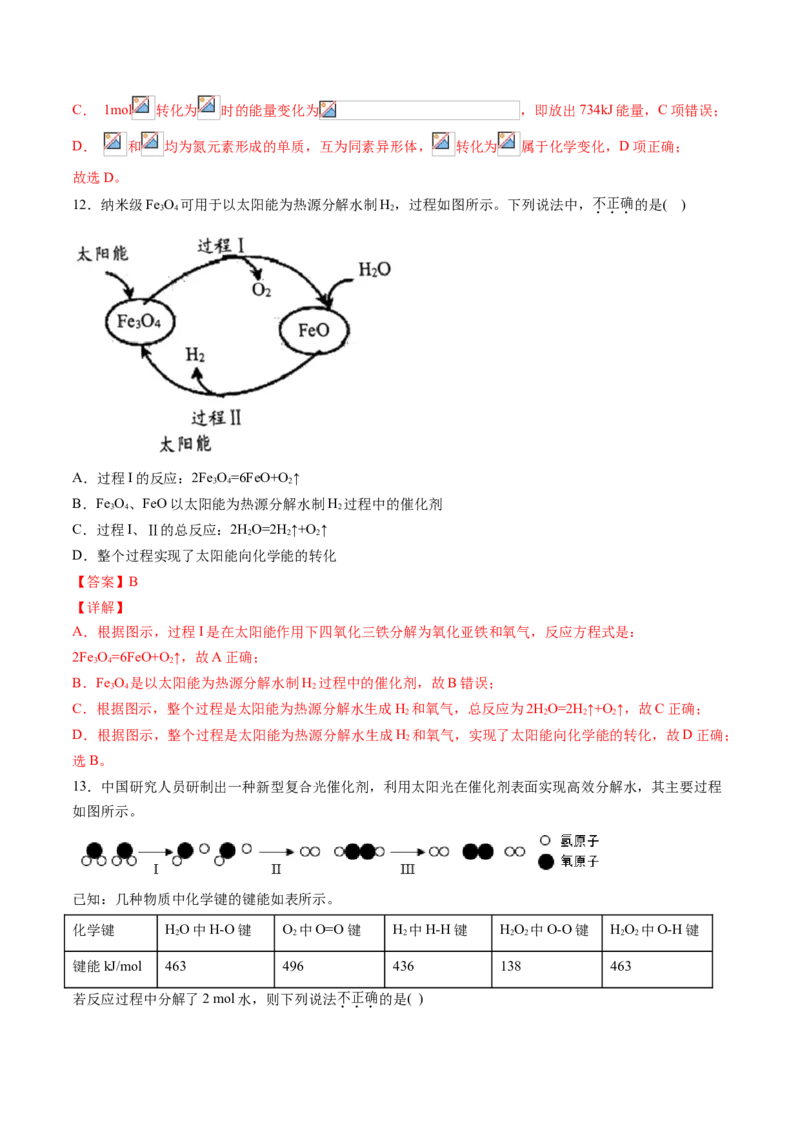
12.纳米级Fe O 可用于以太阳能为热源分解水制H,过程如图所示。下列说法中,不正确的是( )
3 4 2
A.过程I的反应:2Fe O=6FeO+O ↑
3 4 2
B.Fe O、FeO以太阳能为热源分解水制H 过程中的催化剂
3 4 2
C.过程I、Ⅱ的总反应:2HO=2H↑+O ↑
2 2 2
D.整个过程实现了太阳能向化学能的转化
【答案】B
【详解】
A.根据图示,过程I是在太阳能作用下四氧化三铁分解为氧化亚铁和氧气,反应方程式是:
2Fe O=6FeO+O ↑,故A正确;
3 4 2
B.Fe O 是以太阳能为热源分解水制H 过程中的催化剂,故B错误;
3 4 2
C.根据图示,整个过程是太阳能为热源分解水生成H 和氧气,总反应为2HO=2H↑+O ↑,故C正确;
2 2 2 2
D.根据图示,整个过程是太阳能为热源分解水生成H 和氧气,实现了太阳能向化学能的转化,故D正确;
2
选B。
13.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程
如图所示。
已知:几种物质中化学键的键能如表所示。
化学键 HO中H-O键 O 中O=O 键 H 中H-H键 HO 中O-O键 HO 中O-H键
2 2 2 2 2 2 2
键能kJ/mol 463 496 436 138 463
若反应过程中分解了2 mol水,则下列说法不正确的是( )A.总反应为2HO 2H↑+O ↑ B.过程I吸收了926 kJ能量
2 2 2
C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应
【答案】D
【详解】
A.用太阳光在催化剂表面实现高效分解水,则总反应为2HO 2H↑+O ↑,故A正确;
2 2 2
B.断裂化学键吸收能量,结合表中数据可知,过程Ⅰ吸收了463kJ×2=926kJ能量,故B正确;
C.形成化学键释放能量,则过程Ⅱ放出了436kJ+138kJ=574kJ能量,故C正确;
D.过程IIIH O 中的O−H键断裂,无化学键的形成,不属于放热反应,故D错误;
2 2
故选:D。
14.下列反应属于放热反应的是______;属于吸热反应的是_______。
A.锌粒与稀HSO 反应制取H
2 4 2
B.氢气在氧气中燃烧
C.碳酸钙高温分解成氧化钙和二氧化碳
D.氢氧化钾和硫酸中和
E.Ba(OH) ·8H O与NH Cl反应
2 2 4
F.氢气还原氧化铜
G.葡萄糖在人体内氧化分解
H.钢铁制品生锈的反应
【答案】ABDGH CEF
【分析】
一般而言,化合反应、金属和酸的反应、燃烧、酸碱中和反应、铁生锈等缓慢氧化反应、铝热反应等都是
放热反应;分解反应、还原反应、Ba(OH) •8H O与NH Cl反应等都是吸热反应,据此分析判断。
2 2 4
【详解】
A.锌粒与稀HSO 反应制取H 为放热反应;
2 4 2
B.氢气在氧气中燃烧为放热反应;
C.碳酸钙高温分解成氧化钙和二氧化碳为吸热反应;
D.氢氧化钾和硫酸中和为放热反应;
E.Ba(OH) ·8H O与NH Cl反应为吸热反应;
2 2 4
F.氢气还原氧化铜为吸热反应;
G.葡萄糖在人体内氧化分解为放热反应;
H.钢铁制品生锈的反应为放热反应;
所以属于放热反应的有ABDGH,属于吸热反应的有CEF,故答案为:ABDGH;CEF。
【点睛】
本题的易错点为G,要注意葡萄糖在人体内氧化分解实质是葡萄糖与氧气的反应,属于物质的缓慢氧化,为放热反应。
15.化学反应一定伴随能量变化。
(1)将20gBa(OH) ·8H O晶体与10g NHCl晶体一起放入烧杯中,并将烧杯放在滴有几滴水的玻璃片上,
2 2 4
用玻璃棒快速搅拌,闻到______气味,用手触摸烧杯底部感觉________,烧杯下面的玻璃片可能与烧杯
___。 说明Ba(OH) ·8H O跟NH Cl的反应是_____(填“吸热”或“放热”)反应。该反应的化学方程式
2 2 4
_________
(2)NaOH稀溶液跟稀盐酸反应的中和热与KOH稀溶液跟稀硫酸反应的中和热_____(填 “相等”或
“不等”),原因是(用适当的文字和离子方程式解释)_____
(3)下列措施可以提高燃料的燃烧效率的是________(填序号)
①提高燃料的着火点,②降低燃料的着火点,③将固体燃料粉碎,④将液体燃料雾化,⑤将燃料煤气化处
理,⑥通入适量空气
【答案】刺激性气味 烧杯底部很冷 被冻在一起 吸热
相等 中和反应的实质是:H++OH-=H O,
2
两个反应参加反应的物质、生成物均相同,反应物、生成物蕴含的化学能相同,所以反应放出的能量也相
同 ③④⑤⑥
【详解】
(1)氢氧化钡和氯化铵反应生成氯化钡、氨气和水,反应的方程式为
,氨气有刺激性气味,该反应为吸热反应,故用手
触摸烧杯底部感觉烧杯底部很冷,烧杯下面的玻璃片可能与烧杯下面的玻璃片被冻在一起;故答案为:有
刺激性气味;烧杯底部很冷;被冻在一起;吸热; ;
(2)中和热都是生成1mol水放出的热量,中和反应的实质是:H++OH-=H O,两个反应参加反应的物质、生
2
成物均相同,反应物、生成物蕴含的化学能相同,所以反应放出的能量也相同;故答案为:相等;中和反
应的实质是:H++OH-=H O,两个反应参加反应的物质、生成物均相同,反应物、生成物蕴含的化学能相
2
同,所以反应放出的能量也相同;
(3)①燃料的着火点不能改变,故①错误;
②燃料的着火点不能改变,故②错误;
③将固体燃料粉碎,能增大与空气的接触面积,提高燃料的燃烧效率,故③正确;
④将液体燃料雾化,能增大与空气的接触面积,提高燃料的燃烧效率,故④正确;
⑤将燃料煤气化处理,能增大与空气的接触面积,提高燃料的燃烧效率,故⑤正确;
⑥通入适量空气也是提高燃烧效率的一种方法,故⑥正确;
故答案为:③④⑤⑥。
16.某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,I.若E1>E2,则该反应为_____(填“放热”或“吸热”)反应。该反应可用图____(填“A”或“B”)表示。
II.若E1<E2,则该反应为______(填“放热”或“吸热”)反应。该反应可用图_____(填“A”或“B”)表示
III.下表中的数据是破坏1mol物质中的化学键所消耗的最小能量:
物质 Cl Br I HCl HBr HI H
2 2 2 2
键能(kJ/mol) 243 193 151 432 366 298 436
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是(_____)
A.H B.Cl C.Br D.I
2 2 2 2
(2)下列氢化物中最稳定的是(_____)
A.HCl B.HBr C.HI
(3)X+H===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?_______。
2 2
(4)相同条件下,X(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热
2
量最多的是_____(填写化学式)。
【答案】放热 A 吸热 B A A 放热 Cl
2
【分析】
I、反应物的总能量大于生成物的总能量为放热反应,反之为吸热反应;III、键能越大,反应时释放的能量
越多,物质本身具有的能量越低,则越稳定;旧键断裂吸收的总能量小于新键形成释放的总能量为放热反
应,反之为吸热反应;
【详解】
I.若E1>E2,反应物的总能量大于生成物的总能量,为图像A,反应放热;答案为:放热;A;
II.若E1<E2,反应物的总能量小于生成物的总能量,为图像B,反应吸热,答案为:吸热;B
III. (1)键能越大,反应时释放的能量越多,物质本身具有的能量越低,则越稳定,根据表中数据,答案
为A;
(2)键能越大,反应时释放的能量越多,则越稳定,答案为A;
(3)X+H===2HX(X代表Cl、Br、I),以氯气为例,旧键断裂吸收的总能量=243+436=679;新键形成释
2 2
放的总能量=432×2=864,反应为放热反应,答案为:放热;
(4)相同条件下,X(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,释放的热量分别
2
为:185、103、9,答案为:Cl;
2