文档内容
专题 04 化学反应与热能
知识梳理
一.化学反应与热能的转化
化石燃料燃烧会放出大量的热,除了燃烧,其它化学反应也伴随着放热或吸热现象。
1.两条基本规律
质量守恒定律: 化学反应前后物质的总质量保持不变。
能量守恒定律: 一种形式的能量可以转化为另一种形式的能量,转化的途经和能量的形式不同,
但是体系包含的总能量不变。
2.化学反应 一定 伴随有能量的变化,化学反应中能量变化主要表现为 热量 的变化,吸热或放热。
3.化学能与热能的实验探究
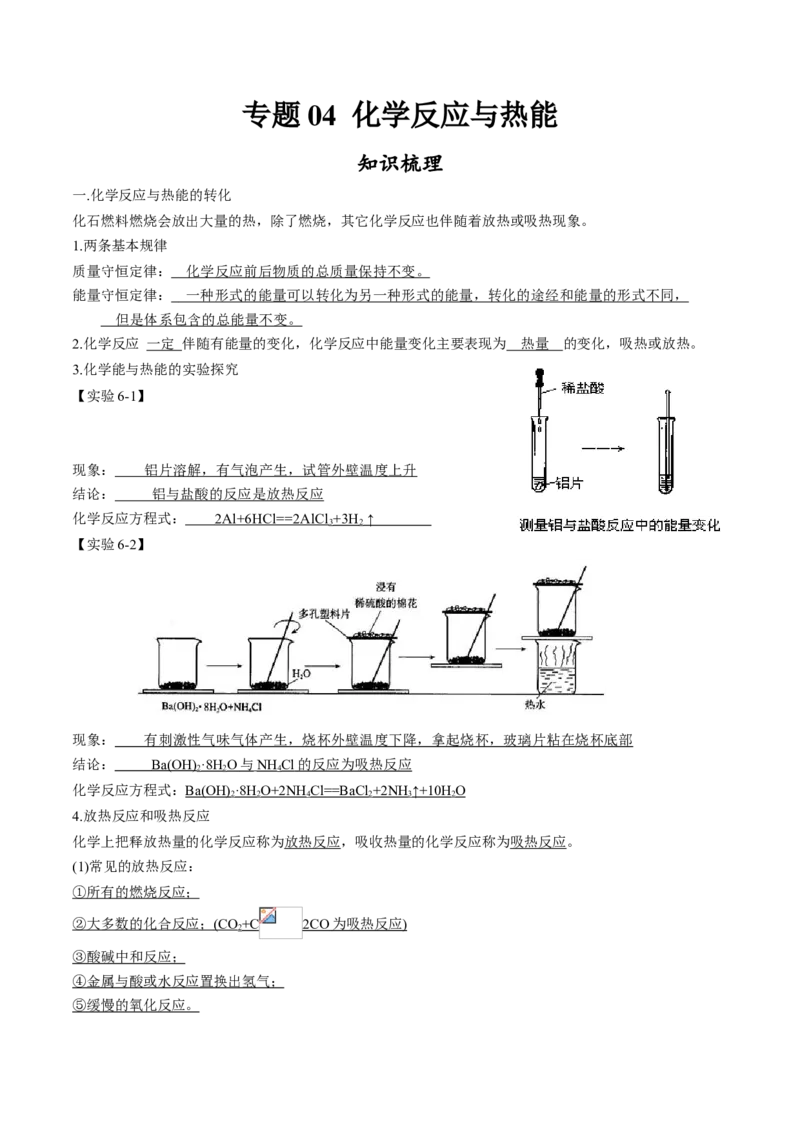
【实验6-1】
现象: 铝片溶解,有气泡产生,试管外壁温度上升
结论: 铝与盐酸的反应是放热反应
化学反应方程式: 2Al+6HCl==2AlC l +3H ↑
3 2
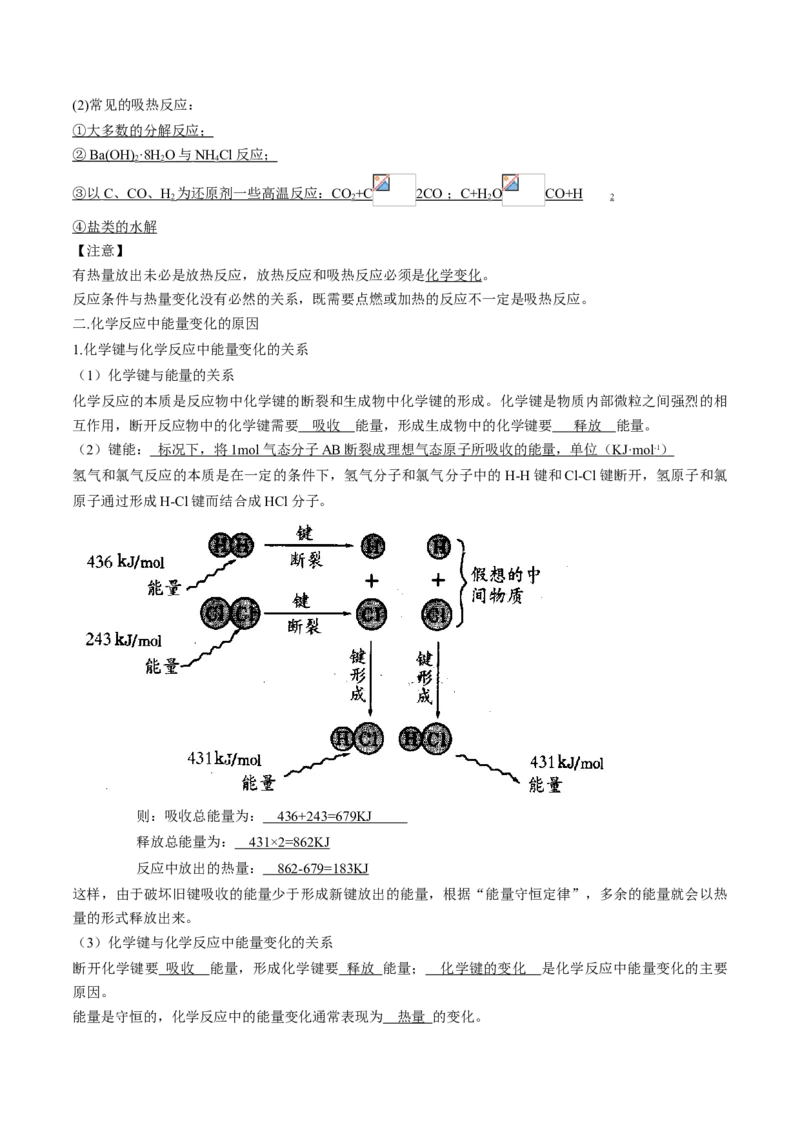
【实验6-2】
现象: 有刺激性气味气体产生,烧杯外壁温度下降,拿起烧杯,玻璃片粘在烧杯底部
结论: Ba(OH ) ·8H O 与 NH Cl 的反应为吸热反应
2 2 4
化学反应方程式:Ba(OH) ·8H O+2NH Cl==BaCl +2NH↑+10H O
2 2 4 2 3 2
4.放热反应和吸热反应
化学上把释放热量的化学反应称为放热反应,吸收热量的化学反应称为吸热反应。
(1)常见的放热反应:
① 所有的燃烧反应;
② 大多数的化合反应; (CO +C 2CO 为吸热反应 )
2
③ 酸碱中和反应;
④ 金属与酸或水反应置换出氢气;
⑤ 缓慢的氧化反应。(2)常见的吸热反应:
① 大多数的分解反应;
② Ba(OH ) ·8H O 与 NH Cl 反应;
2 2 4
③ 以 C 、 CO 、 H 为还原剂一些高温反应: CO +C 2CO ; C+H O CO+H
2 2 2 2
④ 盐类的水解
【注意】
有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。
反应条件与热量变化没有必然的关系,既需要点燃或加热的反应不一定是吸热反应。
二.化学反应中能量变化的原因
1.化学键与化学反应中能量变化的关系
(1)化学键与能量的关系
化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。化学键是物质内部微粒之间强烈的相
互作用,断开反应物中的化学键需要 吸收 能量,形成生成物中的化学键要 释放 能量。
(2)键能: 标况下, 将 1mo l 气态分子 AB 断裂成理想气态原子所吸收的能量,单位( KJ·mo l -1 )
氢气和氯气反应的本质是在一定的条件下,氢气分子和氯气分子中的H-H键和Cl-Cl键断开,氢原子和氯
原子通过形成H-Cl键而结合成HCl分子。
则:吸收总能量为: 436+243=679KJ
释放总能量为: 431×2=862K J
反应中放出的热量: 862-679=183K J
这样,由于破坏旧键吸收的能量少于形成新键放出的能量,根据“能量守恒定律”,多余的能量就会以热
量的形式释放出来。
(3)化学键与化学反应中能量变化的关系
断开化学键要 吸收 能量,形成化学键要 释放 能量; 化学键的变化 是化学反应中能量变化的主要
原因。
能量是守恒的,化学反应中的能量变化通常表现为 热量 的变化。2.从物质储存化学能的角度理解化学反应过程中能量变化的关系
(1)一个确定的化学反应完成后的结果是吸收能量还是放出能量,决定于 反应物总能量 和
生成物总能量 相对大小。
(2)化学反应中的能量变化通常表现为热量的变化,吸热或者放热。吸热反应和放热反应与反应物和生
成物总能量的关系如下:
吸热反应:反应物的总能量 小于 生成物的总能量
放热反应:反应物的总能量 大于 生成物的总能量
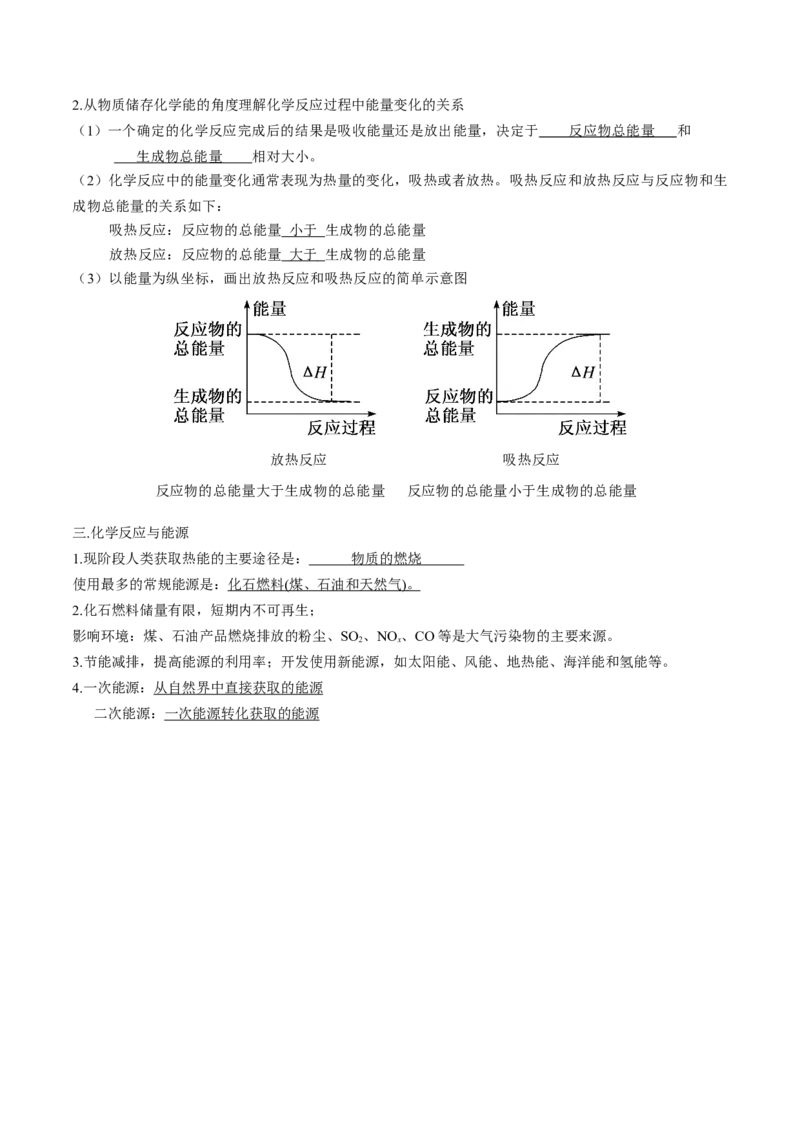
(3)以能量为纵坐标,画出放热反应和吸热反应的简单示意图
放热反应 吸热反应
反应物的总能量大于生成物的总能量 反应物的总能量小于生成物的总能量
三.化学反应与能源
1.现阶段人类获取热能的主要途径是: 物质的燃烧
使用最多的常规能源是: 化石燃料 ( 煤、石油和天然气 ) 。
2.化石燃料储量有限,短期内不可再生;
影响环境:煤、石油产品燃烧排放的粉尘、SO 、NO、CO等是大气污染物的主要来源。
2 x
3.节能减排,提高能源的利用率;开发使用新能源,如太阳能、风能、地热能、海洋能和氢能等。
4.一次能源:从自然界中直接获取的能源
二次能源:一次能源转化获取的能源