文档内容
专题 06 化学反应的速率和限度
专项训练
1.下列关于化学反应速率的说法正确的是( )
A.增加反应物的量、提高反应温度都能增大反应速率
B.化学反应速率为0.6 是指1s时某物质浓度为0.6
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度
2.下列有关化学反应限度的说法不正确的是( )
A.任何可逆反应的进程都有一定限度
B.化学反应的限度决定了反应物在该条件下转化为生成物的最大转化率
C.化学平衡状态是指一定条件下进行的可逆反应达到的最大限度
D.化学反应的限度不可以通过改变条件而改变
3.某可逆反应达到平衡状态时,下列说法正确的是( )
①正反应和逆反应同时进行,两者的速率完全相等
②反应物和生成物同时存在,两者的浓度相同
③混合物的组成比例不会因时间而改变
A.只有① B.①③ C.只有② D.①②③
4.在密闭容器中进行如下反应: ,已知 、 、Z的起始浓度分别为
、 、 ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Y为 B. 为
C. 为 D.Z为
5.在2L恒容密闭容器中投入2.0molX(g)、4.0molY发生如下反应:X(g)+Y(?) 3Z(g),测得X物质的
量与时间的关系如表所示:
时间/min 1 2 4 6 8
X物质的量/mol 1.5 1.2 1.0 0.9 0.8
下列说法正确的是( )
A.增加Y的质量,反应速率一定加快
B.0~4minZ的平均反应速率为 mol•L-1•min-1C.2~4minX的平均反应速率为 mol•L-1•min-1
D.X、Y的反应速率一定相等
6.反应 在四种不同情况下的反应速率如下,则反应速率由快到慢的顺序为( )
① ② ③ ④
A.②>④>③>① B.②=③>④>① C.①>②=③>④ D.④>①>②>③
7.在恒温、恒容的密闭容器中进行反应 ,若反应物的浓度由 降到
需要20s,那么反应物浓度再由 降到 所需要的时间为( )
A.10s B.大于10s C.小于10s D.无法判断
8.等质量的锌与过量盐酸在不同的实验条件下进行反应,实验数据如表所示。收集相同条件下相同体积
的氢气,所需时间最短的一组是( )
组别 A B C D
盐酸浓度/(mol/L) 2.0 2.5 2.5 2.5
温度/℃ 25 30 50 50
锌的状态 块状 粉末 块状 粉末
9.在 的反应中,现采取下列措施,其中能够使反应速率增大的措施是
①缩小体积,增大压强 ②增加碳的量
③通入 ④恒容下充入 ⑤恒压下充入
A.①④ B.②③⑤ C.①③ D.①②④
10.在可逆反应: 中,已知:起始浓度A为 ,B为 ,C
的反应速率为0.5 mol/(L·min), 后,测得D的浓度为 。则关于此反应的下列说法正确的
是
A. 末时A和B的浓度之比为5:3
B.
C. 末时B的浓度为
D. 末时A的消耗浓度为
11.关于一定温度下进行的反应A(g)+3B(g) 2C(g),下列叙述不能表明该反应达到化学平衡状态的是(
)
⇌
A.C的生成速率与C的分解速率相等B.混合气体的总物质的量不再变化
C.A、B、C的浓度不再变化
D.单位时间内生成a mol A,同时分解2a mol C
12.一定温度下,向一恒容密闭容器中充入2 mol SO 和1 mol O ,在一定条件下发生反应:
2 2
2SO (g)+O(g) 2SO (g),下列有关说法正确的是( )
2 2 3
A.当O 的浓度不变时,反应达到平衡状态
2 ⇌
B.达到化学平衡时,正反应和逆反应的速率相等且都为零
C.当单位时间内消耗a mol O ,同时消耗2a mol SO 时,反应达到平衡状态
2 2
D.当SO 、O、SO 的分子数之比为2:1:2时,反应达到平衡状态
2 2 3
13.在容积固定的容器中,发生反应2HI(g) H(g)+I(g),下列说法中能证明反应已达到平衡状态的是(
2 2
)
⇌
①混合气体的颜色不再变化 ②各组分浓度相等 ③v (H )=2v (HI)
正 2 逆
④一个H—H键断裂的同时有两个H—I键断裂 ⑤混合气体的平均摩尔质量不再变化
A.①④ B.①②④
C.①③⑤ D.①④⑤
14.在一定温度下,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应:
A(s)+2B(g) C(g)+2D(g)。5 min后达到平衡,测得容器内B的浓度减少了0.2 mol·L-1,则下列叙述不正
确的是( )
⇌
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.平衡时B的转化率为50%
C.平衡时B的体积分数约为33.3%
D.初始时的压强与平衡时的压强比为4:5
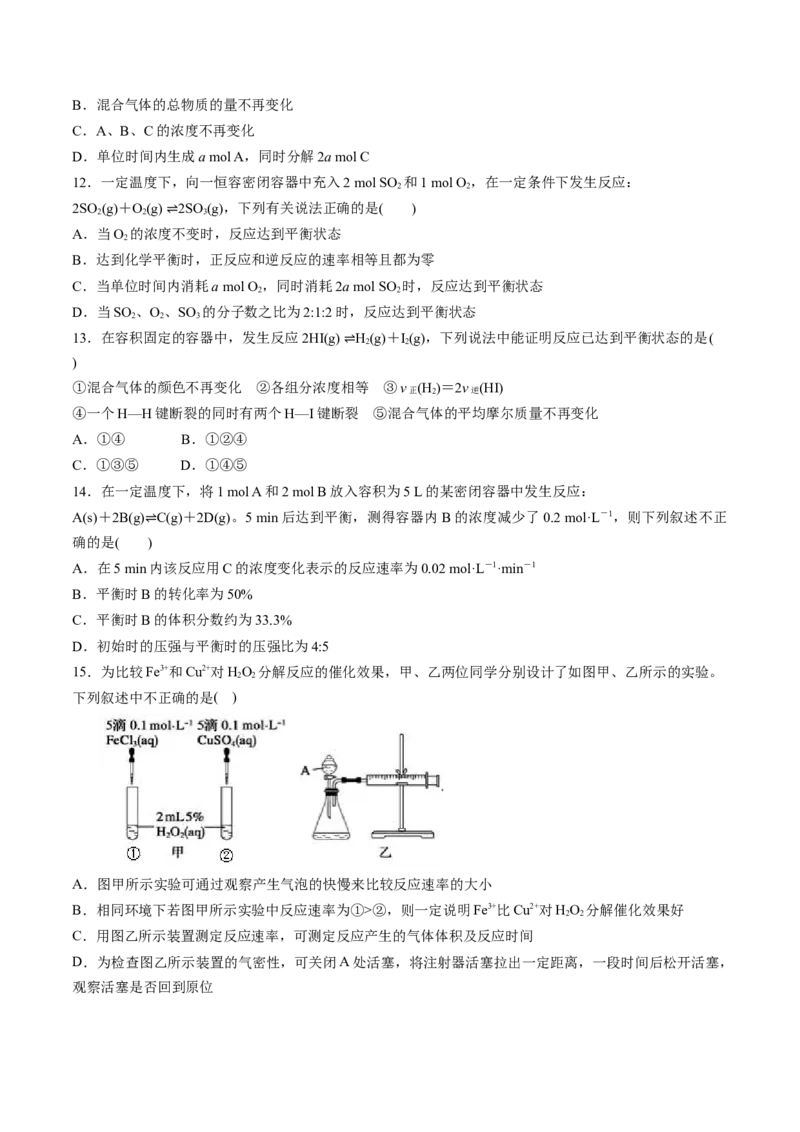
15.为比较Fe3+和Cu2+对HO 分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。
2 2
下列叙述中不正确的是( )
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.相同环境下若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对HO 分解催化效果好
2 2
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图乙所示装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,
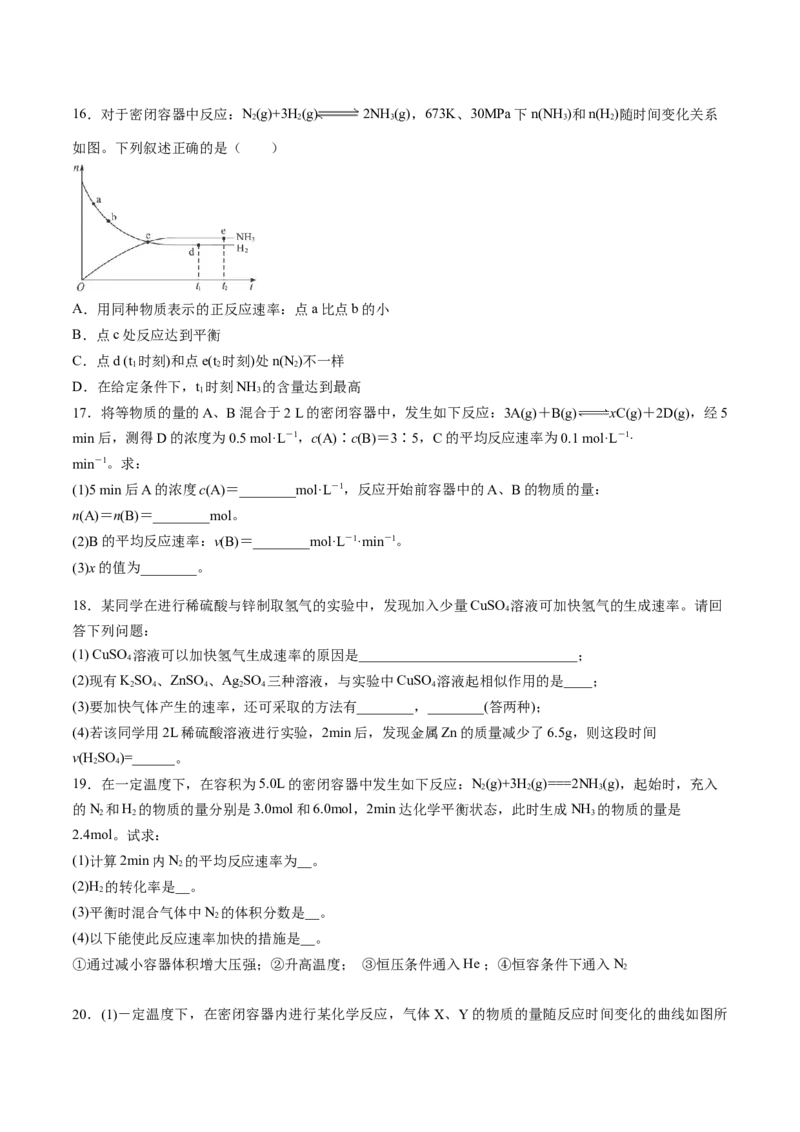
观察活塞是否回到原位16.对于密闭容器中反应:N(g)+3H(g) 2NH(g),673K、30MPa下n(NH )和n(H )随时间变化关系
2 2 3 3 2
如图。下列叙述正确的是( )
A.用同种物质表示的正反应速率:点a比点b的小
B.点c处反应达到平衡
C.点d (t 时刻)和点e(t 时刻)处n(N )不一样
1 2 2
D.在给定条件下,t 时刻NH 的含量达到最高
1 3
17.将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5
min后,测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,C的平均反应速率为0.1 mol·L-1·
min-1。求:
(1)5 min后A的浓度c(A)=________mol·L-1,反应开始前容器中的A、B的物质的量:
n(A)=n(B)=________mol。
(2)B的平均反应速率:v(B)=________mol·L-1·min-1。
(3)x的值为________。
18.某同学在进行稀硫酸与锌制取氢气的实验中,发现加入少量CuSO 溶液可加快氢气的生成速率。请回
4
答下列问题:
(1) CuSO 溶液可以加快氢气生成速率的原因是_______________________________;
4
(2)现有KSO 、ZnSO、Ag SO 三种溶液,与实验中CuSO 溶液起相似作用的是____;
2 4 4 2 4 4
(3)要加快气体产生的速率,还可采取的方法有________,________(答两种);
(4)若该同学用2L 稀硫酸溶液进行实验,2min后,发现金属Zn的质量减少了6.5g,则这段时间
v(H SO )=______。
2 4
19.在一定温度下,在容积为5.0L的密闭容器中发生如下反应:N(g)+3H(g)===2NH (g),起始时,充入
2 2 3
的N 和H 的物质的量分别是3.0mol和6.0mol,2min达化学平衡状态,此时生成NH 的物质的量是
2 2 3
2.4mol。试求:
(1)计算2min内N 的平均反应速率为__。
2
(2)H 的转化率是__。
2
(3)平衡时混合气体中N 的体积分数是__。
2
(4)以下能使此反应速率加快的措施是__。
①通过减小容器体积增大压强;②升高温度; ③恒压条件通入He ;④恒容条件下通入N
2
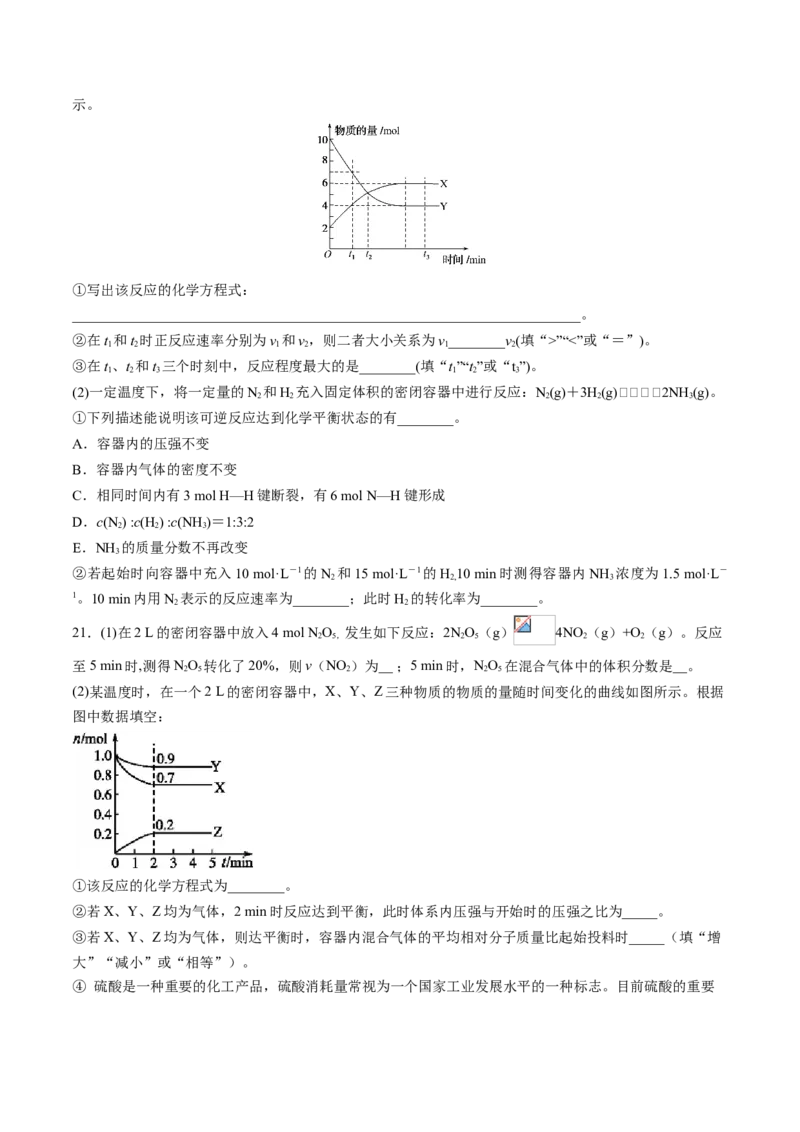
20.(1)-定温度下,在密闭容器内进行某化学反应,气体X、Y的物质的量随反应时间变化的曲线如图所示。
①写出该反应的化学方程式:
________________________________________________________________________。
②在t 和t 时正反应速率分别为v 和v,则二者大小关系为v________v(填“>”“<”或“=”)。
1 2 1 2 1 2
③在t、t 和t 三个时刻中,反应程度最大的是________(填“t”“t”或“t”)。
1 2 3 1 2 3
(2)一定温度下,将一定量的N 和H 充入固定体积的密闭容器中进行反应:N(g)+3H(g)2NH (g)。
2 2 2 2 3
①下列描述能说明该可逆反应达到化学平衡状态的有________。
A.容器内的压强不变
B.容器内气体的密度不变
C.相同时间内有3 mol H—H键断裂,有6 mol N—H键形成
D.c(N ) :c(H ) :c(NH )=1:3:2
2 2 3
E.NH 的质量分数不再改变
3
②若起始时向容器中充入10 mol·L-1的N 和15 mol·L-1的H 10 min时测得容器内NH 浓度为1.5 mol·L-
2 2, 3
1。10 min内用N 表示的反应速率为________;此时H 的转化率为________。
2 2
21.(1)在2 L的密闭容器中放入4 mol N O 发生如下反应:2NO(g) 4NO (g)+O (g)。反应
2 5, 2 5 2 2
至5 min时,测得NO 转化了20%,则v(NO )为__ ;5 min时,NO 在混合气体中的体积分数是__。
2 5 2 2 5
(2)某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据
图中数据填空:
①该反应的化学方程式为________。
②若X、Y、Z均为气体,2 min时反应达到平衡,此时体系内压强与开始时的压强之比为_____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时_____(填“增
大”“减小”或“相等”)。
④ 硫酸是一种重要的化工产品,硫酸消耗量常视为一个国家工业发展水平的一种标志。目前硫酸的重要生产方法是“接触法”,有关反应2SO +O 2SO 的说法正确的是___(多选) 。
2 2 3
A.该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫
B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为0
C.一定条件下,向某密闭容器中加入2 mol SO 和1 mol O 则从反应开始到达平衡的过程中,正反应速率
2 2,
不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
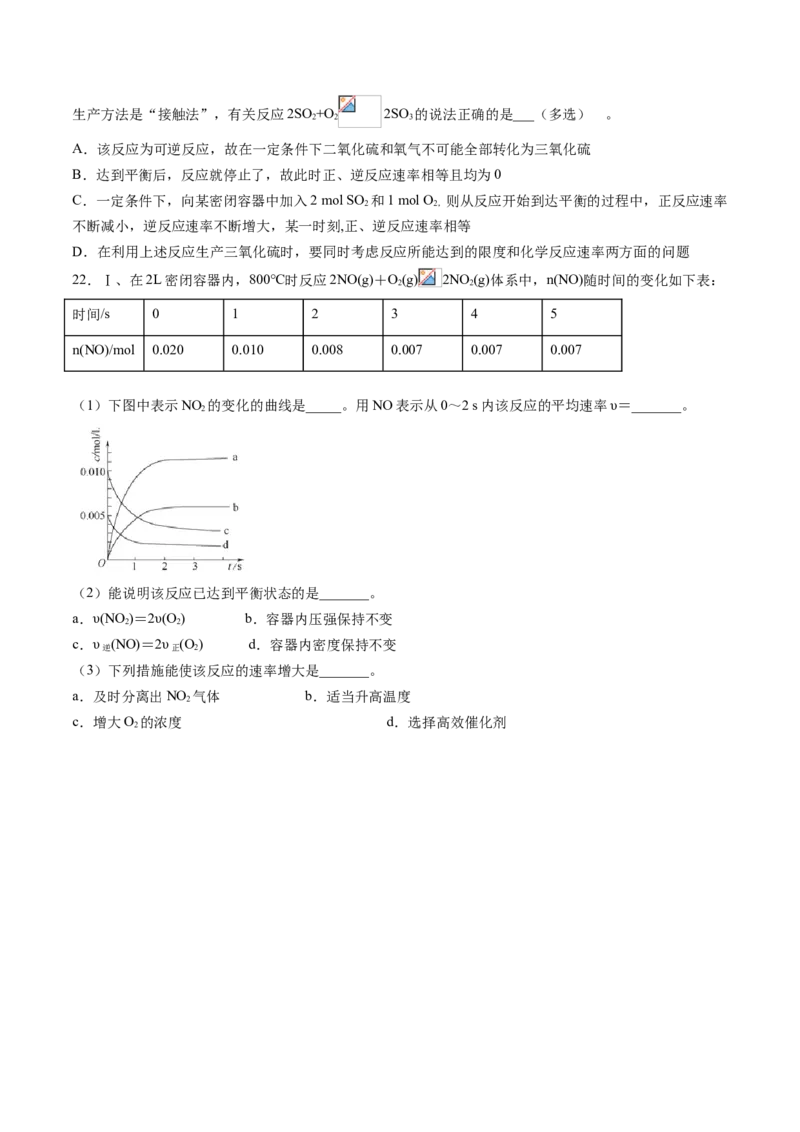
22.Ⅰ、在2L密闭容器内,800℃时反应2NO(g)+O(g) 2NO (g)体系中,n(NO)随时间的变化如下表:
2 2
时间/s 0 1 2 3 4 5
n(NO)/mol 0.020 0.010 0.008 0.007 0.007 0.007
(1)下图中表示NO 的变化的曲线是_____。用NO表示从0~2 s内该反应的平均速率υ=_______。
2
(2)能说明该反应已达到平衡状态的是_______。
a.υ(NO )=2υ(O ) b.容器内压强保持不变
2 2
c.υ (NO)=2υ (O ) d.容器内密度保持不变
逆 正 2
(3)下列措施能使该反应的速率增大是_______。
a.及时分离出NO 气体 b.适当升高温度
2
c.增大O 的浓度 d.选择高效催化剂
2