文档内容
1990年江西高考化学真题及答案
可能用到的数据
原子量 H 1 C 12 N 14 O 16 Na 23 Si 28 S 32 Cl 35.5
K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Hg 201
一、 选择题(本题共有5小题,每小题1分,共5分)
说明:每小题只有一个选项符合题意,请将所选编号(A、B、C、D)填入括号内.
1.通常用来衡量一个国家的石油化学工业发展水平的标志是
(A)石油的产量 (B)乙烯的产量
(C)合成纤维的产量 (D)硫酸的产量
2.设N 代表阿佛加德罗常数,下列说法正确的是
A
(A)2.3克金属钠变为钠离子时失去的电子数目为0.1N
A
(B)18克水所含的电子数目为N
A
(C)在常温常压下11.2升氯气所含的原子数目为N
A
(D)32克氧气所含的原子数目为N
A
3.道尔顿的原子学说曾经起了很大作用.他的学说中,包含有下述三个论点:①原子
是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球
体。从现代观点看,你认为这三个论点中不确切的
(A)只有③ (B)只有①③
(C)只有②③ (D)有①②③
4.下列四种物质,只能跟NaOH溶液作用,不能跟盐酸作用的是
(A)NaHS (B)NaAlO
2
(C)KHSO (D)CH COONH
4 3 4
5.以下贮存物质的方法正确的是
(A)少量白磷贮存在二硫化碳中
(B)水玻璃贮存在带玻璃塞的玻璃瓶中
(C)少量钠贮存在酒精中
(D)少量钠贮存在煤油中
二、选择题(本题共有20小题,每小题2分,共40分)
第1页 | 共11页说明:每小题有一个或两个选项符合题意,请将所选编号(A、B、C、D)填入括号内.
若正确答案只包含一个选项,多选时,该小题为零分;若正确答案包括两个选项,每选对一个
给一分,但只要选错一个,该小题就为零分.
1
6.X、Y、Z分别代表3种不同的短周期元素.X元素的原子最外层电子排布为ns ;Y元素
原子的M电子层中有2个未成对电子;Z元素原子的L电子层的P亚层中有4个电子.由这3种元
素组成的化合物的分子式可能是
(A)X YZ (B)X YZ (C)XYZ (D)X YZ
3 4 4 4 2 2 4
7.某元素X的核外电子数等于核内中子数.取该元素单质2.8克与氧气充分作用,可得
到6克化合物XO .该元素在周期表中的位置是
2
(A)第三周期 (B)第二周期
(C)第Ⅳ主族 (D)第Ⅴ主族
8.下列说法正确的是
(A)可逆反应的特征是正反应速度总是和逆反应速度相等
(B)在其它条件不变时,使用催化剂只能改变反应速度,而不能改变化学平衡状态
(C)在其它条件不变时,升高温度可以使化学平衡向吸热反应的方向移动
(D)在其它条件不变时,增大压强一定会破坏气体反应的平衡状态
9.下列说法正确的是
(A)酸式盐的溶液一定显碱性
(B)只要酸与碱的摩尔浓度和体积分别相等,它们反应后的溶液就呈中性
(C)纯水呈中性是因为水中氢离子摩尔浓度和氢氧根离子摩尔浓度相等
(D)碳酸溶液中氢离子摩尔浓度是碳酸根离子摩尔浓度的二倍
10.把0.05摩NaOH固体分别加入下列100毫升液体中,溶液的导电能力变化不大的是:
(A)自来水 (B)0.5摩/升盐酸
(C)0.5摩/升醋酸 (D)0.5摩/升氯化铵溶液
第2页 | 共11页11.已知:①2FeCl +2Kl=2FeCl +2KCl+I ②2FeCl +Cl =2FeCl 判断下列物质的氧化
3 2 2 2 2 3
能力由大到小的顺序是
3+ 3+
(A)Fe >Cl >I (B)Cl >Fe >I
2 2 2 2
3+ 3+
(C)I >Cl >Fe (D)Cl >I >Fe
2 2 2 2
12.下列各组物质气化或熔化时,所克服的微粒间的作用(力),属同种类型的是
(A)碘和干冰的升华 (B)二氧化硅和生石灰的熔化
(C)氯化钠和铁的熔化 (D)苯和已烷的蒸发
13.下列反应的离子方程式不正确的是:
(A)醋酸加入氨水:CHCOOH+NH·HO CHCOO-+NH++HO
3 3 2 3 4 2
+ 2+
(B)铜片插入硝酸银溶液:Cu+Ag =Cu +Ag
(C)碳酸钙加入醋酸:CO2-+2CHCOOH=CO↑+2CHCOO-+HO
3 3 2 3 2
3+ - 2+
(D)硫氰化钾溶液加入三氯化铁溶液:Fe +SCN =[Fe(SCN)]
14.下列各组离子中,在碱性溶液里能大量共存,且溶液为无色透明的是
(A)K+、MnO-、Cl-、SO2-
4 4
(B)Na+、AlO-、NO-、CO2-
2 3 3
(C)Na+、H+、NO-、SO2-
3 4
(D)Na+、SO2-、S2-、Cl-
4
15.分别由下列四组物质制取气体:①浓盐酸和MnO ;②(NH ) SO 和Ca(OH) ;③NaCl
2 4 2 4 2
和H SO (浓);④FeS和H SO (稀).所产生的气体在同温同压下的密度,由小到大的排列顺序
2 4 2 4
为
(A) ②<④<③<① (B)②<④<①<③
(C) ③<①<④<② (D)①<③<④<②
16.某无色混和气体可能含有CO 、CO、H O(水蒸气)、H 中的一种或几种依次进行如
2 2 2
下处理(假定每次处理都反应完全):①通过碱石灰时,气体体积变小;②通过赤热的氧
化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清的石灰水时,
溶液变得浑浊.由此可以确定原混和气体中
第3页 | 共11页(A)一定含有CO 、H O,可能含有H 、CO
2 2 2
(B)一定含有H O、CO,可能含有CO 、H
2 2 2
(C)一定含有CO、CO ,可能含有H O、H
2 2 2
(D)一定含有CO、H ,可能含有H O、CO
2 2 2
17.关于实验室制备乙烯的实验,下列说法正确的是
(A)反应物是乙醇和过量的3摩/升硫酸的混和液
(B)温度计插入反应溶液液面以下,以便控制温度在140℃
(C)反应容器(烧瓶)中应加入少许瓷片
(D)反应完毕先灭火再从水中取出导管
18.烯烃在一定条件下发生氧化反应时,C=C双键发生断裂,RCH=CHR'可以氧化成RCHO
和R'CHO.在该条件下,下列烯烃分别被氧化后,产物中可能有乙醛的是
(A)CH CH=CH(CH ) CH (B)CH =CH(CH ) CH
3 2 2 3 2 2 3 3
(C)CH CH=CHCH=CHCH (D)CH CH CH=CHCH CH
3 3 3 2 2 3
19.10毫升某种气态烃,在50毫升氧气里充分燃烧,得到液态水和体积为35毫升的混和
气体(所有气体体积都是在同温同压下测定的),则该气态烃可能是
(A)甲烷 (B)乙烷 (C)丙烷 (D)丙烯
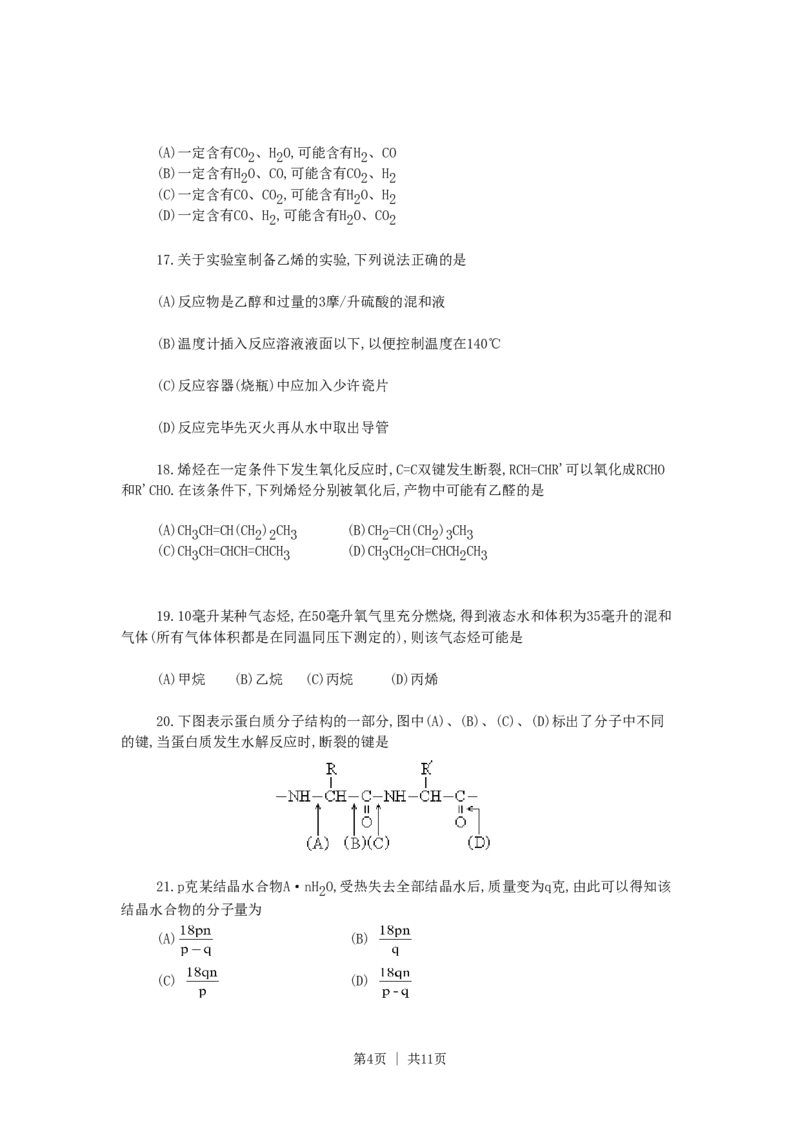
20.下图表示蛋白质分子结构的一部分,图中(A)、(B)、(C)、(D)标出了分子中不同
的键,当蛋白质发生水解反应时,断裂的键是
21.p克某结晶水合物A·nH O,受热失去全部结晶水后,质量变为q克,由此可以得知该
2
结晶水合物的分子量为
(A) (B)
(C) (D)
第4页 | 共11页22.分别加热下列三种物质各100克:①KMnO 、②KClO (另加少量MnO 、③HgO.完全
4 3 2
反应后,所放出的氧气量由多到少的顺序是
(A)①>②>③ (B)②>①>③
(C)①>③>② (D)②>③>①
23.今有H 和CO(体积比为1:2)的混和气体V升,当其完全燃烧时,所需O 的体积为
2 2
(A)3V升 (B)2V升 (C)V升 (D)0.5V升
24.把100克10%KNO 溶液的浓度增加到20%,可以采用的方法是
3
(A)蒸发掉45克水 (B)蒸发掉50克水
(C)加入10克KNO 固体 (D)加入15克KNO 固体
3 3
25.若20克密度为d克/厘米3的硝酸钙溶液里含1克Ca2+,则NO-离子的浓度是
3
(A) 摩/升 (B) 摩/升
(C)2.5d摩/升 (D)1.25d摩/升
三、选择题(本题共有5小题,每小题3分,共15分)说明:每小题只有一个选项符合题意,
请将所选编号(A、B、C、D)填入括号内.
26.某元素的醋酸盐的分子量为m,相同价态该元素的硝酸盐的分子量为n.则该元素的
此种化合价的数值为
(A) (B)
(C) (D)
27.在373K时,把0.5摩N O 气通入体积为5升的真空密闭容器中,立即出现棕色.反应
2 4
进行到2秒时,NO 的浓度为0.02摩/升.在60秒时,体系已达平衡,此时容器内压强为开始时
2
的1.6倍.下列说法正确的是
(A)前2秒,以N O 的浓度变化表示的平均反应速度为0.01摩/升·秒
2 4
(B)在2秒时体系内的压强为开始时的1.1倍
第5页 | 共11页(C)在平衡时体系内含N O 0.25摩
2 4
(D)平衡时,如果压缩容器体积,则可提高N O 的转化率
2 4
28.把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶
液和盐酸的摩尔浓度相同,它们的浓度是
(A)0.5摩/升 (B)0.1摩/升 (C)0.05摩/升 (D)1摩/升
29.将两个铂电极插入500毫升CuSO 溶液中进行电解,通电一定时间后,某一电极增重
4
0.064克(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化).此时溶液中氢离子
浓度约为
-3 -3
(A)4×10 摩/升 (B)2×10 摩/升
-3 -7
(C)1×10 摩/升 (D)1×10 摩/升
30.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
(A)(CH)CHCHCHCH (B)(CHCH)CHCH
3 2 2 2 3 3 2 2 3
(C)(CH)CHCH(CH) (D)(CH)CCHCH
3 2 3 2 3 3 2 3
四、(本题包括6小题,共20分)
31.(本小题2分)完成并配平化学方程式(在空格内填入系数或化合物的分子式).
32.(本小题2分)请写出五种化学性质不同的物质的分子式,这些分子都各具有10个电
子.它们的分子式是: 、 、 、 、 .
33.(本小题2分)请写出六种你学过的有机化合物的结构简式,这些化合物燃烧后产生
的CO 和H O(气)的体积比符合如下比值(各写三种):
2 2
V /V =2的有:________、________、________
CO2 H2O(气)
V /V =0.5的有:________、________、________
CO2 H2O(气)
34.(本小题6分)有A、B、C、D、E、F六瓶未知溶液.它
们是MgSO 、BaCl 、(NH ) CO 、AgNO 、HBr和NaOH.为了鉴
4 2 4 2 3 3
别,各取少许溶液进行两两混和试验,结果如右表.表
中"↓"表示有沉淀或生成微溶化合物,"↑"表示有气体生
成,"—"表示观察不到明显的现象变化.由此可以判断:
A是 、B是 、C是 、
第6页 | 共11页D是 、E是 、F是 .
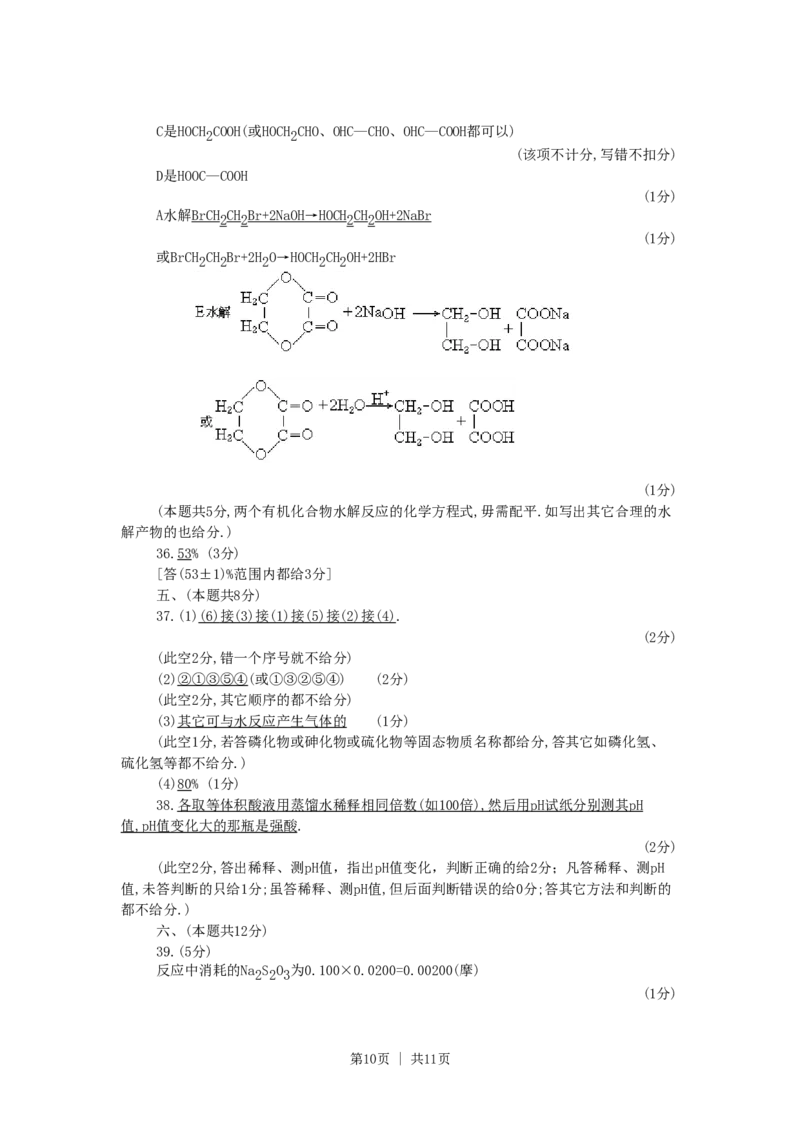
35.(本小题5分)由乙烯和其它无机原料合成环状化合物E,请在下列方框内填入合适
的化合物的结构简式.
并请写出A和E的水解反应的化学方程式.
A水解: .
E水解: .
36.(本小题3分)某化肥厂用NH 制备NH NO 已知:由NH 制NO的产率是96%、NO制HNO
3 4 3 3 3
的产率是92%,HNO 跟NH 反应生成NH NO .则制HNO 所用去的NH 的质量占总耗NH 质量(不
3 3 4 3 3 3 3
考虑生产上的其它损耗)的 %.
五、(本题共8分)
37.(本小题6分)电石中的碳化钙和水能完全反应:
CaC +2H O=C H ↑+Ca(OH)
2 2 2 2 2
使反应产生的气体排水,测量排出水的体积,可计算出标准状况乙炔的体积,从而可测
定电石中碳化钙的含量.
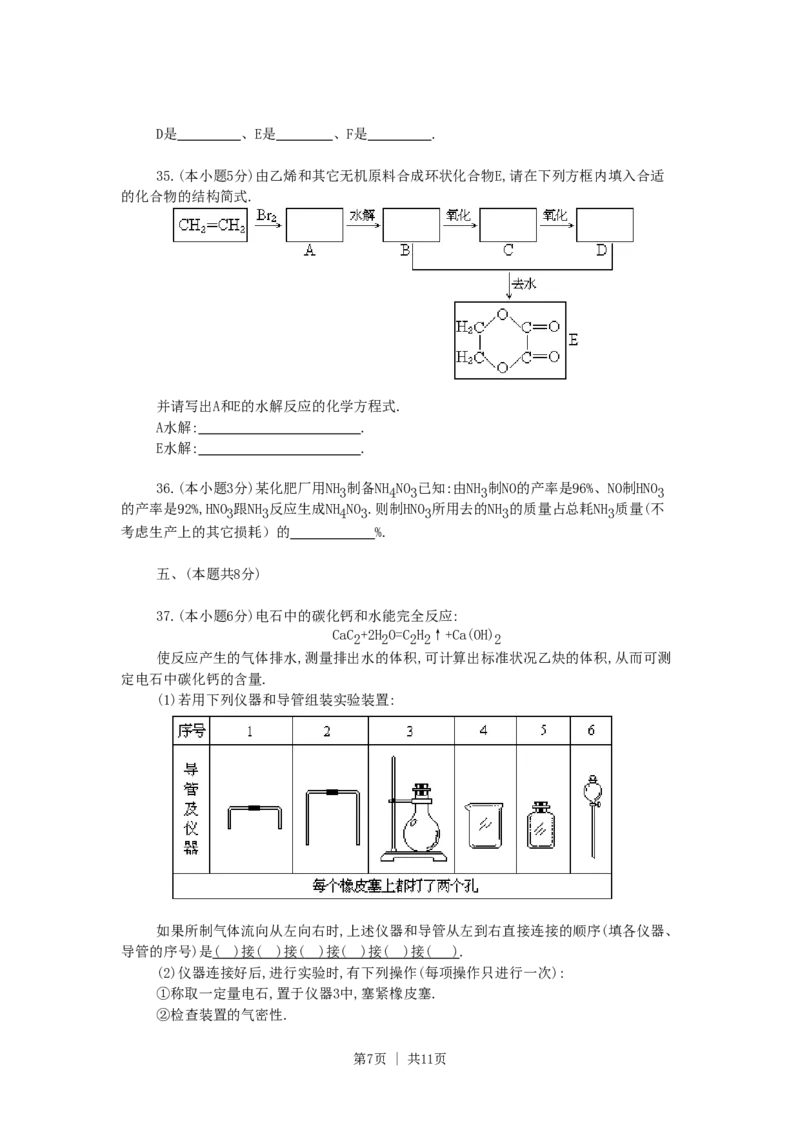
(1)若用下列仪器和导管组装实验装置:
如果所制气体流向从左向右时,上述仪器和导管从左到右直接连接的顺序(填各仪器、
导管的序号)是 ( ) 接 ( ) 接 ( ) 接 ( ) 接 ( ) 接 ( ).
(2)仪器连接好后,进行实验时,有下列操作(每项操作只进行一次):
①称取一定量电石,置于仪器3中,塞紧橡皮塞.
②检查装置的气密性.
第7页 | 共11页③在仪器6和5中注入适量水.
④待仪器3恢复到室温时,量取仪器4中水的体积(导管2中的水忽略不计).
⑤慢慢开启仪器6的活塞,使水逐滴滴下,至不发生气体时,关闭活塞.
正确的操作顺序(用操作编号填写)是 .
(3)若实验产生的气体有难闻的气味,且测定结果偏大,这是因为电石中含有
杂质.
(4)若实验时称取的电石1.60克,测量排出水的体积后,折算成标准状况乙炔的体积为
448毫升,此电石中碳化钙的百分含量是 %.
38.(本小题2分)有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸.现只有石蕊试液、酚
酞试液、pH试纸和蒸馏水,而没有其它试剂.简述如何用最简便的实验方法来判别哪瓶是强
酸: .
六、(本题共12分)
39.(本小题5分)工业上常用漂白粉跟酸反应放出的氯气质量对漂白粉质量的百分比
(x%)来表示漂白粉的优劣.漂白粉与酸的反应为:
Ca(ClO) +CaCl +2H SO =2CaSO +2Cl ↑+2H O
2 2 2 4 4 2 2
现为了测定一瓶漂白粉的x%,进行了如下实验.称取漂白粉样品2.00克,加水研磨后,
转入250毫升容量瓶内,用水稀释至刻度.摇匀后,取出25.0毫升,加入过量的KI溶液和过量
的稀硫酸,静置.待漂白粉放出的氯气与KI完全反应后,用0.100摩/升的
Na S O 标准溶液滴定反应中生成的碘,反应如下:
2 2 3
2Na S O +I =Na S O +2NaI
2 2 3 2 2 4 6
滴定时用去Na S O 溶液20.0毫升.试由上述数据计算该漂白粉的x%.
2 2 3
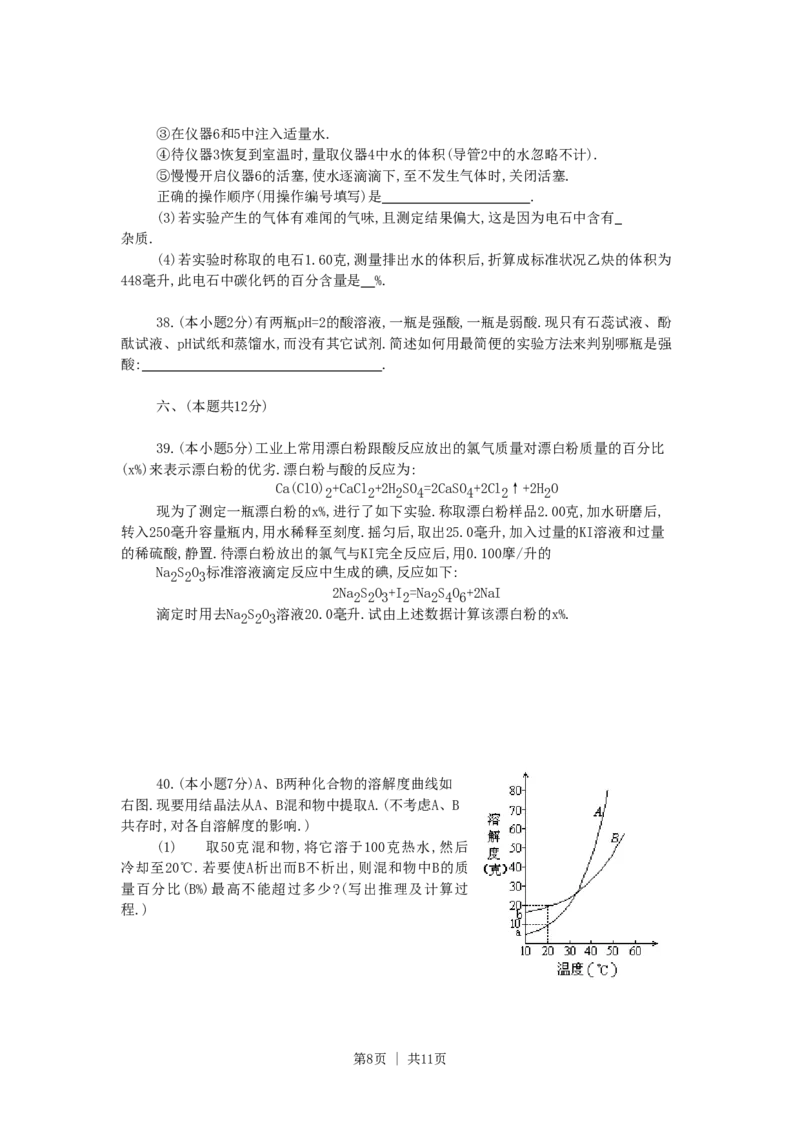
40.(本小题7分)A、B两种化合物的溶解度曲线如
右图.现要用结晶法从A、B混和物中提取A.(不考虑A、B
共存时,对各自溶解度的影响.)
(1) 取50克混和物,将它溶于100克热水,然后
冷却至20℃.若要使A析出而B不析出,则混和物中B的质
量百分比(B%)最高不能超过多少?(写出推理及计算过
程.)
第8页 | 共11页(2)取W克混和物,将它溶于100克热水,然后冷却至10℃.若仍要使A析出而B不析出,请
写出在下列两种情况下,混和物中A的质量百分比(A%)应满足什么关系式.(以W、a、b表示.
只需将答案填写在下列横线的空白处.)
答:当Wa+b时,A% .
参考答案
一、(本题共有5小题,每小题1分,共5分)
1.B 2.A 3.D 4.C 5.D
(每小题只有1个选项符合题意.只选1项且选对者给1分,其它选法该小题均为0分)
二、(本题共有20小题,每小题2分,共40分)
6.B、D 7.A、C 8.B、C 9.C 10.B、D
11.B 12.A、D 13.B、C 14.B、D 15.A
16.D 17.C 18.A、C 19.B、D 20.C
21.A 22.B 23.D 24.B 25.C
(每小题有1个或2个选项符合题意.对于正确答案只包括1个选项的:只选1项且选对者
给2分;其它选法,该小题均为0分.对于正确答案包括2个选项的:只选2项,且全选对者给2分;
只选1项且选对者给1分;其它选法,该小题均为0分.)
三、(本题共有5小题,每小题3分,共15分)
26.A 27.B 28.C 29.A 30.D
(每小题只有1个选项符合题意.只选1项且选对者给3分,其它选法该小题均为0分)
四、(本题共20分)
31.
[2]KMnO +[5]KNO +[3][H SO ]=[2]MnSO +[1]K SO +[5]KNO +[3]H O
4 2 2 4 4 2 4 3 2
(2分)(除系数1可以不写外,其它各空,包括H SO ,只要错1项,该题为0分)
2 4
32.Ne、HF、H O、NH 、CH .(2分)
2 3 4
[答对5个,给2分;答对3个或4个,给1分;只答对1个或2个,不给分.考生如答其它正确
答案(如B ),也可以算答对1个,但同时答D O和H O的,只算答对1个.]
2 2 2
(气)=2的有:CH≡CH、或
33. 、
(1分)
(气)=0.5的有:CH 、CH OH、NH CONH (1分)
4 3 2 2
(每行3个全对,给1分,不全对不给分.两行共2行.其它合理答案可给分;不合理答案,
如HC≡C—OH不给分.)
34.A是(NH ) CO B是NaOH C是MgSO D是BaCl E是HBr F是AgNO
4 2 3 4 2 3
(每空1分,共6分)
35.A是BrCH CH Br(或BrCH CH OH)
2 2 2 2
(1分)
B是HOCH CH OH
2 2
(1分)
第9页 | 共11页C是HOCH COOH(或HOCH CHO、OHC—CHO、OHC—COOH都可以)
2 2
(该项不计分,写错不扣分)
D是HOOC—COOH
(1分)
A水解BrCH CH Br+2NaO H → HOC H CH OH+2NaBr
2 2 2 2
(1分)
或BrCH CH Br+2H O→HOCH CH OH+2HBr
2 2 2 2 2
(1分)
(本题共5分,两个有机化合物水解反应的化学方程式,毋需配平.如写出其它合理的水
解产物的也给分.)
36.53% (3分)
[答(53±1)%范围内都给3分]
五、(本题共8分)
37.(1) (6 ) 接 (3 ) 接 (1 ) 接 (5 ) 接 (2 ) 接 (4 ).
(2分)
(此空2分,错一个序号就不给分)
(2)②①③⑤④(或①③②⑤④) (2分)
(此空2分,其它顺序的都不给分)
(3)其它可与水反应产生气体的 (1分)
(此空1分,若答磷化物或砷化物或硫化物等固态物质名称都给分,答其它如磷化氢、
硫化氢等都不给分.)
(4)80% (1分)
38. 各取等体积酸液用蒸馏水稀释相同倍数 ( 如 10 0 倍 ) , 然后用 p H 试纸分别测其 p H
值 ,p H 值变化大的那瓶是强酸 .
(2分)
(此空2分,答出稀释、测pH值,指出pH值变化,判断正确的给2分;凡答稀释、测pH
值,未答判断的只给1分;虽答稀释、测pH值,但后面判断错误的给0分;答其它方法和判断的
都不给分.)
六、(本题共12分)
39.(5分)
反应中消耗的Na S O 为0.100×0.0200=0.00200(摩)
2 2 3
(1分)
第10页 | 共11页(1分)
因而Cl 亦为0.00100摩
2
(1分)
(2分)
或列成一个总式:
(5分)
40.(7分)
(1)在20℃时,若要B不析出,该溶液中B的质量不能超过20克,由于A、B质量共50克,所
以这时A的质量超过30克,大于它的溶解度,A析出,符合题意.即50克×B%≤20克,B%≤40%或
B%<40%.
(2分)
(只答B%=40%给1分)
(5分)
(全对给5分,答对一个给2分.若答案中没有等号、不等号,也没有用中文说明大小的,
该答案不给分.
)
第11页 | 共11页