文档内容
机密★启⽤前
⽟溪⼀中 2024—2025学年下学期⾼⼀ 6⽉⽉考
化 学
注意事项:
1.答卷前,考⽣务必⽤⿊⾊碳素笔将⾃⼰的姓名、准考证号、考场号、座位号填写在
答题卡上,并认真核准条形码上的姓名、准考证号、考场号、座位号及科⽬,在规定的位置
贴好条形码。
2.回答选择题时,选出每⼩题答案后,⽤2B铅笔把答题卡上对应题⽬的答案标号涂
⿊。如需改动,⽤橡⽪擦⼲净后,再选涂其他答案标号。回答⾮选择题时,⽤⿊⾊碳素笔将
答案写在答题卡上。写在本试卷上⽆效。
3.考试结束后,将本试卷和答题卡⼀并交回。
⼀、选择题:本题共14⼩题,每⼩题3分,共42分。在每⼩题给出的四个选项中,只有⼀
项是符合题⽬要求的。
1.下列说法正确的是
A.丙烯(CH-CH=CH)所有原⼦均处于同⼀平⾯
3 2
B.某有机物完全燃烧⽣成⼆氧化碳和⽔,说明该有机物⼀定属于烃
C.可⽤酸性⾼锰酸钾溶液除去⼄烷中混有的⼄烯
D.1 mol⼄醇与⾜量钠反应可产⽣11.2L氢⽓(标况下),但没有钠与⽔反应剧烈,说明
⼄醇中含⼀个羟基且羟基上的氢没有⽔中的氢活性⼤
2.下列化学式只表示⼀种物质的是
A.C B.C H C.C H D.C H O
3 8 5 15 2 16
3.少量铁粉与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率⽽不
改变H 的产量,可使⽤如下⽅法中的
2
①加⼊少量Cu粉 ②加⼊⼏滴浓硝酸 ③加CH COONa固体
3
④加NaCl溶液 ⑤加⼊⼏滴硫酸铜溶液 ⑥升⾼温度(不考虑盐酸发挥)
⑦改⽤10mL0.1mol/L盐酸
A.①⑥⑦ B.②④⑦ C.④⑥⑦ D.③⑥⑦
4.在光照的条件下,将1 mol甲烷与⼀定量的氯⽓充分混合,经过⼀段时间,甲烷和氯⽓
均⽆剩余,⽣成⼀氯甲烷、⼆氯甲烷、三氯甲烷、四氯化碳和氯化氢,若已知⽣成的⼆氯甲
烷、三氯甲烷、四氯化碳的物质的量分别为amol、bmol、cmol,该反应中消耗的氯⽓的物
质的量是
A.(1-a-b-c)mol B.(1+a+2b+3c) mol
C.(2a+3b+4c)mol D.(a+b+c)mol
化学试题第1⻚(共6⻚)
学科⽹(北京)股份有限公司5.对于反应:4NH(g)+5O(g)4NO(g)+6HO(g),不同条件下,其化学反应速率
3 2 2
最快的是
A.v(NH)=0.2mol·L-1·s-1 B.v(O)=0.24mol·L-1·s-1
3 2
C.v(HO)=15mol·L-1·min-1 D.v(NO) =9mol·L-1·min-1
2
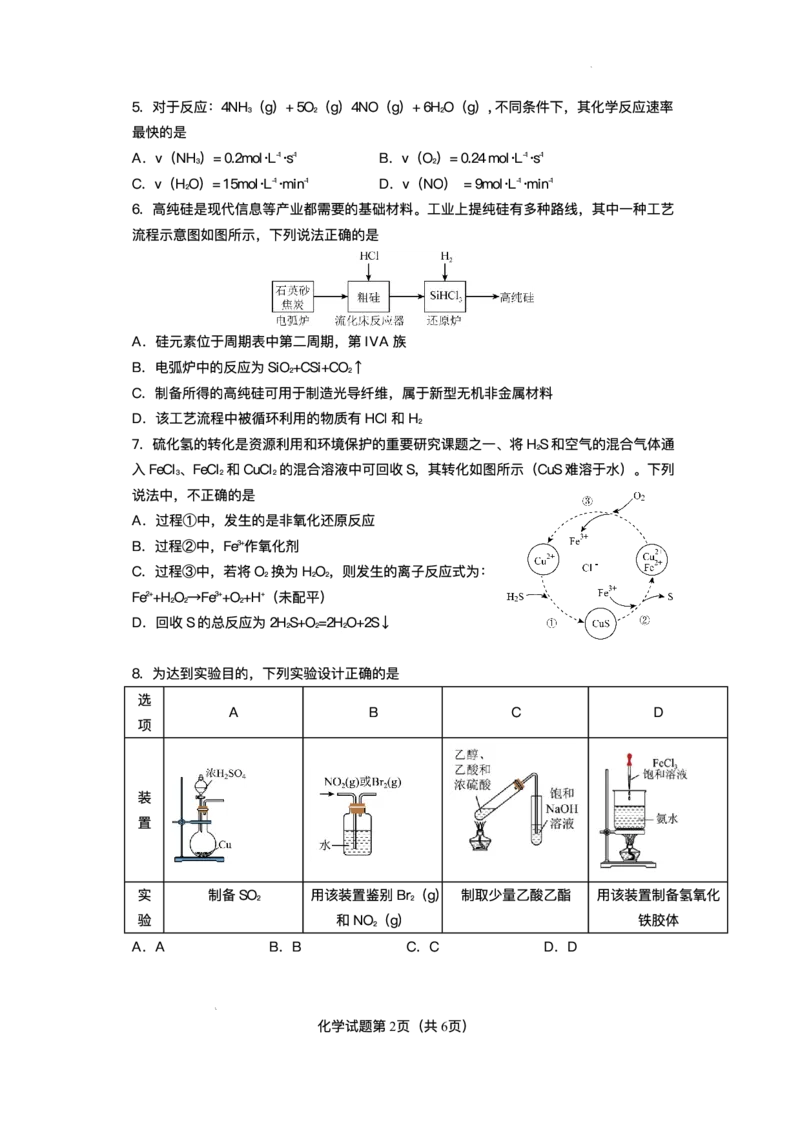
6.⾼纯硅是现代信息等产业都需要的基础材料。⼯业上提纯硅有多种路线,其中⼀种⼯艺
流程示意图如图所示,下列说法正确的是
A.硅元素位于周期表中第⼆周期,第IVA 族
B.电弧炉中的反应为SiO+CSi+CO↑
2 2
C.制备所得的⾼纯硅可⽤于制造光导纤维,属于新型⽆机⾮⾦属材料
D.该⼯艺流程中被循环利⽤的物质有HCl和H
2
7.硫化氢的转化是资源利⽤和环境保护的重要研究课题之⼀、将HS和空⽓的混合⽓体通
2
⼊FeCl、FeCl 和CuCl 的混合溶液中可回收S,其转化如图所示(CuS难溶于⽔)。下列
3 2 2
说法中,不正确的是
A.过程①中,发⽣的是⾮氧化还原反应
B.过程②中,Fe3+作氧化剂
C.过程③中,若将O 换为HO,则发⽣的离⼦反应式为:
2 2 2
Fe2++HO→Fe3++O+H+(未配平)
2 2 2
D.回收S的总反应为2HS+O=2HO+2S↓
2 2 2
8.为达到实验⽬的,下列实验设计正确的是
选
A B C D
项
装
置
实 制备SO ⽤该装置鉴别Br(g) 制取少量⼄酸⼄酯 ⽤该装置制备氢氧化
2 2
验 和NO(g) 铁胶体
2
A.A B.B C.C D.D
化学试题第2⻚(共6⻚)
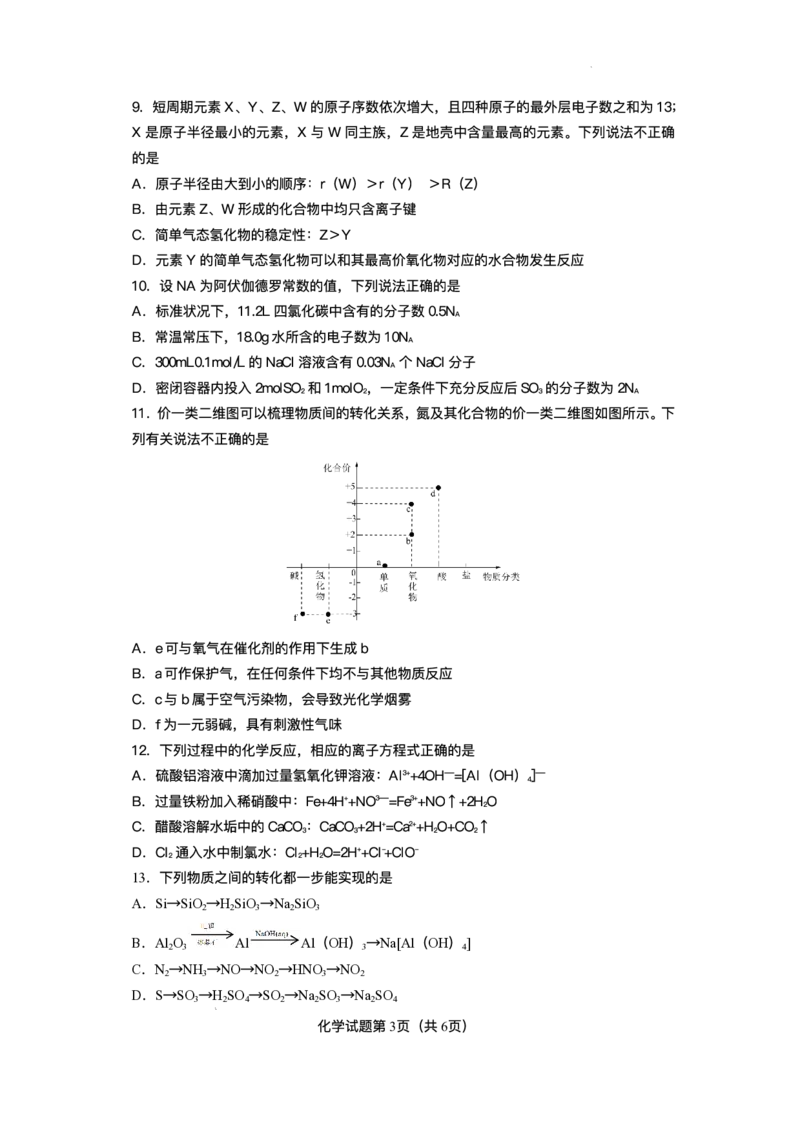
学科⽹(北京)股份有限公司9.短周期元素X、Y、Z、W的原⼦序数依次增⼤,且四种原⼦的最外层电⼦数之和为13;
X 是原⼦半径最⼩的元素,X 与W同主族,Z是地壳中含量最⾼的元素。下列说法不正确
的是
A.原⼦半径由⼤到⼩的顺序:r(W)>r(Y) >R(Z)
B.由元素Z、W形成的化合物中均只含离⼦键
C.简单⽓态氢化物的稳定性:Z>Y
D.元素Y 的简单⽓态氢化物可以和其最⾼价氧化物对应的⽔合物发⽣反应
10.设NA 为阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,11.2L四氯化碳中含有的分⼦数0.5N
A
B.常温常压下,18.0g⽔所含的电⼦数为10N
A
C.300mL0.1mol/L的NaCl溶液含有0.03N 个NaCl分⼦
A
D.密闭容器内投⼊2molSO 和1molO,⼀定条件下充分反应后SO 的分⼦数为2N
2 2 3 A
11.价⼀类⼆维图可以梳理物质间的转化关系,氮及其化合物的价⼀类⼆维图如图所示。下
列有关说法不正确的是
A.e可与氧⽓在催化剂的作⽤下⽣成b
B.a可作保护⽓,在任何条件下均不与其他物质反应
C.c与b属于空⽓污染物,会导致光化学烟雾
D.f为⼀元弱碱,具有刺激性⽓味
12.下列过程中的化学反应,相应的离⼦⽅程式正确的是
A.硫酸铝溶液中滴加过量氢氧化钾溶液:Al3++4OH—=[Al(OH)]—
4
B.过量铁粉加⼊稀硝酸中:Fe+4H++NO3—=Fe3++NO↑+2HO
2
C.醋酸溶解⽔垢中的CaCO:CaCO+2H+=Ca2++HO+CO↑
3 3 2 2
D.Cl 通⼊⽔中制氯⽔:Cl+HO=2H++Cl-+ClO-
2 2 2
13.下列物质之间的转化都⼀步能实现的是
A.Si→SiO →H SiO →Na SiO
2 2 3 2 3
B.Al O Al Al(OH) →Na[Al(OH) ]
2 3 3 4
C.N →NH →NO→NO →HNO →NO
2 3 2 3 2
D.S→SO →H SO →SO →Na SO →Na SO
3 2 4 2 2 3 2 4
化学试题第3⻚(共6⻚)
学科⽹(北京)股份有限公司14.某电池的⼯作原理如图所示,阳离⼦交换膜只允许阳离⼦通过,总反应为,下列说法正
确的是
A.⽯墨为电池的负极
B.通过该原电池反应可知,Cu可溶于稀硫酸中
C.电池⼯作时,HO 被氧化
2 2
D.H+透过阳离⼦交换膜向⽯墨电极区移动
⼆、⾮选择题:本题共4⼩题,共52分。
15.(16分)化学反应速率和限度与⽣产、⽣活密切相关,这是化学学科重点研究发展的
⽅⾯之⼀。
(1)氨⽓被⼴泛⽤于化⼯、轻⼯、化肥、合成纤维、制药等领域,已知⼯业合成氨的反应
为 。⽓态分⼦中1mol化学键解离成⽓态原⼦所吸收的能量称为键
能(kJ·mol-1),⼀些共价键的键能如下表所示。
共价键
键能(kJ·mol-1) 436 946 391
①请根据上表数据计算,⼀定条件下氮⽓与氢⽓⽣成2molNH 时___________(填“ 放
3
出” 或“ 吸收” )的热量为M。
②在与①相同条件下,将1molN 和3molH 放⼊⼀密闭容器中发⽣上述反应,放出或
2 2
吸收的热量为N,则M与N数值⼤⼩⽐较,正确的是___________(填选项字⺟)。
A.M<N B.M>N C.M=N D.⽆法确定
(2)⼀定条件下铁可以和CO 发⽣反应: 。⼀定温度下,
2
向某密闭容器中加⼊⾜量铁粉并充⼊⼀定量的CO ⽓体,反应过程中CO ⽓体和CO⽓体
2 2
的浓度与时间的关系如图所示。
①t min时,正、逆反应速率的⼤⼩关系为v ___________v (填“ >”“ <” 或“ =” )
1 正 逆
。
②下列条件的改变能减慢其反应速率的是___________(填选项字⺟)。
A.降低温度 B.减⼩铁粉的质量
化学试题第4⻚(共6⻚)
学科⽹(北京)股份有限公司C.保持压强不变,充⼊He D.保持容积不变,充⼊⼀定量CO
2
③下列描述能说明上述反应已达到平衡状态的是___________(填选项字⺟)。
A.v(CO) =v(CO)
2
B.单位时间内,⽣成nmolCO 的同时也⽣成nmolCO
2
C.容器中⽓体压强不随时间变化⽽变化
D.容器中⽓体的平均相对分⼦质量不随时间变化⽽变化
(3)N H 空⽓碱性燃料电池的能量转化效率⾼,装置示意图如图所示。
2 4
①电池⼯作⼀段时间后,电解质溶液的碱性___________(填“ 增强” 、“ 减弱” 或“ 不
变” );
②写出a极的电极反应式:___________。
③当⽣成11.2LN(标准状况)时,电路中电⼦转移了___________mol。
2
16.(14分)Na S O 应⽤⼴泛,可由反应Na CO +2Na S+4SO =3Na S O +CO 制备。实
2 2 3 2 3 2 2 2 2 3 2
验室制备Na S O 的⼀种装置如下。
2 2 3
已知:Na S O 在中性或碱性环境中稳定,在酸性环境下易分解产⽣硫单质和SO 。
2 2 3 2
(1)装置A中发⽣反应的化学⽅程式为_______。
(2)C中发⽣的总反应可视为由以下4个反应组成:
I.Na CO +SO =Na SO +CO
2 3 2 2 3 2
Ⅱ.Na S+SO +H O=Na SO +H S
2 2 2 2 3 2
Ⅲ.……
Ⅳ.S+Na SO =Na S O
2 3 2 2 3
①补全反应Ⅲ的化学⽅程式:_______。
②已知反应(Ⅳ)相对较慢,则装置C中反应达到终点的现象是_______。此时若不及时
停⽌装置A中的反应,Na S O 产量会降低,原因是_______。
2 2 3
(3)Na S O 固体久置会存在硫酸根,请设计简单的实验⽅案检验Na S O 中存在硫酸
2 2 3 2 2 3
根_______。
化学试题第5⻚(共6⻚)
学科⽹(北京)股份有限公司(4)可⽤Na S O 清除⾃来⽔中的余氯(以Cl 代表余氯),该反应的离⼦⽅程式_______
2 2 3 2
。某天然⽔经氯⽓消毒后,其中的余氯含量为15.2mg/L(以Cl 计),欲使⽔中余氯含量降
2
低⾄1.0mg/L,理论上每升⽔中应加⼊Na S O 的质量为_______ mg。
2 2 3
17.(14分)⾼铁酸钾(化学式: )是⼀种暗紫⾊固体,具有强氧化性。在强碱性溶
液中稳定,易溶于⽔,微溶于浓KOH溶液,难溶于异丙醇(⼀种有机溶剂),在⽣活中常
被⽤作⽔处理剂。某兴趣⼩组利⽤废铁屑(含少量杂质)制备⾼铁酸钾的⼯艺流程如图所示:
回答下列问题:
(1) 中铁元素的化合价为_____,“ 氧化Ⅰ” 反应的还原产物为_____。
(2)已知“ 转化” 为复分解反应,“ 氧化Ⅱ” 中NaClO被还原为NaCl,则“ 氧化Ⅱ” 反
应的离⼦⽅程式为_____。
(3) 晶体“ 洗涤” 时,洗涤剂最好选⽤_____(填字⺟序号)。
A. B.NaOH溶液 C.异丙醇 D.稀盐酸
(4)若 晶体未洗涤⼲净,含有的杂质阴离⼦为_____。
(5)另⼀种制备 的原理为:
①请⽤单线桥法表示出电⼦转移情况_____。
②由该反应可知,氧化性: _____ (填“ >” 或“ <” )。
③向 溶液中滴加浓盐酸,能产⽣ ,这个反应表明 和 的氧化性强弱关系与②
结论相反,原因可能是_____。
18.(14分)化合物G(丙酸异丙酯)可⽤作⻝品⾹料。现可通过下列转化制取(部分反
应条件略去):
(1)A→E是加成反应,物质X的化学式是_______。
(2)物质C、D中的官能团名称分别是_______、_______。
(3)写出 的化学反应⽅程式_______。
(4)写出D+F→G的化学反应⽅程式_______,反应类型是_______。
(5)PP材料是⼀种具有耐酸碱、耐油性的⾼分⼦材料,通常⽤于制作餐具,⼯业上⽤A
来合成,请写出该化学反应⽅程式_______。
(6)某烷烃的摩尔质量是72g· mol-1,该烷烃的同分异构体有_______种,写出⼀氯代物
只有⼀种的该烷烃同分异构体的结构简式_______。
化学试题第6⻚(共6⻚)
学科⽹(北京)股份有限公司