文档内容
赤峰二中 2024 级高一下学期第二次月考
化学试题
本试卷共 19 道题 满分:100分 考试时间:75分钟
可能用到的相对原子质量: H—1 Li—7 C—12 N—14 O—16 Na-23 Si—
28 Ca-40 Br—80
第I 卷
一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个正确选项)
1.能源、材料和环境与人类生活和社会发展密切相关。下列说法错误的是
A.石灰法是燃煤脱硫的一种方法
B.航天飞机与火箭的发动机所使用的煤油属于不可再生能源
C.具有高耐腐蚀性和高硬度的钴铬人造心脏支架,其材质属于合金
D.人工智能服务于生活,其智能芯片的主要成分为SiO
2
2.下列化学用语表述错误的是
A.94号元素钚(Pu)中有145个中子的核素符号为239Pu
94
B.用电子式表示NaCl 的形成过程:
C.乙烯的结构简式为CH CH
2 2
D.正丁烷的球棍模型:
3.2025年将举办四年一届的全运会,在激动人心的体育世界中处处充满着化学知
识。下列叙述正确的是
A.开幕式时燃放的烟花,体现了金属单质的性质
B.红磷常用来制作发令枪子弹,它与白磷互为同素异形体
C.电解质饮料中常含食用盐、赤藓糖醇、柠檬酸等成分,这些成分都属于电解质
高一化学 第 1 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}D.运动员若出现急性损伤,可喷复方氯乙烷气雾剂快速镇痛,氯乙烷属于烃类
物质
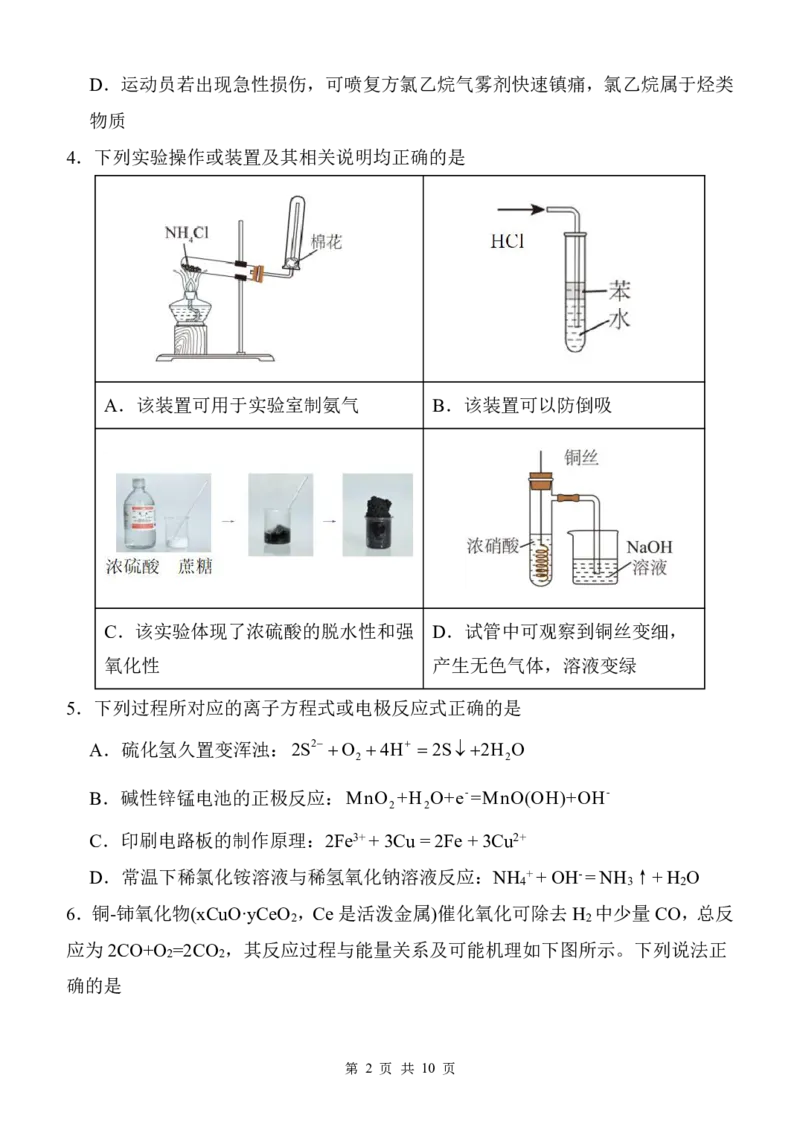
4.下列实验操作或装置及其相关说明均正确的是
A.该装置可用于实验室制氨气 B.该装置可以防倒吸
C.该实验体现了浓硫酸的脱水性和强 D.试管中可观察到铜丝变细,
氧化性 产生无色气体,溶液变绿
5.下列过程所对应的离子方程式或电极反应式正确的是
A.硫化氢久置变浑浊:2S2 O 4H 2S2H O
2 2
B.碱性锌锰电池的正极反应:MnO +H O+e-=MnO(OH)+OH-
2 2
C.印刷电路板的制作原理:2Fe3++ 3Cu =2Fe +3Cu2+
D.常温下稀氯化铵溶液与稀氢氧化钠溶液反应:NH ++ OH-=NH ↑+H O
4 3 2
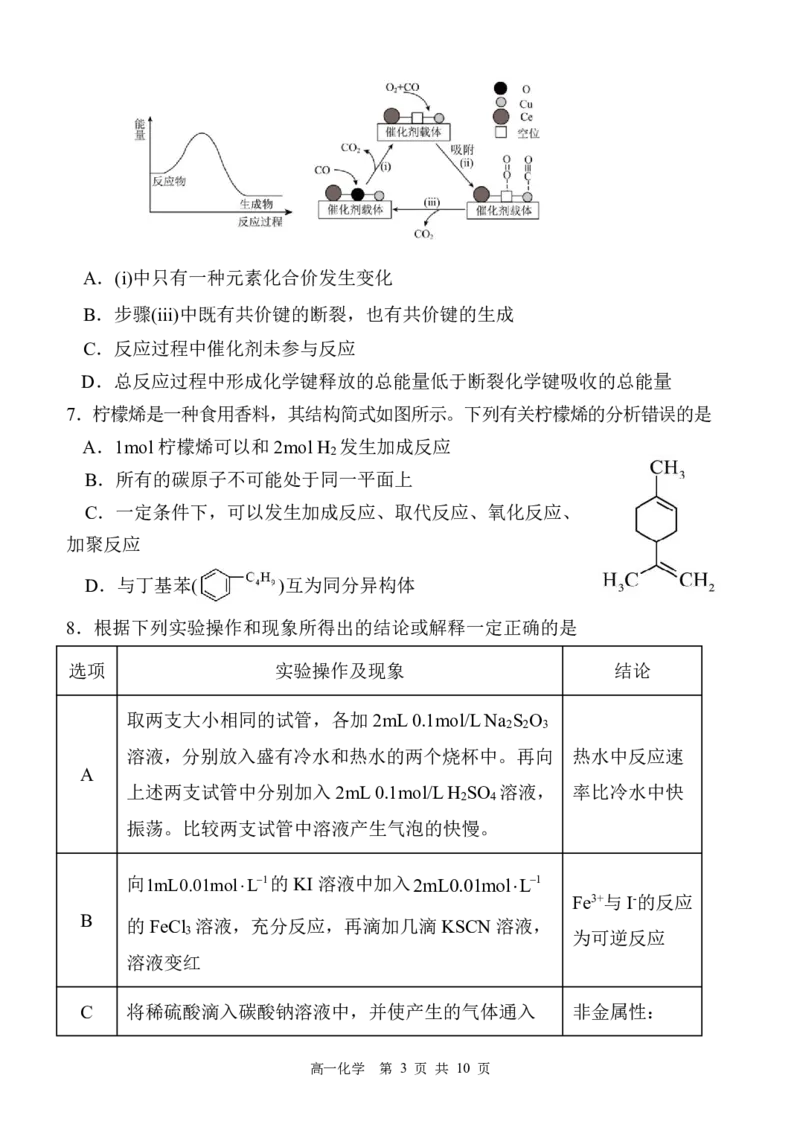
6.铜-铈氧化物(xCuO·yCeO ,Ce是活泼金属)催化氧化可除去H 中少量 CO,总反
2 2
应为2CO+O =2CO ,其反应过程与能量关系及可能机理如下图所示。下列说法正
2 2
确的是
第 2 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}A.(i)中只有一种元素化合价发生变化
B.步骤(iii)中既有共价键的断裂,也有共价键的生成
C.反应过程中催化剂未参与反应
D.总反应过程中形成化学键释放的总能量低于断裂化学键吸收的总能量
7.柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的分析错误的是
A.1mol柠檬烯可以和2mol H 发生加成反应
2
B.所有的碳原子不可能处于同一平面上
C.一定条件下,可以发生加成反应、取代反应、氧化反应、
加聚反应
D.与丁基苯( )互为同分异构体
8.根据下列实验操作和现象所得出的结论或解释一定正确的是
选项 实验操作及现象 结论
取两支大小相同的试管,各加2mL0.1mol/LNa S O
2 2 3
溶液,分别放入盛有冷水和热水的两个烧杯中。再向 热水中反应速
A
上述两支试管中分别加入2mL0.1mol/LH SO 溶液, 率比冷水中快
2 4
振荡。比较两支试管中溶液产生气泡的快慢。
向1mL0.01molL1的KI溶液中加入2mL0.01molL1
Fe3+与I-的反应
B 的FeCl 溶液,充分反应,再滴加几滴 KSCN溶液,
3 为可逆反应
溶液变红
C 将稀硫酸滴入碳酸钠溶液中,并使产生的气体通入 非金属性:
高一化学 第 3 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}Na SiO 溶液中,观察到有白色沉淀出现 S>C>Si
2 3
将红热的木炭放入装有浓硝酸的试管中,试管上部出 木炭将浓硝酸
D
现红棕色气体 还原成NO
2
9.用N 表示阿伏加德罗常数的值,下列叙述正确的是
A
A.标准状况下,1molCH 与足量Cl 发生取代反应可得到 N 个CH Cl
4 2 A 3
B.0.1mol/LNa SO 溶液中含有的 Na+数目为0.2N
2 4 A
C.28g乙烯和丙烯(C H )的混合气体中含有的氢原子数为4N
3 6 A
D.一定条件下,2molSO 与1mol O 充分反应,转移的电子数为4N
2 2 A
10.由四种短周期元素X、Y、Z、R 构成的分子结构如图所示,其中所有原子均达
到8电子稳定结构。四种元素位于不同主族,R 的内层电子数比其最外层电子数多
3;X、Y、Z 同周期,Z的原子半径为三者中最小,Y 的非金属性为三者中最弱。
下列有关叙述正确的是
A.元素Y、Z 的氢化物均可能含非极性键
B.最高价氧化物的水化物的酸性:X<Y
C.氢化物的沸点:Y<Z
D.离子半径:X<Z<R
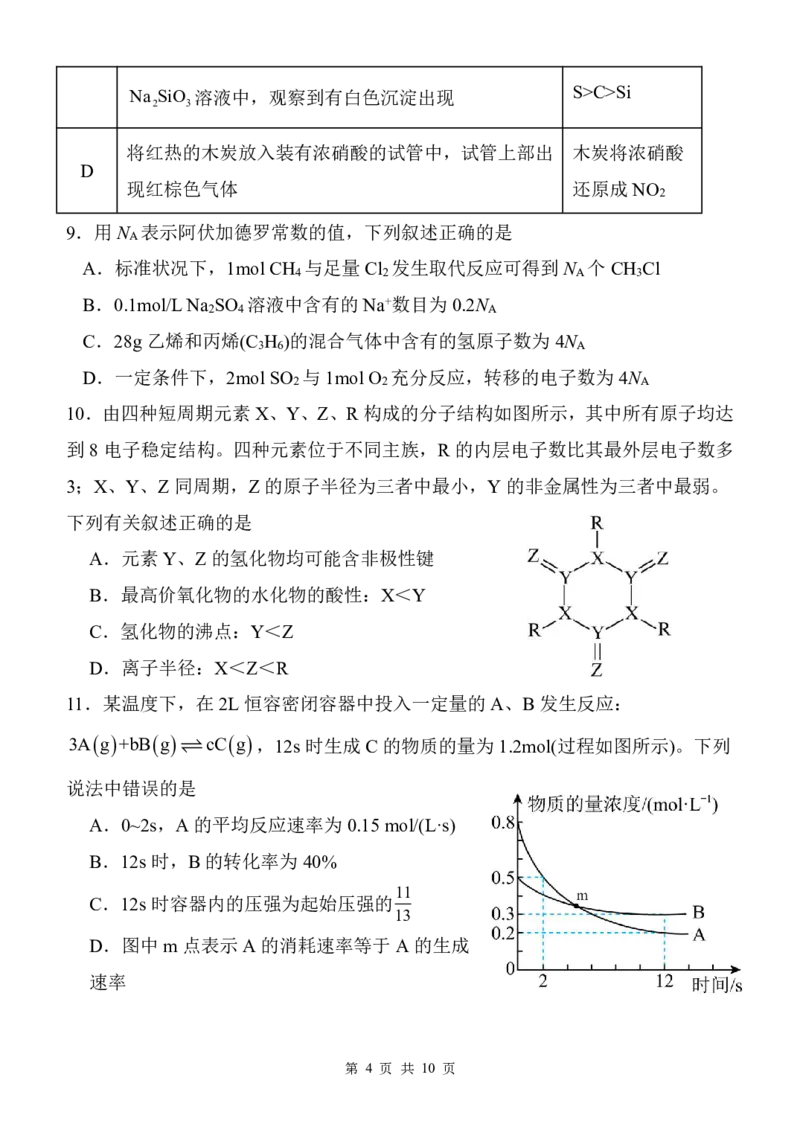
11.某温度下,在2L恒容密闭容器中投入一定量的A、B发生反应:
3A g +bB g cC g ,12s 时生成C的物质的量为 1.2mol(过程如图所示)。下列
说法中错误的是
A.0~2s,A的平均反应速率为0.15mol/(L·s)
B.12s 时,B的转化率为40%
11
C.12s 时容器内的压强为起始压强的
13
D.图中m 点表示A的消耗速率等于A的生成
速率
第 4 页 共 10 页
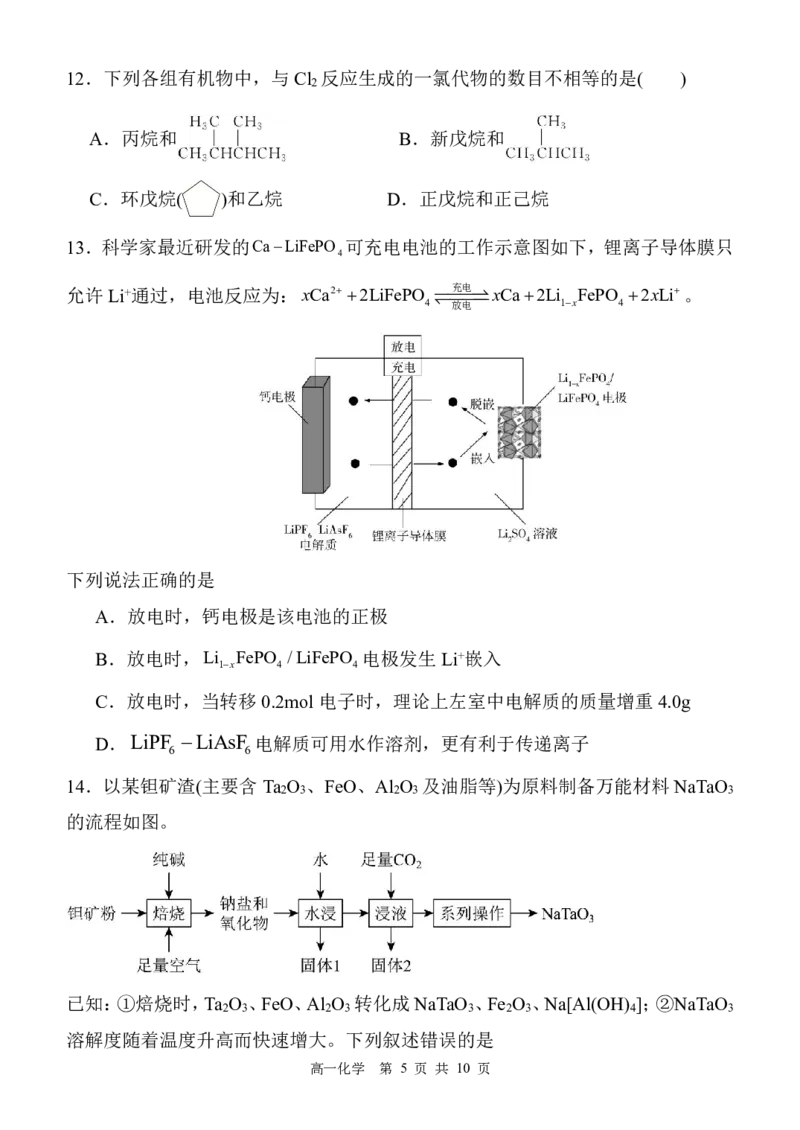
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}12.下列各组有机物中,与Cl 反应生成的一氯代物的数目不相等的是( )
2
A.丙烷和 B.新戊烷和
C.环戊烷( )和乙烷 D.正戊烷和正己烷
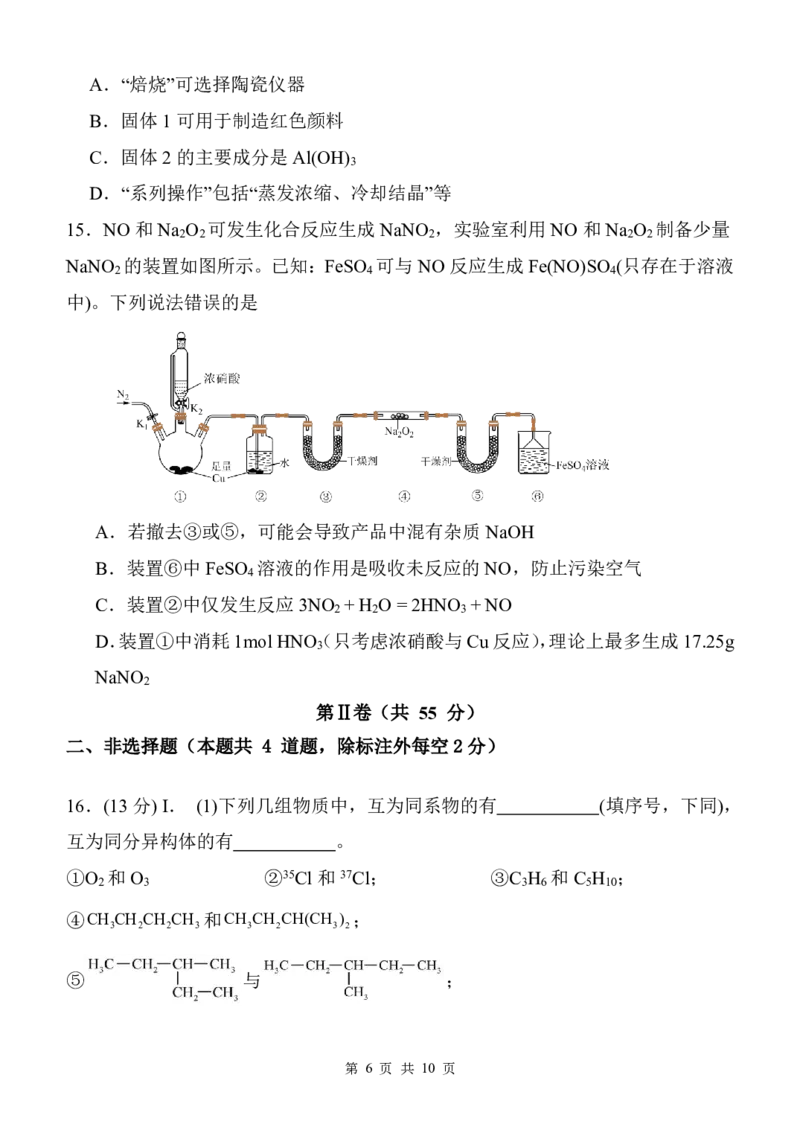
13.科学家最近研发的CaLiFePO 可充电电池的工作示意图如下,锂离子导体膜只
4
允许Li+通过,电池反应为:xCa2 2LiFePO 充 电 xCa2Li FePO 2xLi。
4 放电 1x 4
下列说法正确的是
A.放电时,钙电极是该电池的正极
B.放电时,Li FePO /LiFePO 电极发生Li+嵌入
1x 4 4
C.放电时,当转移0.2mol 电子时,理论上左室中电解质的质量增重 4.0g
D.LiPF LiAsF 电解质可用水作溶剂,更有利于传递离子
6 6
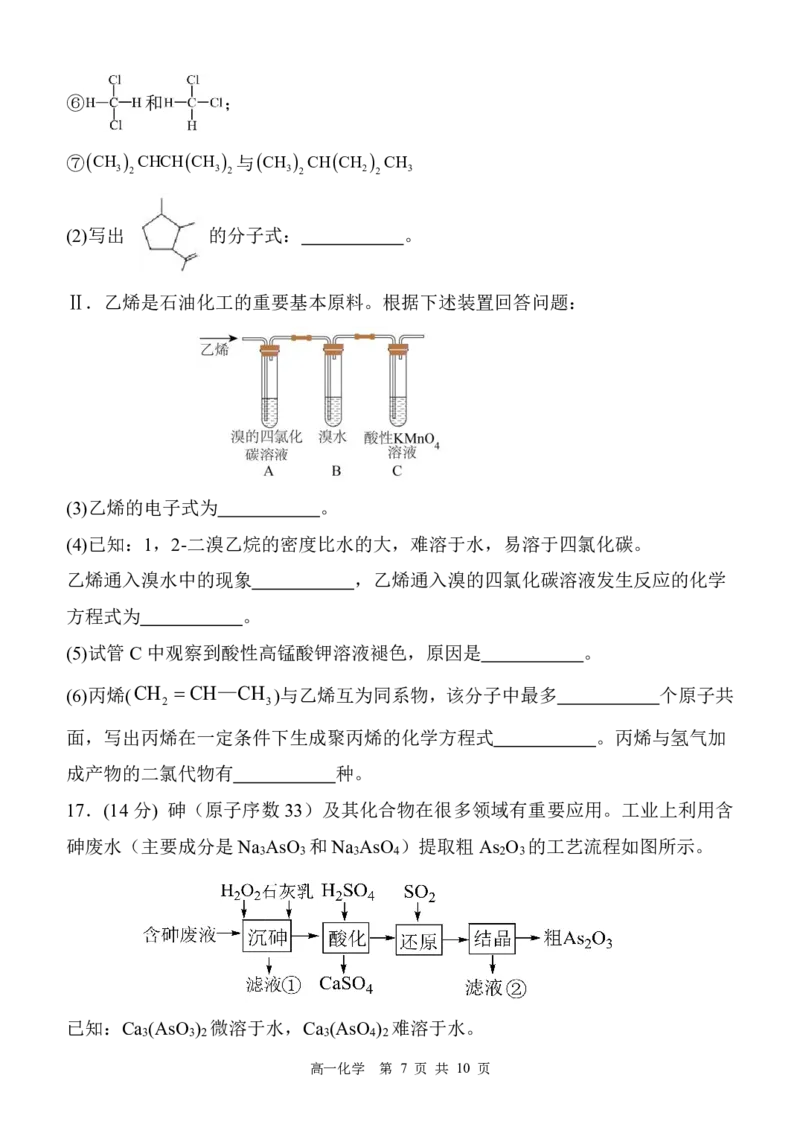
14.以某钽矿渣(主要含Ta O 、FeO、Al O 及油脂等)为原料制备万能材料NaTaO
2 3 2 3 3
的流程如图。
已知:①焙烧时,Ta O 、FeO、Al O 转化成NaTaO 、Fe O 、Na[Al(OH) ];②NaTaO
2 3 2 3 3 2 3 4 3
溶解度随着温度升高而快速增大。下列叙述错误的是
高一化学 第 5 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}A.“焙烧”可选择陶瓷仪器
B.固体1可用于制造红色颜料
C.固体2的主要成分是Al(OH)
3
D.“系列操作”包括“蒸发浓缩、冷却结晶”等
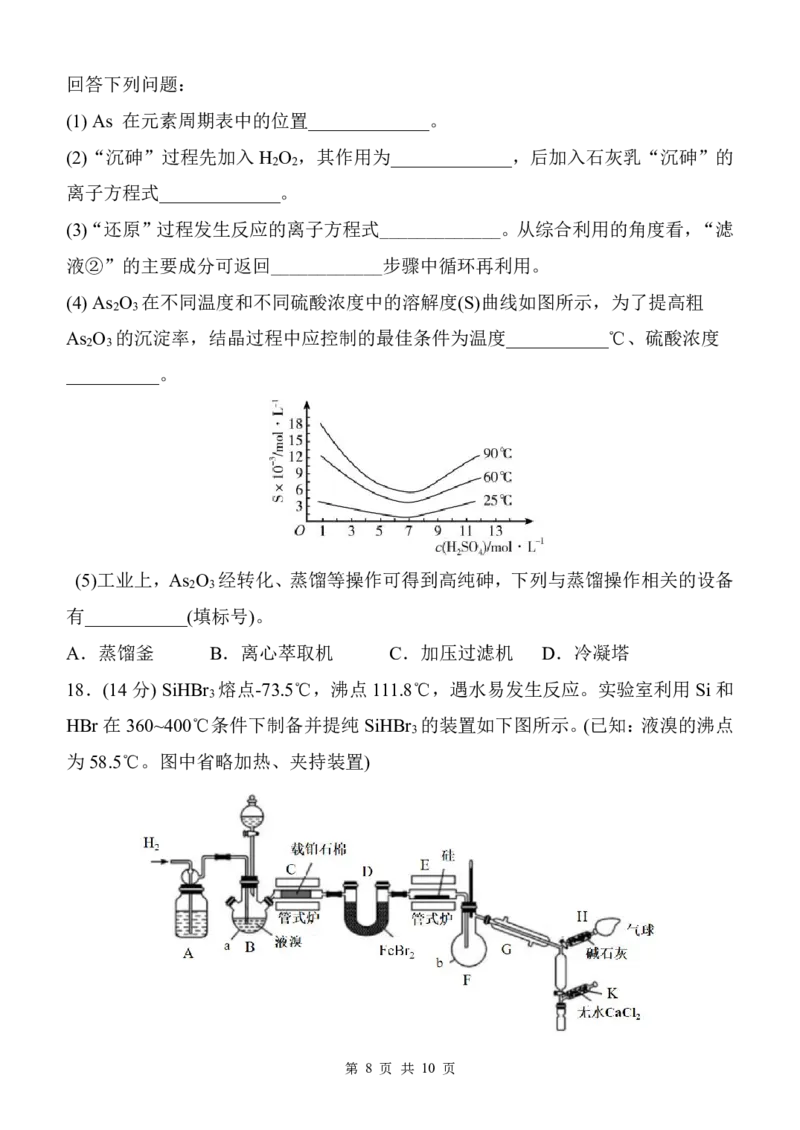
15.NO和Na O 可发生化合反应生成NaNO ,实验室利用NO 和Na O 制备少量
2 2 2 2 2
NaNO 的装置如图所示。已知:FeSO 可与NO反应生成Fe(NO)SO (只存在于溶液
2 4 4
中)。下列说法错误的是
A.若撤去③或⑤,可能会导致产品中混有杂质 NaOH
B.装置⑥中FeSO 溶液的作用是吸收未反应的NO,防止污染空气
4
C.装置②中仅发生反应3NO +H O=2HNO + NO
2 2 3
D.装置①中消耗1molHNO(只考虑浓硝酸与Cu反应),理论上最多生成17.25g
3
NaNO
2
第Ⅱ卷(共 55 分)
二、非选择题(本题共 4 道题,除标注外每空 2分)
16.(13分)I. (1)下列几组物质中,互为同系物的有 (填序号,下同),
互为同分异构体的有 。
①O 和O ②35Cl 和37Cl; ③C H 和C H ;
2 3 3 6 5 10
④CH CH CH CH 和CH CH CH(CH ) ;
3 2 2 3 3 2 3 2
⑤ 与 ;
第 6 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}⑥ 和 ;
⑦CH CHCHCH 与CH CHCH CH
3 2 3 2 3 2 2 2 3
(2)写出 的分子式: 。
Ⅱ.乙烯是石油化工的重要基本原料。根据下述装置回答问题:
(3)乙烯的电子式为 。
(4)已知:1,2-二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
乙烯通入溴水中的现象 ,乙烯通入溴的四氯化碳溶液发生反应的化学
方程式为 。
(5)试管C 中观察到酸性高锰酸钾溶液褪色,原因是 。
(6)丙烯(CH CH—CH )与乙烯互为同系物,该分子中最多 个原子共
2 3
面,写出丙烯在一定条件下生成聚丙烯的化学方程式 。丙烯与氢气加
成产物的二氯代物有 种。
17.(14 分) 砷(原子序数 33)及其化合物在很多领域有重要应用。工业上利用含
砷废水(主要成分是Na AsO 和Na AsO )提取粗As O 的工艺流程如图所示。
3 3 3 4 2 3
已知:Ca (AsO ) 微溶于水,Ca (AsO ) 难溶于水。
3 3 2 3 4 2
高一化学 第 7 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}回答下列问题:
(1)As 在元素周期表中的位置_____________。
(2)“沉砷”过程先加入H O ,其作用为_____________,后加入石灰乳“沉砷”的
2 2
离子方程式_____________。
(3)“还原”过程发生反应的离子方程式_____________。从综合利用的角度看,“滤
液②”的主要成分可返回____________步骤中循环再利用。
(4)As O 在不同温度和不同硫酸浓度中的溶解度(S)曲线如图所示,为了提高粗
2 3
As O 的沉淀率,结晶过程中应控制的最佳条件为温度___________℃、硫酸浓度
2 3
__________。
(5)工业上,As O 经转化、蒸馏等操作可得到高纯砷,下列与蒸馏操作相关的设备
2 3
有___________(填标号)。
A.蒸馏釜 B.离心萃取机 C.加压过滤机 D.冷凝塔
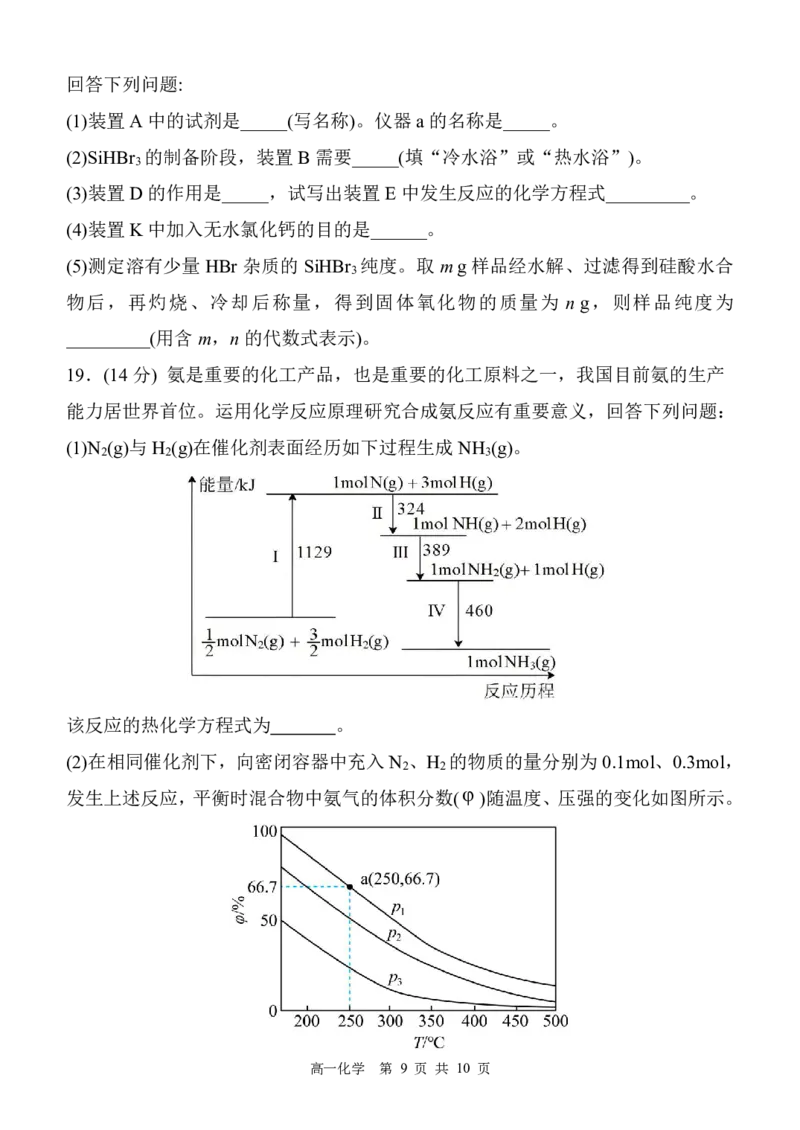
18.(14 分)SiHBr 熔点-73.5℃,沸点111.8℃,遇水易发生反应。实验室利用Si 和
3
HBr 在360~400℃条件下制备并提纯SiHBr 的装置如下图所示。(已知:液溴的沸点
3
为58.5℃。图中省略加热、夹持装置)
第 8 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}回答下列问题:
(1)装置A 中的试剂是_____(写名称)。仪器 a的名称是_____。
(2)SiHBr 的制备阶段,装置B需要_____(填“冷水浴”或“热水浴”)。
3
(3)装置D 的作用是_____,试写出装置E 中发生反应的化学方程式_________。
(4)装置K 中加入无水氯化钙的目的是______。
(5)测定溶有少量 HBr 杂质的 SiHBr 纯度。取 mg 样品经水解、过滤得到硅酸水合
3
物后,再灼烧、冷却后称量,得到固体氧化物的质量为 n g,则样品纯度为
_________(用含m,n的代数式表示)。
19.(14 分) 氨是重要的化工产品,也是重要的化工原料之一,我国目前氨的生产
能力居世界首位。运用化学反应原理研究合成氨反应有重要意义,回答下列问题:
(1)N (g)与H (g)在催化剂表面经历如下过程生成NH (g)。
2 2 3
该反应的热化学方程式为 。
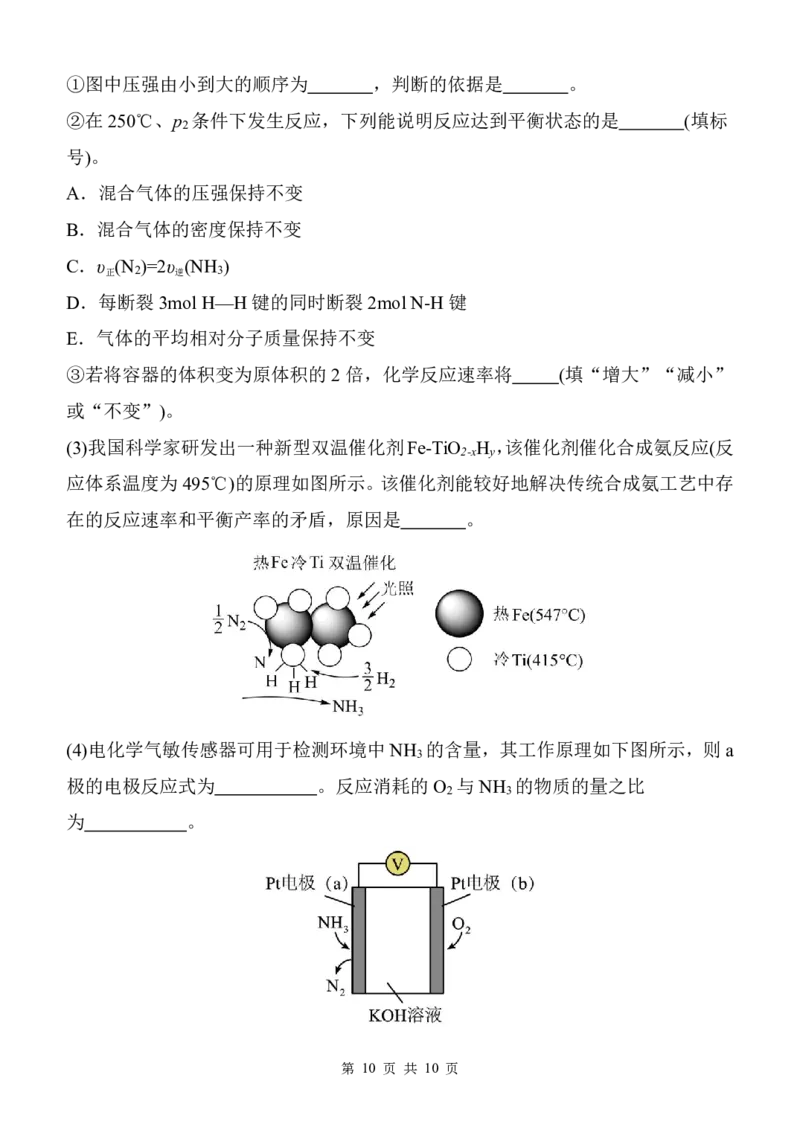
(2)在相同催化剂下,向密闭容器中充入N 、H 的物质的量分别为0.1mol、0.3mol,
2 2
发生上述反应,平衡时混合物中氨气的体积分数( φ )随温度、压强的变化如图所示。
高一化学 第 9 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}①图中压强由小到大的顺序为 ,判断的依据是 。
②在250℃、p 条件下发生反应,下列能说明反应达到平衡状态的是 (填标
2
号)。
A.混合气体的压强保持不变
B.混合气体的密度保持不变
C.υ (N )=2υ (NH )
正 2 逆 3
D.每断裂3mol H—H键的同时断裂2mol N-H 键
E.气体的平均相对分子质量保持不变
③若将容器的体积变为原体积的2倍,化学反应速率将 (填“增大”“减小”
或“不变”)。
(3)我国科学家研发出一种新型双温催化剂Fe-TiO H ,该催化剂催化合成氨反应(反
2-x y
应体系温度为495℃)的原理如图所示。该催化剂能较好地解决传统合成氨工艺中存
在的反应速率和平衡产率的矛盾,原因是 。
(4)电化学气敏传感器可用于检测环境中NH 的含量,其工作原理如下图所示,则a
3
极的电极反应式为 。反应消耗的 O 与NH 的物质的量之比
2 3
为 。
第 10 页 共 10 页
{#{QQABDYagwwowkgRACBa6FQEyCQmQsoESLQoGgVCYOEQCgANAFCA=}#}2024 级高一下第二次月考化学参考答案
20250530
一、选择题(共15道题,每题3分,共 45分)
1~5.DCBCB 6~10.BDCCA 11~15.DBBAC
二、填空题(共4道题,共 55分)
16题.(共13分,除标注外,每空2分)
Ⅰ(1)④ (1分) ⑦ (1 分) (2)C H (1 分)
10 18
Ⅱ(3)
(1分) (4)溴水褪色,溶液分层,下层为油状液体
CH =CH +Br →CH BrCH Br
2 2 2 2 2
乙烯含有碳碳双键,能被酸性高锰酸钾溶液氧化而使其褪色(1分)
(4)7(1分)
(条件标注“一定条件”也正确)
4(1分)
17题.(共14分,除标注外,每空2分)
(1)(1)第四周期第VA族
(2)将AsO3
3
氧化为AsO3
4
3CaOH
2
2AsO3
4
Ca
3
AsO
4
2
6OH
(3) 2H 3 AsO 4 2SO 2 2SO 4 2As 2 O 3 H 2 O4H 酸化
(4)25(1分) 7mol/L(1 分,不写单位不给分)
(5)AD
18题.(共14分,每空2分)
(1)浓硫酸(H SO 不给分) 三颈烧瓶(或三口烧瓶、只写烧瓶不给分)
2 4
(2)热水浴 (3)吸收未反应完的溴(吸收氢气中的溴,答出吸收溴就给分)
Si(s)+3HBr(g) SiHBr (g) + H₂(g) (不标注状态不扣分)
3
(4)防止外界水蒸气进入使产品变质
(5) ×100%
269
60
{#{QQABBYCAggggABJAARhCAQX4CkEQkBACCaoOBFAcsAABAANABAA=}#}19题.(共14分,除标注外,每空2分)
(1) -88kJ/mol 或
N2 g +3H2 g ⇌ 2NH3 g ΔH =-44kJ/mol
1 3
2N2 gp + p2H 2 pg ⇌ NH3 g ΔH =
(2)① 3 2 1 (1 分)
温度一定时,压强越大,氨的产率越高,氨气的体积分数越大
②BE ③减小 (1 分)
(3)“热Fe”高于体系温度,有利于(共价键断裂)加快反应速率,“冷 Ti”低于
体系温度,有利于(平衡向正反应方向移动)提高氨气的产率
2NH 6e+6OH= N +6H O
(4) 3 2 2 3∶4
{#{QQABBYCAggggABJAARhCAQX4CkEQkBACCaoOBFAcsAABAANABAA=}#}