文档内容
高一化学高频考题期末测试卷 06
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修二 难度:★★★★★
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Cl-35.5 Fe-56 Cu-64
一、选择题(本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
题目要求的。)
1.《天工开物》中关于制青瓦有如下记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而
为之……凡坯既成,干燥之后,则堆积窑中燃薪举……浇水转锈,与造砖同法。”下列说法错
误的是( )
A.黏土的主要成分为硅酸盐
B.青砖中铁元素主要以氧化铁的形式存在
C.烧制后自然冷却不能制成青瓦
D.黏土是制作砖瓦和陶瓷的主要原料
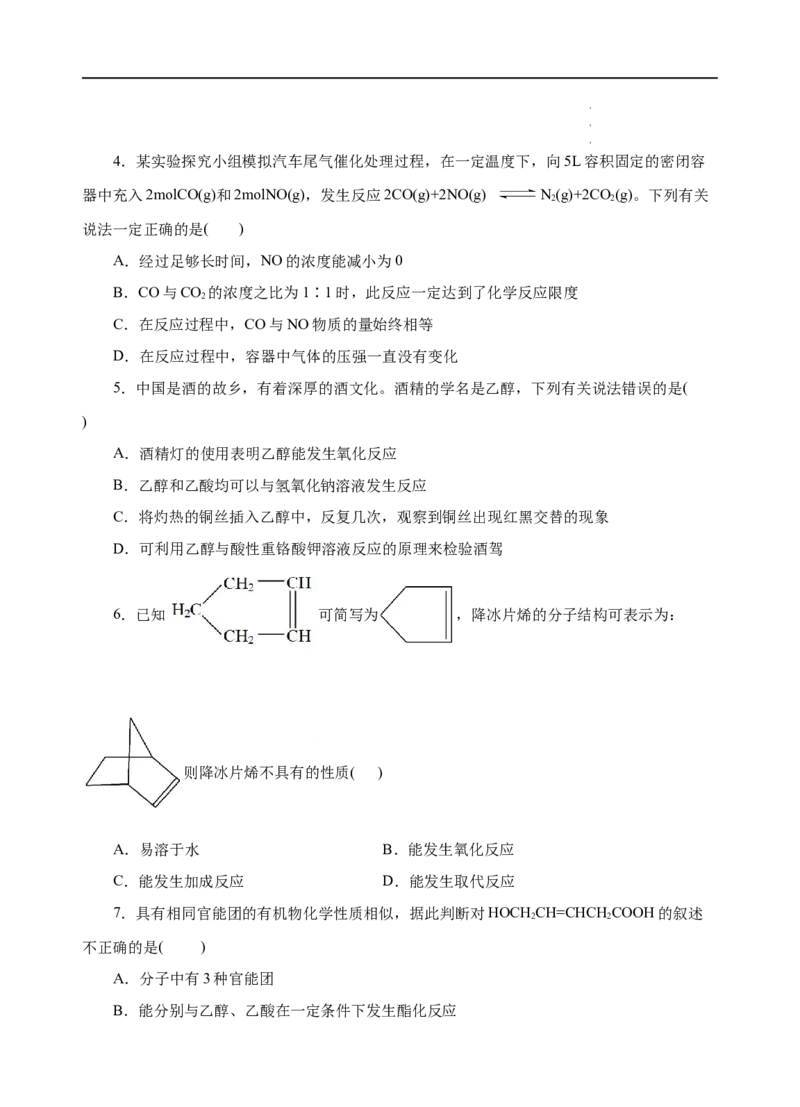
2.下列化学用语表示不正确的是
A.羟基的电子式: B.乙烷的球根模型:
C.氯原子的结构示意图: D.四氯化碳的电子式:
3.含硅元素的物质有很多用途,下列说法错误的是( )
A.硅胶多孔、吸水能力强,可用作袋装食品的干燥剂
B.陶瓷、水晶、水泥、玛瑙等均属于硅酸盐材料
C.高压输电线使用的陶瓷绝缘材料属于硅酸盐材料
D.高温结构陶瓷具有耐高温、抗氧化等性能,可应用于火箭发动机等
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司4.某实验探究小组模拟汽车尾气催化处理过程,在一定温度下,向5L容积固定的密闭容
器中充入2molCO(g)和2molNO(g),发生反应2CO(g)+2NO(g) N(g)+2CO (g)。下列有关
2 2
说法一定正确的是( )
A.经过足够长时间,NO的浓度能减小为0
B.CO与CO 的浓度之比为1∶1时,此反应一定达到了化学反应限度
2
C.在反应过程中,CO与NO物质的量始终相等
D.在反应过程中,容器中气体的压强一直没有变化
5.中国是酒的故乡,有着深厚的酒文化。酒精的学名是乙醇,下列有关说法错误的是(
)
A.酒精灯的使用表明乙醇能发生氧化反应
B.乙醇和乙酸均可以与氢氧化钠溶液发生反应
C.将灼热的铜丝插入乙醇中,反复几次,观察到铜丝出现红黑交替的现象
D.可利用乙醇与酸性重铬酸钾溶液反应的原理来检验酒驾
6.已知 可简写为 ,降冰片烯的分子结构可表示为:
则降冰片烯不具有的性质( )
A.易溶于水 B.能发生氧化反应
C.能发生加成反应 D.能发生取代反应
7.具有相同官能团的有机物化学性质相似,据此判断对HOCH CH=CHCH COOH的叙述
2 2
不正确的是( )
A.分子中有3种官能团
B.能分别与乙醇、乙酸在一定条件下发生酯化反应
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.与溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
D.1mol 该有机分子与足量钠反应能产生2g H
2
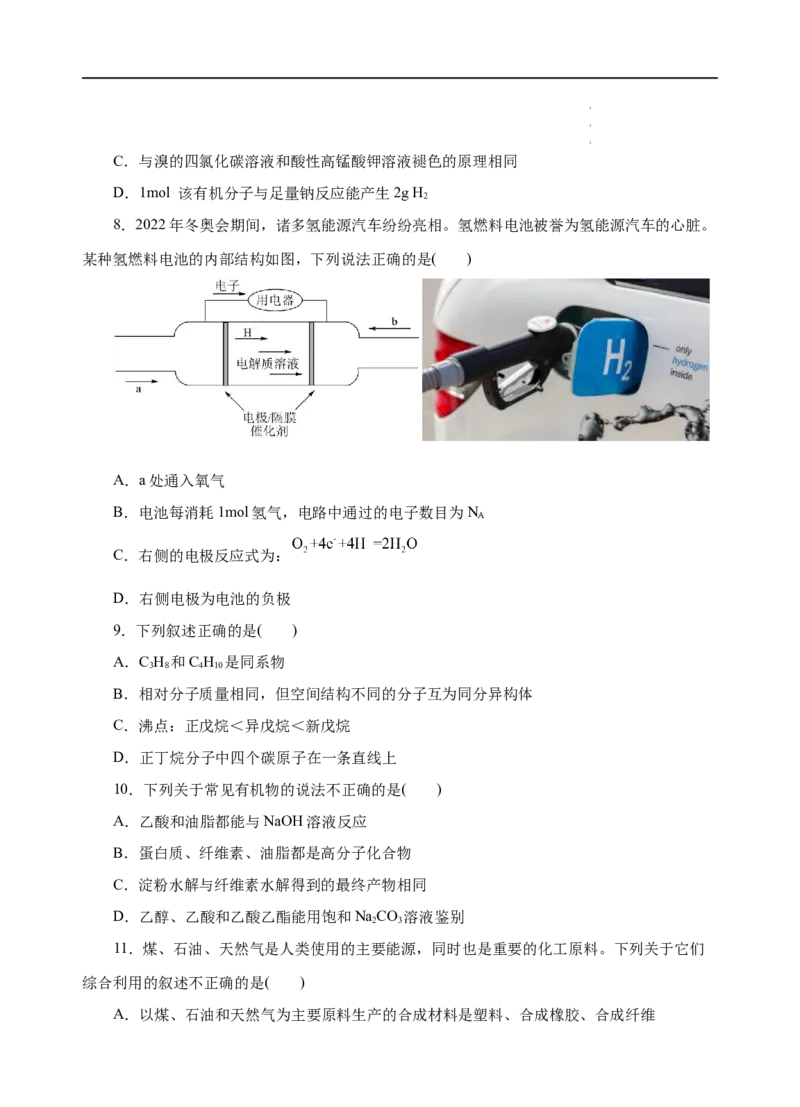
8.2022年冬奥会期间,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。
某种氢燃料电池的内部结构如图,下列说法正确的是( )
A.a处通入氧气
B.电池每消耗1mol氢气,电路中通过的电子数目为N
A
C.右侧的电极反应式为:
D.右侧电极为电池的负极
9.下列叙述正确的是( )
A.C H 和C H 是同系物
3 8 4 10
B.相对分子质量相同,但空间结构不同的分子互为同分异构体
C.沸点:正戊烷<异戊烷<新戊烷
D.正丁烷分子中四个碳原子在一条直线上
10.下列关于常见有机物的说法不正确的是( )
A.乙酸和油脂都能与NaOH溶液反应
B.蛋白质、纤维素、油脂都是高分子化合物
C.淀粉水解与纤维素水解得到的最终产物相同
D.乙醇、乙酸和乙酸乙酯能用饱和NaCO 溶液鉴别
2 3
11.煤、石油、天然气是人类使用的主要能源,同时也是重要的化工原料。下列关于它们
综合利用的叙述不正确的是( )
A.以煤、石油和天然气为主要原料生产的合成材料是塑料、合成橡胶、合成纤维
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司B.煤是工业上获得芳香烃的一种重要来源
C.石油的裂解是为了提高轻质油(例如汽油)的产量
D.天然气的主要成分是甲烷,属于不可再生资源
12.下列应用的解释错误的是( )
应用 解释
A 二氧化硫可以作为食品添加剂 二氧化硫具有漂白性,防腐和抗氧化等作用
B 高纯硅可以用于制作光感电池 硅具有半导体性能,可将太阳能转化为电能
C 二氧化硅可以用于制作光导纤维 二氧化硅具有良好的导电性能,硬度大
碳纳米管可以用于生产复合材料,电 碳纳米管比表面积大,强度大,有优良的电学性
D
池 能
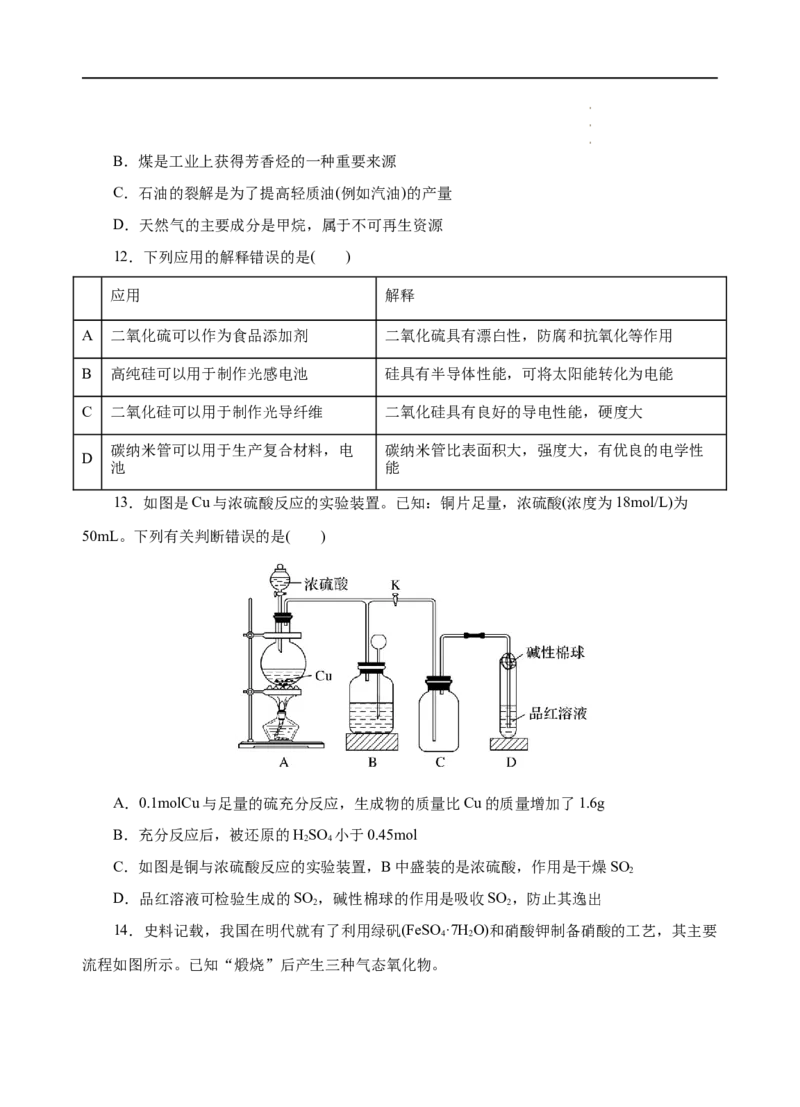
13.如图是Cu与浓硫酸反应的实验装置。已知:铜片足量,浓硫酸(浓度为18mol/L)为
50mL。下列有关判断错误的是( )
A.0.1molCu与足量的硫充分反应,生成物的质量比Cu的质量增加了1.6g
B.充分反应后,被还原的HSO 小于0.45mol
2 4
C.如图是铜与浓硫酸反应的实验装置,B中盛装的是浓硫酸,作用是干燥SO
2
D.品红溶液可检验生成的SO ,碱性棉球的作用是吸收SO ,防止其逸出
2 2
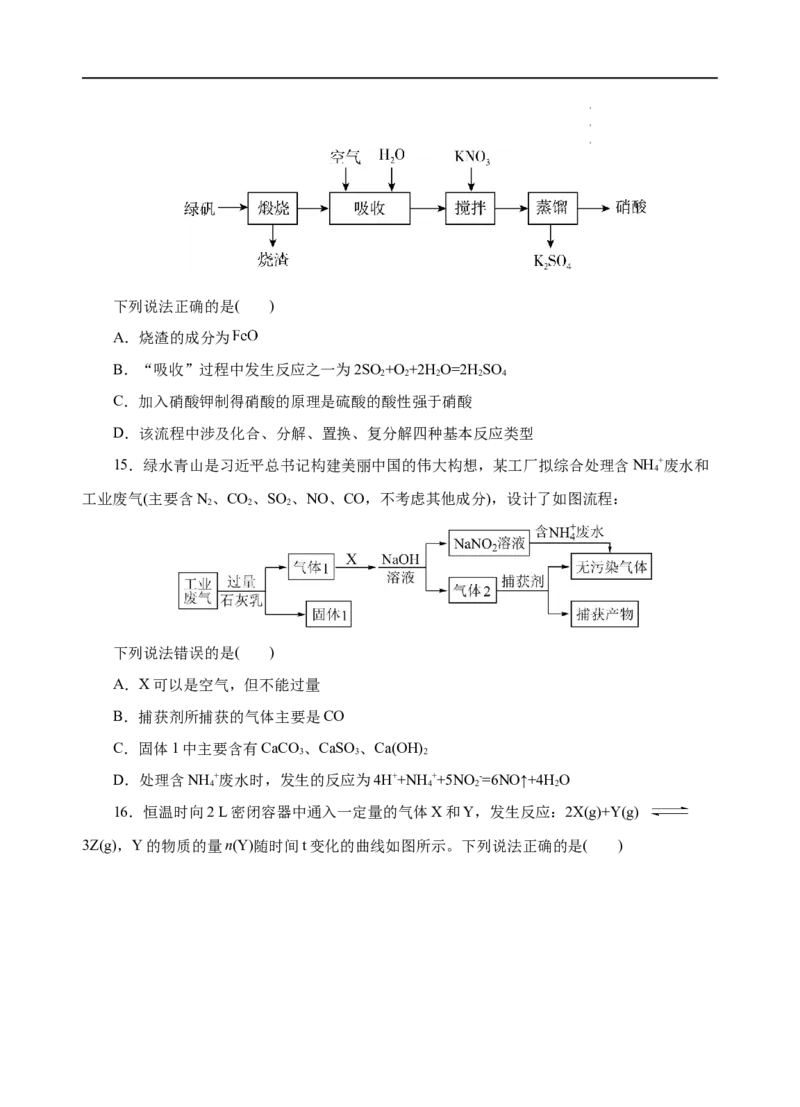
14.史料记载,我国在明代就有了利用绿矾(FeSO ·7H O)和硝酸钾制备硝酸的工艺,其主要
4 2
流程如图所示。已知“煅烧”后产生三种气态氧化物。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司下列说法正确的是( )
A.烧渣的成分为
B.“吸收”过程中发生反应之一为2SO +O +2H O=2HSO
2 2 2 2 4
C.加入硝酸钾制得硝酸的原理是硫酸的酸性强于硝酸
D.该流程中涉及化合、分解、置换、复分解四种基本反应类型
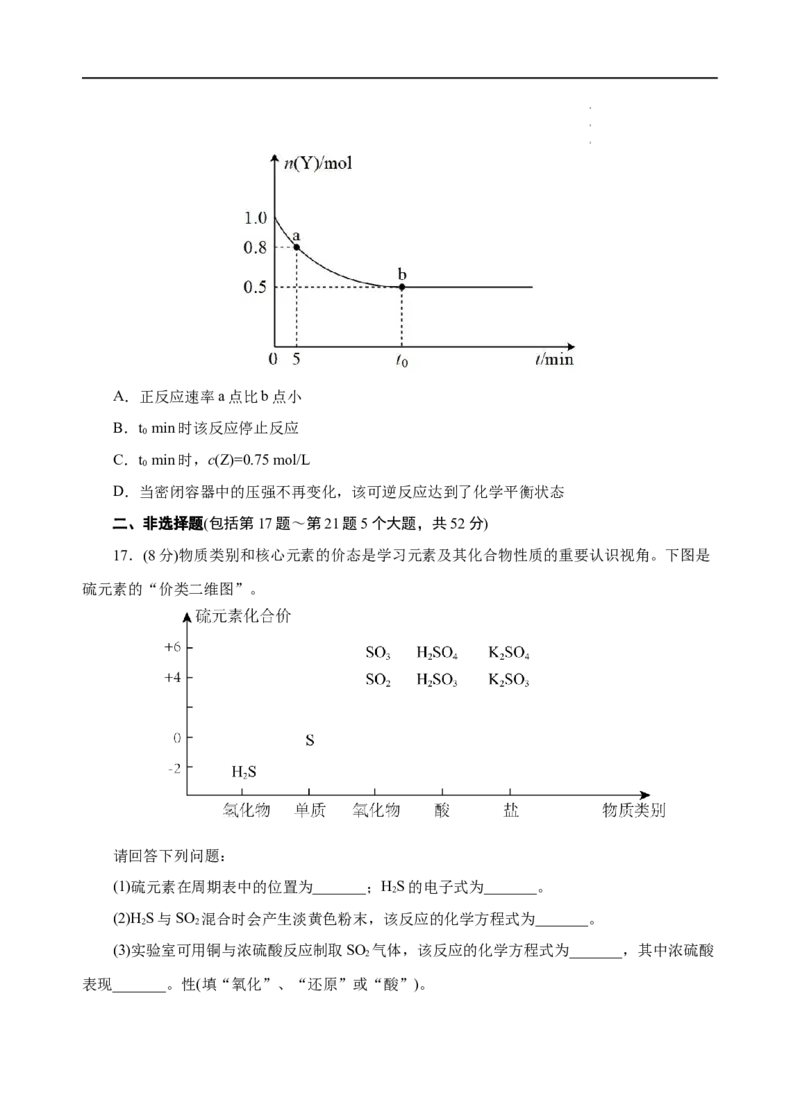
15.绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含NH +废水和
4
工业废气(主要含N、CO、SO 、NO、CO,不考虑其他成分),设计了如图流程:
2 2 2
下列说法错误的是( )
A.X可以是空气,但不能过量
B.捕获剂所捕获的气体主要是CO
C.固体1中主要含有CaCO 、CaSO、Ca(OH)
3 3 2
D.处理含NH +废水时,发生的反应为4H++NH++5NO-=6NO↑+4HO
4 4 2 2
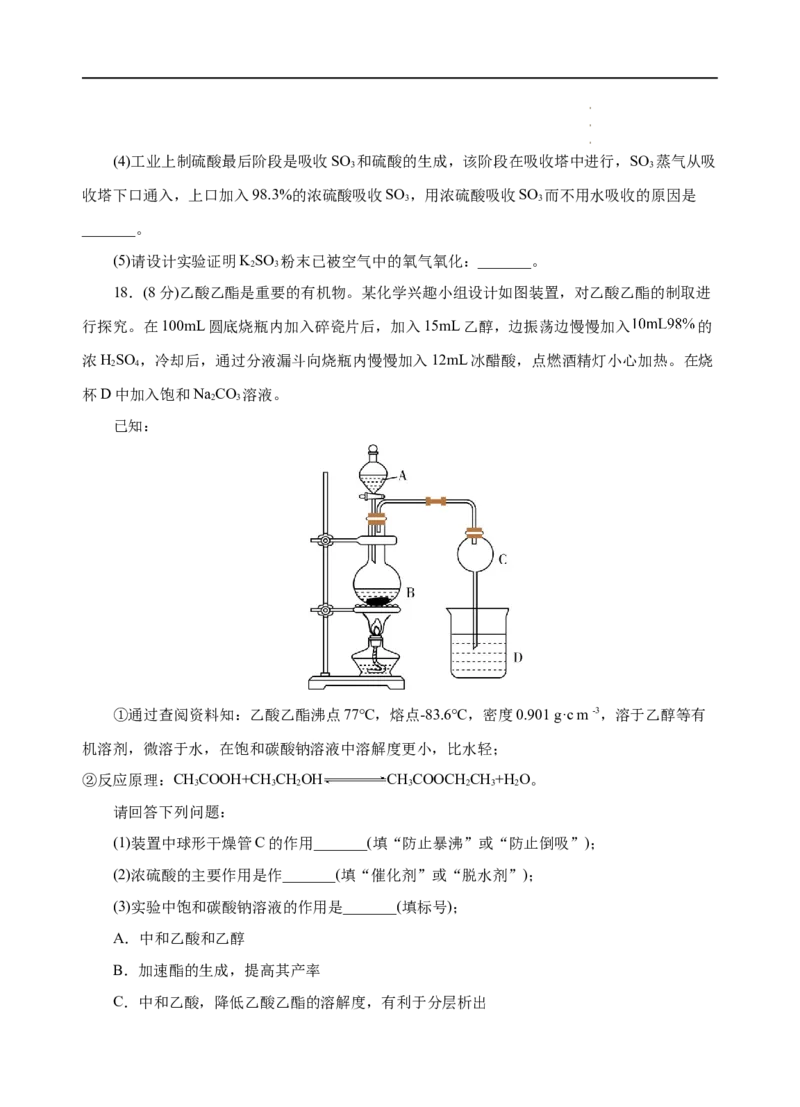
16.恒温时向2 L密闭容器中通入一定量的气体X和Y,发生反应:2X(g)+Y(g)
3Z(g),Y的物质的量n(Y)随时间t变化的曲线如图所示。下列说法正确的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.正反应速率a点比b点小
B.t min时该反应停止反应
0
C.t min时,c(Z)=0.75 mol/L
0
D.当密闭容器中的压强不再变化,该可逆反应达到了化学平衡状态
二、非选择题(包括第17题~第21题5个大题,共52分)
17.(8分)物质类别和核心元素的价态是学习元素及其化合物性质的重要认识视角。下图是
硫元素的“价类二维图”。
请回答下列问题:
(1)硫元素在周期表中的位置为_______;HS的电子式为_______。
2
(2)H S与SO 混合时会产生淡黄色粉末,该反应的化学方程式为_______。
2 2
(3)实验室可用铜与浓硫酸反应制取SO 气体,该反应的化学方程式为_______,其中浓硫酸
2
表现_______。性(填“氧化”、“还原”或“酸”)。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(4)工业上制硫酸最后阶段是吸收SO 和硫酸的生成,该阶段在吸收塔中进行,SO 蒸气从吸
3 3
收塔下口通入,上口加入98.3%的浓硫酸吸收SO ,用浓硫酸吸收SO 而不用水吸收的原因是
3 3
_______。
(5)请设计实验证明KSO 粉末已被空气中的氧气氧化:_______。
2 3
18.(8分)乙酸乙酯是重要的有机物。某化学兴趣小组设计如图装置,对乙酸乙酯的制取进
行探究。在100mL圆底烧瓶内加入碎瓷片后,加入15mL乙醇,边振荡边慢慢加入 的
浓HSO ,冷却后,通过分液漏斗向烧瓶内慢慢加入12mL冰醋酸,点燃酒精灯小心加热。在烧
2 4
杯D中加入饱和NaCO 溶液。
2 3
已知:
①通过查阅资料知:乙酸乙酯沸点77℃,熔点-83.6℃,密度0.901 g·c m -3,溶于乙醇等有
机溶剂,微溶于水,在饱和碳酸钠溶液中溶解度更小,比水轻;
②反应原理:CHCOOH+CH CHOH CHCOOCH CH+H O。
3 3 2 3 2 3 2
请回答下列问题:
(1)装置中球形干燥管C的作用_______(填“防止暴沸”或“防止倒吸”);
(2)浓硫酸的主要作用是作_______(填“催化剂”或“脱水剂”);
(3)实验中饱和碳酸钠溶液的作用是_______(填标号);
A.中和乙酸和乙醇
B.加速酯的生成,提高其产率
C.中和乙酸,降低乙酸乙酯的溶解度,有利于分层析出
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(4)反应结束后D中的现象是_______(填标号);
A.没有气泡冒出,溶液不分层
B.有细小的气泡冒出,溶液分层,无色油状液体在上层
C.溶液分层,无色油状液体在下层
(5)若化学兴趣小组同学经分离得到纯乙酸乙酯8.8g,则理论上参加反应的乙醇的质量是
_______g。
19.(12分)过多的NO 排放,往往会产生污染。某研究性小组探究NO与炽热的铜粉反应,
x
设计如下
已知: 能被酸性高锰酸钾溶液氧化成NO -,此体系中产生的NO -浓度较稀。
3 3
(1)实验开始前,检查装置气密性涉及到以下操作,给出合理的操作顺序:将F中的长导管
插入液面以下___________:
→___________→___________→________→________→_________(操作可重复使用)。
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象 ③用酒精灯加热A中三颈烧瓶
④撤走酒精灯
(2)装置B的作用___________。
(3)反应一段时间后,装置D中铜粉变黑,写出装置D中发生反应的化学方程式
___________。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为___________;请设
计一种简单的实验方案,证明氧化产物为NO -___________ 。
3
(5)实验前和实验结束时,都需通一段时间的N,目的分别是___________、___________。
2
(6)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中
不可行的是___________。
A.加水稀释绿色溶液,观察颜色变化
B.加热该绿色溶液,观察颜色变化
C.向该绿色溶液中通入氮气,观察颜色变化
D.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
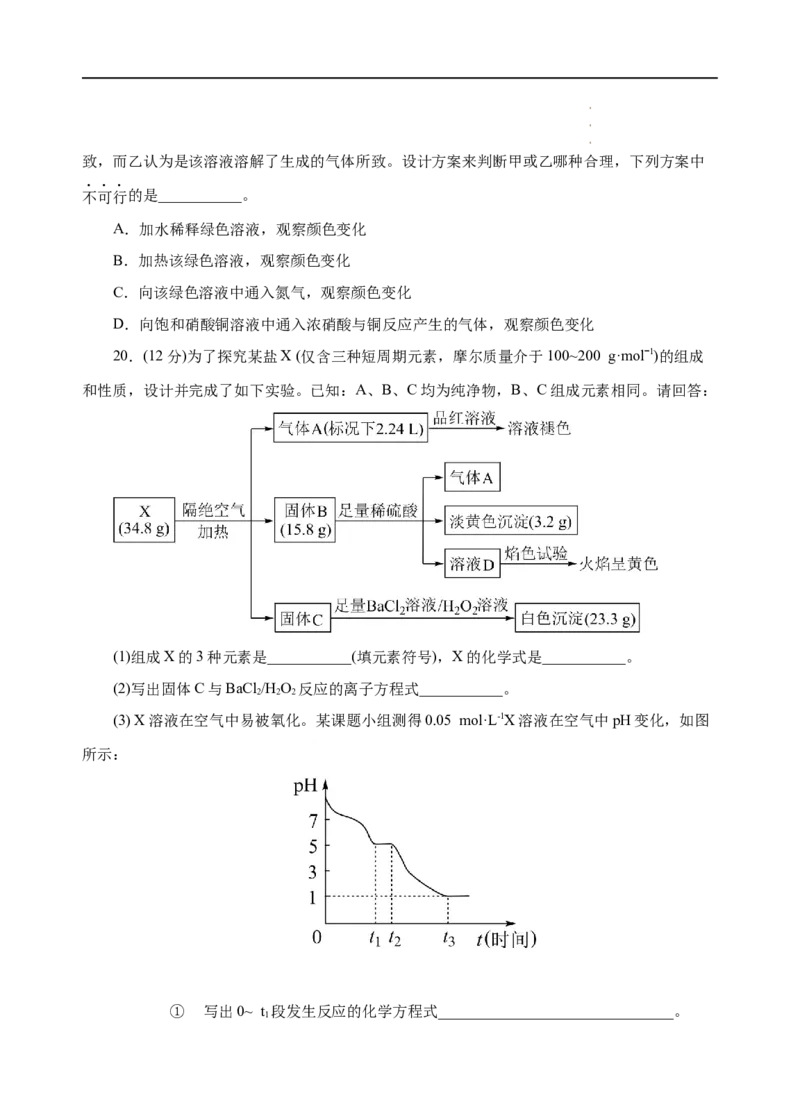
20.(12分)为了探究某盐X (仅含三种短周期元素,摩尔质量介于100~200 g·molˉ1)的组成
和性质,设计并完成了如下实验。已知:A、B、C均为纯净物,B、C组成元素相同。请回答:
(1)组成X的3种元素是___________(填元素符号),X的化学式是___________。
(2)写出固体C与BaCl/H O 反应的离子方程式___________。
2 2 2
(3) X溶液在空气中易被氧化。某课题小组测得0.05 mol·L-1X溶液在空气中pH变化,如图
所示:
① 写出0~ t 段发生反应的化学方程式_______________________________。
1
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司②设计实验检验t 时刻后溶液中的主要阴离子___________。
3
(4)有同学预测X也能与稀硫酸反应,现象与固体B和稀硫酸反应相同。你是否支持他的观
点并说明理由_______________________________。
21.(12分)乙烯(CH=CH )是非常重要的化工基础原料,由乙烯可以制备很多有机物。
2 2
I.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol水,发生CH=CH (g)+HO(g)
2 2 2
CH-CH-OH(g)。乙醇的物质的量与反应时间的关系如下图:
3 2
时间(min) 0 2 4 6 8 10
乙醇的物质的量(mol) 0 0.3 0.5 0.6 0.65 0.65
(1)乙烯和水生成乙醇的反应类型是_______。该反应涉及到的三种物质中属于烃类的是
_______(填分子式)。
(2)计算在0-6min内的反应速率v(H O)=_______mol·L-1·min-1。
2
(3)8min时反应达到化学平衡状态,其理由是:_______。
II.在恒温1L的刚性密闭容器中,加入1mol乙烯和1mol氢气,发生CH=CH (g)+H(g)
2 2 2
C H(g),容器内气体的压强与反应时间的关系如下图:
2 6
时间(min) 0 2 4 6 8 10
8 6
气体压强(MPa) 100 70 65 60
0 0
(4)有机物C H 的名称是_______。该有机物属于_______(填序号)。
2 6
A.烯烃B.芳香烃C.环状饱和烃D.链状饱和烃(烷烃)
(5)该反应的类型属于_______(填序号)。
A.取代反应 B.加成反应 C.加成聚合反应 D.聚合反应
(6)达到化学平衡状态时,下列数值与开始时相同的是_______(填序号)
A.容器内气体的压强 B.容器内n(H )
2
C.容器内c(CH=CH ) D.容器内气体的总质量
2 2
(7)反应进行到10min时,乙烯(CH=CH )的转化率a%=_______。
2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司