文档内容
高一化学高频考题期末测试卷 04
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修二 难度:★★★★☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Cl-35.5 Fe-56 Cu-64
一、选择题(本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
题目要求的。)
1.“树立健康新观念、促进身心健康全面发展”。下列不属于健康文明生活方式的是(
)
A.适度参加体育运动 B.暴饮暴食
C.正确使用药物 D.多吃蔬菜水果
2.化学与环境密切相关,下列有关酸雨的说法错误的是( )
A.酸雨是pH小于7的雨水
B.空气中的SO 主要来自于含硫的煤和石油的燃烧
2
C.SO 属于大气污染物
2
D.NO 或SO 都会导致酸雨的形成
2 2
3.我国提出争取在2030年前实现碳达峰,2060年实现碳中和,这对于改善环境,实现绿
色发展至关重要。下列措施中不利于实现漫画中提到的“碳中和”目标的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.将煤转化为煤粉再燃烧,可以从根本上杜绝碳排放
B.农村推广风力发电、光伏发电有利于“碳达峰、碳中和”
C.努力开发太阳能、氢能等多种形式能源,降低化石燃料需求量,控制CO 排放量
2
D.推广使用新能源汽车有利于促进碳达峰、碳中和
4.下列说法错误的是( )
A.SiO 是酸性氧化物,能与碱、碱性氧化物反应
2
B.SO 中硫元素的化合价是 价,SO 即有氧化性又有还原性
2 2
C.常温下,浓硝酸能用铝制容器盛装,是因为铝表面被浓硝酸氧化生成了致密的氧化膜
D.SO 、氯水、NaO,均能使品红褪色,其褪色原理相同
2 2 2
5.下列说法中错误的是( )
A.陶瓷、玻璃、水泥、水晶饰品等,都是硅酸盐产品
B.光导纤维被称为信息高速公路的骨架,其主要成分是二氧化硅
C.水玻璃可以作为粘合剂、木材防火剂
D.“中国天眼”的镜片材料为SiC,属于新型无机非金属材料
6.食品添加剂是指为改善食品的色、香、味,以及对食品进行防腐和加工而加入食品中的
化学合成或天然物质。下列关于SO 的说法正确的是( )
2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.SO 具有还原性,不能用浓硫酸干燥
2
B.SO 是一种无色无味的有毒气体
2
C.SO 可以使酸性KMnO 溶液褪色,体现了它的漂白性
2 4
D.SO 具有还原性,少量的SO 可防止葡萄酒氧化变质
2 2
7.根据乙烯的性质可以推测丁烯(CH=CHCHCH)的性质,下列说法不正确的是( )
2 2 3
A.丁烯能使酸性高锰酸钾溶液褪色
B.聚丁烯的结构可以表示为
C.丁烯能在空气中燃烧
D.丁烯与溴发生加成反应的产物是BrCHCHCHCHBr
2 2 2 2
8.下列说法错误的是( )
A.蛋白质、油脂、聚乙烯塑料都是有机高分子化合物
B.大多数酶是具有高选择催化性能的蛋白质
C.植物油含不饱和脂肪酸酯,能使Br /CCl 褪色
2 4
D.淀粉和纤维素水解的最终产物均为葡萄糖
9.由丁烯与氯气加成得到的分子式为C HCl 的有机物,其结构简式不可能为( )
4 8 2
A. CHClCHCl-CH -CH B. CH-CHCl-CHCl-CH
2 2 3 3 3
C.CHCH(CH Cl) D.
3 2 2
10.常温下,可逆反应2NO 2NO+O 在恒容密闭容器中进行,下列叙述能够说明反
2 2
应已达到平衡状态的是( )
A.单位时间内生成n mol O 的同时生成2n mol NO
2 2
B.单位时间内生成n mol O 的同时生成2n mol NO
2
C.混合气体的密度不再改变
D.容器中NO 、NO、O 的物质的量之比为2∶2∶1
2 2
11.工业制硫酸中一步重要的反应是: SO 在400~ 500 °C的条件下进行催化氧化:
2
2SO +O 2SO ,其正反应为放热反应,如果该反应是在密闭容器中进行的,下列有关说法
2 2 3
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司中错误的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,反应达平衡时容器中存在SO 、O、SO 三种物质
2 2 3
C.达到平衡时,正逆反应速率为0
D.通过调控反应条件,可以提高反应进行的程度
12.用N 表示阿伏伽德罗常数的值,下列说法正确的是( )
A
A.1 L 1 mol/L的氨水中含有NH ·H O分子的数目为N
3 2 A
B.过量的Cu与含0.2 molHNO 的浓硝酸反应,转移电子的数目大于0.1N
3 A
C.标准状况下,2.24 LSO 所含的原子总数为0.4N
2 A
D.1 molN 与3 molH 一定条件下充分反应,生成NH 的分子数为2N
2 2 3 A
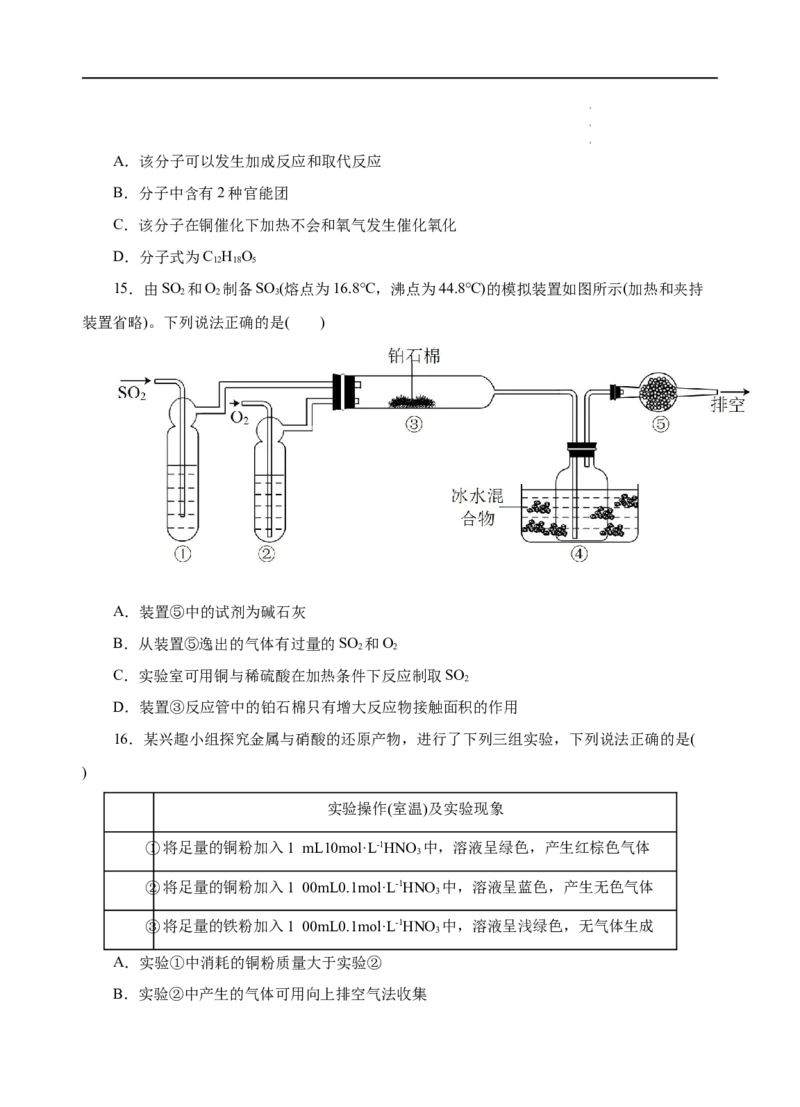
13.从淡化海水后的浓海水中提取溴的流程如图所示,下列有关说法错误的是( )
A.X为SO 气体,也可将SO 换成NaSO
2 2 2 3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1 mol Br ,需要消耗Cl 的体积最多为22.4 L(标准状况下)
2 2
14.某有机物的结构简式如图所示,下列说正确的( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.该分子可以发生加成反应和取代反应
B.分子中含有2种官能团
C.该分子在铜催化下加热不会和氧气发生催化氧化
D.分子式为C H O
12 18 5
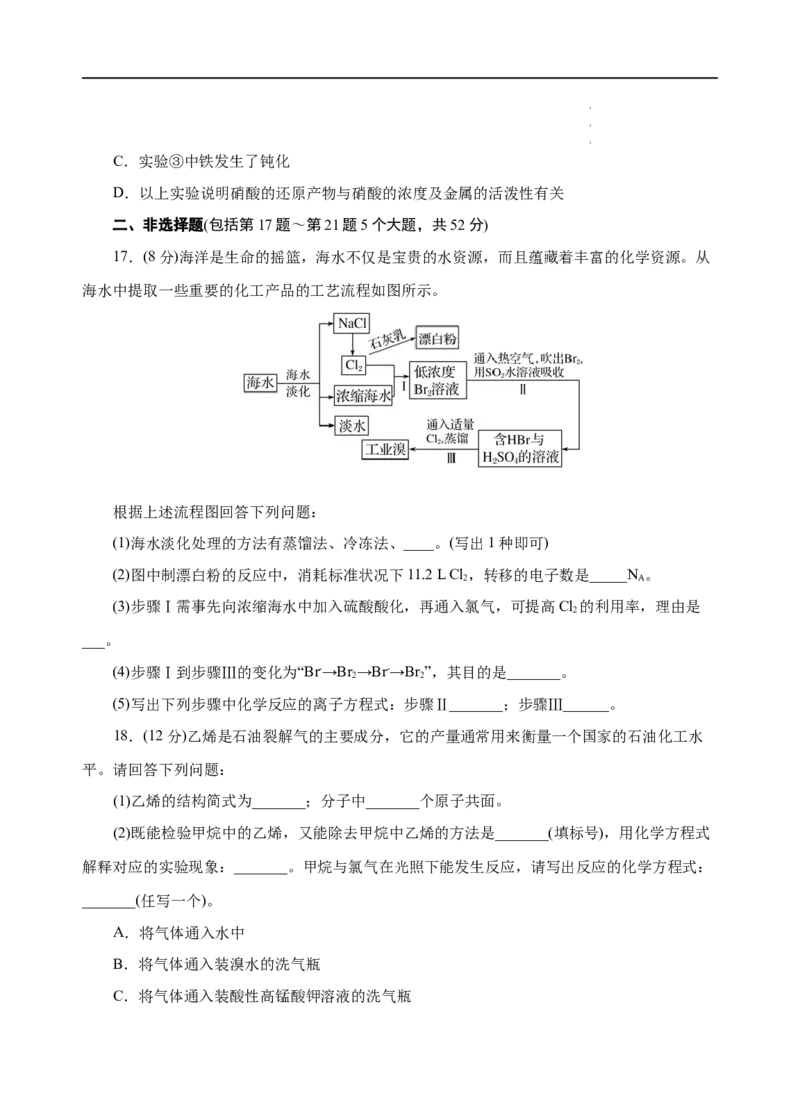
15.由SO 和O 制备SO (熔点为16.8℃,沸点为44.8℃)的模拟装置如图所示(加热和夹持
2 2 3
装置省略)。下列说法正确的是( )
A.装置⑤中的试剂为碱石灰
B.从装置⑤逸出的气体有过量的SO 和O
2 2
C.实验室可用铜与稀硫酸在加热条件下反应制取SO
2
D.装置③反应管中的铂石棉只有增大反应物接触面积的作用
16.某兴趣小组探究金属与硝酸的还原产物,进行了下列三组实验,下列说法正确的是(
)
实验操作(室温)及实验现象
①将足量的铜粉加入1 mL10mol·L-1HNO 中,溶液呈绿色,产生红棕色气体
3
②将足量的铜粉加入1 00mL0.1mol·L-1HNO 中,溶液呈蓝色,产生无色气体
3
③将足量的铁粉加入1 00mL0.1mol·L-1HNO 中,溶液呈浅绿色,无气体生成
3
A.实验①中消耗的铜粉质量大于实验②
B.实验②中产生的气体可用向上排空气法收集
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.实验③中铁发生了钝化
D.以上实验说明硝酸的还原产物与硝酸的浓度及金属的活泼性有关
二、非选择题(包括第17题~第21题5个大题,共52分)
17.(8分)海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从
海水中提取一些重要的化工产品的工艺流程如图所示。
根据上述流程图回答下列问题:
(1)海水淡化处理的方法有蒸馏法、冷冻法、____。(写出1种即可)
(2)图中制漂白粉的反应中,消耗标准状况下11.2 L Cl ,转移的电子数是_____N 。
2 A
(3)步骤Ⅰ需事先向浓缩海水中加入硫酸酸化,再通入氯气,可提高Cl 的利用率,理由是
2
___。
(4)步骤Ⅰ到步骤Ⅲ的变化为“Br-→Br →Br-→Br ”,其目的是_______。
2 2
(5)写出下列步骤中化学反应的离子方程式:步骤Ⅱ_______;步骤Ⅲ______。
18.(12分)乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水
平。请回答下列问题:
(1)乙烯的结构简式为_______;分子中_______个原子共面。
(2)既能检验甲烷中的乙烯,又能除去甲烷中乙烯的方法是_______(填标号),用化学方程式
解释对应的实验现象:_______。甲烷与氯气在光照下能发生反应,请写出反应的化学方程式:
_______(任写一个)。
A.将气体通入水中
B.将气体通入装溴水的洗气瓶
C.将气体通入装酸性高锰酸钾溶液的洗气瓶
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司D.将气体通入氢氧化钠溶液中
(3)下列物质中,可以通过乙烯加成反应得到的是_______(填标号)。
A.CHCH B.CHCHBr C.CHCHOH D.CHCHBr
3 3 3 2 3 2 3 3
(4)CH CHCl是一种重要的化工原料,可通过乙烯与氯化氢的加成反应或乙烷与氯气的取代
3 2
反应制得,你认为哪种方法较好?请说明理由_______。
(5)乙烯常用于制造聚乙烯塑料,写出该反应的化学方程式:_______。
19.(10分)乙烯是石油化工的重要基本原料。通过一系列化学反应,可以由乙烯得到有机
高分子材料、药物等成千上万种有用的物质。
根据上述装置,回答下列问题:
(1)已知:1,2—二溴乙烷的密度比水的大,难溶于水,易溶于四氯化碳。
预测:试管①中装有溴的四氯化碳溶液,试管①可能出现的实验现象是___。
试管②中装有溴水,则试管②可能出现的实验现象为____。
(2)试管③中装有的是酸性高锰酸钾溶液,则试管③发生反应的类型为____。
(3)写出试管①中发生反应的化学方程式:____,反应类型为____。
(4)做乙烯燃烧实验之前必须进行的操作是____,乙烯燃烧可能观察到的现象是____。
(5)下列属于有机高分子化合物的是____(填标号)。
①聚乙烯(PE) ②光导纤维 ③聚四氟乙烯(PTFE) ④聚丙烯(PP) ⑤聚
氯乙烯(PVC) ⑥石墨纤维
A.①②③④ B.②③④⑥ C.③④⑤⑥ D.①③④⑤
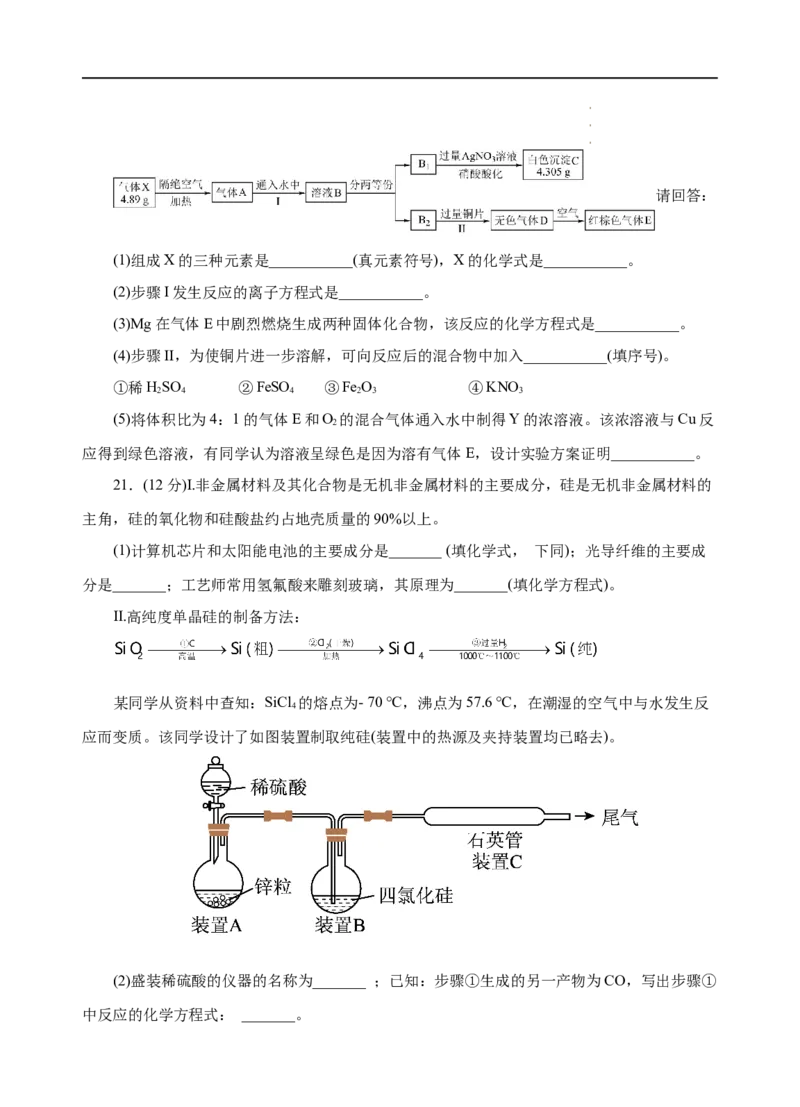
20.(10分)由三种元素组成的化合物X,按如下流程进行实验。气体A是由气体E和气体F
组成的混合物,溶液B可被80mL1.5mol·L-1的NaOH溶液恰好中和。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司请回答:
(1)组成X的三种元素是___________(真元素符号),X的化学式是___________。
(2)步骤I发生反应的离子方程式是___________。
(3)Mg在气体E中剧烈燃烧生成两种固体化合物,该反应的化学方程式是___________。
(4)步骤II,为使铜片进一步溶解,可向反应后的混合物中加入___________(填序号)。
①稀HSO ②FeSO ③Fe O ④KNO
2 4 4 2 3 3
(5)将体积比为4:1的气体E和O 的混合气体通入水中制得Y的浓溶液。该浓溶液与Cu反
2
应得到绿色溶液,有同学认为溶液呈绿色是因为溶有气体E,设计实验方案证明___________。
21.(12分)I.非金属材料及其化合物是无机非金属材料的主要成分,硅是无机非金属材料的
主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)计算机芯片和太阳能电池的主要成分是_______ (填化学式, 下同);光导纤维的主要成
分是_______;工艺师常用氢氟酸来雕刻玻璃,其原理为_______(填化学方程式)。
Ⅱ.高纯度单晶硅的制备方法:
某同学从资料中查知:SiCl 的熔点为- 70 ℃,沸点为57.6 ℃,在潮湿的空气中与水发生反
4
应而变质。该同学设计了如图装置制取纯硅(装置中的热源及夹持装置均已略去)。
(2)盛装稀硫酸的仪器的名称为_______ ;已知:步骤①生成的另一产物为CO,写出步骤①
中反应的化学方程式: _______。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(3)装置A中发生反应的离子方程式为_______。
(4)已知:SiCl 在潮湿的空气中能与水发生反应生成氯化氢。为防止空气污染,含有SiCl 的
4 4
尾气可通入盛有_______(填试剂名称)的烧杯中。
(5)同学甲认为用该装置进行实验,可能会导致实验失败,为保证制备纯硅实验的成功,你
认为该装置应进行的改进措施是_______。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司