文档内容
高一化学高频考题期末测试卷 02
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修二 难度:★★★☆☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Cl-35.5 Fe-56 Cu-64
一、选择题(本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
题目要求的。)
1.下列含硅制品中,主要成分为硅单质的是( )
A.水晶镜片 B.玛瑙手镯 C.陶瓷餐具 D.计算机芯片
【答案】D
【解析】A项,水晶镜片的主要成分是二氧化硅,故A不符合题意;B项,玛瑙手镯的主
要成分是二氧化硅,故B不符合题意;C项,陶瓷餐具为硅酸盐材料,故C不符合题意;D项,
计算机芯片是硅单质,故D符合题意;故选D。
2.下列表示正确的是( )
A.乙烯的实验式:C H B.N 的电子式:
2 4 2
C.聚氯乙烯的结构简式: D.异丁烷的球棍模型:
【答案】C
【解析】A项,乙烯的实验式是CH,A项错误;B项,N 为共价化合物,则其电子式是:
2 2
,B项错误;C项,氯乙烯的结构简式为CH=CH Cl,则聚氯乙烯的结构简式:
2 2
,C项正确;D项, 为正丁烷的球棍模型,D项错误;故选C。
3.能证明CH 分子的空间结构为正四面体形而非平面正方形的事实是
4
A.CH 的二氯取代物只有一种结构 B.CHC1分子只有一种结构
4 3
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.C原子距离四个H原子距离一样 D.CH 分子中的四个碳氢键一样
4
【答案】A
【解析】A项,若CH 分子的空间结构为平面正方形,二氯代物有2种,CH 的二氯取代物
4 4
只有一种结构,说明CH 分子的空间结构为正四面体形,故选A;B项,无论CH 分子的空间结
4 4
构为正四面体形还是平面正方形,CHC1分子都只有一种结构,故不选B;C项,无论CH 分子
3 4
的空间结构为正四面体形还是平面正方形,C原子距离四个H原子距离一样,故不选C;D项,
无论CH 分子的空间结构为正四面体形还是平面正方形,CH 分子中的四个碳氢键一样,故不选
4 4
D;故选A。
4.下列有关化学品的说法不正确的是( )
A.阿司匹林是一种重要的天然药物,具有解热镇痛作用
B.亚硝酸钠能防止肉制品变质,但有一定毒性
C.农药在农作物病虫害的综合防治中占有重要地位
D.毒品对个人和社会危害极大,每一个人都应远离毒品
【答案】A
【解析】A项,阿司匹林是一种重要的合成药物,化学名称为乙酰水杨酸,具有解热镇痛
作用,A错误;B项,亚硝酸钠具有还原性,因此能防止肉制品氧化变质,但有一定毒性,因此
一定要注意量的使用在安全范围,B正确;C项,农药可以治疗病虫害,提高农作物的产量,因
此在农作物病虫害的综合防治中占有重要地位,C正确;D项,毒品对中枢神经系统和周围神经
系统都有很大的损害,可产生异常的兴奋、抑制等作用,出现一系列神经、精神症状,如失眠、
烦躁、惊厥、麻痹、记忆力下降、主动性降低、性格孤僻、意志消沉、周围神经炎等。对心血
管系统、呼吸系统、消化系统和生殖系统等都会造成严重的危害。吸毒使免疫力下降,还会成
为感染艾滋病、乙肝等血液传染病的高危人群。可见毒品对个人和社会危害极大,每一个人都
应远离毒品,D正确;故选A。
5.下列关于材料的说法错误的是( )
A.碳纳米管是一种含有碳元素的化合物,属于新型无机非金属材料
B.钛合金密度小、硬度大、熔点高,可用于制造飞机、火箭
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.三峡大坝的建设使用了大量的水泥,水泥属于硅酸盐材料
D.不锈钢的抗腐蚀性能良好,可用于制作医疗器械
【答案】A
【解析】A项,碳纳米管是一种含有碳元素的单质,属于新型无机非金属材料,故A错误;
B项,钛合金具有密度小、硬度大、熔点高的特性,常用于制造飞机、火箭,故B正确;C项,
三峡大坝的建设中使用了大量的水泥,水泥的主要成分是硅酸盐,属于硅酸盐材料,故C正确;
D项,不锈钢具有抗腐蚀性能良好的特性,常用于制作医疗器械,故C正确;故选A。
6.下列说法正确的是( )
A.沼气和水煤气的主要成分均为甲烷
B.甲烷中含有乙烯,可通过溴水除去
C.1 mol CH 与4 mol Cl 在光照下完全反应可生成1 mol CCl
4 2 4
D.棉花、塑料、涂料都是合成有机高分子材料
【答案】B
【解析】A项,水煤气的主要成分是CO和H,故A错误;B项,甲烷和溴不反应,乙烯
2
和溴发生加成反应生成1,2-二溴乙烷,所以可以用溴水除去甲烷中的乙烯,故B正确;C项,
1 mol CH 与4 mol Cl 在光照下完全反应可生成多种取代物,故C错误;D项,棉花不是合成有
4 2
机高分子材料,属于天然高分子材料,故D错误;故选B。
7.糖类、脂肪和蛋白质是维持人体生命活动所需的三大营养物质。下列有关基本营养物质
的说法不正确的是( )
A.蛋白质可水解生成氨基酸 B.常温下淀粉溶液遇碘变蓝
C.制备肥皂是利用油脂的水解 D.油脂由C、H、O、N四种元素组成
【答案】D
【解析】A项,蛋白质含-CONH-,水解生成氨基酸,故A正确;B项,淀粉遇碘单质变蓝,
则常温下淀粉溶液遇碘变蓝,故B正确;C项,油脂在碱性条件下水解反应为皂化反应,故C
正确;D项,油脂为高级脂肪酸甘油酯,只含C、H、O元素,不含N元素,故D错误;故选
D。
8.下列说法正确的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.化学电池的反应基础是氧化还原反应
C.燃料电池是一种高效但是会严重污染环境的新型电池
D.铅蓄电池放电的时候正极是Pb,负极是PbO
2
【答案】B
【解析】A项,镍氢电池、锂离子电池为二次电池,碱性锌锰千电池为一次电池,选项A
错误;B项,化学电池是将化学能转变为电能的装置,有电子的转移,实质为氧化还原反应,
选项B正确;C项,燃料电池如氢氧燃料电池高效,但没有污染, 选项C错误;D项,铅蓄电
池放电的时候,Pb被氧化,为原电池的负极,PbO 被还原,为原电池的正极,选项D错误;故
2
选B。
9.有关有机化合物中碳原子的成键特点,下列说法错误的是( )
A.碳原子最外层有4个电子,每个碳原子形成4个价键
B.碳原子间只能形成碳链,不能形成碳环
C.在CH 分子中,四个碳氢共价键的长度和强度均相同
4
D.在正丁烷分子中,4个碳原子形成的碳链为锯齿形,不为直线形
【答案】B
【解析】A项,碳的原子序数为6,碳原子最外层有4个电子,每个碳原子可形成4个价键,
A正确;B项,碳原子间不但能形成碳链,还可以形成碳环,如环丁烷( ),B错误;C
项,在CH 分子中,形成4个碳氢键,四个碳氢键的键长与键能均相同,C正确;D项,饱和碳
4
与周围四个原子形成四面体结构,因此正丁烷分子中,4个碳原子形成的碳链为锯齿形,不为直
线形,D正确;故选B。
10.在一定温度下的恒容密闭容器中,能说明反应X(g)+Y(g) 2XY(g)已达到平衡状
2 2
态的是( )
A.容器内气体的密度不再变化
B.容器内气体总物质的量不随时间变化而变化
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.每断开1个X—X键的同时,有2个X—Y键形成
D.XY的分解速率是Y 的消耗速率的两倍
2
【答案】D
【解析】A项,该反应的反应物和生成物都是气体,混合气的总质量不变,容器体积恒定,
所以容器内气体密度一直不变,所以不能根据容器内气体密度不再变化确定反应达到平衡状态;
B项,反应前后化学计量数之和相等,反应容器内总物质的量不随时间变化而变化,不能判断
反应达到平衡;C项,根据化学方程式,每断开1个X—X键的同时,一定有2个X—Y键形成,
不能判断反应达到平衡;D项,XY的分解速率是Y 的消耗速率的两倍即正逆反应速率相等,
2
可以证明达到平衡状态;故选D。
11.聚乙烯可用于制作食品包装袋,在一定条件下可通过乙烯生成聚乙烯,下列说法中正
确的是( )
A.燃烧等质量的乙烯和聚乙烯时,聚乙烯消耗的氧气多
B.乙烯和纯净的聚乙烯都有固定的熔沸点
C.乙烯生成聚乙烯的反应是加成反应,ag乙烯完全反应可生成ag聚乙烯
D.乙烯和聚乙烯都能使溴的四氯化碳溶液和酸性KMnO 溶液褪色
4
【答案】C
【解析】A项,乙烯是聚乙烯的单体,它们的最简式相同,都是CH,故含C和H的质量
2
分数分别相等,则等质量的二者燃烧时消耗氧气的量相同,A错误;B项,聚乙烯具有固定的元
素组成,但因为n值不确定,为混合物,因而没有固定的熔、沸点,B错误;C项,乙烯生成聚
乙烯的反应是加成反应,没有副产物生成,故ag乙烯完全反应可生成ag聚乙烯,C正确;D项,
聚乙烯中没有不饱和键,不能使溴的四氯化碳溶液和酸性KMnO 溶液褪色,D错误;故选C。
4
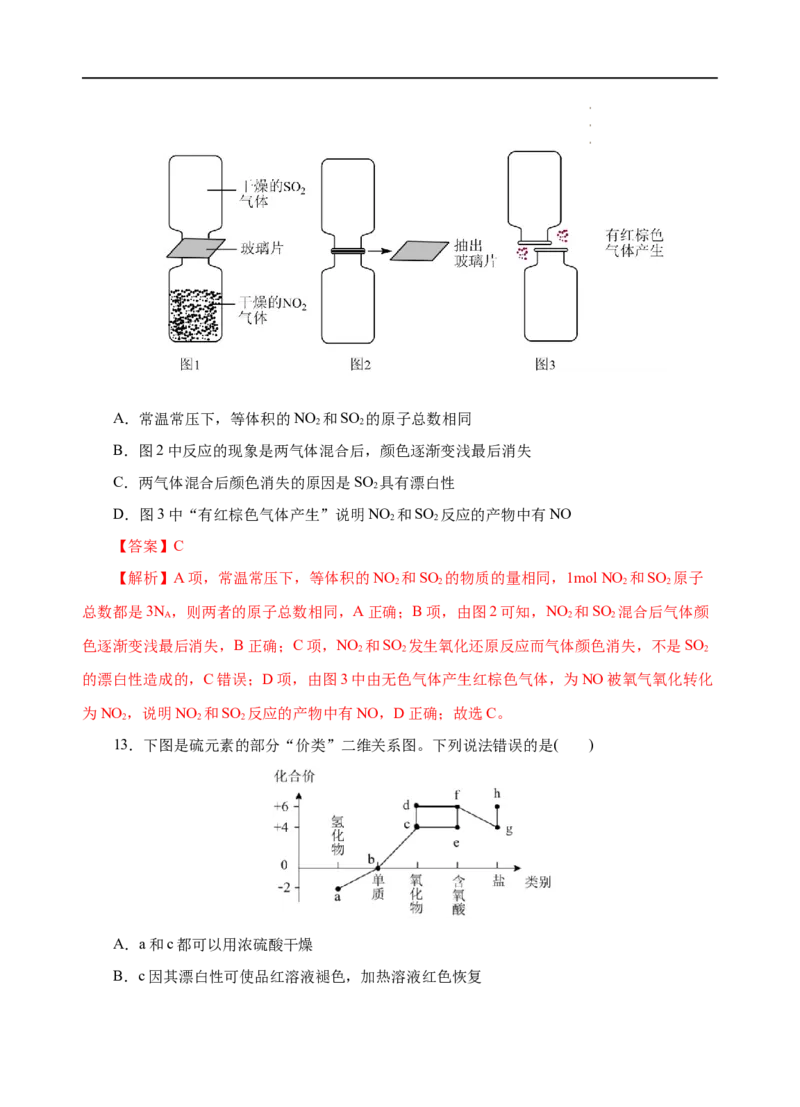
12.某化学学习小组为探究NO 和SO 的反应,进行了如图实验。下列说法不正确的是(
2 2
)
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.常温常压下,等体积的NO 和SO 的原子总数相同
2 2
B.图2中反应的现象是两气体混合后,颜色逐渐变浅最后消失
C.两气体混合后颜色消失的原因是SO 具有漂白性
2
D.图3中“有红棕色气体产生”说明NO 和SO 反应的产物中有NO
2 2
【答案】C
【解析】A项,常温常压下,等体积的NO 和SO 的物质的量相同,1mol NO 和SO 原子
2 2 2 2
总数都是3N ,则两者的原子总数相同,A正确;B项,由图2可知,NO 和SO 混合后气体颜
A 2 2
色逐渐变浅最后消失,B正确;C项,NO 和SO 发生氧化还原反应而气体颜色消失,不是SO
2 2 2
的漂白性造成的,C错误;D项,由图3中由无色气体产生红棕色气体,为NO被氧气氧化转化
为NO ,说明NO 和SO 反应的产物中有NO,D正确;故选C。
2 2 2
13.下图是硫元素的部分“价类”二维关系图。下列说法错误的是( )
A.a和c都可以用浓硫酸干燥
B.c因其漂白性可使品红溶液褪色,加热溶液红色恢复
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司C.硫酸型酸雨 的原因之一是发生了e→f的转化,使 减小
D.实验室常用g与f反应制备c,利用g与h也可以生成c
【答案】A
【解析】依据硫元素的部分“价类”二维关系图可知,a为HS,b为S,c为SO ,d为
2 2
SO ,e为HSO ,f为HSO ,g为含亚硫酸根离子或亚硫酸氢根离子的盐,h为含硫酸根离子或
3 2 3 2 4
硫酸氢根离子的盐。A项,a为HS,c为SO ,二氧化硫不与浓硫酸反应,可用浓硫酸干燥,但
2 2
硫化氢有还原性,浓硫酸有强氧化性,两者能发生氧化还原反应,不能用浓硫酸干燥硫化氢,A
错误;B项,c为SO ,二氧化硫有漂白性,能使品红溶液褪色,加热溶液红色恢复,B正确;C
2
项,e为HSO ,f为HSO ,硫酸型酸雨 的原因之一是发生了HSO 到HSO 的转化,
2 3 2 4 2 3 2 4
弱酸变为强酸,酸性增强,pH减小,C正确;D项,g为含亚硫酸根离子的盐,f为HSO ,c为
2 4
SO ,实验室用饱和亚硫酸溶液和浓硫酸反应制备二氧化硫;h为含硫酸氢根离子的盐,利用硫
2
酸氢钠和亚硫酸钠反应,也可生成二氧化硫,D正确;故选A。
14.2021年9月,我国科学家实现了CO 到淀粉的全合成,其部分转化关系如下图所示。
2
N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.反应①中每消耗11.2LCO,转移电子数为3N
2 A
B.1molCH OH所含共价键数为4N
3 A
C. 与 的混合物中所含氧原子数为N
A
D.162g淀粉完全水解生成的葡萄糖分子数为0.9N
A
【答案】C
【解析】A项,没有给标准状况,无法计算,A错误;B项,CHOH分子中含3个C-H键,
3
1个C-O键,1个H-O键,共5个共价键,故1molCH OH所含共价键数为5N ,B错误;C项,
3 A
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司DHA的分子式为C HO,其最简式和HCHO的最简式均为CHO,30g二者混合物的可以看成
3 6 3 2
由CHO组成,物质的量为30g÷30g/mol=1mol,含有的O原子为1mol,数目为N ,C正确;D
2 A
项,淀粉水解的化学方程式为 ,则162g淀粉完全水解生成的
葡萄糖分子数为N ,D错误;故选C。
A
15.某研究性学习小组所做的石蜡油(17个碳原子以上的烷烃)分解实验如图所示。下列有
关说法不正确的是( )
A.装置Ⅱ中逸出的气体通入高锰酸钾溶液,发生氧化反应
B.石蜡油分解生成的气体中只有烯烃
C.十八烷完全分解为乙烷和最多乙烯时,二者物质的量之比为1∶8
D.装置Ⅰ中硫酸铝和碎瓷片都是催化剂
【答案】B
【解析】装置I中发生石蜡油的分解实验,装置II中用冰水冷凝产物,装置III中为酸性高
锰酸钾溶液,检验还原性烯烃的存在。A项,装置II中逸出的气体通入高锰酸钾溶液,烯烃将
发生氧化反应,A正确;B项,石蜡油发生的是裂解反应,所以分解生成的气体中既有烯烃,又
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司有烷烃,B不正确;C项,十八烷完全分解为乙烷和最多乙烯时,按每两个碳原子作为一组,将
碳碳单键打断,共可断为9截,其中8截为乙烯,一截为乙烷,乙烷与乙烯物质的量之比为
1:8,C正确;D项,装置Ⅰ中硫酸铝和碎瓷片都是催化剂,D正确。故选B。
16.T ℃时,在恒容的密闭容器中通入一定量的NO和CO,发生反应:2NO(g)+2CO(g)
2CO(g)+N(g);测得NO和CO的浓度如表:
2 2
时间/s 0 2 4 6
NO 1.00 0.25 0.10 0.10
c/mol·L-1
CO 3.60 2.85 2.70 2.70
下列说法中,正确的是( )
A.0~2 s内,用NO表示的平均速率为0.125 mol·L-1·s-1
B.若使用催化剂,2 s时的c(NO)将大于0.25 mol·L-1
C.若升高温度,反应达到平衡的时间将缩短
D.4 s时,反应恰好达到该条件下的最大限度,且气体压强不再变化
【答案】C
【解析】A项,0~2s内,用NO表示的平均速率为 mol·L‾1·s‾1,A
项错误;B项,使用催化剂,反应速率加快,NO为反应物,则2s时的c(NO)将小于
0.25mol/L,B项错误;C项,升高温度,反应速率加快,则反应到达平衡的时间将缩短,C项正
确;D项,由图示数据知,4s时反应物的浓度不在改变,达到了平衡状态,则反应达到该条件
下的最大限度,但不能说明恰好此刻达到,D项错误;故选C。
二、非选择题(包括第17题~第21题5个大题,共52分)
17.(8分)山西运城实施“盐湖‘全科’修复,生态蝶变‘提速’”工程,“五步制盐”古
老工艺将传承再现。模拟“五步制盐法”制备粗盐(主要成分NaCl,还含有MgCl 、CaCl 、
2 2
NaSO 以及泥沙等杂质),并进一步在实验室中制备精盐的流程如下。
2 4
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)加入过量BaCl 溶液时发生反应的离子方程式为_______。
2
(2)试剂A是_______,加入它的目的是_______。
(3)操作X的名称是_______,这一操作类似于“五步制盐法”中的_______。
(4)加入适量稀盐酸的目的是_______。
(5)操作Y中所用的陶瓷仪器是_______。
【答案】(1)Ba2++SO2-=BaSO ↓(1分)
4 4
(2) Na CO(1分) 除去CaCl 和过量的BaCl (1分)
2 3 2 2
(3) 过滤(1分) 铲出(1分)
(4)除去滤液中NaCO、NaOH(2分) (5)蒸发皿(1分)
2 3
【解析】粗盐水中加入过量BaCl 溶液除去NaSO ,加入A为NaCO 除去CaCl 和过量的
2 2 4 2 3 2
BaCl ,加入B为NaOH除去MgCl ,操作X是过滤除去沉淀,再加入适量稀盐酸除去滤液中
2 2
NaCO、NaOH,最后操作Y是蒸发结晶得到NaCl晶体。(1)加入过量BaCl 溶液与NaSO 反应
2 3 2 2 4
生成硫酸钡沉淀,发生反应的离子方程式为Ba2++SO2-=BaSO ↓;(2)试剂A是NaCO,目的是
4 4 2 3
除去CaCl 和过量的BaCl ;(3)操作X是分离出沉淀和溶液,操作名称是过滤,“五步产盐法”
2 2
即通过“集卤蒸发、过箩调配、储卤、结晶、铲出”五个生产步骤产盐,过滤类似于铲出步骤;
(4)加入适量稀盐酸的目的是除去滤液中NaCO、NaOH;(5)从NaCl溶液中的得到NaCl晶体,
2 3
可采用在蒸发皿中蒸发结晶得到,操作Y是蒸发结晶,所用的陶瓷仪器是蒸发皿。
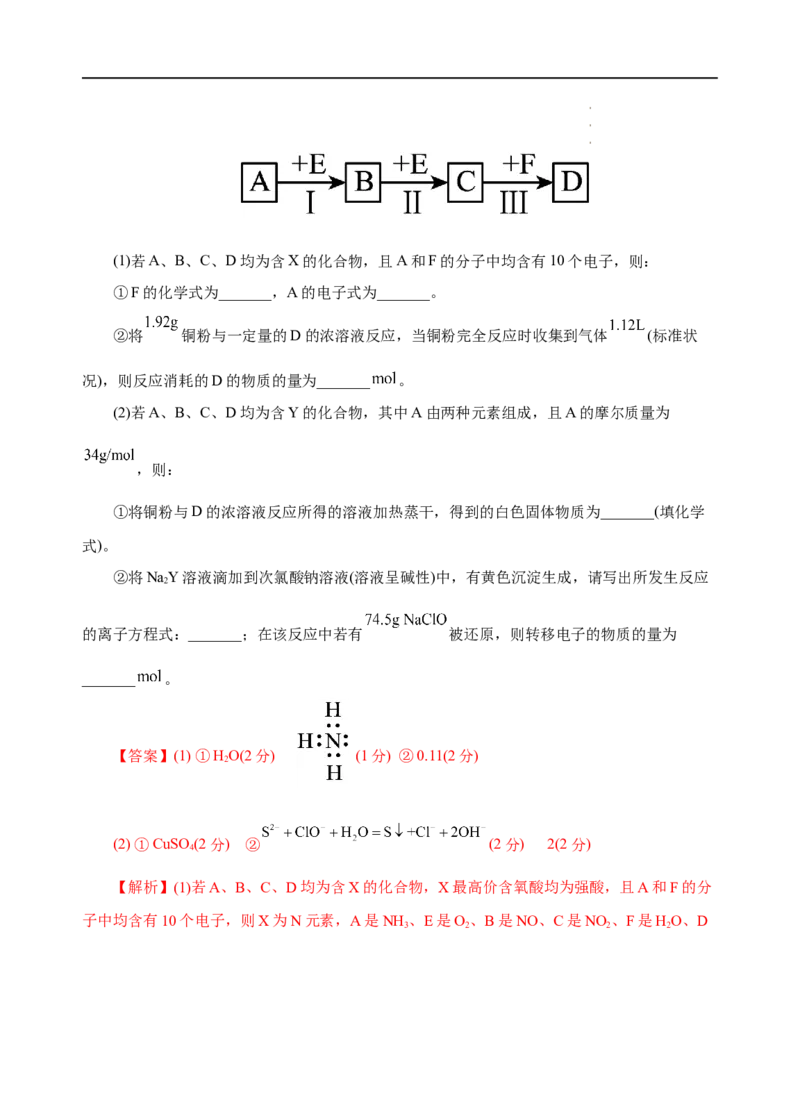
18.(11分)已知X和Y为中学化学中的常见元素,其最高价含氧酸均为强酸。根据如图所
示转化关系(反应条件及部分产物己略去),回答下列问题。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)若A、B、C、D均为含X的化合物,且A和F的分子中均含有10个电子,则:
①F的化学式为_______,A的电子式为_______。
②将 铜粉与一定量的D的浓溶液反应,当铜粉完全反应时收集到气体 (标准状
况),则反应消耗的D的物质的量为_______ 。
(2)若A、B、C、D均为含Y的化合物,其中A由两种元素组成,且A的摩尔质量为
,则:
①将铜粉与D的浓溶液反应所得的溶液加热蒸干,得到的白色固体物质为_______(填化学
式)。
②将NaY溶液滴加到次氯酸钠溶液(溶液呈碱性)中,有黄色沉淀生成,请写出所发生反应
2
的离子方程式:_______;在该反应中若有 被还原,则转移电子的物质的量为
_______ 。
【答案】(1) ①HO(2分) (1分) ②0.11(2分)
2
(2) ①CuSO (2分) ② (2分) 2(2分)
4
【解析】(1)若A、B、C、D均为含X的化合物,X最高价含氧酸均为强酸,且A和F的分
子中均含有10个电子,则X为N元素,A是NH 、E是O、B是NO、C是NO 、F是HO、D
3 2 2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司是HNO。①F的化学式为HO,A是NH ,氨气是共价化合物,电子式为 。②将
3 2 3
铜粉与一定量的硝酸的浓溶液反应,生成硝酸铜、一氧化氮或二氧化氮、水, 铜粉生成
Cu(NO ) 的物质的量是 ,生成一氧化氮和二氧化氮的物质的量是
3 2
,根据氮元素守恒,则反应消耗的D的物质的量为(0.03×2+0.05)=0.11
。(2)若A、B、C、D均为含Y的化合物,最高价含氧酸均为强酸,Y是S元素,其中A由两种
元素组成,且A的摩尔质量为 ,A是HS、E是O、B是SO 、C是SO 、F是HO、D
2 2 2 3 2
是HSO 。①将铜粉与浓硫酸反应生成硫酸铜、二氧化硫、水,所得的溶液加热蒸干,得到的白
2 4
色固体物质为CuSO 。②将NaS溶液滴加到次氯酸钠溶液(溶液呈碱性)中,有黄色沉淀生成,
4 2
说明S2-被氧化为S沉淀,发生反应的离子方程式 。在该反应
中,次氯酸钠中Cl元素化合价由+1降低为-1,若有 被还原,则转移电子的物质的
量为 。
19.(12分)请回答下列问题:
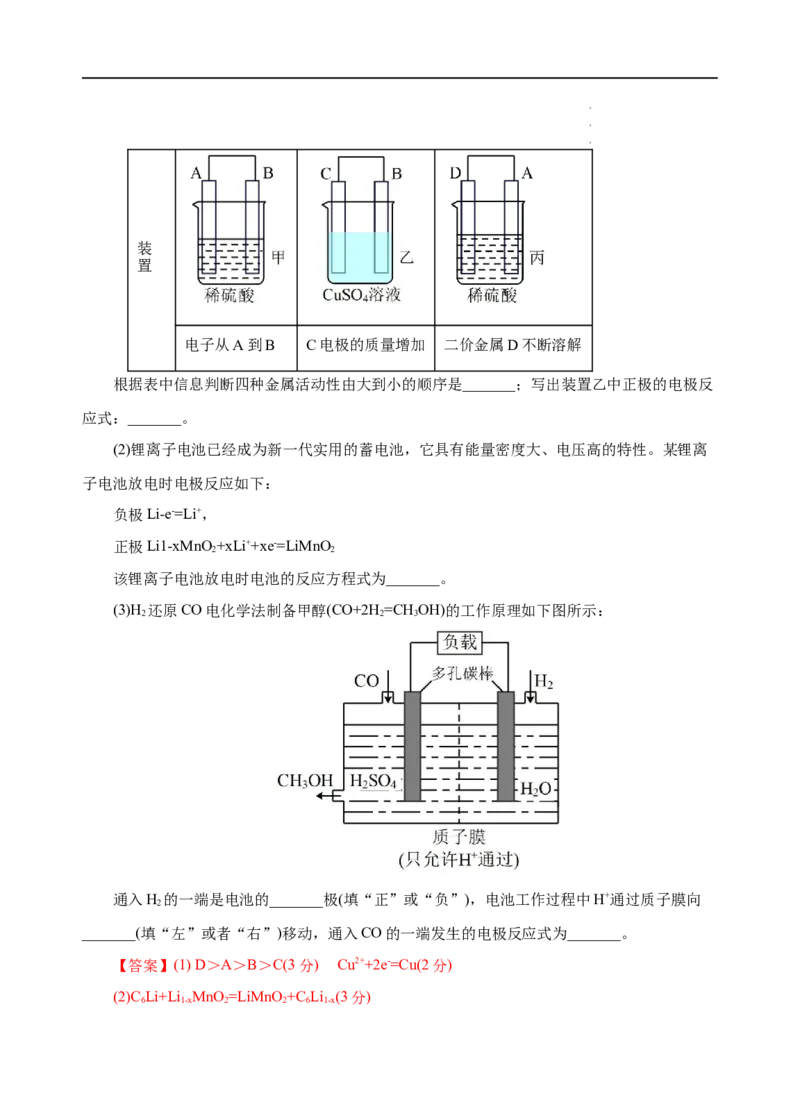
(1)把A、B、C、D四种金属按表中装置进行实验。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司装
置
电子从A到B C电极的质量增加 二价金属D不断溶解
根据表中信息判断四种金属活动性由大到小的顺序是_______;写出装置乙中正极的电极反
应式:_______。
(2)锂离子电池已经成为新一代实用的蓄电池,它具有能量密度大、电压高的特性。某锂离
子电池放电时电极反应如下:
负极Li-e-=Li+,
正极Li1-xMnO+xLi++xe-=LiMnO
2 2
该锂离子电池放电时电池的反应方程式为_______。
(3)H 还原CO电化学法制备甲醇(CO+2H=CH OH)的工作原理如下图所示:
2 2 3
通入H 的一端是电池的_______极(填“正”或“负”),电池工作过程中H+通过质子膜向
2
_______(填“左”或者“右”)移动,通入CO的一端发生的电极反应式为_______。
【答案】(1) D>A>B>C(3分) Cu2++2e-=Cu(2分)
(2)C Li+Li MnO =LiMnO +C Li (3分)
6 1-x 2 2 6 1-x
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(3) 负(1分) 左(1分) CO+4e-+4H+=CH OH(2分)
3
【解析】在原电池反应中,活泼金属为负极,失去电子,发生氧化反应;不活泼的金属为
正极,正极上得到电子发生还原反应。电子由负极经外电路流向正极,溶液中阳离子向正极定
向移动,阴离子向负极定向移动,同一闭合回路中电子转移数目相等。(1)在装置甲中,电子从
A到B,则A为负极,B为正极,所以金属活动性:A>B;在装置乙中,C电极质量增加,说
明在C上Cu2+得到电子变为Cu单质,因此C电极为正极,正极的电极反应式为:Cu2++2e-
=Cu;B电极为负极,则金属活动性:B>C;在装置丙中,二价金属D不断溶解,则D失去电
子,发生氧化反应,所以D为负极,A为正极,故金属活动性:D>A。综上所述可知:四种金
属活动性由大到小的顺序是:D>A>B>C;装置乙中C电极为正极,正极的电极反应式为:
Cu2++2e-=Cu;(2)在原电池反应中,同一闭合回路中电子转移数目相等。负极电极反应式为:Li-
e-=Li+,正极电极反应式为:Li MnO +xLi++xe-=LiMnO ,将负极电极式与正极电极式相加,可
1-x 2 2
得该锂离子电池放电时电池的反应方程式为:C Li+Li MnO =LiMnO +C Li ;(3)根据总反应方
6 1-x 2 2 6 1-x
程式CO+2H=CH OH可知:H 失去电子变为H+,发生氧化反应,CO得到电子发生还原反应变
2 3 2
为CHOH。故在该燃料电池中,通入H 的一端为原电池的负极,失去电子发生氧化反应,通入
3 2
CO的一端为正极,得到电子发生还原反应。电池工作过程中H+通过质子膜向正极CO一端即向
左移动,通入CO的一端为正极,正极上的电极反应式为:CO+4e-+4H+=CH OH。
3
20.(10分)A~F各物质间转化关系如下图所示。A为常见气态烃,可作果实催熟剂,其产量
可作为一个国家石油化工发展水平的标志,B和D是生活中常见有机物,F有香味。
(1)D中含有的官能团名称是_____________,④的反应类型是_______。
(2)写出有机物E的结构简式___________________;
(3)写出反应②的化学方程式:_______________________________;
(4)熔喷布是口罩最核心的材料,熔喷布主要以聚丙烯为主要原料。聚丙烯可由丙烯
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(CHCH=CH)合成。下列说法不正确的是_______。
3 2
a.聚丙烯与丙烯互为同分异构体 b.丙烯与题中物质A互为同系物
c.丙烯通常是由煤的综合利用得到的 d.丙烯和题中物质B都能被酸性高
锰酸钾氧化
【答案】(1) 羧基(1分) 酯化反应或取代反应(2分) (2)BrCH CHBr(2分)
2 2
(3)2CH CHOH+O 2CHCHO+2H O(2分) (4)bd(3分)
3 2 2 3 2
【解析】由A为常见气态烃,可作果实催熟剂,其产量可作为一个国家石油化工发展水平
的标志可知A为CH=CH ;B和D是生活中常见有机物,F有香味,则B为CHCHOH、C为
2 2 3 2
CHCHO、D为CHCOOH、F为CHCOOCH CH;由有机物的转化关系可知,E为
3 3 3 2 3
BrCHCHBr。(1)由分析可知,D的结构简式为CHCOOH,官能团为羧基;④的反应为在浓硫
2 2 3
酸作用下,乙醇与乙酸共热发生酯化反应生成乙酸乙酯和水;(2) E的结构简式为BrCHCHBr;
2 2
(3)由分析可知,反应②为在铜做催化剂作用下,乙醇与氧气共热发生催化氧化反应生成乙醛和
水,反应的化学方程式为2CHCHOH+O 2CHCHO+2H O;(4)a项,聚丙烯与丙烯的分
3 2 2 3 2
子式不同,不可能互为同分异构体,故错误;b项,丙烯与乙烯结构相似都含有1个碳碳双键,
分子组成相差1个CH 原子团,互为同系物,故正确;c项,丙烯是短链不饱和气态烃,通常是
2
由是由石油的催化裂化得到的,故错误;d项,丙烯中的碳碳双键和乙醇中的羟基都能与酸性高
锰酸钾溶液发生氧化反应,被酸性高锰酸钾氧化,故正确;故选bd。
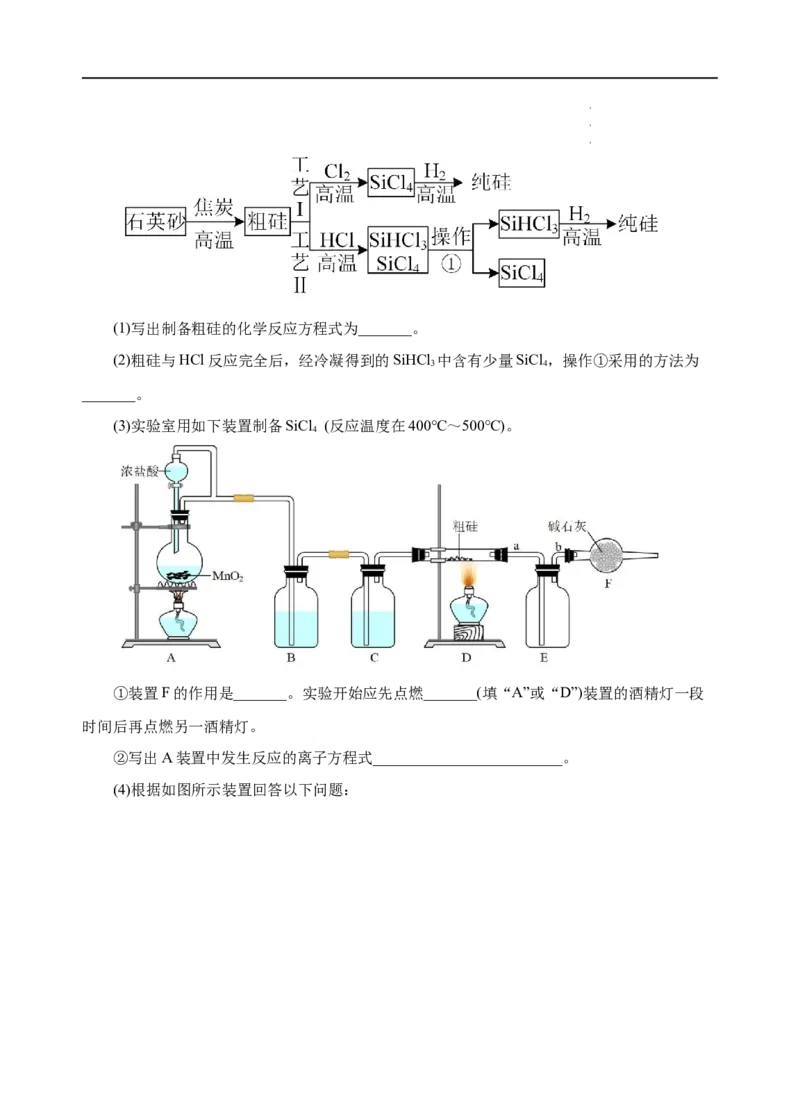
21.(11分)以粗硅(含铁、铝等杂质)为原料,工业上有以下两种制备高纯硅的工艺。已知:
SiCl 沸点57.7℃,遇水强烈水解;SiHCl 沸点31.5℃,且能与HO强烈反应,并在空气中易自
4 3 2
燃。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)写出制备粗硅的化学反应方程式为_______。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl 中含有少量SiCl ,操作①采用的方法为
3 4
_______。
(3)实验室用如下装置制备SiCl (反应温度在400℃~500℃)。
4
①装置F的作用是_______。实验开始应先点燃_______(填“A”或“D”)装置的酒精灯一段
时间后再点燃另一酒精灯。
②写出A装置中发生反应的离子方程式_________________________。
(4)根据如图所示装置回答以下问题:
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司若要用此装置证明非金属性:C>Si,从以下所给物质中选出甲同学设计的实验所用到的物
质:①稀盐酸 ②稀硫酸 ③碳酸钙 ④NaSiO 溶液 ⑤碳酸钠。试剂A为_______,试剂C为
2 3
_______(填序号)。
【答案】(1)SiO+2C Si+2CO↑(2分) (2)蒸馏(1分)
2
(3) 吸收未反应完的氯气和防止空气中水蒸气进入E中(2分) A(2分)
MnO +4H++2Cl- Mn2++Cl↑+2HO(2分)
2 2 2
(4) ②(1分) ④(1分)
【解析】石英砂和焦炭高温下反应生成粗硅和一氧化碳,粗硅和氯化氢高温反应生成四氯
化硅和SiHCl ,根据沸点不同进行蒸馏得到SiHCl ,SiHCl 再和氢气高温反应生成纯硅,粗硅
3 3 3
也可以先和氯气反应生成四氯化硅,四氯化硅和氢气高温反应生成纯硅。实验室用浓盐酸和二
氧化锰在加热条件下反应生成氯气、氯化锰和水,先用饱和食盐水除掉氯化氢气体杂质,再用
浓硫酸干燥氯气,氯气再和粗硅反应生成四氯化硅,由于四氯化硅见水强烈水解,因此用碱石
灰防止空气中水蒸气进入装置。(1)制备粗硅是碳和二氧化硅反应生成粗硅和一氧化碳,其化学
反应方程式为SiO+2C Si+2CO↑;(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl 中含
2 3
有少量SiCl ,由于两者都要与水反应,又根据两者沸点不同,因此操作①采用的方法为蒸馏;
4
(3)①D中氯气未反应完,需要进行尾气处理且四氯化硅遇见强烈水解,因此装置F的作用是吸
收未反应完的氯气和防止空气中水蒸气进入E中。实验时先利用氯气将装置内的空气排出,再
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司是氯气和硅反应,因此开始应先点燃A装置的酒精灯一段时间后再点燃另一酒精灯;②A装置
是实验室制取氯气,利用二氧化锰和浓盐酸在加热条件下反应生成氯气、氯化锰和水,其发生
反应的离子方程式MnO +4H++2Cl- Mn2++Cl↑+2HO; (4)要用此装置证明非金属性:C
2 2 2
>Si,一般利用最高价氧化物对应水化物的酸性强弱来比较,由于盐酸易挥发,因此只能用稀硫
酸和碳酸钠反应生成二氧化碳、硫酸钠和水,再是二氧化碳气体通入到硅酸钠溶液中产生白色
沉淀,因此试剂A为②,试剂C为④。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司