文档内容
2024 级“贵百河—武鸣高中”10 月高一年级新高考月考测试
化 学
(考试时间:75分钟 满分:100分)
注意事项:
1.本试卷分选择题和非选择题两部分。答卷前,考生务必将自己的姓名、学校、班级、准考
证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需
改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符
合题意要求的。
1.化学与生产、生活、科技等方面密切相关,下列说法正确的是( )
A.水是生存之本,文明之源,H O与H O 互为同素异形体
2 2 2
B.河道中的垃圾回收分类后,进行无害化处理,该处理过程中没有涉及化学变化
C.德尔塔新冠病毒有可能在空气中以气溶胶的形式传播,气溶胶属于胶体
D.维生素C又称“抗坏血酸”,能帮助人体将食物中摄取的、不易吸收的 转变为易吸收的
Fe2+,这说明维生素C具有氧化性
2.安全意识对我们的生产生活非常重要,下列操作错误的是( )
A.钠着火时,不能用大量水扑灭
B.闻气味时,用手轻轻地在瓶口扇动,使极少量的气体进入鼻孔
C.中学实验室可以将未用完的钠、钾、白磷等易燃物放回原试剂瓶
D.不慎将强酸沾到皮肤上,应立即用大量水冲洗,然后用3%~5%稀NaOH溶液冲洗
3.下列关于电解质与非电解质的说法正确的是( )
A.电解质一定能导电,能导电的物质一定属于电解质
B.SO 溶于水形成的溶液能导电,但SO 是非电解质
3 3
C.液态氯化氢不导电,所以氯化氢是非电解质
D.BaSO 在水中难导电,所以BaSO 不是电解质
4 4
4.化学是一门以实验为基础的科学,下列实验操作正确的是( )
A.稀释浓硫酸 B.称取药品 C.滴加液体 D.溶解固体
5.下列物质分类的正确组合是( )选项 碱 酸 盐 碱性氧化物 酸性氧化物
A 纯碱 H SO NaHCO MgO CO
2 4 3 2
B 碱石灰 HCl NaCl Na O CO
2
C 烧碱 HF CaCl Na O SO
2 2 2 2
D KOH HNO Cu (OH) CO CaO SO
3 2 2 3 3
6.酸、碱、盐、氧化物与生产生活密切相关,下列物质性质与用途对应关系不正确的是( )
A.CO具有还原性,可用于冶炼铁
B.NaOH易潮解,可用于SO 尾气的吸收
2
C.铁粉能与O 反应,可用作食品保存的脱氧剂
2
D.CaO具有吸水性,可用于制作干燥剂
7.已知氧化还原反应:
①Fe2++Zn=Fe+Zn2+ ②Cu2++Fe=Fe2++Cu ③2Fe3++Cu=2Fe2++Cu2+
下列说法不正确的是( )
A.氧化性:Fe3+>Cu2+>Fe2+>Zn2+
B.还原性:Zn>Fe>Cu>Fe2+
C.Fe3+不能与Zn反应
D.Fe2+在反应②中是氧化产物,在反应③中是还原产物
8.常温下,下列离子在指定的溶液中能大量共存的是( )
A.使酚酞变红的溶液中:K+、Na+、SO 2-、Cl-
4
B.酸性溶液中:Fe2+、Na+、SO 2-、NO -
4 3
C.在NaHCO 溶液中:K+、OH-、SO 2-、Cl-
3 4
D.无色透明溶液中:Cu2+、K+、Cl-、SO 2-
4
9.甲、乙、丙有如图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略
去)。下列各组物质按照甲、乙、丙的顺序不符合要求的是( )
A.C、CO、CO B.H O 、H O、O
2 2 2 2 2
C.NaOH、Na CO 、NaNO D.Fe O 、FeCl 、Fe(OH)
2 3 3 2 3 3 3
10.下列实验方案能够达到目的的是( )
实验目的 实验方案取试样加入稀盐酸,产生能使澄清石灰水变浑浊
A 证明某钠盐是碳酸盐
的气体
B 观察钠与水反应的现象 切下绿豆大小的钠,小心放入装满水的烧杯中
C 除去CO 中的少量HCl 将混合气体通过盛有氢氧化钠溶液的洗气瓶
2
用棉花包裹 Na O 粉末后,滴加几滴水,棉花燃
2 2
D 证明Na O 与H O反应放热
2 2 2
烧说明该反应放热
11.下列离子方程式书写正确的是( )
A.钠与水反应:Na + 2H O = Na+ + 2OH- + H ↑
2 2
B.Fe O 溶于盐酸中:O2- + 2H+ =H O
2 3 2
C.Cu(OH) 中加入硝酸:Cu(OH) + 2H+ = Cu2+ + 2H O
2 2 2
D.钠和硫酸铜溶液反应:2Na + Cu2+ = Cu + 2Na+
12.有①NaOH ②Ba(NO ) ③FeCl ④MgSO 四种溶液,不加其他试剂就可鉴别出来,鉴别
3 2 3 4
的先后顺序是( )
A.②①③④ B.③①④② C.④③①② D.③④②①
13.韦恩(Venn)图常用于展示不同的事物群组(集合)之间的数学或逻辑联系。如图是钠及其化合物
反应的韦恩图,图中两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。下列说法正确的
是( )
A.甲、乙、丙都属于氧化还原反应
B.丙反应中,H O是还原剂
2
C.Na O和Na O 中阴阳离子个数比不同
2 2 2
D.等量的Na与O 分别在常温和加热条件下完全反应,转移的电子数相等
2
14.工业上,氯气主要用于生产塑料、合成纤维、染料、农药、消毒剂以及各种氯化物。某种制备
氯气的反应原理如图所示。下列说法正确的是( )A.总反应为
B.转化过程中铜元素的化合价发生了变化
C.反应③中Cl 是还原产物
2
D.反应①②③均为氧化还原反应
二、非选择题:本题共4大题,共58分。
15.(14分)现有下列10种物质:①CO ②盐酸 ③CH COOH ④熔融NaOH ⑤酒精 ⑥
2 3
钠
⑦氢氧化铁胶体 ⑧KHSO 固体 ⑨Ba(OH) 溶液 ⑩胆矾晶体
4 2
(1)上述物质中属于电解质的是 (填序号)。
(2)写出物质⑧在熔融状态下的电离方程式: 。
(3)写出制备物质⑦的化学方程式: ,证明物质⑦已经制
成,可利用的胶体性质为______________(1分)。
(4)写出少量的①和⑨反应的离子方程式:______________________________。
(5)实验室中钠保存在___________中(1 分),钠在空气中燃烧火焰颜色为______(1
分)。
(6)将 Ba(OH) 溶液滴入 KHSO 溶液中至 SO 2-恰好沉淀完全,写出相应的离子方程式:
2 4 4
,在反应后的混合液中滴加紫色石蕊溶液,现象是
_____________(1分)(填“变红”、“变蓝”或“不变色”)。
16.(14分)化学实验是研究物质组成和探究物质性质的重要途径。
I.某化工厂排出的废水呈酸性,且其中含有大量Na+、Cu2+、SO 2-、Cl-、NO -。
4 3
(1)下列离子中,能大量存在于该废水中的是___________(填标号)。
A.Mg2+ B.Ag+ C.OH- D.HCO -
3
(2)取100mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子
的数目会发生变化的是 (用离子符号表示)。
Ⅱ.某有色透明溶液(忽略水的电离),可能含有Fe3+、Mg2+、CO 2-、SO 2-、Ba2+、MnO -、X
3 4 4
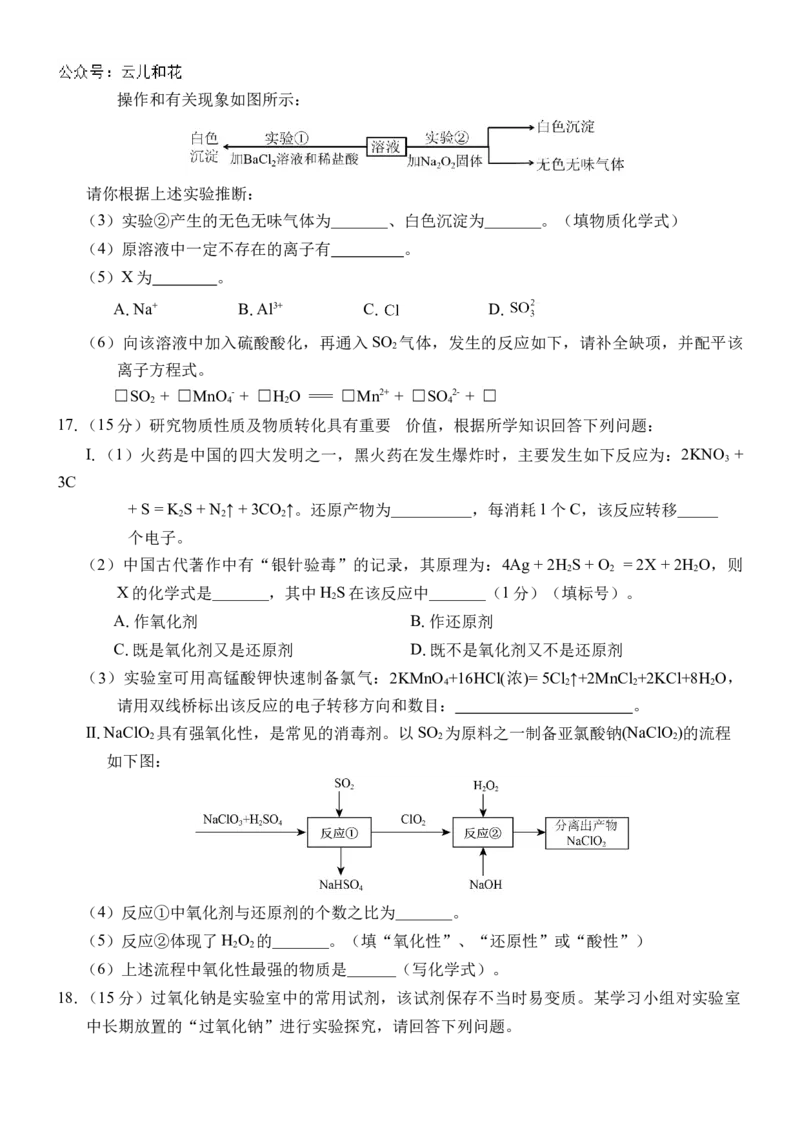
等离子中的几种,且离子数目相等,为分析其成分,取此溶液分别进行了两个实验,其操作和有关现象如图所示:
请你根据上述实验推断:
(3)实验②产生的无色无味气体为_______、白色沉淀为_______。(填物质化学式)
(4)原溶液中一定不存在的离子有 。
(5)X为 。
A.Na+ B.Al3+ C. D.
(6)向该溶液中加入硫酸酸化,再通入SO 气体,发生的反应如下,请补全缺项,并配平该
2
离子方程式。
☐SO + ☐MnO - + ☐H O === ☐Mn2+ + ☐SO 2- + ☐
2 4 2 4
17.(15分)研究物质性质及物质转化具有重要 价的值,根据所学知识回答下列问题:
I.(1)火药是中国的四大发明之一,黑火药在发生爆炸时,主要发生如下反应为:2KNO +
3
3C
+ S = K S + N ↑ + 3CO ↑。还原产物为__________,每消耗1个C,该反应转移_____
2 2 2
个电子。
(2)中国古代著作中有“银针验毒”的记录,其原理为:4Ag + 2H S + O = 2X + 2H O,则
2 2 2
X的化学式是_______,其中H S在该反应中_______(1分)(填标号)。
2
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(3)实验室可用高锰酸钾快速制备氯气:2KMnO +16HCl(浓)= 5Cl ↑+2MnCl +2KCl+8H O,
4 2 2 2
请用双线桥标出该反应的电子转移方向和数目: 。
Ⅱ.NaClO 具有强氧化性,是常见的消毒剂。以SO 为原料之一制备亚氯酸钠(NaClO )的流程
2 2 2
如下图:
(4)反应①中氧化剂与还原剂的个数之比为_______。
(5)反应②体现了H O 的_______。(填“氧化性”、“还原性”或“酸性”)
2 2
(6)上述流程中氧化性最强的物质是______(写化学式)。
18.(15分)过氧化钠是实验室中的常用试剂,该试剂保存不当时易变质。某学习小组对实验室
中长期放置的“过氧化钠”进行实验探究,请回答下列问题。Ⅰ.探究试剂的组成
实验小组成员取出该标有“过氧化钠”试剂瓶中的试剂,观察其外部特征:主要为块状、白
色,用研钵捣碎块状物,可观察到内部呈淡黄色。
(1)上述试剂外层显白色的物质组成可能是:
猜想1:只有NaOH;
猜想2:只有Na CO ;
2 3
猜想3: 。
(2)设计实验验证并得出结论:
【限用试剂:BaCl 溶液、NaCl溶液、Ba(OH) 溶液】
2 2
实验步骤 实验现象 结论或解析
a.取少量上述白色物质,加入到盛有 猜想 不成立 (1
① 有气泡产生
稀盐酸的试管中。 分)。
b.取少量上述白色物质溶于水,向其 涉及的离子反应方程式
产生白色沉淀
中加入过量的 。 。
②
c.过滤步骤 b所得的混合物,向滤液
猜想2成立。
中滴加几滴酚酞试液。
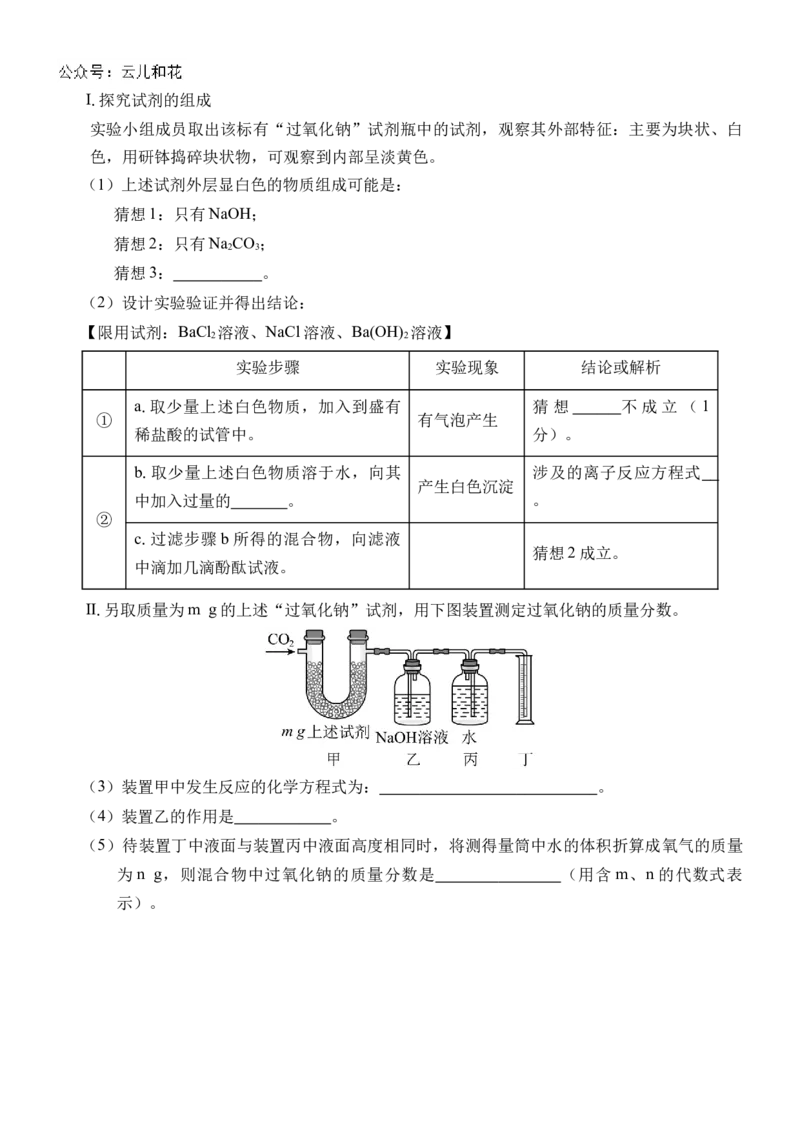
Ⅱ.另取质量为m g的上述“过氧化钠”试剂,用下图装置测定过氧化钠的质量分数。
(3)装置甲中发生反应的化学方程式为: 。
(4)装置乙的作用是 。
(5)待装置丁中液面与装置丙中液面高度相同时,将测得量筒中水的体积折算成氧气的质量
为 n g,则混合物中过氧化钠的质量分数是 (用含 m、n 的代数式表
示)。2024 级“贵百河—武鸣高中”10 月高一年级新高考月考测试
化学参考答案
一、选择题
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 C D B A D B C A C D C B D A
二、非选择题(除注明外,每空2分)
15.(14分)
(1)③④⑧⑩
(2)KHSO === K+ + HSO -
4 4
△
(3)FeCl + 3H O Fe(OH) (胶体) + 3HCl 丁达尔效应(1分)
3 2 3
(4)CO + Ba2+ + 2O H- === BaCO ↓ + H O
2 3 2
(5)煤油(1分) 黄色(1分)
(6)H+ + SO 2- + Ba2+ + OH- === BaSO↓ + H O 变蓝(1分)
4 4 2
16.(14分)
(1)A
(2)H+、Na+、Cu2+
(3)O Mg(OH)
2 2
(4)Fe3+、CO2-、Ba2+
3
(5)A
(6)5SO + 2MnO - + 2HO === 2Mn2+ + 5SO 2- + 4H+
2 4 2 4
17.(15分)
(1)KS、N 4
2 2
(2)Ag S D(1分)
2
(3)
(4)2∶1
(5)还原性
(6)NaClO
3
18.(15分)
(1)有NaOH和NaCO
2 3
(2)①a. 1 (1分)
②b.BaCl 溶液 Ba2+ + CO2- === BaCO ↓
2 3 3
c.溶液不变色
(3)2NaO + 2CO === 2Na CO + O
2 2 2 2 3 2
(4)除去CO,防止干扰O 体积的测定
2 2
(5)