文档内容
高一化学高频考题期末测试卷 03
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修二 难度:★★★★☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Cl-35.5 Fe-56 Cu-64
一、选择题(本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合
题目要求的。)
1.我国在科技上不断取得重大成果。下列各项中使用的材料不属于无机非金属材料的是(
)
“神舟十三
用于吊装港珠澳大桥的 “嫦娥五号”探测器使
应用于5G手机中的石墨 号”载人飞船
超高分子量聚乙烯纤维 用的砷化镓太阳能电池
烯导热膜 使用的石英挠
吊绳 板
性加速度计
A B C D
【答案】B
【解析】A项,石墨烯由碳元素形成的单质,属于无机非金属材料,故A不选;B项,聚
乙烯纤维是有机材料,不属于无机非金属材料,故B选;C项,砷化镓是一种半导体材料,属
于无机非金属材料,故C不选;D项,石英成分是SiO,属于无机非金属材料,故D不选;故
2
选B。
2.下列物品的俗名、有效成分和用途都正确的是( )
A.漂白粉,有效成分Ca(ClO ),做消毒剂 B.小苏打,NaHCO ,做发酵粉
3 2 3
C.碱石灰,Ca (OH),做干燥剂 D.铝热剂,Al O 和Fe,冶炼金属
2 2 3
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司【答案】B
【解析】A项,漂白粉的主要成分是Ca (ClO) 和CaCl ,漂白粉可生成HClO,做漂白剂或
2 2
环境消毒剂,A错误;B项,小苏打是碳酸氢钠,化学式为NaHCO ,受热分解可生成二氧化碳
3
气体,可做发酵粉,B正确;C项,碱石灰是氢氧化钠和氧化钙的混合物不含Ca (OH),可做干
2
燥剂,C错误;D项,铝热剂是Al和Fe O,用于冶炼金属,D错误;故选B。
2 3
3.化学与科技、社会、生活有着密切联系。下列有关说法不正确的是( )
A.港珠澳大桥路面使用了沥青和混凝土,沥青可以通过石油分馏得到
B.As O 是治疗白血病的一线药物,我国首次实现其仿生递送,As O 是碱性氧化物
2 3 2 3
C.北京冬奥会采用光伏发电以减少CO 排放,有利于实现碳达峰
2
D.神舟十三号飞船成功发射,航天员的头盔主要成分是聚碳酸酯,属于有机高分子
【答案】B
【解析】A项,沥青主要成分是含有C原子数多的烃,是石油通过石油分馏得到的烃,A
正确;B项,As O 与碱NaOH反应产生盐和水,因此As O 是酸性氧化物,A错误;C项,北
2 3 2 3
京冬奥会采用光伏发电既满足了人类对能源的需求,还同时能够减少CO 产生与排放,因此有
2
利于实现碳达峰,C正确;D项,神舟十三号飞船成功发射,航天员的头盔主要成分是聚碳酸酯,
聚碳酸酯是高聚物,属于有机高分子化合物,D正确;故选B。
4.下列说法不正确的是( )
A.O、O 同素异形体
2 3
B.35Cl 与37Cl 互为同位素
2 2
C.乙烷和戊烷互为同系物
D.CH-CH-CH-CH 与 互为同分异构体
3 2 2 3
【答案】B
【解析】A项,O、O 是组成元素相同、结构不同、性质不同的两种单质,属于同素异形
2 3
体,A正确;B项,35Cl与37Cl为质子数相同中子数不同的核素、互为同位素, 35Cl 与37Cl 均
2 2
为氯气分子,B错误;C项,乙烷和戊烷为结构相似、通式相同、相差3个CH 原子团,互为同
2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司系物,C正确;D项,CH-CH-CH-CH 与CH(CH ) 分子式均为C H ,但结构不同,互为同分
3 2 2 3 3 3 4 10
异构体,D正确;故选B。
5.下列表示乙烯的表示方法不正确的是( )
A.电子式: B.球棍模型:
C.结构式: D.结构简式:CH=CH
2 2
【答案】A
【解析】A项,乙烯中碳碳键是碳碳双键,其电子式: ,故A错误;B项,
乙烯含有碳碳双键,氢原子半径小于碳原子半径,因此其球棍模型 ,故B正确;
C项,乙烯含有碳碳双键,碳氢的单键,其结构式: ,故C正确;D项,乙烯
结构简式:CH=CH ,故D正确;故选A。
2 2
6.年度热播扶贫剧《山海情》中有部分农民用硫磺熏制枸杞,遭到有正义感村民的反对,
下列说法错误的是( )
A.硫磺熏制枸杞是利用了SO 的漂白性
2
B.二氧化硫是强致癌物,不可用于食品添加剂
C.某些中药材利用硫磺熏制也起到了一定的杀菌消毒作用
D.硫磺熏制过的枸杞可能呈现鲜红色,而未熏制过的枸杞可能呈现暗红色
【答案】B
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司【解析】A项,硫磺熏制枸杞使枸杞增白,利用二氧化硫的漂白性,故A正确;B项,二
氧化硫有具有还原性,可用作葡萄酒抗氧化剂,故B错误;C项,硫磺熏蒸具有干燥、漂白、
杀菌防腐的作用,可在一定程度上延长药材的保质,故C正确;D项,正常枸杞的自然色为赤
红或偏暗红,硫磺熏制过的枸杞使其变得鲜红好看,可能呈现鲜红色,故D正确;故选B。
7.近期我国多地开始施行限电令,减少工业用电。为了改善人类的生存环境与社会可持续
发展,节能和寻找清洁的新能源成为人类的必然选择。下列选项不符合这一理念的是( )
A.贯彻落实国家政策,尽可能节约用电
B.改进锅炉的炉型和燃料空气比、清理积灰
C.禁止使用燃油车,大力发展新能源汽车
D.为减少化石燃料的使用,积极进行技术创新
【答案】C
【解析】A项,节约用电了减少用电浪费,节能环保,A正确;B项,改进锅炉的炉型和燃
料空气比、清理积灰可使燃料完全燃烧,B正确;C项,由于新能源汽车还有很多技术瓶颈未攻
破,如电池续航问题,禁止使用燃油车不现实,C错误;D项,为减少化石燃料的使用,积极进
行技术创新,开发新能源,D正确;故选C。
8.近年来,我国在探索太空、开发5G等方面都取得了举世瞩目的成就,这些成就都离不
开化学材料的开发和利用,下列有关说法正确的是( )
A.小米全自动扫拖一体机“T7PrO”搭载骁龙八核芯片的主要成分是二氧化硅
B.我国新一代运载火箭长征八号使用的碳化硅陶瓷是传统无机非金属材料
C.5G技术的应用离不开光缆,我国光缆线路总长度超过了三千万千米,光缆的主要成分
是晶体硅
D.碳纳米管有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司【答案】D
【解析】A项,芯片的主要成分是晶体硅,故A错误;C项,光缆的主要成分是二氧化硅,
故C错误;D项,碳纳米管是一种具有特殊结构及优异性能的纳米材料,它是由碳原子形成的
无缝、中空管体材料,具有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传
感器等,故D正确;故选D。
9.已知2SO +O 2SO 为放热反应,对该反应的下列说法正确的是( )
2 2 3
A.O 的能量一定高于SO 的能量
2 3
B.SO 和O 的总能量一定高于SO 的总能量
2 2 3
C.SO 的能量一定高于SO 的能量
2 3
D.因该反应为放热反应,故不必加热就可发生
【答案】B
【解析】A项,放热反应,反应物总能量高于生成物总能量,O 的能量不一定高于SO 的
2 3
能量,故A错误;B项,放热反应,反应物总能量高于生成物总能量,所以SO 和O 的总能量
2 2
一定高于SO 的总能量,故B正确;C项,放热反应,反应物总能量高于生成物总能量,SO 的
3 2
能量不一定高于SO 的能量,故C错误;D项,反应是否为放热反应,与反应条件无关,放热
3
反应,可能需要加热才能发生,故D错误;故选B。
10.新冠病毒是一种具有包膜的RNA病毒,包膜的主要成分是蛋白质和脂质。核酸检测就
是检测新冠病毒的RNA。下列说法不正确的是( )
A.核酸和蛋白质都是生物大分子
B.核酸和蛋白质都不能发生水解反应
C.核酸中核苷酸之间通过磷酯键连接
D.一定浓度的含氯消毒液可使新冠病毒中的蛋白质变性
【答案】B
【解析】A项,蛋白质、核酸都是由单体聚合形成的生物大分子,选项A正确;B项,蛋
白质最终水解为氨基酸、核酸最终水解为核苷酸,均能发生水解反应,选项B不正确;C项,
所有的核酸都是核苷酸的多聚体,通过磷酸二酯键相连,选项C正确;D项,次氯酸钠等含氯
消毒剂可用于杀死新冠病毒是因为它们都能使蛋白质变性,选项D正确;故选B。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司11.构建和谐社会的内容之一是人类与环境的和谐发展,而“绿色化学”的内容是指从技
术经济上设计可行的化学反应,尽可能减少对环境的副作用,下列化学反应不符合“绿色化
学”理念的是( )
A.消除硫酸厂尾气中的SO :SO +2NH+H O=(NH )SO
2 2 3 2 4 2 3
B.消除硝酸工业尾气的氮氧化物的污染:NO+NO +2NaOH=2NaNO +H O
2 2 2
C.制CuSO :Cu+2H SO (浓) CuSO +SO↑+2H O
4 2 4 4 2 2
D.制CuSO :2Cu+O +2H SO 2CuSO +2H O
4 2 2 4 4 2
【答案】C
【解析】A项,用氨气和水与二氧化硫反应,减少了污染性气体排放,符合绿色化学理念,
A正确;B项,用氢氧化钠溶液吸收氮氧化物,减少了污染性气体排放,符合绿色化学理念,B
正确;C项,铜与浓硫酸反应有二氧化硫放出,不符合绿色化学理念,C错误;D项,制备硫酸
铜过程无污染性气体产生,符合绿色化学理念,D正确;故选C。
12.化学反应A+B =2AB的能量变化如图所示,则下列说法正确的是( )
2 2
A.该反应是吸收能量的反应
B.1molA—A键和1molB—B键断裂能放出xkJ的能量
C.2molA—B键断裂需要放出ykJ的能量
D.1molA 和1molB 的总能量高于2molAB的总能量
2 2
【答案】D
【解析】A项,生成物总能量小于反应物总能量,该反应是放出能量的反应,故A错误;B
项,1molA—A键和1molB—B键断裂吸收xkJ的能量,故B错误;C项,2molA—B键生成需
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司要放出ykJ的能量,故C错误;D项,根据图示,1molA 和1molB 的总能量高于2molAB的总
2 2
能量,故D正确;故选D。
13.一定条件下,将2molA气体和2molB气体通入体积为2L的密闭容器中发生如下反应:
2A(g)+B(g) x C(g) +2D(s),在2min末测得剩余B的物质的量为1.2mol,生成C的物质
的量为2.4mol。下列有关说法错误的是( )
A.x的数值为3
B.2min末,A的浓度为0.2 mol∙L−1
C.2min内,用D表示的反应的平均速率为
D.将容器的容积变为3L,化学反应速率将减小
【答案】C
【解析】A项,在2min末测得剩余B的物质的量为1.2mol,则B消耗的物质的量为
0.8mol,生成C的物质的量为2.4mol,根据该变量之比等于计量系数之比,则x的数值为3,故
A正确;B项,在2min末测得剩余B的物质的量为1.2mol,则B消耗的物质的量为0.8mol,根
据该变量之比等于计量系数之比得到A消耗了1.6mol,则剩余0.4mol,2min末,则A的浓度为
0.2 mol∙L−1,故B正确;C项,D为固体,浓度是固定值,不能描述其平均速率,故C错误;D
项,将容器的容积变为3L,浓度减小,因此化学反应速率将减小,故D正确。故选C。
14.甲、乙两种有机物的结构简式如图所示,下列有关叙述正确的是( )
甲: 乙:
A.乙能发生酯化反应 B.甲和乙互为同分异构体
C.甲和乙互为同系物 D.甲的分子式为C H O
8 10 2
【答案】A
【解析】A项,乙中含有羧基,能与羟基发生酯化反应,A正确;B项,甲中含有8个碳原
子,乙中含有7个碳原子,不可能互为同分异构体,B错误;C项,甲属于酯类有机物,乙属于
羧酸类有机物,所含官能团不同,故不属于同系物,C错误;D项,甲分子中含有8个碳原子、
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司8个氢原子、2个氧原子,对应分子式为C H O,D错误;故选A。
8 10 2
15.实验室可用如图所示装置探究石蜡油(液态烷烃混合物)分解产物的性质,下列说法错误
的是( )
A.仪器①可控制石蜡油的滴加速率
B.装置②起防倒吸的作用
C.实验过程中,关闭 、打开 ,装置②中溶液颜色逐渐褪去证明有烯烃等生成
D.加热一段时间后,关闭 、打开 ,在③处点燃气体可看到淡蓝色火焰
【答案】D
【解析】A项,石蜡油在二氧化锰做催化剂的条件下分解,仪器①是注射器,可控制石蜡
油滴加的速率,A正确;B项,装置②增大了石蜡分解后产生的乙烯等气体与酸性高锰酸钾溶液
的接触面积,可起到防倒吸的作用,B正确;C项,实验过程中,关闭K,打开K,可以被装
1 2
置②中的酸性高锰酸钾溶液颜色逐渐褪去,可以说明石蜡油分解的产物含有烯烃等物质,C正
确;D项,加热一段时间后,关闭K,打开K,在③处点燃气体中含有乙烯等烃类,可看到明
2 1
亮的火焰,并伴有黑烟,D错误;故选D。
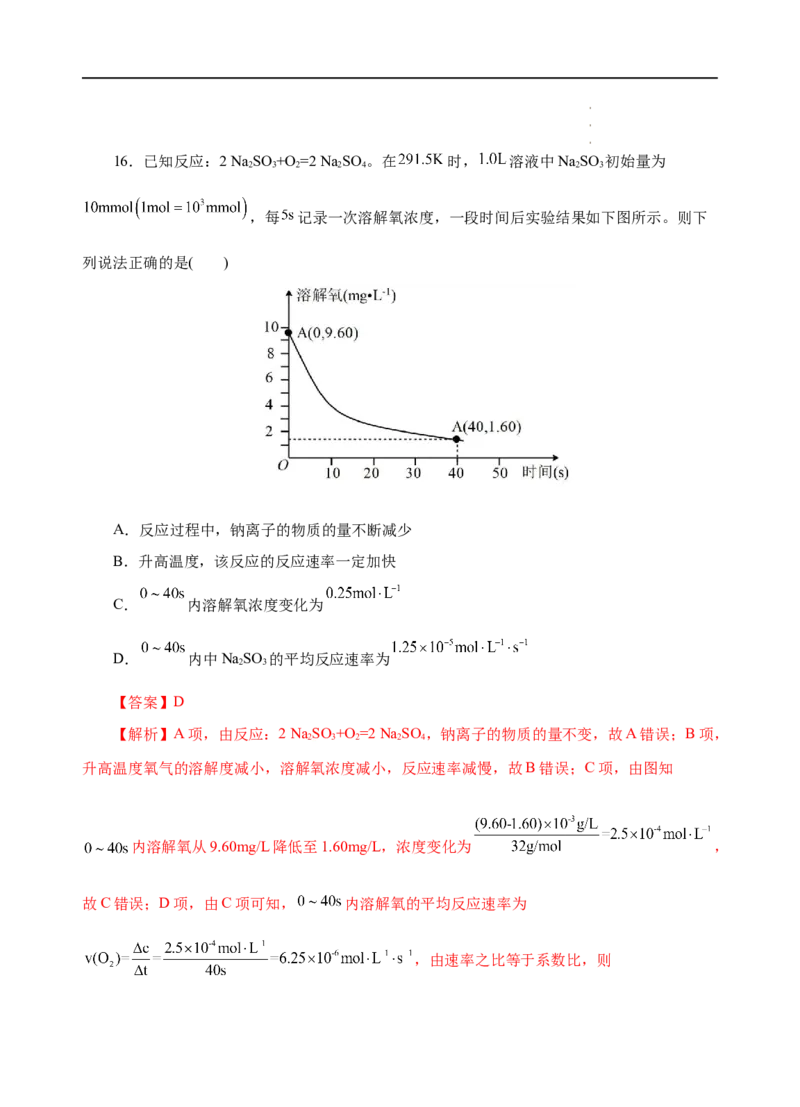
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司16.已知反应:2 Na SO +O =2 Na SO 。在 时, 溶液中NaSO 初始量为
2 3 2 2 4 2 3
,每 记录一次溶解氧浓度,一段时间后实验结果如下图所示。则下
列说法正确的是( )
A.反应过程中,钠离子的物质的量不断减少
B.升高温度,该反应的反应速率一定加快
C. 内溶解氧浓度变化为
D. 内中NaSO 的平均反应速率为
2 3
【答案】D
【解析】A项,由反应:2 Na SO +O =2 Na SO ,钠离子的物质的量不变,故A错误;B项,
2 3 2 2 4
升高温度氧气的溶解度减小,溶解氧浓度减小,反应速率减慢,故B错误;C项,由图知
内溶解氧从9.60mg/L降低至1.60mg/L,浓度变化为 ,
故C错误;D项,由C项可知, 内溶解氧的平均反应速率为
,由速率之比等于系数比,则
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司,故D正确;故选D。
二、非选择题(包括第17题~第21题5个大题,共52分)
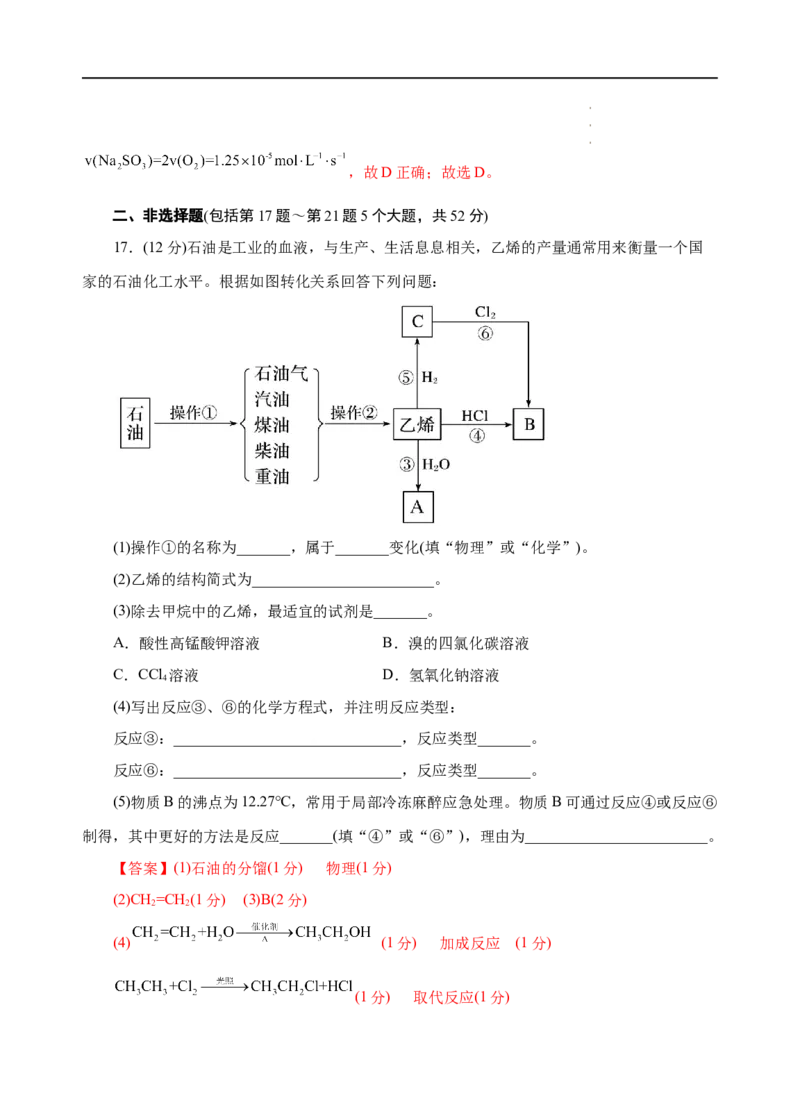
17.(12分)石油是工业的血液,与生产、生活息息相关,乙烯的产量通常用来衡量一个国
家的石油化工水平。根据如图转化关系回答下列问题:
(1)操作①的名称为_______,属于_______变化(填“物理”或“化学”)。
(2)乙烯的结构简式为________________________。
(3)除去甲烷中的乙烯,最适宜的试剂是_______。
A.酸性高锰酸钾溶液 B.溴的四氯化碳溶液
C.CCl 溶液 D.氢氧化钠溶液
4
(4)写出反应③、⑥的化学方程式,并注明反应类型:
反应③:______________________________,反应类型_______。
反应⑥:______________________________,反应类型_______。
(5)物质B的沸点为12.27℃,常用于局部冷冻麻醉应急处理。物质B可通过反应④或反应⑥
制得,其中更好的方法是反应_______(填“④”或“⑥”),理由为________________________。
【答案】(1)石油的分馏(1分) 物理(1分)
(2)CH =CH (1分) (3)B(2分)
2 2
(4) (1分) 加成反应 (1分)
(1分) 取代反应(1分)
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(5) ④(1分) 乙烷与氯气反应将得到多种氯代物的混合物,产物不纯(2分)
【解析】石油经过分馏可得液化石油气、汽油、煤油、 柴油等产品,而上述产品再经过高
温裂解可得到乙烯等化工产品,所以操作①、操作②分别为石油的分馏、石油的裂解;乙烯与
氢气发生加成反应生成乙烷,则C为乙烷,乙烯与氯气发生加成反应得到氯乙烷,则B为氯乙
烷,乙烯与水反应生成乙醇,则A为乙醇。(1)由上述分析可知,操作①为石油的分馏;分馏的
过程中没有生成新物质,属于物理变化;(2)乙烯的分子式为C H,官能团为碳碳双键,其结构
2 4
简式为CH=CH ;(3)A项,甲烷不与酸性高锰酸钾溶液反应,乙烯与酸性高锰酸钾溶液反应,
2 2
酸性高锰酸钾溶液能除去甲烷中的乙烯,但引入新的杂质二氧化碳,故A不符合题意;B项,
溴的四氯化碳溶液能与乙烯发生加成反应,与甲烷不反应,能除去甲烷中的乙烯,且不引入新
的杂质,故B符合题意;C项,CCl 溶液与甲烷和乙烯均不反应,故C不符合题意;D项,氢
4
氧化钠溶液与甲烷和乙烯均不反应,故D不符合题意;故选B;(4)反应③是乙烯和水反应生成
乙醇,反应的化学方程式为 ,该反应属于加成反应;反应
⑥是乙烷和氯气反应生成氯乙烷,反应的化学方程式为 ,
该反应属于取代反应;(5)氯乙烷可通过乙烯与氯化氢发生加成反应或乙烷与氯气发生取代反应
制得,最好的方法是反应④,因为乙烷与氯气反应将得到多种氯代物的混合物,产物不纯。
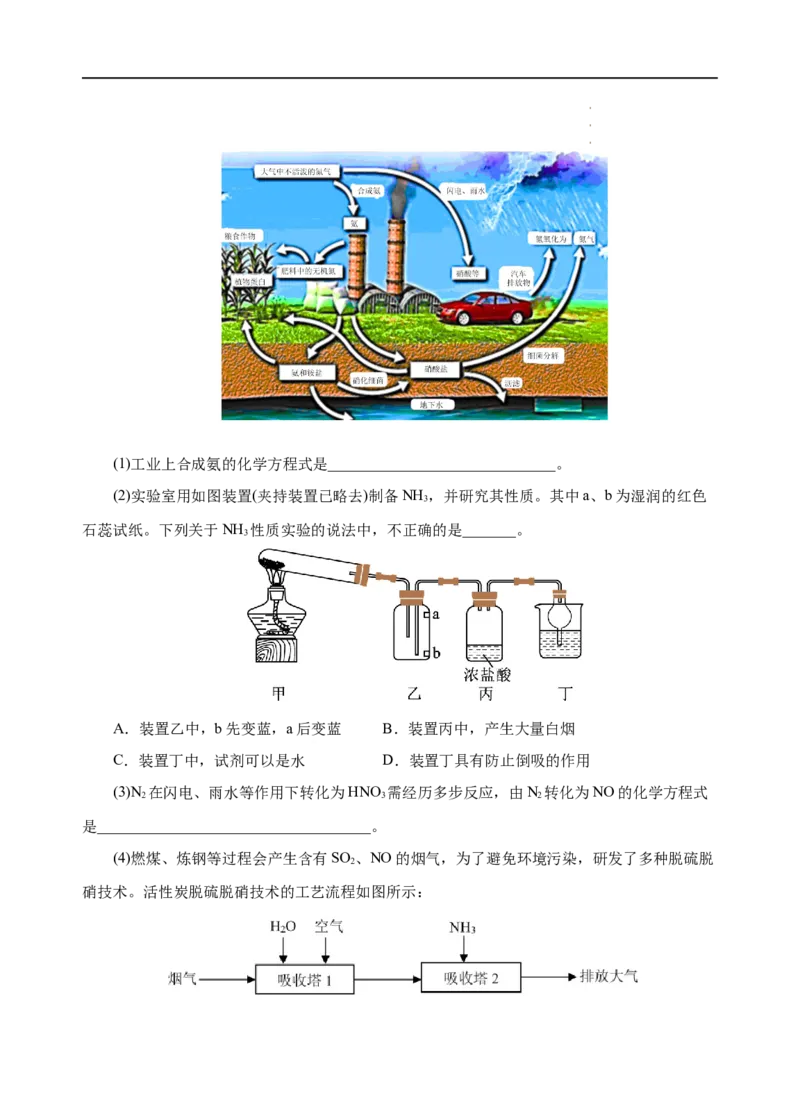
18.(10分)如图是氮在自然界中的循环示意图。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)工业上合成氨的化学方程式是______________________________。
(2)实验室用如图装置(夹持装置已略去)制备NH ,并研究其性质。其中a、b为湿润的红色
3
石蕊试纸。下列关于NH 性质实验的说法中,不正确的是_______。
3
A.装置乙中,b先变蓝,a后变蓝 B.装置丙中,产生大量白烟
C.装置丁中,试剂可以是水 D.装置丁具有防止倒吸的作用
(3)N 在闪电、雨水等作用下转化为HNO 需经历多步反应,由N 转化为NO的化学方程式
2 3 2
是____________________________________。
(4)燃煤、炼钢等过程会产生含有SO 、NO的烟气,为了避免环境污染,研发了多种脱硫脱
2
硝技术。活性炭脱硫脱硝技术的工艺流程如图所示:
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司①吸收塔1,在100-200℃,SO 在活性炭的吸附催化下生成硫酸,该过程的化学方程式为
2
__________________。
②吸收塔2,在活性炭的催化作用下,烟气中的NO转化为无毒无害的气体排放到大气中,
该过程体现了NH 具有_______(填“氧化性”或“还原性”)。
3
③吸收塔1中若SO 去除不彻底,进入吸收塔2,会使NH 用量增大,原因是___________
2 3
______ (写化学方程式)。
【答案】(1) N +3H 2NH (1分) (2)A(3分)
2 2 3
(3) N +O 2NO(1分)
2 2
(4) (2分) 还原性(1分) SO +2NH+H O=(NH )SO (2分)
2 3 2 4 2 3
【解析】(1)工业上利用N 和H 合成氨,化学方程式是:N+3H 2NH 。(2)装置
2 2 2 2 3
甲是固固加热型气体发生装置,装入氯化铵和氢氧化钙混合粉末,加热制得氨气,氨气密度比
空气小,装置乙中a处先与b处接触氨气,氨气进入装置丙,与挥发出来的HCl气体反应生成氯
化铵白烟,氨气极易溶于水,在干燥管防倒吸情况下,可接入装置丁中的水进行尾气处理。则:
A项,装置乙中是a先变蓝,错误;B项,装置丙中产生大量白烟NH Cl,正确;C项,装置丁
4
中,试剂可以是水,正确;D项,装置丁干燥管具有防止倒吸的作用,正确;故选A。(3)N 在
2
空气中受闪电作用转化为NO,化学方程式是:N+O 2NO。(4)含有SO 、NO的烟气在吸
2 2 2
收塔1内被空气和HO共同作用吸收,进入吸收塔2与NH 反应生成可直接排入大气的无污染
2 3
物质。①吸收塔1,在100-200℃,SO 在活性炭的吸附催化下生成硫酸,该过程的化学方程式
2
为: ;②吸收塔2中的NO转化为无毒无害的气体N 排放到
2
大气中,N元素化合价从+2价降低到0价,被还原,则该过程体现了NH 具有还原性;③吸收
3
塔1中若SO 去除不彻底,进入吸收塔2,SO 与NH 发生反应:SO +2NH+H O=(NH )SO ,则
2 2 3 2 3 2 4 2 3
会使NH 用量增大。
3
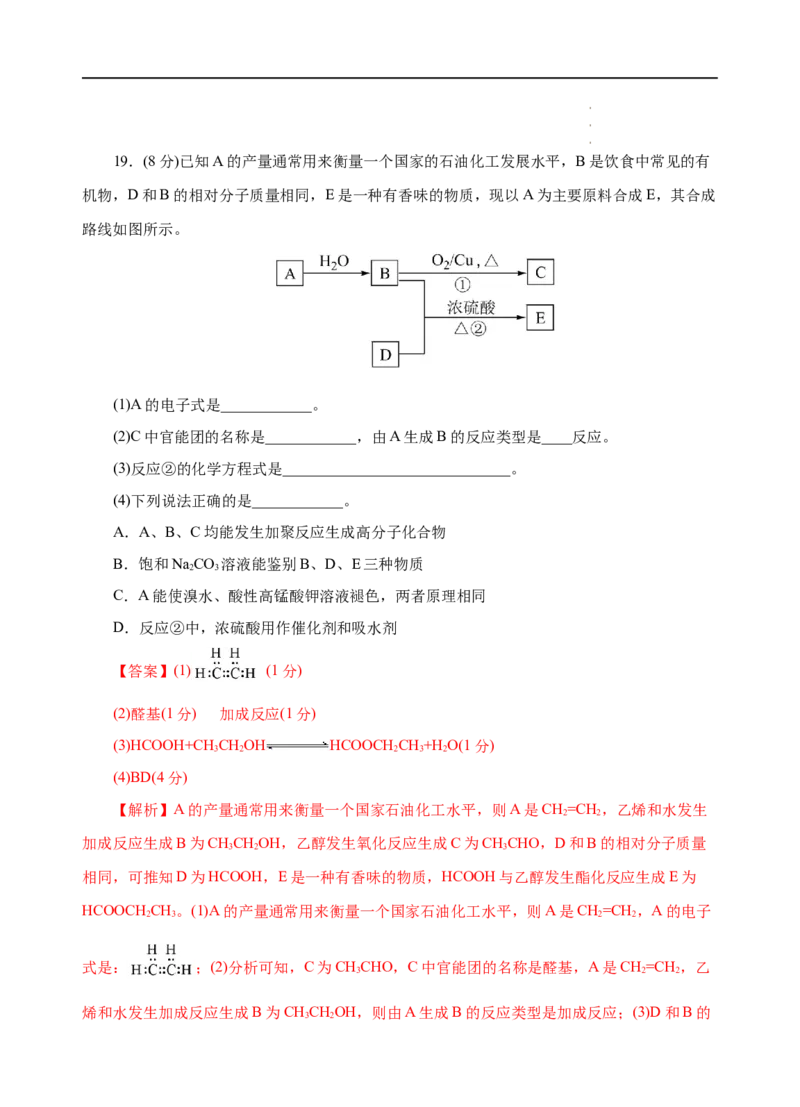
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司19.(8分)已知A的产量通常用来衡量一个国家的石油化工发展水平,B是饮食中常见的有
机物,D和B的相对分子质量相同,E是一种有香味的物质,现以A为主要原料合成E,其合成
路线如图所示。
(1)A的电子式是____________。
(2)C中官能团的名称是____________,由A生成B的反应类型是____反应。
(3)反应②的化学方程式是______________________________。
(4)下列说法正确的是____________。
A.A、B、C均能发生加聚反应生成高分子化合物
B.饱和NaCO 溶液能鉴别B、D、E三种物质
2 3
C.A能使溴水、酸性高锰酸钾溶液褪色,两者原理相同
D.反应②中,浓硫酸用作催化剂和吸水剂
【答案】(1) (1分)
(2)醛基(1分) 加成反应(1分)
(3)HCOOH+CH CHOH HCOOCH CH+H O(1分)
3 2 2 3 2
(4)BD(4分)
【解析】A的产量通常用来衡量一个国家石油化工水平,则A是CH=CH ,乙烯和水发生
2 2
加成反应生成B为CHCHOH,乙醇发生氧化反应生成C为CHCHO,D和B的相对分子质量
3 2 3
相同,可推知D为HCOOH,E是一种有香味的物质,HCOOH与乙醇发生酯化反应生成E为
HCOOCH CH。(1)A的产量通常用来衡量一个国家石油化工水平,则A是CH=CH ,A的电子
2 3 2 2
式是: ;(2)分析可知,C为CHCHO,C中官能团的名称是醛基,A是CH=CH ,乙
3 2 2
烯和水发生加成反应生成B为CHCHOH,则由A生成B的反应类型是加成反应;(3)D和B的
3 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司相对分子质量相同,可推知D为HCOOH,HCOOH与乙醇发生酯化反应生成E为
HCOOCH CH,反应②的化学方程式是HCOOH+CH CHOH HCOOCH CH+H O;
2 3 3 2 2 3 2
(4)A项,B为CHCHOH,不含有不饱和键,不能发生加聚反应,A错误;B项,B为
3 2
CHCHOH,能溶于NaCO 溶液,D为HCOOH,含有羧基具有酸性,能与NaCO 溶液反应生
3 2 2 3 2 3
成二氧化碳气体,E为HCOOCH CH,属于酯类,难溶于水,与NaCO 溶液出现分层,能鉴别,
2 3 2 3
B正确;C项,A是CH=CH ,与溴单质发生加成反应而使溴水褪色,与酸性高锰酸钾溶液发生
2 2
氧化还原反应而褪色,两者原理不同,C错误;D项,反应②是酯化反应,浓硫酸用作催化剂,
由于浓硫酸具有吸水性可减少生成物浓度,促进反应正向进行,浓硫酸做吸水剂,D正确;故
选BD。
20.(10分)某同学根据铜与浓硫酸反应能生成SO ,预测锌与浓硫酸反应生成的产物可能
2
为混合气体(水蒸气除外),设计如下装置进行验证(加热和部分夹持装置略):
回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式______________________________。
(2)该同学预测锌与浓硫酸反应生成的混合气体的成分可能为_______(用化学式表示)。
(3)C装置所盛常见试剂可以是_______(填一种)。
(4)为了验证SO 是酸性氧化物,B中可选用的试剂是_______。
2
A.无色酚酞溶液 B.紫色石蕊试液 C.红色品红溶液 D. 淀粉混合溶液
(5)为测定空气中SO 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的
2
的酸性高锰酸钾溶液。已知SO 与该溶液反应的离子方程式为:
2
,若管道中空气流量为 ,经过 溶液恰好褪
色,假定样品中的SO 可以被溶液充分吸收,则该样品中的SO 含量是_______ 。
2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司【答案】(1) Cu+2H SO (浓) CuSO +SO↑+2H O(2分) (2) SO 、H(2分)
2 4 4 2 2 2 2
(3)酸性KMnO 溶液(或NaOH溶液)等(1分)
4
(4)B(2分) (5) (3分)
【解析】装置A中锌与浓硫酸反应生成二氧化硫,浓硫酸变为稀硫酸后,与锌反应生成氢
气;装置B中品红溶液检验二氧化硫,装置C用于除去二氧化硫,装置D用于干燥氢气,装置
E中氢气和氧化铜反应生成铜和水蒸气,装置F中的无水硫酸铜的作用是检验水的生成,装置E
和装置F中的现象共同证明混合气体中是否含有氢气。(1)铜与浓硫酸反应生成硫酸铜、二氧化
硫和水,反应的化学方程式为Cu+2H SO (浓) CuSO +SO↑+2H O。(2)锌与浓硫酸反应生成二
2 4 4 2 2
氧化硫,浓硫酸变为稀硫酸后,与锌反应生成氢气,因此混合气体的成分可能为SO 、H。(3)
2 2
装置C用于除去二氧化硫,二氧化硫是酸性氧化物,且具有还原性,除去二氧化硫常用的试剂
是酸性KMnO 溶液(或NaOH溶液等)。(4)SO 是酸性氧化物,溶于水生成亚硫酸,能使紫色石
4 2
蕊试液变红,因此B中试剂应为紫色石蕊试液,故选B。(5)根据
可知,
, ,
则该样品中的SO 含量是 。
2
21.(12分)某课外兴趣小组实验探究影响化学反应速率的因素。
(1)硫代硫酸钠(NaSO)俗称大苏打、海波,广泛应用于照相定影等领域。乙同学利用控制
2 2 3
变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
NaSO 浓度 稀硫酸
2 2 3
实验序 反应温
号 度/℃
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
1 20 10.0 0.10 10.0 0.50 0
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司2 40 V 0.10 V 0.50 V
1 2 3
3 20 V 0.10 4.0 0.50 V
4 5
①从类别的角度分析,硫代硫酸钠(NaSO)属于_______(填标号)。
2 2 3
A.盐 B.碱 C.酸 D.氧化物
②写出硫代硫酸钠与硫酸反应的化学方程式______________________________。
③该实验1和2可探究____________对反应速率的影响,因此V 是_______。实验1和3可
1
探究硫酸浓度对反应速率的影响,因此V=_______。
5
(2)为更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备,
探究镁与不同浓度硫酸的反应速率,两组实验所用药品如下:
硫酸
序
镁条的质量/g
号
物质的量浓度(mol/L) 体积/mL
Ⅰ 0.01 1.0 2
Ⅱ 0.01 0.5 2
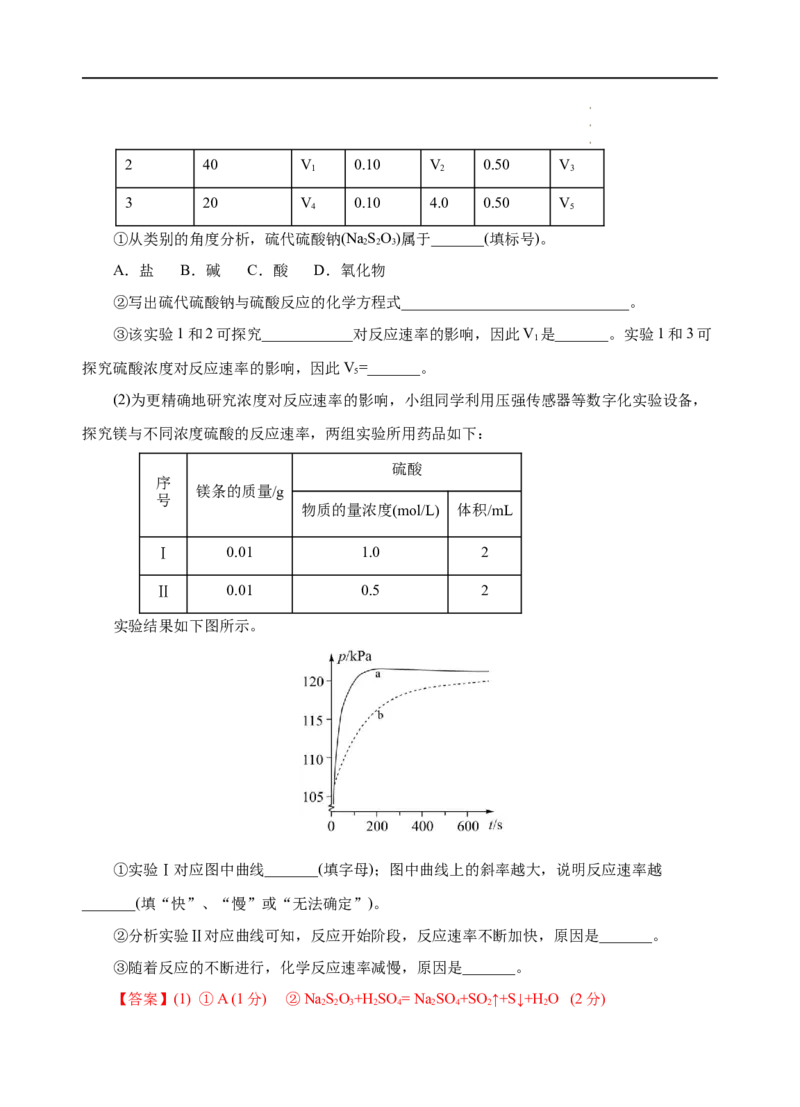
实验结果如下图所示。
①实验Ⅰ对应图中曲线_______(填字母);图中曲线上的斜率越大,说明反应速率越
_______(填“快”、“慢”或“无法确定”)。
②分析实验Ⅱ对应曲线可知,反应开始阶段,反应速率不断加快,原因是_______。
③随着反应的不断进行,化学反应速率减慢,原因是_______。
【答案】(1) ①A (1分) ②NaSO+H SO = Na SO +SO↑+S↓+H O (2分)
2 2 3 2 4 2 4 2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司③反应温度(1分) 10.0 (1分) 6.0(1分)
(2) ①a(1分) 快(1分) ②镁与硫酸反应是放热反应,温度升高,化学反应速率加快 (2
分)
③硫酸的浓度逐渐降低,化学反应速率减慢(2分)
【解析】(1)①根据物质的分类,酸是电离出来的阳离子全部都是氢离子的化合物,碱是电
离出来的阴离子全部都是氢氧根离子的化合物,氧化物是指由两种元素组成其中一种是氧元素
的化合物,盐是指金属阳离子(或铵根离子)和酸根阴离子构成的化合物,则NaSO 属于盐,故
2 2 3
选A;②NaSO 中S元素的化合价由+2价变为0价和+4价,硫元素发生歧化反应,硫代硫酸
2 2 3
钠与硫酸发生氧化还原反应的化学方程式为:NaSO+H SO = Na SO +SO↑+S↓+H O;③实验1
2 2 3 2 4 2 4 2 2
温度20℃,实验2温度40℃,实验1和实验2探究反应温度对化学反应速率的影响,因此其余
实验条件相同,V 是10.0;实验1和3可探究硫酸浓度对反应速率的影响,其余实验条件相同,
1
液体体积相同,因此V=10.0-4.0=6.0;(2)①根据浓度对反应速率的影响可知,浓度越大反应速
5
率越快,实验Ⅰ的硫酸浓度大于实验Ⅱ,则反应速率越快,单位时间内产生气体越多,则实验
Ⅰ对应图中曲线a;图中曲线上的斜率表示单位时间内压强的变化量,斜率越大,说明反应速率
越越快;②活泼金属与酸反应为放热反应,温度升高反应速率加快,实验Ⅱ对应曲线可知,反
应开始阶段,反应速率不断加快,原因是:镁与硫酸反应是放热反应,温度升高,化学反应速
率加快;③随着反应的进行硫酸的浓度逐渐减小,反应速率减小,则随着反应的不断进行,化
学反应速率减慢,原因是:硫酸的浓度逐渐降低,化学反应速率减慢。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司