文档内容
专题 06 化学反应的速率和限度
知识梳理
【化学反应的速率】
一.化学反应速率
1.通常用化学反应速率来衡量化学反应进行的 快慢 ,化学反应速率可用单位时间内 反应物浓度的
减少量 或 生成物浓度的增加量 来表示。
表达式 v=,式中各符号的表示意义:
v——反应速率。
Δc——某一时间段浓度的变化量,单位: mol/L 。
Δt——反应时间,单位: mi n (分) 、 s (秒) 、 h (小时) 。
速率单位(常用): mol·L - 1 · mi n - 1 、 mol·L - 1 · s - 1 。
【注意】应用化学反应速率需注意以下问题:
(1) 化学反应速率是标量,只有 数值 而没有 方向 ;
(2) 一般计算出来的化学反应速率是一段时间内的 平均 速率,不同时刻的化学反应速率是不相同的;
(3) 对于纯液体或固体物质,反应在其表面进行,它们的“浓度” 是 不 变的,因此一般 不能 用固体、
纯液体表示化学反应速率;
(4) 对于同一化学反应,用不同的物质表示其化学反应速率在数值上可能 不 同,但其意义相同,化学
反应速率之比等于 化学计量系数 之比。
2.化学反应速率的计算
(1)定义式法:利用公式v=计算化学反应速率,也可利用该公式计算浓度变化量或时间。
(2)关系式法:化学反应速率之比=物质的量浓度变化之比=物质的量变化之比=化学计量数之比。
3.反应速率大小比较的两种方法
同一化学反应速率用不同物质表示时数值可能不同,比较化学反应速率的快慢不能只看数值大小,还要进
行一定的换算。
(1)方法一:换算成同一物质、同一单位表示,再比较数值大小。
(2)方法二:比较化学反应速率与化学计量数的比值。
【模型认知】“三段式”计算化学反应速率和转化率
mA(g)+nB(g) pC(g)+qD(g)
起始浓度/(mol·L-1) a b 0 0
转化浓度/(mol·L-1) mx nx px qx
终态浓度/(mol·L-1) a-mx b-nx px qx
①v(A)=,v(C)= ②α(A)=×100%
二..影响化学反应速率的因素
1.内因(主要因素)
化学反应速率的大小主要是由 物质本身的性质 决定的,即反应物的分子结构或原子结构决定的。2.外界条件的影响(次要因素)
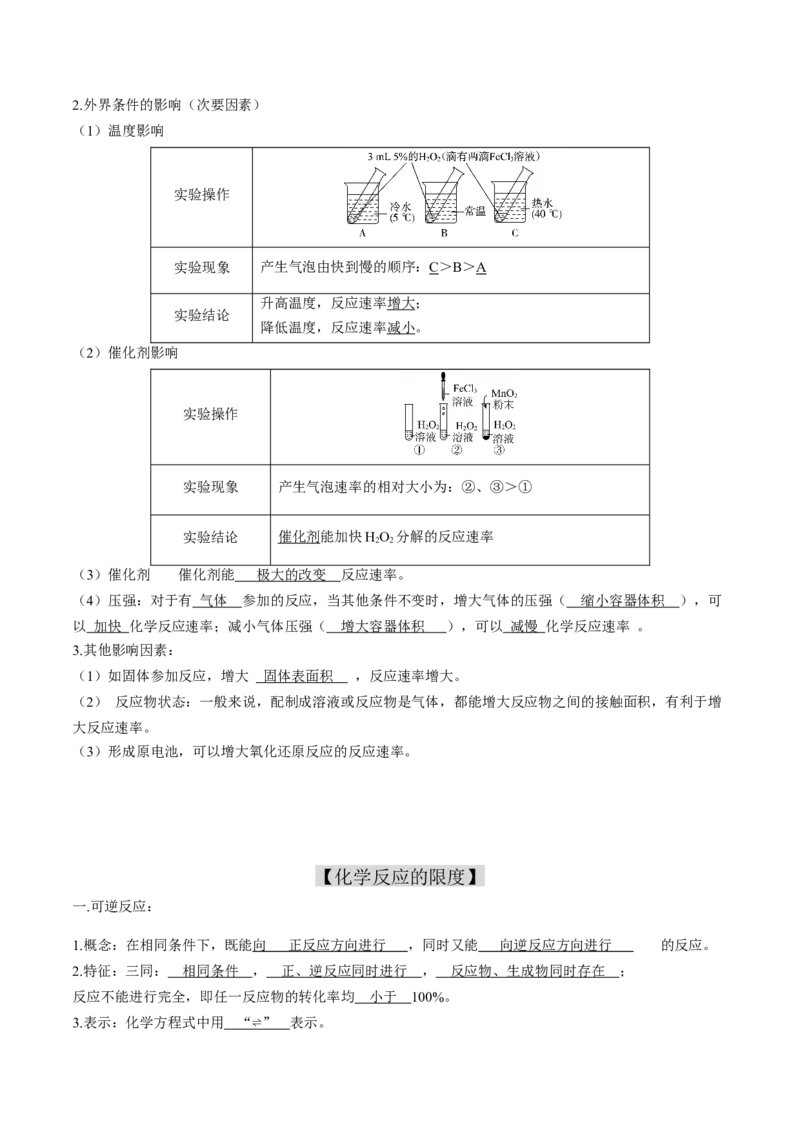
(1)温度影响
实验操作
实验现象 产生气泡由快到慢的顺序:C>B>A
升高温度,反应速率增大;
实验结论
降低温度,反应速率减小。
(2)催化剂影响
实验操作
实验现象 产生气泡速率的相对大小为:②、③>①
实验结论 催化剂能加快HO 分解的反应速率
2 2
(3)催化剂 催化剂能 极大的改变 反应速率。
(4)压强:对于有 气体 参加的反应,当其他条件不变时,增大气体的压强( 缩小容器体积 ),可
以 加快 化学反应速率;减小气体压强( 增大容器体积 ),可以 减慢 化学反应速率 。
3.其他影响因素:
(1)如固体参加反应,增大 固体表面积 ,反应速率增大。
(2) 反应物状态:一般来说,配制成溶液或反应物是气体,都能增大反应物之间的接触面积,有利于增
大反应速率。
(3)形成原电池,可以增大氧化还原反应的反应速率。
【化学反应的限度】
一.可逆反应:
1.概念:在相同条件下,既能向 正反应方向进行 ,同时又能 向逆反应方向进行 的反应。
2.特征:三同: 相同条件 , 正、逆反应同时进行 , 反应物、生成物同时存在 ;
反应不能进行完全,即任一反应物的转化率均 小于 100%。
3.表示:化学方程式中用 “ ⇌ ” 表示。4.很多化学反应在进行时都有一定的可逆性,不同反应的可逆性不同,有些化学反应在同一条件下可逆程
度很小,如 2 Na + 2 HO === 2 NaOH + H ↑,视为“不可逆”反应。
2 2
典型的可逆反应有:
H +I 2HI , 2SO +O 2SO ,
2 2 2 2 3
SO+H O H SO , NH +H O NH ﹒HO 等。
2 2 ⇌ 2 3 3 2 ⇌ 3 2
二.化学反应的限度
⇌ ⇌
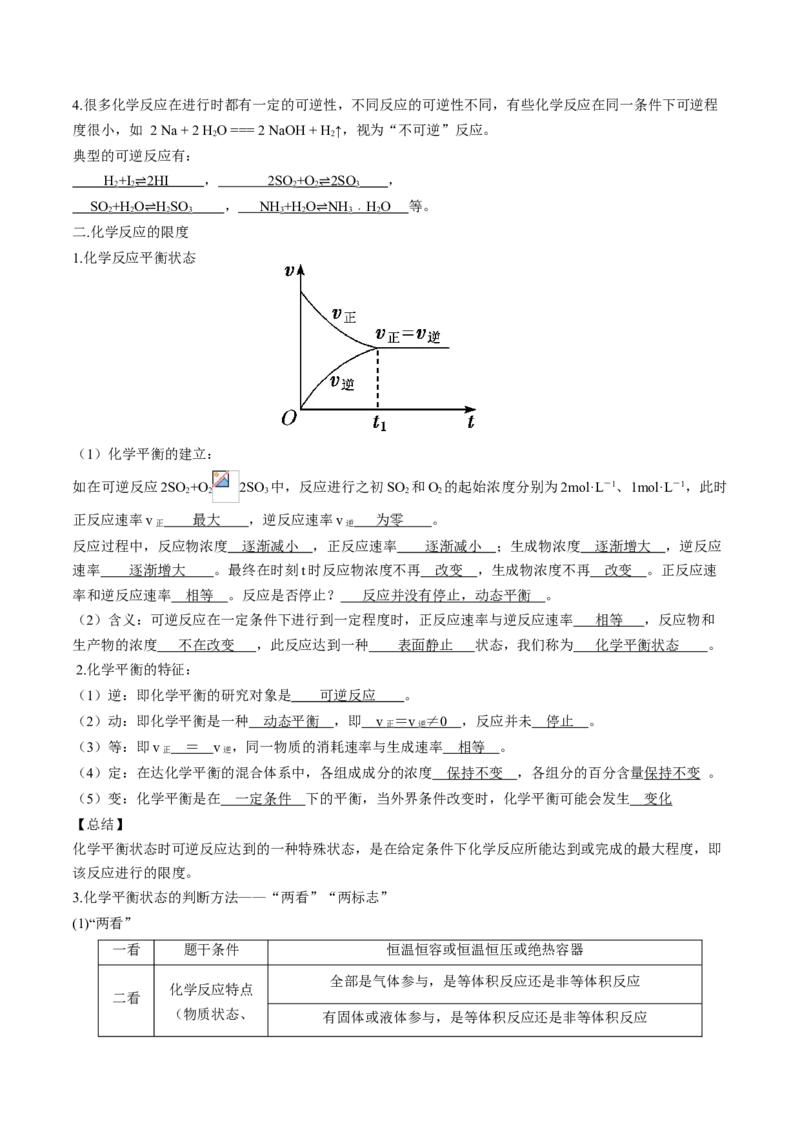
1.化学反应平衡状态
(1)化学平衡的建立:
如在可逆反应2SO +O 2SO 中,反应进行之初SO 和O 的起始浓度分别为2mol·L-1、1mol·L-1,此时
2 2 3 2 2
正反应速率v 最大 ,逆反应速率v 为零 。
正 逆
反应过程中,反应物浓度 逐渐减小 ,正反应速率 逐渐减小 ;生成物浓度 逐渐增大 ,逆反应
速率 逐渐增大 。最终在时刻t时反应物浓度不再 改变 ,生成物浓度不再 改变 。正反应速
率和逆反应速率 相等 。反应是否停止? 反应并没有停止,动态平衡 。
(2)含义:可逆反应在一定条件下进行到一定程度时,正反应速率与逆反应速率 相等 ,反应物和
生产物的浓度 不在改变 ,此反应达到一种 表面静止 状态,我们称为 化学平衡状态 。
2.化学平衡的特征:
(1)逆:即化学平衡的研究对象是 可逆反应 。
(2)动:即化学平衡是一种 动态平衡 ,即 v = v ≠ 0 ,反应并未 停止 。
正 逆
(3)等:即v = v ,同一物质的消耗速率与生成速率 相等 。
正 逆
(4)定:在达化学平衡的混合体系中,各组成成分的浓度 保持不变 ,各组分的百分含量保持不变 。
(5)变:化学平衡是在 一定条件 下的平衡,当外界条件改变时,化学平衡可能会发生 变化
【总结】
化学平衡状态时可逆反应达到的一种特殊状态,是在给定条件下化学反应所能达到或完成的最大程度,即
该反应进行的限度。
3.化学平衡状态的判断方法——“两看”“两标志”
(1)“两看”
一看 题干条件 恒温恒容或恒温恒压或绝热容器
全部是气体参与,是等体积反应还是非等体积反应
化学反应特点
二看
(物质状态、 有固体或液体参与,是等体积反应还是非等体积反应气体计量系数)
(2)“两标志”
正、逆反应 同一物质表示的正、逆反应速率相等v =v ,或者不同物质表示的正、逆速
正 逆
速率相等 率(或变化的物质的量、浓度)之比等于化学计量数之比
题目中的变量,指的是随着反应的进行而改变的量,(如某物质的质量、浓
变量 度、百分含量,n (气体)、压强、气体密度、气体平均分子质量、颜色等),
总
不变 当“变量”不再变化(保持恒定)时,证明可逆反应达到平衡,但“定量”无
法证明。
三.化学反应条件的控制
1.在生产和生活中,人们希望促进 有利 的化学反应(提高反应物的转化率即原料的利用率,加快反应速
率等),抑制 有害 的化学反应(减缓反应速率,减少甚至消除有害物质的产生,控制副反应的发生
等),即通过控制化学反应的条件,使反应向着我们有利的方向进行。
案例分析:如何提高煤的燃烧效率?
(1)煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
固体表面积增大,反应速率加快,能使煤燃烧更充分。
(2)空气用量对煤的充分燃烧及热能利用有什么影响?原因是什么?
空气过少,煤不能充分燃烧;空气过多,会带走热量,热量散失增多。
(3)应选择什么样的炉(灶)膛材料?理由是什么?
选择隔热保温耐热效果好的,减少热量散失。
(4)如何充分利用煤燃烧后烟道废气中的热量?
回收热量,产生蒸汽,转化为动能;循环冷却水,居民供暖。
2.基本措施
(1)改变化学反应速率:改变反应体系的温度、物质的浓度、气体的压强、固体的表面积以及催化剂的合
理使用等。
(2)改变可逆反应进行的限度:改变可逆反应体系的温度、物质的浓度、气体的压强等。