文档内容
2024 学年第一学期金华市卓越联盟 12 月阶段性考试
高一年级化学试题
命题:东阳二中 审核:巍山高中 义乌三中
考生须知:
1.本卷共8页满分100分,考试时间90分钟;
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
可能用到的相对原子质量:H1 C12 O16 Na23 S32 Cl35.5 K39 Fe56 Ag108 Ba137
选择题部分
一、选择题(本大题共25小题,每小题2分,共50分。每小题列出的四个备选项中只有一个是符
合题目要求的,不选、多选、错选均不得分)
1.我国很多珍贵文物都记载着中华文明的灿烂成就,下列文物主要由合金材料制成的是
A.曜变天目茶碗 B.甲骨文 C.千里江山图 D.三星堆青铜面具
A.A B.B C.C D.D
2.下列元素中,不
.
属
.
于
.
第三周期元素的是
A.B B.S C.Na D.Cl
3.下列物质中,不
.
属
.
于
.
电解质的是
A.H SO B.NaOH C.CO D.Na SO
2 4 2 2 4
4.下列物质中,只含共价键的是
A.NaCl B.Na CO C.HCl D.KOH
2 3
5.NaHCO
3
俗名小苏打,下面是对NaHCO
3
采用不同分类法的分类,不
.
正
.
确
.
的是
A.NaHCO 是含氧酸盐 B.NaHCO 是正盐
3 3
C.NaHCO 是钠盐 D.NaHCO 是弱酸盐
3 3
6.下列化学用语书写不
.
正
.
确
.
的是
Δ
A.H 还原CuO反应中电子的转移: Cu+H O
2 2
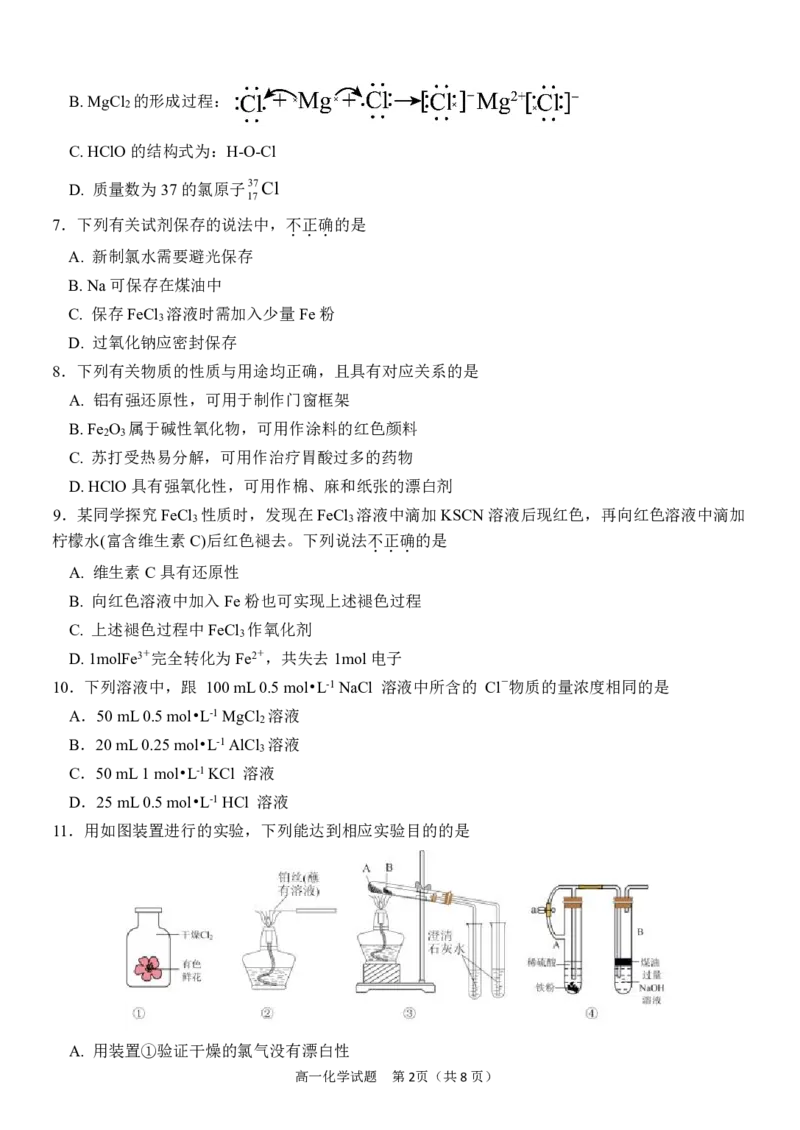
高一化学试题 第1页(共8页)B.MgCl 的形成过程:
2
C.HClO的结构式为:H-O-Cl
D.
质量数为37的氯原子37Cl
17
7.下列有关试剂保存的说法中,不
.
正
.
确
.
的是
A. 新制氯水需要避光保存
B.Na可保存在煤油中
C. 保存FeCl 溶液时需加入少量Fe粉
3
D. 过氧化钠应密封保存
8.下列有关物质的性质与用途均正确,且具有对应关系的是
A. 铝有强还原性,可用于制作门窗框架
B.Fe O 属于碱性氧化物,可用作涂料的红色颜料
2 3
C. 苏打受热易分解,可用作治疗胃酸过多的药物
D.HClO具有强氧化性,可用作棉、麻和纸张的漂白剂
9.某同学探究FeCl 性质时,发现在FeCl 溶液中滴加KSCN溶液后现红色,再向红色溶液中滴加
3 3
柠檬水(富含维生素C)后红色褪去。下列说法不
.
正
.
确
.
的是
A. 维生素C具有还原性
B. 向红色溶液中加入Fe粉也可实现上述褪色过程
C. 上述褪色过程中FeCl 作氧化剂
3
D.1molFe3+完全转化为Fe2+,共失去1mol电子
10.下列溶液中,跟 100mL0.5mol•L-1NaCl 溶液中所含的 Cl-物质的量浓度相同的是
A.50mL0.5mol•L-1MgCl 溶液
2
B.20mL0.25mol•L-1AlCl 溶液
3
C.50mL1mol•L-1KCl 溶液
D.25mL0.5mol•L-1HCl 溶液
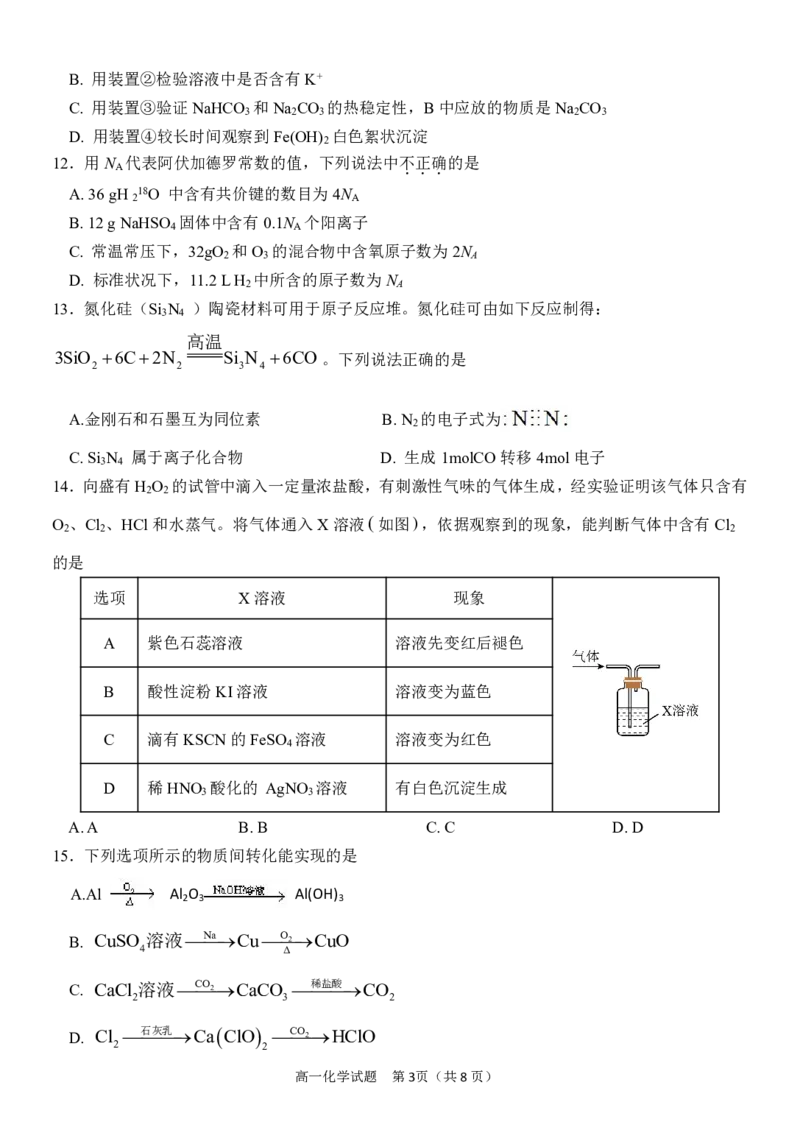
11.用如图装置进行的实验,下列能达到相应实验目的的是
A. 用装置①验证干燥的氯气没有漂白性
高一化学试题 第2页(共8页)B. 用装置②检验溶液中是否含有K+
C. 用装置③验证NaHCO 和Na CO 的热稳定性,B中应放的物质是Na CO
3 2 3 2 3
D. 用装置④较长时间观察到Fe(OH) 白色絮状沉淀
2
12.用N
A
代表阿伏加德罗常数的值,下列说法中不
.
正
.
确
.
的是
A.36gH 18O 中含有共价键的数目为4N
2 A
B.12gNaHSO 固体中含有0.1N 个阳离子
4 A
C. 常温常压下,32gO 和O 的混合物中含氧原子数为2N
2 3 A
D. 标准状况下,11.2LH 中所含的原子数为N
2 A
13.氮化硅(Si N )陶瓷材料可用于原子反应堆。氮化硅可由如下反应制得:
3 4
高温
3SiO 6C2N Si N 6CO。下列说法正确的是
2 2 3 4
A.金刚石和石墨互为同位素 B.N 的电子式为
2
C.Si N 属于离子化合物 D. 生成1molCO转移4mol电子
3 4
14.向盛有H O 的试管中滴入一定量浓盐酸,有刺激性气味的气体生成,经实验证明该气体只含有
2 2
O 、Cl 、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl
2 2 2
的是
选项 X溶液 现象
A 紫色石蕊溶液 溶液先变红后褪色
B 酸性淀粉KI溶液 溶液变为蓝色
C 滴有KSCN的FeSO 溶液 溶液变为红色
4
D 稀HNO 酸化的 AgNO 溶液 有白色沉淀生成
3 3
A.A B.B C.C D.D
15.下列选项所示的物质间转化能实现的是
A.Al Al O Al(OH)
2 3 3
B. CuSO 溶液NaCuO2CuO
4 Δ
C. CaCl 溶液CO 2CaCO 稀盐酸CO
2 3 2
D. Cl 石灰乳Ca ClO CO 2HClO
2 2
高一化学试题 第3页(共8页)16.如图是某学校实验室从化学试剂商店采购的浓盐酸试剂标签上
的部分内容,实验室用该浓盐酸配制240mL0.5mol/L的稀盐酸。下
列说法正确的是
A. 实验需要用量筒取该浓盐酸10.5mL
B. 定容摇匀后发现溶液液面低于刻度线,用胶头滴管再加入蒸
馏水至与刻度线相切
C. 用蒸馏水洗净容量瓶后未干燥,直接配制所得溶液浓度偏小
D. 定容过程中俯视读数会导致配制盐酸浓度偏低
17.下列各组离子在溶液中能大量共存的是
A.Na+、H+、SO2-、HCO- B.NO、OH、Na、Ba2
4 3 3
C.Mg2、Na、Cl、OH D.Fe2、Ba2、MnO、H
4
18.下列有关氯及其化合物的叙述不
.
正
.
确
.
的是
A. 将Cl 通入烧碱溶液可制取漂白液
2
B. AlCl 、FeCl 、CuCl 均可通过化合反应制得
3 2 2
C. 利用丁达尔效应可区分Fe(OH) 胶体和FeCl 溶液
3 3
D. 向FeCl 溶液中滴加氯水,溶液颜色变成黄色,说明氯水中含有HClO
2
19.某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不
.
正
.
确
.
的是
A. E处棉花球变成黄色,说明Cl 的氧化性比Br 强
2 2
B. F处棉花球变成蓝色,说明Br 的氧化性比I 强
2 2
C. E处发生反应的离子方程式为Cl +2Br-===2Cl-+Br
2 2
D. G装置中NaOH溶液与Cl 反应的离子方程式为2OH-+Cl ===ClO-+Cl-+H O
2 2 2
20.下列反应的离子方程式书写正确的是
A. Cl 通入水中制氯水:Cl +H O 2H++Cl-+ClO-
2 2 2
B. 澄清石灰水中通入过量的二氧化碳:CO +OH-===HCO-
2 3
C. 碳酸钙与稀盐酸反应:CO2-+2H+===CO ↑+H O
3 2 2
D. 向Ba(OH) 溶液中滴加稀硫酸:Ba2++OH-+H++SO2-===BaSO ↓+H O
2 4 4 2
21.类推是化学学习和研究常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与
否。根据你所掌握的知识,判断下列类推结论中正确的是
高一化学试题 第4页(共8页)A. Na 在O 中燃烧生成Na O ,故Li在O 中燃烧生成Li O
2 2 2 2 2 2
B. 已知溶解度:CaCO C
产生的气体通入足量的澄清石灰水中,石灰水变浑浊
取少量溶液于试管中,加入稀硫酸,将产生的气体通入足量的澄清石灰 该溶液中可能含
B
水中,产生无色无味的能使石灰水变浑浊的气体 HCO -
3
该溶液中一定含
C 向某溶液中加入盐酸酸化的BaCl 溶液,有白色沉淀生成
2
SO 2-
4
某溶液中滴加新制氯水,无明显现象,再滴加几滴KSCN溶液,溶液变 原溶液中一定含
D
为血红色, 有Fe2+
A.A B.B C.C D.D
23.某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并研究反应后硬质试管中黑色固
体物质的成分。下列说法不正确的是
...
A.点燃酒精灯的顺序是先A后B
B.湿棉花的作用是提供水蒸气
C. 观察到肥皂水中产生气泡说明该反应中已经有氢气生成
D. 排除氧气干扰的条件下,将反应后的固体用稀硫酸溶解,若滴加KSCN溶液后变红色,说明黑
色固体中可能有Fe O
3 4
24. X、Y、Z、W是原子序数依次增大的4种短周期元素,其中Y和Z的单质是组成空气的主要
成分,W的原子半径是短周期主族元素中最大的,X、Y、Z三种元素可组成一种化合物M,M的
结构式为 。下列说法正确的是
A.M中各原子均达8电子稳定结构
B. 由Z、W两种元素形成的化合物只有一种
高一化学试题 第5页(共8页)C.Y、Z、W形成的简单离子半径大小顺序为W>Y>Z
D.M可作还原剂,与Cl 反应生成1molY 时失去2mol电子
2 2
25.取BaCl 和KCl的混合液1L分成两等份,分别进行了如下实验:一份加入足量稀硫酸,得到
2
4.66g沉淀;另一份加入足量AgNO 溶液,得到14.35g沉淀。则原混合液中c(K+)为
3
A.0.04mol/L B.0.08mol/L C.0.12mol/L D.0.16mol/L
非选择题部分
二、非选择题(本大题共5小题,共50分)
26.(1)考古时常用于测定文物年代的是碳元素的一种核素14C,该核素的中子数为 。
6
(2)写出CO 的电子式为 。
2
(3)某金属单质M与Cl 反应生成26.7gMCl ,其中含0.6molCl-,则M的摩尔质量为 。
2 3
(4)从400mL2.0mol/L的AlCl 溶液中取出20mL,将这20mL溶液用水稀释到100mL,所得溶液
3
中Cl-的物质的量浓度为 。
27.自1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家
的艰辛努力。元素周期表体现了元素位置,结构和性质的关系,揭示了元素间的内在联系。如图是
元素周期表的一部分,回答下列问题:
(1) 氧与氢元素组成含10、18个电子的分子的化学式分别是 、 。
(2)P、S、Cl元素对应的简单离子的还原性由强到弱的顺序为 。(写离子符号)
(3)写出Cl在元素周期表中的位置 。
(4)根据元素周期律,推断:
①阴影部分元素最高价氧化物对应水化物的酸性最强的是 。(写化学式)
②H A O 、H SeO 的酸性强弱:H A O (填“>”“<”或“=”) H SeO 。
3 S 4 2 4 3 S 4 2 4
③镓(Ga)的氯化物与氨水(溶质为NH ·H O)反应的化学方程式为 。
3 2
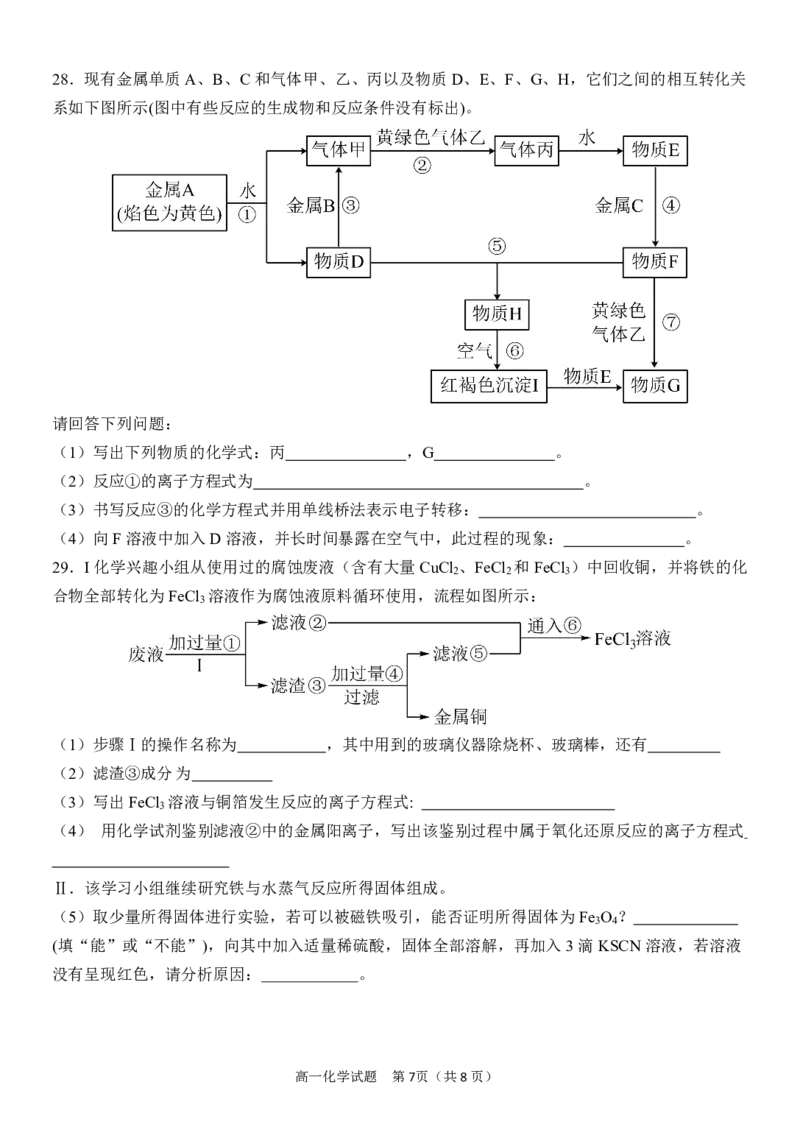
高一化学试题 第6页(共8页)28.现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关
系如下图所示(图中有些反应的生成物和反应条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:丙 ,G 。
(2)反应①的离子方程式为 。
(3)书写反应③的化学方程式并用单线桥法表示电子转移: 。
(4)向F溶液中加入D溶液,并长时间暴露在空气中,此过程的现象: 。
29.I化学兴趣小组从使用过的腐蚀废液(含有大量CuCl 、FeCl 和FeCl )中回收铜,并将铁的化
2 2 3
合物全部转化为FeCl 溶液作为腐蚀液原料循环使用,流程如图所示:
3
(1)步骤Ⅰ的操作名称为 ,其中用到的玻璃仪器除烧杯、玻璃棒,还有
(2)滤渣③成分为
(3)写出FeCl 溶液与铜箔发生反应的离子方程式:
3
(4) 用化学试剂鉴别滤液②中的金属阳离子,写出该鉴别过程中属于氧化还原反应的离子方程式
Ⅱ.该学习小组继续研究铁与水蒸气反应所得固体组成。
(5)取少量所得固体进行实验,若可以被磁铁吸引,能否证明所得固体为Fe O ?
3 4
(填“能”或“不能”),向其中加入适量稀硫酸,固体全部溶解,再加入3滴KSCN溶液,若溶液
没有呈现红色,请分析原因: 。
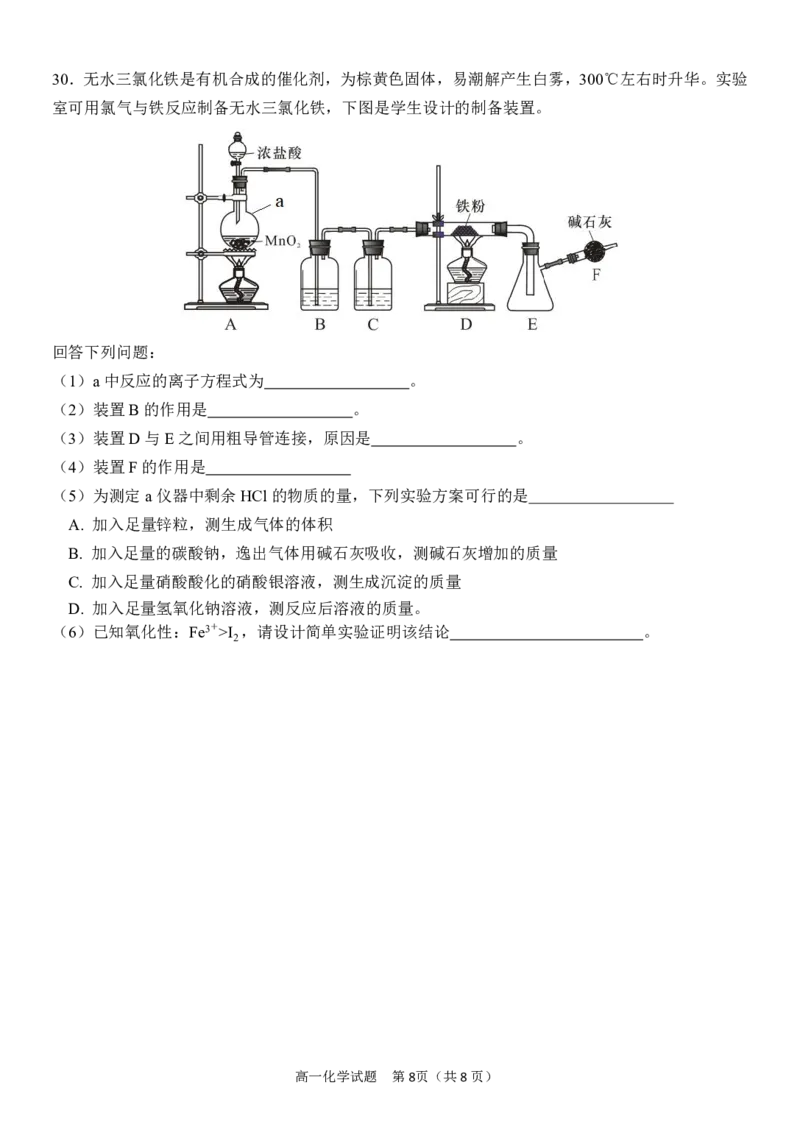
高一化学试题 第7页(共8页)30.无水三氯化铁是有机合成的催化剂,为棕黄色固体,易潮解产生白雾,300℃左右时升华。实验
室可用氯气与铁反应制备无水三氯化铁,下图是学生设计的制备装置。
回答下列问题:
(1)a中反应的离子方程式为 。
(2)装置B的作用是 。
(3)装置D与E之间用粗导管连接,原因是 。
(4)装置F的作用是
(5)为测定a仪器中剩余HCl的物质的量,下列实验方案可行的是
A. 加入足量锌粒,测生成气体的体积
B. 加入足量的碳酸钠,逸出气体用碱石灰吸收,测碱石灰增加的质量
C. 加入足量硝酸酸化的硝酸银溶液,测生成沉淀的质量
D. 加入足量氢氧化钠溶液,测反应后溶液的质量。
(6)已知氧化性:Fe3+>I ,请设计简单实验证明该结论 。
2
高一化学试题 第8页(共8页)