文档内容
班级 姓名 学号 分数
第 05 单元 化工生产中的重要非金属元素
(B 卷•提升能力)
(时间:90分钟,满分:100分)
一、选择题(本题共16小题,每小题3分,共48分。)
1.化学知识与科技、生产、生活有密切的关系。下列叙述中错误的是
A.“天宫二号”空间运行的动力源泉——太阳能电池帆板,其核心材料为晶体硅
B.“天问一号”火星车使用的保温材料——纳米气凝胶,具有丁达尔效应
C.三星堆二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化史上的诸多空白。青铜器的出土
表明我国商代已经掌握冶炼铜技术
D.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
【答案】D
【详解】
A.宫二号使用的光伏太阳能电池的核心材料是半导体硅,天宫二号使用的光伏太阳能电池是将太阳能转
化为电能,A正确;
B.“天问一号”火星车使用的热控材料是新型保温材料-纳米气凝胶,属于胶体,能够产生丁达尔效应,B
正确
C.青铜器的主要成分是铜单质,商代的铜人铜像,说明此时我国已经掌握炼铜技术,C正确;
D.单质硅是半导体材料,芯片中的半导体材料为单质硅,D错误;
故选D。
2.下列说法中正确的是
A.根据化合价可知,S在化学反应中只能作还原剂
B.试管内壁上的硫黄可用CS 清洗
2
C.S+O SO ,S被氧化,作氧化剂
2 2
D.硫只以化合态存在于自然界中
【答案】B
【详解】
学科网(北京)股份有限公司A.0价是S的中间价态,所以S既可作氧化剂,又可作还原剂,A错误;
B.S易溶于CS,所以可以用CS 清洗试管内壁的硫粉,B正确;
2 2
C.S被氧化,化合价升高,作还原剂,C错误;
D.硫在自然界中既有游离态又有化合态,D错误;
故选:B。
3.下列叙述正确的是( )
A.无色有刺激性气味的气体一定是SO
2
B.使澄清石灰水变浑浊的气体一定是CO
2
C.二氧化硫在空气中燃烧生成三氧化硫
D.SO 是一种酸性氧化物
3
【答案】D
【详解】
A. 无色有刺激性气味的气体也可以是HCl,A错误;
B. 使澄清石灰水变浑浊的气体也可以是SO ,A错误;
2
C. 反应没有条件(加热450 ℃,催化剂)不能生成SO ,A错误;
3
D. SO 与水反应生成硫酸,与氢氧化钠溶液反应生成硫酸钠和水,则其是一种酸性氧化物,D正确;
3
故选D。
4.下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A.
B.
C.
D.
【答案】D
【详解】
学科网(北京)股份有限公司A.反应 为复分解反应,浓硫酸表现酸性和难挥发性,A不符合
题意;
B.反应 为复分解反应,浓硫酸表现强酸性,B不符合题意;
C.反应 为氧化还原反应,浓硫酸表现强氧化性,C不符合题
意;
D.反应 中,Fe元素由+2价升高到+3价,同时生成
Fe (SO ),浓硫酸表现强氧化性和酸性,D符合题意;
2 4 3
故选D。
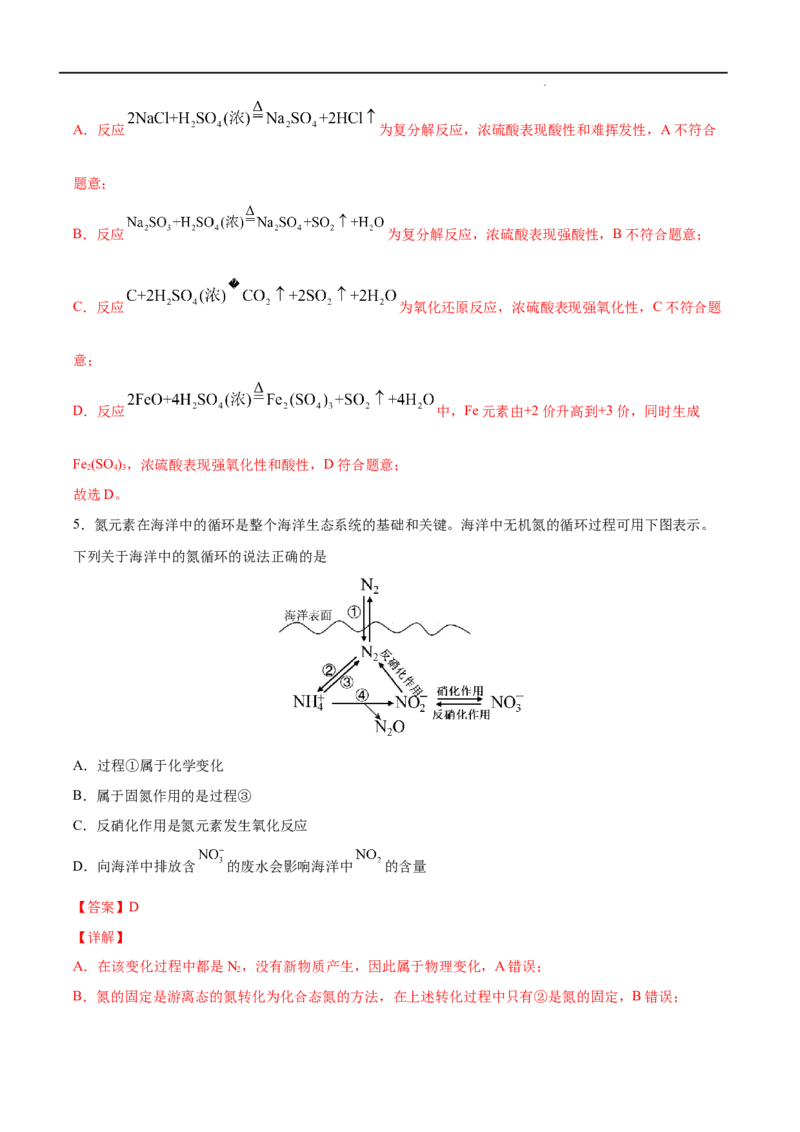
5.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
下列关于海洋中的氮循环的说法正确的是
A.过程①属于化学变化
B.属于固氮作用的是过程③
C.反硝化作用是氮元素发生氧化反应
D.向海洋中排放含 的废水会影响海洋中 的含量
【答案】D
【详解】
A.在该变化过程中都是N,没有新物质产生,因此属于物理变化,A错误;
2
B.氮的固定是游离态的氮转化为化合态氮的方法,在上述转化过程中只有②是氮的固定,B错误;
学科网(北京)股份有限公司C.根据图示可知:反硝化作用是氮元素由 转化为N,N元素化合价降低,得到电子被还原,发生还
2
原反应,C错误;
D.根据图示转化关系可知:若向海洋中排放含 的废水, 会通过反硝化作用产生 ,导致海洋
中 的含量增加,因而影响 的含量,D正确;
故合理选项是D。
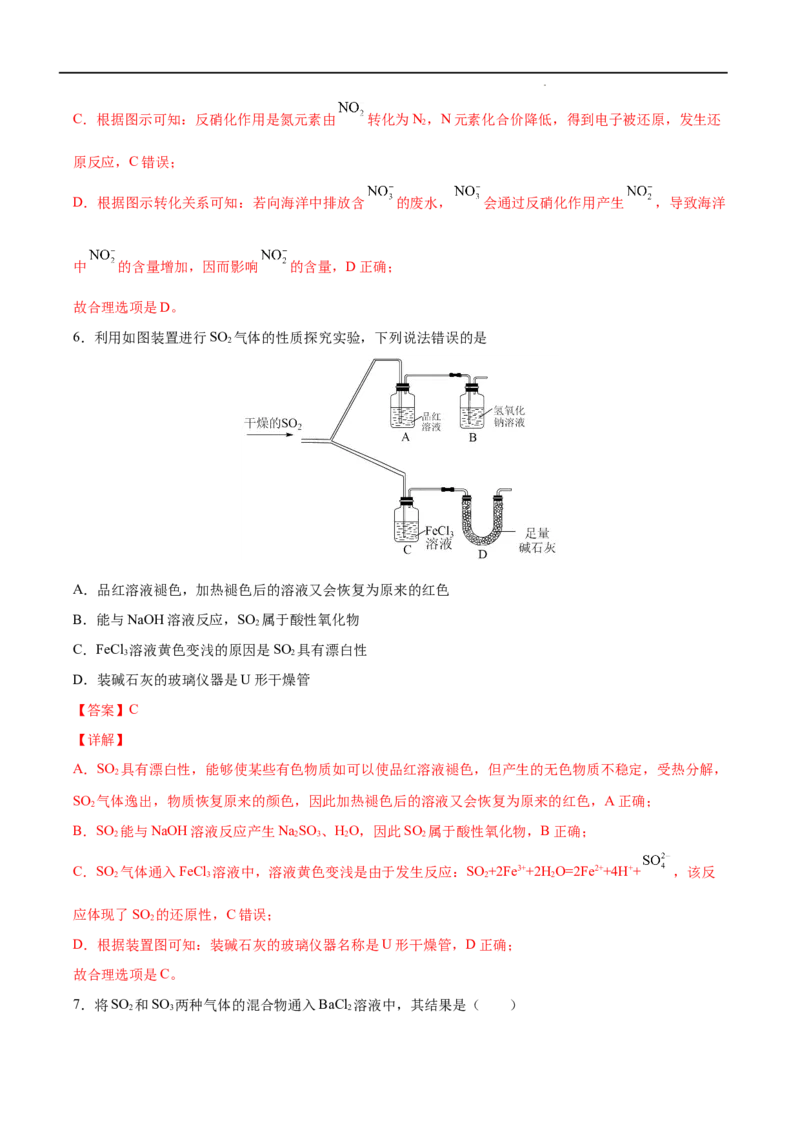
6.利用如图装置进行SO 气体的性质探究实验,下列说法错误的是
2
A.品红溶液褪色,加热褪色后的溶液又会恢复为原来的红色
B.能与NaOH溶液反应,SO 属于酸性氧化物
2
C.FeCl 溶液黄色变浅的原因是SO 具有漂白性
3 2
D.装碱石灰的玻璃仪器是U形干燥管
【答案】C
【详解】
A.SO 具有漂白性,能够使某些有色物质如可以使品红溶液褪色,但产生的无色物质不稳定,受热分解,
2
SO 气体逸出,物质恢复原来的颜色,因此加热褪色后的溶液又会恢复为原来的红色,A正确;
2
B.SO 能与NaOH溶液反应产生NaSO 、HO,因此SO 属于酸性氧化物,B正确;
2 2 3 2 2
C.SO 气体通入FeCl 溶液中,溶液黄色变浅是由于发生反应:SO +2Fe3++2H O=2Fe2++4H++ ,该反
2 3 2 2
应体现了SO 的还原性,C错误;
2
D.根据装置图可知:装碱石灰的玻璃仪器名称是U形干燥管,D正确;
故合理选项是C。
7.将SO 和SO 两种气体的混合物通入BaCl 溶液中,其结果是( )
2 3 2
学科网(北京)股份有限公司A.两种气体都被吸收,并有BaSO 沉淀生成
4
B.只有 BaSO 沉淀,SO 通入溶液中无沉淀生成
3 3
C.生成 BaSO 和BaSO 两种沉淀
3 4
D.只生成BaSO 沉淀,SO 从溶液中逸出
4 2
【答案】D
【详解】
将SO 和SO 两种气体的混合物通入BaCl 溶液,由于盐酸的酸性大于亚硫酸,则SO 不反应,但BaSO 不
2 3 2 2 4
溶于酸,SO 与HO反应产生HSO ,HSO 与BaCl 发生复分解反应生成BaSO 沉淀和HCl,因此最终结
3 2 2 4 2 4 2 4
果是:生成BaSO 沉淀,SO 从溶液中逸出,故答案为D。
4 2
8.下列有关硅制品的说法不正确的是
A.利用高纯二氧化硅的半导体性能, 可以制成光电池,将光能(比如太阳光能)直接转化为电能
B.水晶镜片、石英钟表、玛瑙手镯的主要成分为SiO
2
C.SiO 晶体是由Si与O按照1∶2的比例形成的立体网状结构, 硅氧四面体不仅存在于SiO 晶体中,而
2 2
且存在于硅酸盐矿石中
D.硅在元素周期表中处于金属与非金属的过渡位置,晶体硅的导电性介于导体和绝缘体之间,是良好的
半导体材料
【答案】A
【详解】
A.晶体硅为良好的半导体材料,利用高硅的半导体性能,可以制成光电池,将光能(比如太阳光能)直
接转化为电能,二氧化硅不具有此性质,故A错误;
B.水晶镜片,石英钟表,玛瑙手镯主要成分为SiO,故B正确;
2
C.SiO 为原子晶体,在二氧化硅晶体中每个Si原子周围结合4个O原子,每个O原子周围结合2个Si原
2
子,形成立体网状结构,故C正确;
D.硅在元素周期表中处于金属和非金属的过渡位置,所以晶体硅的导电性介于金属和绝缘体之间,是良
好的半导体材料,故D正确。
故选:A。
9.硫元素的几种化合物存在下列转化关系,下列判断错误的是
浓HSO SO NaSO 溶液 NaSO S
2 4 2 2 3 2 2 3
A.反应①中生成的SO 具有漂白性,可与品红发生化合反应使其褪色
2
B.反应④中当消耗1mol稀硫酸时,电子转移为4mol
学科网(北京)股份有限公司C.可以用CS 清洗做过实验③后附着在试管壁上的硫
2
D.反应④生成S的原子利用率不是100%
【答案】B
【详解】
A.反应①中生成的SO 可结合有机色素化合成不稳定的无色物质,从而具有漂白性,故A正确;
2
B.反应④的化学方程式:NaSO+H SO =Na SO +S↓+SO↑+H O,消耗1mol HSO 时反应中电子转移2
2 2 3 2 4 2 4 2 2 2 4
mol,故B错误;
C.硫单质易溶于二硫化碳溶液,可以用CS 清洗做过实验③后附着在试管壁上的硫,故C正确;
2
D.反应④生成S的反应为:NaSO+H SO =Na SO +S↓+SO↑+H O,原子利用率不是100%,故D正确;
2 2 3 2 4 2 4 2 2
答案B。
10.下列各组离子在碱性条件下可以大量共存,而在强酸性条件下不能大量共存的是
A.K+、Na+、Cl-、SO B.Ca2+、Fe3+、NO 、Cl-
C.Ba2+、Na+、I-、NO D.NH 、Fe2+、Cl-、NO
【答案】C
【详解】
A.K+、Na+、Cl-、SO 与OH-能大量共存,与H+也能大量共存,A不符合题意;
B.Ca2+、Fe3+、NO 、Cl-中Fe3+与OH-不能大量共存,Ca2+、Fe3+、NO 、Cl-与H+能大量共存,B不符合
题意;
C.Ba2+、Na+、I-、NO 与OH-能大量共存,其中NO 在H+环境下具有强氧化性,与I-发生氧化还原反应
不能大量共存,C符合题意;
D.NH 、Fe2+、Cl-、NO 中的NH 、Fe2+与OH-都不能大量共存,其中NO 在H+环境下具有强氧化性,
与Fe2+发生氧化还原反应不能大量共存,D不符合题意;
故选C。
11.由下列实验事实得出的结论正确的是:
A.由SiO 不能与水反应生成硅酸可知,SiO 不是酸性氧化物
2 2
B.CO 通入NaSiO 溶液产生白色沉淀,可知酸性HCO>HSiO
2 2 3 2 3 2 3
学科网(北京)股份有限公司C.由SiO+2C Si+2CO↑,可知碳的非金属性大于硅
2
D.SiO 可与NaOH溶液反应,也可与氢氟酸反应,可知SiO 为两性氧化物
2 2
【答案】B
【详解】
A.酸性氧化物是能跟碱生成盐和水的氧化物,SiO 能与碱反应生成硅酸盐和水,所以SiO 是酸性氧化物,
2 2
酸性氧化物不是用是否跟水反应确定的,故A错误;
B.CO 通入NaSiO 溶液产生白色沉淀,白色沉淀为硅酸,根据强酸可以制弱酸,可知酸性HCO>
2 2 3 2 3
HSiO,故B正确;
2 3
C.碳和硅是同主族元素,碳的原子半径小于硅,碳得电子能力强于硅,所以碳的非金属性强于硅,反应
SiO+2C Si+2CO↑能发生的原因主要是生成了CO气体,CO可以离开反应体系,可以促使反应不断
2
向右进行,故C错误;
D.SiO 可与NaOH等碱溶液反应生成盐和水,SiO 虽然可与氢氟酸反应,但不能和其他酸反应,SiO 和
2 2 2
酸的反应不具有普遍性,所以SiO 不是两性氧化物,SiO 是酸性氧化物,故D错误;
2 2
故选B。
12.某同学按下图实验装置探究铜与浓硫酸的反应,记录实验现象如表,下列说法正确的是( )
A.②③中白色沉淀都是
B.实验开始时①中的黑色固体可能是
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.加热④中褪色后的溶液,溶液不变色
学科网(北京)股份有限公司【答案】B
【详解】
A.②中含有硝酸根,在酸性条件下会把二氧化硫氧化成硫酸,生成的白色沉淀 ,③中二氧化硫和
氨水反应生成生成亚硫酸根,和钡离子结合生成白色沉淀是 ,A错误;
B.一开始硫酸浓度较大,直接把铜氧化成氧化铜,而后硫酸变稀,黑色固体溶解,B正确;
C.反应后剩余硫酸浓度仍然较大,稀释时应该将剩余溶液加入水中稀释以免液体飞溅,C错误;
D.二氧化硫使品红溶液褪色,是二氧化硫与有色物质结合生成不稳定的无色物质,加热可以恢复,所以
加热品红溶液恢复红色,D错误;
故选B。
13.下列关于常见离子的检验方法和结论,其中正确的是 ( )
A.加入AgNO 溶液,有白色沉淀生成,证明原溶液一定有Cl−
3
B.先加入BaCl 溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,证明原溶液一定有SO
2
C.先加入KSCN溶液,无现象,再加氯水后溶液变红,证明原溶液一定有Fe2+
D.加入KSCN溶液变红,证明原溶液一定有Fe3+,一定没有Fe2+
【答案】C
【详解】
A. 氯离子可以和银离子之间反应产生白色难溶于硝酸的沉淀,加入稀硝酸酸化的AgNO 溶液,有白色
3
沉淀生成,证明原溶液一定有氯离子,但只加入AgNO 溶液,有白色沉淀生成,也可能是碳酸根离子等,
3
故A错误;
B. 先加入稀盐酸酸化无明显现象,排除银离子、亚硫酸根离子、碳酸根离子的干扰,再加入 BaCl 溶
2
液有白色沉淀生成,证明原溶液一定有SO ,但先加入BaCl 溶液,有白色沉淀生成,再加入稀盐酸沉淀
2
不溶解,也可能原溶液中含有银离子,故B错误;
C. 先加入KSCN溶液,无现象,说明原溶液中无Fe3+,再加氯水后溶液变红,证明原溶液一定有Fe2+,
故C正确;
D. 加入KSCN溶液变红,证明原溶液一定有Fe3+,无法判断亚铁离子是否存在,故D错误;
故选C。
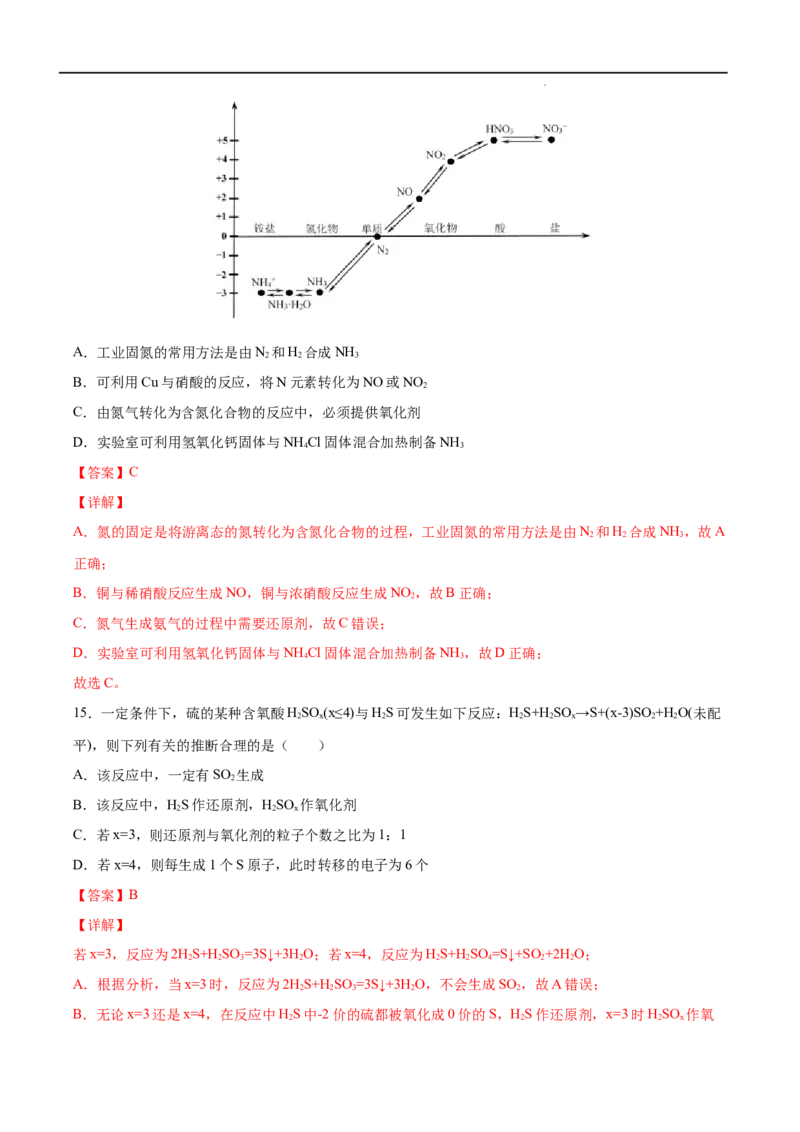
14.利用氮元素的价类二维图可以设计氮及其化合物之间的转化路径,下列说法不正确的是
学科网(北京)股份有限公司A.工业固氮的常用方法是由N 和H 合成NH
2 2 3
B.可利用Cu与硝酸的反应,将N元素转化为NO或NO
2
C.由氮气转化为含氮化合物的反应中,必须提供氧化剂
D.实验室可利用氢氧化钙固体与NH Cl固体混合加热制备NH
4 3
【答案】C
【详解】
A.氮的固定是将游离态的氮转化为含氮化合物的过程,工业固氮的常用方法是由N 和H 合成NH ,故A
2 2 3
正确;
B.铜与稀硝酸反应生成NO,铜与浓硝酸反应生成NO ,故B正确;
2
C.氮气生成氨气的过程中需要还原剂,故C错误;
D.实验室可利用氢氧化钙固体与NH Cl固体混合加热制备NH ,故D正确;
4 3
故选C。
15.一定条件下,硫的某种含氧酸HSO (x≤4)与HS可发生如下反应:HS+HSO →S+(x-3)SO +H O(未配
2 x 2 2 2 x 2 2
平),则下列有关的推断合理的是( )
A.该反应中,一定有SO 生成
2
B.该反应中,HS作还原剂,HSO 作氧化剂
2 2 x
C.若x=3,则还原剂与氧化剂的粒子个数之比为1:1
D.若x=4,则每生成1个S原子,此时转移的电子为6个
【答案】B
【详解】
若x=3,反应为2HS+HSO =3S↓+3H O;若x=4,反应为HS+HSO =S↓+SO +2H O;
2 2 3 2 2 2 4 2 2
A.根据分析,当x=3时,反应为2HS+HSO =3S↓+3H O,不会生成SO ,故A错误;
2 2 3 2 2
B.无论x=3还是x=4,在反应中HS中-2价的硫都被氧化成0价的S,HS作还原剂,x=3时HSO 作氧
2 2 2 x
学科网(北京)股份有限公司化剂被还原成S,x=4时HSO 作氧化剂被还原成SO ,故B正确;
2 x 2
C.若x=3,HSO 为HSO ,HSO 与HS发生归中反应生成S和HO,还原剂HS与氧化剂HSO 物质的
2 x 2 3 2 3 2 2 2 2 3
量之比为2:1,故C错误;
D.若x=4,若为HSO ,应是浓HSO 将HS氧化成S,而浓硫酸自身被还原成SO ,则每生成1molS,转
2 4 2 4 2 2
移2mol电子,故D错误;
答案选B。
16.有某硫酸和硝酸的混合溶液 ,其中含有硫酸的浓度为 ,含硝酸的浓度为 ,现向
其中加入 铜粉,充分反应后 假设只生成 气体 ,最多可收集到标况下的气体的体积为
A. B. C. D.
【答案】D
【详解】
, 、
,发生反应为
,根据方程式知,硝酸根离子完全反应需要 为
、 为 ,所以硝酸根离子不足量,所以硝酸根离子完全被还原生成
,根据 原子守恒得 ,则 ,
故选D。
二、非选择题(本题共5小题,共52分。)
17.(9分)为了探究Cl、SO 同时通入HO中发生的反应,某校化学兴趣小组同学设计了如图所示的实
2 2 2
验装置。
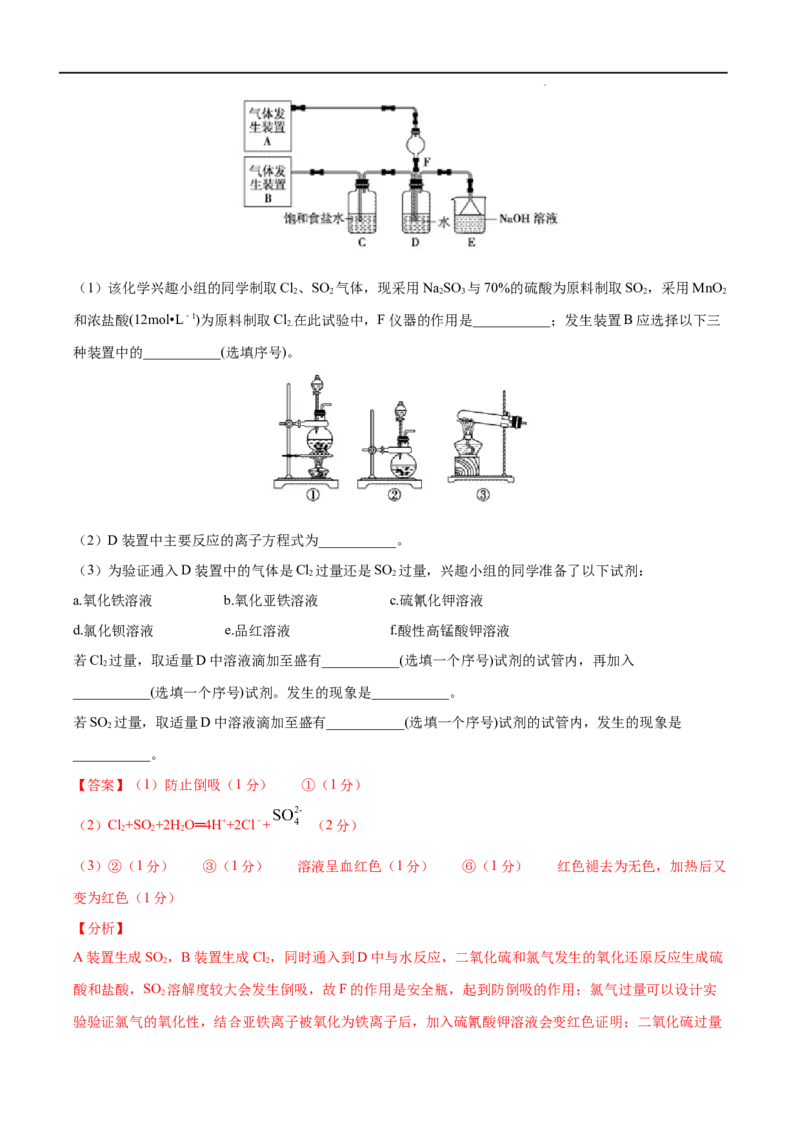
学科网(北京)股份有限公司(1)该化学兴趣小组的同学制取Cl、SO 气体,现采用NaSO 与70%的硫酸为原料制取SO ,采用MnO
2 2 2 3 2 2
和浓盐酸(12mol•L﹣1)为原料制取Cl 在此试验中,F仪器的作用是___________;发生装置B应选择以下三
2.
种装置中的___________(选填序号)。
(2)D装置中主要反应的离子方程式为___________。
(3)为验证通入D装置中的气体是Cl 过量还是SO 过量,兴趣小组的同学准备了以下试剂:
2 2
a.氧化铁溶液 b.氧化亚铁溶液 c.硫氰化钾溶液
d.氯化钡溶液 e.品红溶液 f.酸性高锰酸钾溶液
若Cl 过量,取适量D中溶液滴加至盛有___________(选填一个序号)试剂的试管内,再加入
2
___________(选填一个序号)试剂。发生的现象是___________。
若SO 过量,取适量D中溶液滴加至盛有___________(选填一个序号)试剂的试管内,发生的现象是
2
___________。
【答案】(1)防止倒吸(1分) ①(1分)
(2)Cl+SO+2H O═4H++2Cl﹣+ (2分)
2 2 2
(3)②(1分) ③(1分) 溶液呈血红色(1分) ⑥(1分) 红色褪去为无色,加热后又
变为红色(1分)
【分析】
A装置生成SO ,B装置生成Cl,同时通入到D中与水反应,二氧化硫和氯气发生的氧化还原反应生成硫
2 2
酸和盐酸,SO 溶解度较大会发生倒吸,故F的作用是安全瓶,起到防倒吸的作用;氯气过量可以设计实
2
验验证氯气的氧化性,结合亚铁离子被氧化为铁离子后,加入硫氰酸钾溶液会变红色证明;二氧化硫过量
学科网(北京)股份有限公司可以依据二氧化硫具有漂白性设计实验和选择试剂验证。
【详解】
(1)SO 易与水反应,且溶解度较大会发生倒吸,则F可以防倒吸,装置B为制取氯气的装置,由固液反
2
应且加热的原理可知应选择①,故答案为:防止倒吸;①;
(2)D中是二氧化硫和氯气发生的氧化还原反应生成硫酸和盐酸,反应的离子方程式为:
Cl+SO+2H O=4H++2Cl﹣+ ,故答案为:Cl+SO+2H O=4H++2Cl﹣+ ;
2 2 2 2 2 2
(3)为验证通入D装置中的气体是Cl 还是SO 过量,若Cl 过量,取适量D中溶液滴加至盛有氯化亚铁
2 2 2
溶液,试剂的试管内,再加入硫氰化钾溶液会变血红色,证明氯气氧化亚铁离子;
若SO 过量,取适量D中溶液滴加至盛有品红溶液的试管中,红色褪去,加热又恢复红色,证明含有二氧
2
化硫,故答案为:②;③;溶液呈血红色;⑥;红色褪去为无色,加热后又变为红色。
【点睛】
本题考查二氧化硫、氯气的性质,明确物质的性质及发生的化学反应是解答本题的关键。
18.(9分)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,
其中一种工艺流程示意图及主要反应如下:
(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为_______。当有 1molC参
与反应时,该反应转移的电子数是_______。
(2)有关物质的熔沸点数据如下表,提纯SiHCl 的主要工艺操作依次是沉降、冷凝和_______。
3
物质 Si SiCl SiHCl SiHCl SiHCl HCl SiH
4 3 2 2 3 4
熔点/℃ 1410 -70.4 -126.5 -122 -118 -114.2 -185
沸点/℃ 2355 57.6 31.8 8.2 -30.4 -84.9 -111.9
(3)还原炉中发生的化学反应方程式为:_______。
(4)上述工艺生产中循环使用的物质除Si、SiHCl 外,还有_______。
3
(5)关于硅及其相关化合物的叙述正确的是_______。
A.自然界中存在天然游离的硅单质
学科网(北京)股份有限公司B.已知C与Si属于主族元素,由于CO+H O=HCO,用类比法得知,SiO+H O=HSiO
2 2 2 3 2 2 2 3
C.硅酸钠的水溶液俗称水玻璃,具有粘性和耐高温,可以作为木材的粘合剂和防火材料
D.硅元素在金属与非金属的分界线处,因此具有弱的导电性,一般可用于作为半导体材料
E.光导纤维的主要成分是SiO
2
F.玻璃、水泥、陶瓷都是传统的硅酸盐产品
【答案】(1) (2分) 2N (1分)
A
(2)蒸馏(1分)
(3) (2分)
(4)H、HCl(1分)
2
(5)CDEF(2分)
【分析】
工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅,在流化床反应器中粗硅与HCl反应生成SiHCl
3
等,还原炉中氢气还原SiHCl 得到高纯硅。
3
(1)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅的化学方程式为 ,C
的化合价从0升高为+2价,故当有 1molC参与反应时,该反应转移的电子数是2N 。
A
(2)比较SiCl 、SiHCl 、SiHCl、SiHCl等物质的沸点,可得常温下SiCl 、SiHCl 为液体,SiHCl、
4 3 2 2 3 4 3 2 2
SiHCl为气体,沉降除去产物中的固体后,冷凝得到SiCl 、SiHCl 的混合液体,再进行蒸馏可分离二者。
3 4 3
(3)还原炉中氢气还原SiHCl 得到纯硅,发生的化学反应方程式为: 。
3
(4)粗硅与HCl发生反应 ,生成氢气,还原炉中氢气还原SiHCl 得到纯硅,发生
3
反应: ,则上述工艺生产中循环使用的物质除Si、SiHCl 外,还有H、HCl。
3 2
(5)A.硅元素为亲氧元素,在自然界中主要以硅的氧化物和硅酸盐存在,故A错误;
B.SiO 难溶于水,也不与水反应,故B错误;
2
C.硅酸钠的水溶液俗称水玻璃,具有粘性和耐高温,可以作为木材的粘合剂和防火材料,故C正确;
D.硅元素在金属与非金属的分界线处,因此具有弱的导电性,一般可用于作为半导体材料,故D正确;
E.光导纤维的主要成分是SiO,故E正确;
2
学科网(北京)股份有限公司F.玻璃、水泥、陶瓷都是传统的硅酸盐产品,故F正确;故选CDEF。
19.(11分)硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素
的常见化合价与部分物质类别的对应关系,回答下列问题。
(1)图1中与图2中M、N对应的物质分别是_______、_______。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为_______。
(3)NaSO 溶液易变质,实验室检验NaSO 溶液是否变质的基本操作是_______。
2 3 2 3
(4)SO 和氯水都有漂白性,有人为增强漂白效果,将Cl 和SO 混合使用,结果适得其反,几乎没有漂
2 2 2
白效果,用离子方程式表示其原因:_______。
(5)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫
酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO
4
方案乙:由Cu→CuO→CuSO
4
①方案甲,中铜和浓硫酸反应的化学方程式是_______。该反应体现了浓硫酸的_______性。
②这两种方案,你认为哪一种方案更合理?_______。理由是_______
【答案】(1)CaSO•2H O、NaSO •10H O(1分) CuFeS(1分)
4 2 2 4 2 2
(2)1:2(1分)
(3)取少量溶液于试管中,向其中加入过量稀盐酸,再滴加BaCl 溶液,如果产生白色沉淀,证明混有
2
NaSO (1分)
2 4
(4)Cl+SO+2H O=2Cl-+SO +4H+(2分)
2 2 2
(5)Cu+2H SO (浓) CuSO +SO↑+2H O(2分) 强氧化性、酸性(1分) 方案乙(1分) 无
2 4 4 2 2
污染产生,原料利用率高(1分)
【分析】
(1)图2中M为+6价的硫元素对应的盐,对应图1中的物质为CaSO•2H O、NaSO •10H O,N为-2价的
4 2 2 4 2
学科网(北京)股份有限公司硫元素对应的盐,对应图1中的物质为CuFeS;
2
(2)X为HS、Y为SO ,发生归中反应得到S单质,SO 做氧化剂,化合价降低4,HS做还原剂,化合
2 2 2 2
价升高2,由升降相等,则反应中氧化剂与还原剂的物质的量之比为1:2;
(3)NaSO 溶液易被氧气氧化为NaSO 而变质,即检验硫酸根是否存在即可,实验操作为:取少量溶液
2 3 2 4
于试管中,向其中加入过量稀盐酸,再滴加BaCl 溶液,如果产生白色沉淀,证明混有NaSO ;
2 2 4
(4)二氧化硫与氯气和水发生氧化还原反应生成盐酸和硫酸,离子方程式:Cl+SO+2H O=2Cl-+SO
2 2 2
+4H+;
(5)①铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫与水,反应方程式为:Cu+2H SO (浓)
2 4
CuSO +SO↑+2H O,反应中硫元素的化合价部分降低生成二氧化硫,部分不变存在与硫酸铜中,浓硫酸表
4 2 2
现强氧化性与酸性;
②方案①生成二氧化硫,污染空气,硫元素不能完全利用,方案②与方案①相比,没有污染产生且原料的
利用率高,故方案②更合理。
20.(13分)某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热
装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
实验操作及现象:
实验操作 现象
I.将B装置下移,使碳酸钙与稀硝酸接触 产生气体
II.当C装置中产生白色沉淀时,立刻将B装置上提
A装置中产生无色气体,E装置中开始时
III.将A装置中铜丝放入稀硝酸中,给A装置微微加热
出现浅红棕色气体
IV.用F装置向E装置中鼓入空气 E装置中气体颜色逐渐加深
学科网(北京)股份有限公司V.一段时间后 C装置中白色沉淀溶解
试回答下列问题:
(1)操作I中产生气体的化学式为_______。操作I的目的是_______。D装置的作用是_______。
(2)C装置中白色沉淀的化学式是_______。操作II中当C装置中产生白色沉淀时立刻将B装置上提的原
因是_______。
(3)操作III中A装置中产生无色气体的化学方程式是_______。
(4)E装置内气体颜色逐渐加深的原因是_______。
(5)操作V现象产生的原因是(用两个化学方程式说明)_______,_______。
【答案】(1)CO(1分) 用碳酸钙与稀硝酸反应产生的CO 气体将装置中的空气排尽(1分)
2 2
平衡压强,吸收NO、NO 、CO 等尾气,防止污染空气(1分)
2 2
(2)CaCO (1分) 防止碳酸钙消耗硝酸过多,从而影响铜与稀硝酸的反应 (1分)
3
(3) (2分)
(4)CO 比空气重,从长管进入E,并没有把E中的空气排尽,致使部分NO先与未排尽的空气生成少量
2
红棕色气体NO ,当再从F鼓入空气时,E中有更多的NO 生成,所以气体颜色逐渐加深(2分)
2 2
(5) (或 )(2分)
(2分)
【分析】
该实验的原理是首先用碳酸钙与稀硝酸反应产生的CO 将装置中的空气排尽,以防止空气中的氧气对实验
2
造成干扰,然后铜与稀硝酸反应产生气体,通过向E装置中通入空气,气体颜色变深,说明铜与稀硝酸反
应产生的气体为NO,最后处理尾气。
(1)操作I是用碳酸钙与稀硝酸反应产生的CO 气体将装置中的空气排尽,以防止空气中的氧气对实验的
2
干扰。D装置的作用是平衡压强,吸收NO、NO 、CO 等尾气,防止污染空气。
2 2
(2)C装置中出现白色沉淀说明E中的空气排尽了,生成的沉淀为CaCO ,当C装置中产生白色沉淀时
3
立刻将B装置上提是防止碳酸钙消耗硝酸过多,从而影响铜与稀硝酸的反应。
(3)铜与稀硝酸反应生成硝酸铜、NO无色气体和水,反应的化学方程式是
。
(4)CO 比空气重,从长管进入E,并没有把E中的空气排尽,致使部分NO先与未排尽的空气生成少量
2
学科网(北京)股份有限公司红棕色气体NO ,当再从F鼓入空气时,E中有更多的NO 生成,所以气体颜色逐渐加深。
2 2
(5)C中白色沉淀溶解是因为NO 与水反应生成硝酸,发生反应 (或
2
),硝酸能溶解碳酸钙沉淀,发生反应 。
21.(10分)I.如图所示:在B水槽中装有500mL水,容积为a mL的试管A充满了NO 和NO的混合气
2
体(标准状况),将试管A倒插入B水槽的水中。充分反应后,试管A中余下气体的体积为0.5a mL。
(1)通过导气管C向余下0.5a mL气体的试管A中持续通入氧气,A中可能观察到的现象是___________。
(2)当试管A中充满气体时停止通入氧气,然后将试管取出水槽,水槽B中溶液的物质的量浓度为
___________mol·L−1(设溶液的体积仍为500mL)。
II.将一定量铁粉和铜粉混合均匀后分为四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成
NO的体积和剩余金属的质量如表所示(设HNO 的还原产物只有NO):
3
实验序号 I II III IV
稀硝酸的体积/mL 50 100 150 175
剩余金属的质量/g 9.0 4.8 0 0
NO的体积(标准状况)/mL 1120 2240 3360 V
(3)每等份混合物的质量为___________g。
(4)稀硝酸的物质的量的浓度为___________mol/L。
(5)V=___________。
【答案】(1)无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,试管中液面
下降,最后充满无色气体(2分)
(2) (2分)
(3)13.2(2分)
(4)4mol/L(2分)
(5)4480(2分)
【解析】
学科网(北京)股份有限公司(1)一氧化氮和水不反应,二氧化氮和水反应生成硝酸和一氧化氮,故剩余NO,持续通入氧气,会发生
,无色气体变为红棕色气体,试管中液面不断上升至全充满,继续通入氧气后,
试管中液面下降,最后充满无色气体;故答案为:无色气体变为红棕色气体,试管中液面不断上升至全充
满,继续通入氧气后,试管中液面下降,最后充满无色气体;
(2)试管A中充满气体时停止通入氧气,完全为氧气,水槽中是稀硝酸,根据氮元素守恒可知
,故 ;
(3)由表中数据可知,实验I、II都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,
实验II可以看作是在实验I的基础上加入50mL硝酸,参加反应的金属的质量为9.0g-4.8g=4.2g,生成NO
的体积为2240mL-1120mL=1120 mL,NO物质的量为0.05mol,根据电子转移守恒可知,参加反应金属的
物质的量为 ,参加反应金属的平均摩尔质量为 ,故该过程只有
Fe参加反应,故实验I只有Fe参与反应;实验I发生反应 生成NO
的物质的量为0.05mol,根据方程式可知,参加反应的Fe的物质的量为 ,故参加反
应Fe的质量=0.075mol ×56g/mol=4.2g,则I中溶解4.2g Fe,故每份溶液中含有金属的质量为
4.2g+9g=13.2g;
(4)在实验II的基础上加入50mL硝酸,参加反应的金属的质量为4.8g,生成NO的体积为
3360mL-2240mL=1120mL,NO物质的量为0.05mol,若该过程只有Cu参加反应,根据电子转移守恒,则
Cu的物质的量 ,Cu的质量=0.075mol×64g/mol=4.8g,等于参加反应金属的质量,
故该过程只有Cu反应,且Cu恰好完全反应,故加入100mL硝酸时,Fe恰好反应生成硝酸亚铁;在实验
III的基础上再加入50mL硝酸,为硝酸与溶液中亚铁离子反应生成NO;由上述分析可知,实验I发生反应
,生成NO的物质的量为 ,根据方程式可知,参
学科网(北京)股份有限公司加反应的硝酸的物质的量为0.05mol×4 =0.2mol,故硝酸的物质的量浓度c(HNO) ;
3
(5)由上述分析可知,实验II中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量
,由 可知,溶液中亚铁离子的物质的量为
0.15mol,在实验III的基础上再加入50mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守
恒可知,生成NO的物质的量 ,故生成NO的体积为:0.05mol×22.4L/
mol=1.12L=1120mL,故V=3360+1120=4480。
学科网(北京)股份有限公司学科网(北京)股份有限公司