文档内容
2022-2023 学年上学期期中考前必刷卷(提升卷)
高二化学
(考试时间:75分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考
证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
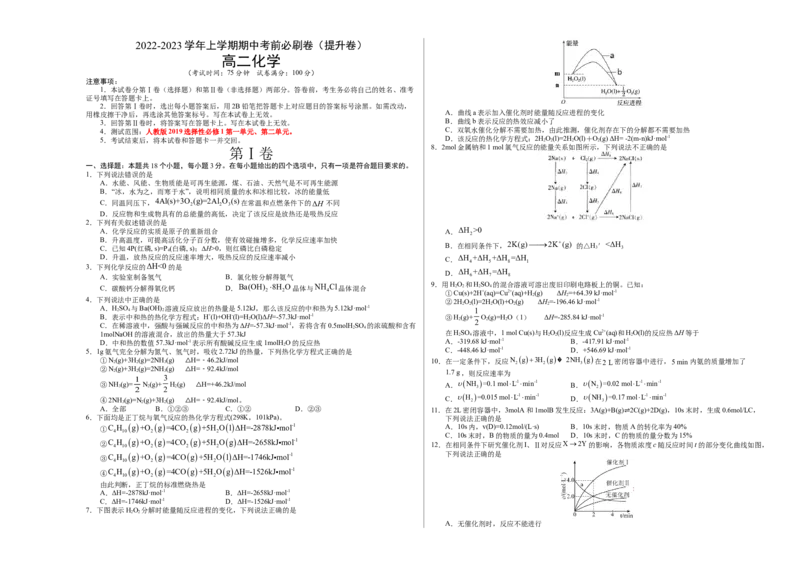
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。 A.曲线a表示加入催化剂时能量随反应进程的变化
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。 B.曲线b表示反应的热效应减小了
4.测试范围:人教版2019选择性必修1第一单元、第二单元。 C.双氧水催化分解不需要加热,由此推测,催化剂存在下的分解都不需要加热
5.考试结束后,将本试卷和答题卡一并交回。 D.该反应的热化学方程式:2H 2 O 2 (l)=2H 2 O(l)+O 2 (g) ΔH= -2(m-n)kJ·mol-1
8.2mol金属钠和1 mol氯气反应的能量关系如图所示,下列说法不正确的是
第Ⅰ卷
一、选择题:本题共18个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法错误的是
A.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
B.“冰,水为之,而寒于水”,说明相同质量的水和冰相比较,冰的能量低
4Al(s)+3O (g)=2Al O (s)
C.同温同压下,
2 2 3
在常温和点燃条件下的ΔH 不同
D.反应物和生成物具有的总能量的高低,决定了该反应是放热还是吸热反应
2.下列有关叙述错误的是
A.化学反应的实质是原子的重新组合 A. ΔH >0
2
B.升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快
B.在相同条件下,2K(g)2K(g) 的△H'<ΔH
C.已知4P(红磷, s)=P(白磷, s);∆H>0,则红磷比白磷稳定 3 3
4
D.升温,放热反应的反应速率增大,吸热反应的反应速率减小 ΔH +ΔH +ΔH =ΔH
C.
4 5 8 1
3.下列化学反应的ΔH<0的是
ΔH +ΔH =ΔH
D.
A.实验室制备氢气 B.氯化铵分解得氨气 6 7 8
C.碳酸钙分解得氧化钙 D.Ba(OH) 8H O晶体与 NH Cl 晶体混合 9.用H 2 O 2 和H 2 SO 4 的混合溶液可溶出废旧印刷电路板上的铜。已知:
2 2 4 ①Cu(s)+2H+(aq)=Cu2+(aq)+H (g) ΔH=+64.39 kJ·mol-1
2 2
4.下列说法中正确的是 ②2HO(l)=2H O(l)+O(g) ΔH=-196.46 kJ·mol-1
2 2 2 2 2
A.HSO 与Ba(OH) 溶液反应放出的热量是5.12kJ,那么该反应的中和热为5.12kJ·mol-1
2 4 2 1
B.表示中和热的热化学方程式:H+(l)+OH-(l)=H O(l)ΔH=-57.3kJ·mol-1 ③H(g)+ O(g)=HO(1) ΔH=-285.84 kJ·mol-1
2 2 2 2 2
C.在稀溶液中,强酸与强碱反应的中和热为ΔH=-57.3kJ·mol-1,若将含有0.5molHSO 的浓硫酸和含有
2 4
1molNaOH的溶液混合,放出的热量大于57.3kJ 在H 2 SO 4 溶液中,1 mol Cu(s)与H 2 O 2 (l)反应生成Cu2+(aq)和H 2 O(l)的反应热ΔH等于
D.中和热的数值57.3kJ·mol-1表示所有酸碱反应生成1molH O的反应热 A.-319.68 kJ·mol-1 B.-417.91 kJ·mol-1
2
5.1g氨气完全分解为氮气、氢气时,吸收2.72kJ的热量,下列热化学方程式正确的是 C.-448.46 kJ·mol-1 D.+546.69 kJ·mol-1
①N 2 (g)+3H 2 (g)=2NH 3 (g) H=﹣46.2kJ/mol 10.在一定条件下,反应N 2 g3H 2 g� 2NH 3 g 在2 L密闭容器中进行,5 min内氨的质量增加了
②N(g)+3H(g)=2NH (g) H=﹣92.4kJ/mol
2 2 3 1.7 g,则反应速率为
1 3 △
③NH (g)= N(g)+ H(g)△ H=+46.2kJ/mol A.NH =0.1 molL-1min-1 B.N =0.02 molL-1min-1
3 2 2 2 2 3 2
④2NH 3 (g)=N 2 (g)+3H 2 (g) H△=﹣92.4kJ/mol。
C.H
2
=0.015 molL-1min-1 D.NH
3
=0.17 molL-1min-1
A.全部 B.①②③ C.①② D.②③ 11.在2L密闭容器中,3molA和1molB发生反应:3A(g)+B(g) 2C(g)+2D(g),10s末时,生成0.6mol/LC,
6.下面均是正丁烷与氧气反应的△热化学方程式(298K,101kPa)。
下列说法正确的是
①C
4
H
10
g+O
2
g=4CO
2
g+5H
2
OlΔH=-2878kJ
mol-1 A.10s内,v(D)=0.12mol/(L·s) B.10s末时,物质⇌A的转化率为40%
C.10s末时,B的物质的量为0.4mol D.10s末时,C的物质的量分数为15%
②C 4 H 10 g+O 2 g=4CO 2 g+5H 2 OgΔH=-2658kJ mol-1 12.在相同条件下研究催化剂I、Ⅱ对反应X2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,
③C
4
H
10
g+O
2
g=4COg+5H
2
OlΔH=-1746kJ
mol-1 下列说法正确的是
④C
4
H
10
g+O
2
g=4COg+5H
2
OgΔH=-1526kJ
mol-1
由此判断,正丁烷的标准燃烧热是
A.ΔH=-2878kJ·mol-1 B.ΔH=-2658kJ·mol-1
C.ΔH=-1746kJ·mol-1 D.ΔH=-1526kJ·mol-1
7.下图表示HO 分解时能量随反应进程的变化,下列说法正确的是
2 2
A.无催化剂时,反应不能进行………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低 D.已知S(g)+O (g)=SO (g) ΔH ,S(s)+O (g)=SO (g) ΔH ,则ΔH >ΔH
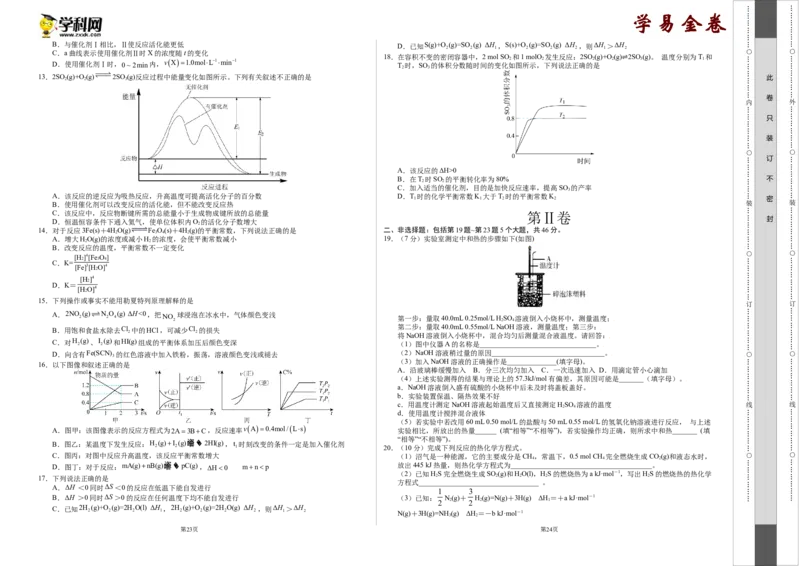
2 2 1 2 2 2 1 2
C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化
18.在容积不变的密闭容器中,2 mol SO 和1 molO 发生反应:2SO (g)+O(g) 2SO (g)。 温度分别为T 和 D.使用催化剂Ⅰ时,0~2min内,vX1.0molL1min1
T 时,SO 的体积分数随时间的变化如
2
图所示,
2
下列说法正确的
2
是
2 3 1
2 3
⇌
13.2SO 2 (g)+O 2 (g)2SO 3 (g)反应过程中能量变化如图所示。下列有关叙述不正确的是 此
卷
只
装
订
A.该反应的ΔH>0
B.在T 时SO 的平衡转化率为80% 不
2 2
C.加入适当的催化剂,目的是加快反应速率,提高SO 的产率
3
A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 D.T 时的化学平衡常数K 大于T 时的平衡常数K
1 1 2 2 密
B.使用催化剂可以改变反应的活化能,但不能改变反应热
C.该反应中,反应物断键所需的总能量小于生成物成键所放的总能量 第Ⅱ卷
封
D.恒温恒容条件下通入氦气,使单位体积内O 的活化分子数增大
2
14.对于反应3Fe(s)+4HO(g) Fe O(s)+4H(g)的平衡常数,下列说法正确的是 二、非选择题:包括第19题~第23题5个大题,共46分。
2 3 4 2
A.增大HO(g)的浓度或减小H 的浓度,会使平衡常数减小 19.(7分)实验室测定中和热的步骤如下(如图)
2 2
B.改变反应的温度,平衡常数不一定变化
[H]4[FeO ]
2 3 4
C.K=
[Fe]3[HO]4
2
[H ]4
2
D.K=
[H O]4
2
15.下列操作或事实不能用勒夏特列原理解释的是
A.2NO 2 (g) N 2 O 4 (g) ΔH<0,把 NO 球浸泡在冰水中,气体颜色变浅 第一步:量取40.0mL 0.25mol/L H SO 溶液倒入小烧杯中,测量温度;
2 2 4
B.用饱和食盐水除去Cl 中的HCl,可减少Cl 的损失 第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;第三步:
2 2
将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
C.对H
2
(g)、I
2
(g)和HI(g)组成的平衡体系加压后颜色变深
(1)图中仪器A的名称是_________________________________。
D.向含有Fe(SCN) 的红色溶液中加入铁粉,振荡,溶液颜色变浅或褪去 (2)NaOH溶液稍过量的原因________________________________。
3
(3)加入NaOH溶液的正确操作是______________(填字母)。
16.以下图像和叙述正确的是
A.沿玻璃棒缓慢加入 B.分三次均匀加入 C.一次迅速加入 D.用滴定管小心滴加
(4)上述实验测得的结果与理论上的57.3kJ/mol有偏差,其原因可能是_______(填字母)。
a.NaOH溶液倒入盛有硫酸的小烧杯中后未及时将盖板盖好。
b.实验装置保温、隔热效果不好
c.用温度计测定NaOH溶液起始温度后又直接测定HSO 溶液的温度
2 4
d.使用温度计搅拌混合液体
(5)若实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述
A.图甲:该图像表示的反应方程式为2A3BC,反应速率vA0.4mol/Ls
实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填
“相等”“不相等”)。
B.图乙:某温度下发生反应:H (g)I (g)噲垐�� 2HI(g),t 时刻改变的条件一定是加入催化剂
2 2 1 20.(10分)完成下列反应的热化学方程式。
C.图丙:对图中反应升高温度,该反应平衡常数增大 (1)沼气是一种能源,它的主要成分是CH,常温下,0.5 mol CH 完全燃烧生成CO(g)和液态水时,
4 4 2
D.图丁:对于反应:mA(g)nB(g)噲垐�� pC(g),H0 mnp 放出445 kJ热量,则热化学方程式为________________________________________。
(2)已知HS完全燃烧生成SO (g)和HO(l),HS的燃烧热为a kJ·mol-1,写出HS的燃烧热的热化学
17.下列说法正确的是 2 2 2 2 2
方程式__________________________________ 。
A.ΔH <0同时ΔS<0的反应在低温下能自发进行
1 3
B.ΔH >0同时ΔS>0的反应在任何温度下均不能自发进行 (3)已知: N(g)+ H(g)=N(g)+3H(g) ΔH=+a kJ·mol-1
2 2 2 2 1
C.已知2H (g)+O (g)=2H O(l) ΔH ,2H (g)+O (g)=2H O(g) ΔH ,则ΔH >ΔH
2 2 2 1 2 2 2 2 1 2 N(g)+3H(g)=NH (g) ΔH=-b kJ·mol-1
3 2
第23页 第24页NH (g)=NH (l) ΔH=-c kJ·mol-1
3 3 3
写出N(g)和H(g)反应生成液氨的热化学方程式______________________________。
2 2
(4)已知:①HF(aq)+OH-(aq)=F-(aq)+HO(l) ΔH=-67.7 kJ·mol-1
2
②H+(aq)+OH-(aq)=H O(l) ΔH=-57.3 kJ·mol-1
2
试写出HF电离的热化学方程式_____________________________________________。
(5)SF 是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收
6
能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F(g)反应生成SF (g)
2 6
的热化学方程式___________________________________________。
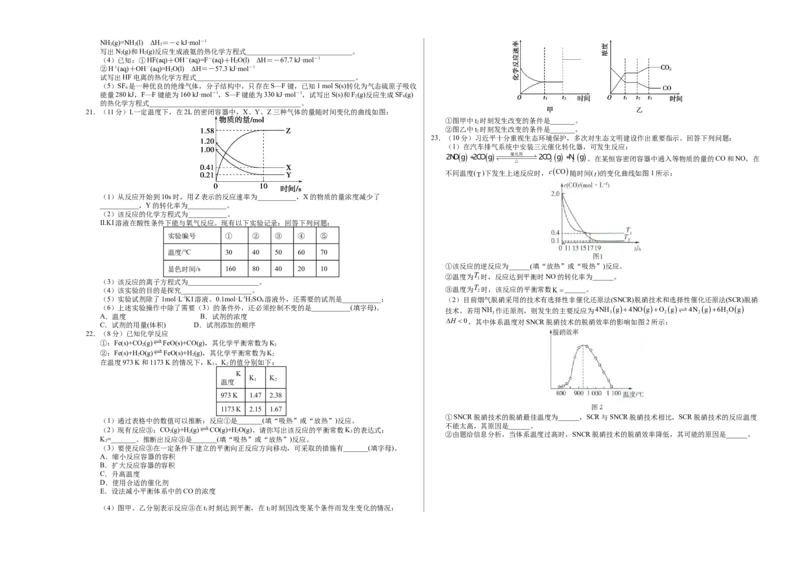
21.(11分)I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图:
①图甲中t 时刻发生改变的条件是_______。
2
②图乙中t 时刻发生改变的条件是_______。
2
23.(10分)习近平十分重视生态环境保护,多次对生态文明建设作出重要指示。回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:
催化剂
2NO g +2CO g △ 2CO
2
g +N
2
g 。在某恒容密闭容器中通入等物质的量的CO和NO,在
不同温度(T)下发生上述反应时,cCO
随时间(t)的变化曲线如图1所示:
(1)从反应开始到10s时,用Z表示的反应速率为___________,X的物质的量浓度减少了
___________,Y的转化率为___________。
(2)该反应的化学方程式为___________。
II.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
实验编号 ① ② ③ ④ ⑤
温度/℃ 30 40 50 60 70
①该反应的逆反应为______(填“放热”或“吸热”)反应。
显色时间/s 160 80 40 20 10
②温度为T 时,反应达到平衡时NO的转化率为______。
1
(3)该反应的离子方程式为____________________。
(4)该实验的目的是探究____________________。 ③温度为T 2 时,该反应的平衡常数K______。
(5)实验试剂除了1mol·L-1KI溶液、0.1mol·L-1HSO 溶液外,还需要的试剂是___________; (2)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催化还原法(SCR)脱硝
2 4
(6)上述实验操作中除了需要(3)的条件外,还必须控制不变的是___________(填字母)。 技术。若用NH 3 作还原剂,则发生的主要反应为4NH 3 g4NOgO 2 g 4N 2 g6H 2 Og
A.温度 B.试剂的浓度
H 0,其中体系温度对SNCR脱硝技术的脱硝效率的影响如图2所示:
C.试剂的用量(体积) D.试剂添加的顺序
22.(8分)已知化学反应
①:Fe(s)+CO (g)FeO(s)+CO(g),其化学平衡常数为K
2 1
②:Fe(s)+H O(g)FeO(s)+H (g),其化学平衡常数为K
2 2 2
在温度973 K和1173 K的情况下,K、K 的值分别如下:
1 2
K
K K
温度 1 2
973 K 1.47 2.38
1173 K 2.15 1.67
①SNCR脱硝技术的脱硝最佳温度为______,SCR与SNCR脱硝技术相比,SCR脱硝技术的反应温度
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
不能太高,其原因是______。
(2)现有反应③:CO(g)+H(g)CO(g)+HO(g),请你写出该反应的平衡常数K 的表达式:
2 2 2 3 ②由题给信息分析,当体系温度过高时,SNCR脱硝技术的脱硝效率降低,其可能的原因是______。
K=_______。推断出反应③是_______(填“吸热”或“放热”)反应。
3
(3)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有_______(填字母)。
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(4)图甲、乙分别表示反应③在t 时刻达到平衡,在t 时刻因改变某个条件而发生变化的情况:
1 2………………
○
………………
外
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
………………
○
………………
内
………………
○
………………
装
………………
○
………………
订
………………
○
………………
线
………………
○
………………
此
卷
只
装
订
不
密
封
第43页 第44页