文档内容
射洪中学高 2024 级高一上期第一学月考试
化学试题
考试时间:60分钟 满分:100分
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂
黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
第 I 卷(选择题)
一、选择题(1-8每题3分,9-14每题4分,共48分。)
1.化学与生活密切相关,下列过程中发生化学变化的是
A.利用金刚石切割大理石 B.利用醋去除茶壶内的水垢
C.利用活性炭去除冰箱异味 D.利用电厂余热集中供暖
2.下列分散系不能发生丁达尔现象的是
A.牛奶 B.有色玻璃 C.食盐水 D.烟、云、雾
3.适度饮水有益于健康,但过量饮水使体内电解质浓度过低导致生理紊乱而引起“水中
毒”,下列属于人体内常见电解质的是
A.CO B.NaCl C.BaSO D.葡萄糖
2 4
4.分类是科学研究的重要方法,下列物质分类不正确的是
A.纯净物:液氯、CuSO ·5H O
4 2
B.同素异形体:金刚石、石墨
C.酸性氧化物:SO 、CO
2 2
D.电解质:Cu、Na O
2
5、某植物用营养液含K+、Mg2+、Cl-、和M共4种离子,它们的个数之比为4:3:6:2,则M
有可能是
A.CO 2- B.SO 2- C.NO - D.OH-
3 4 3
6、Mg + H SO = MgSO + H ↑中电子转移的关系如图,则图中的甲、乙分别表示的元素为
2 4 4 2
A.Mg、S B.H、O C.Mg、H D.H、S
7、在溶液中能大量共存且溶液为无色透明的是
A.Ba2+、NO 、H+、SO B.K+、Cl-、CO 、Na+
C.H+、NO 、Na+、CO D.K+、MnO 、Na+、Cl-
高一化学 第 1 页 共 6 页8.下列反应可用离子方程式H++OH-=H O表示的是
2
A.CH COOH + NaOH = CH COONa + H O
3 3 2
B.Cu(OH) +2HCl=CuCl +2H O
2 2 2
C.Ba(OH) +H SO =BaSO ↓+2H O
2 2 4 4 2
D.2NaOH+H SO =Na SO +2H O
2 4 2 4 2
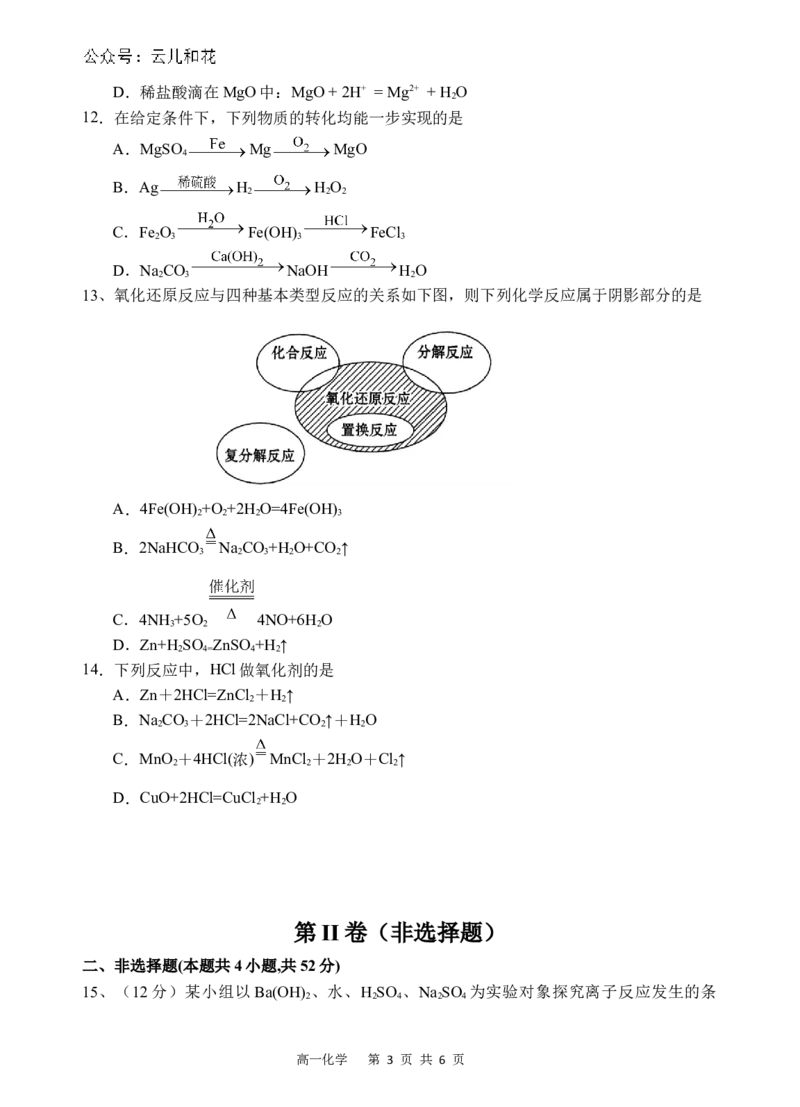
9.氯化钠是我们生活中必不可少的物质,图a、b、c为氯化钠在不同状态下导电实验图,
下列说法正确的是
A.固体 中不存在离子,不能导电
B.图c表示熔融状态的导电情况
C. 表示水合氯离子
D. 溶液能导电,是电解质
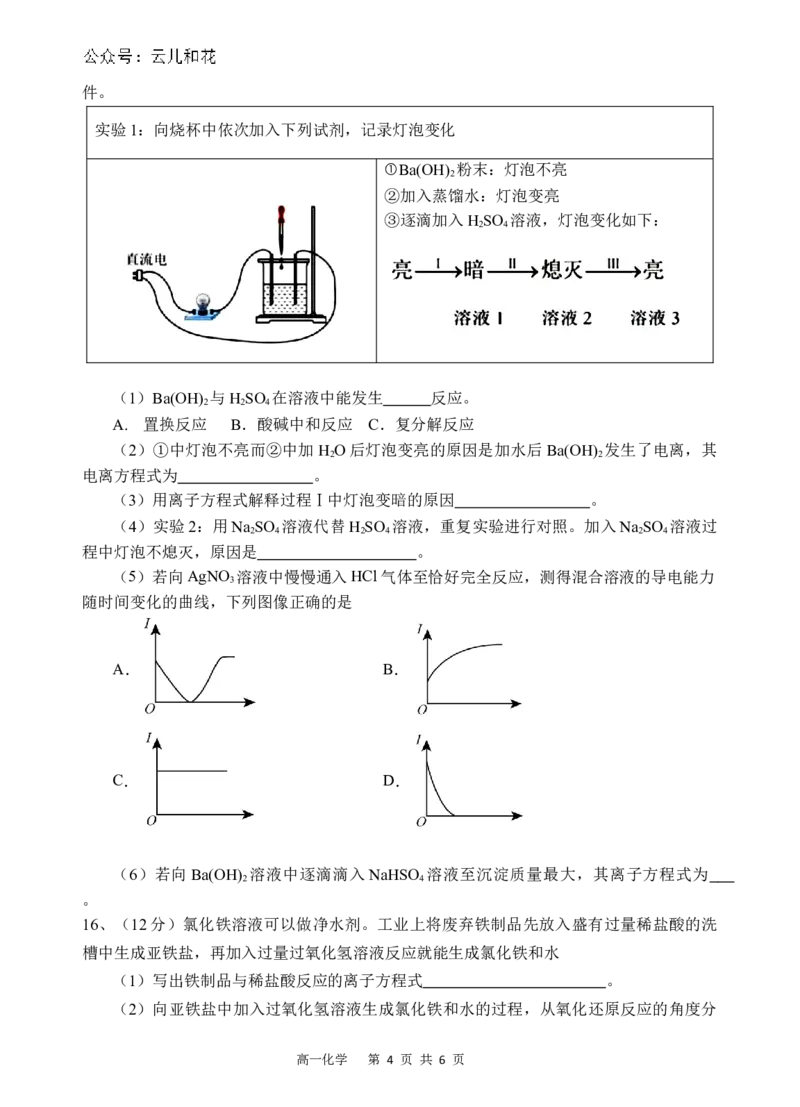
10、分类是一种重要的学习方法,物质的分类如图所示,下列说法正确的是
A.图甲所示的分类方法属于树状分类法
B.酸性氧化物一定是非金属氧化物
C.Fe(OH) 胶体属于碱
3
D.图甲中“........”包含混合物
11.下列反应的离子方程式书写正确的是
A.硫酸铜与氢氧化钡:Ba2+ + SO 2- = BaSO ↓
4 4
B.烧碱中通入过量CO :2OH- + CO = CO 2- + H O
2 2 3 2
C.小苏打NaHCO 中和胃酸(HCl):CO 2-+ 2H+ = CO ↑ + H O
3 3 2 2
高一化学 第 2 页 共 6 页D.稀盐酸滴在MgO中:MgO + 2H+ = Mg2+ + H O
2
12.在给定条件下,下列物质的转化均能一步实现的是
A.MgSO Mg MgO
4
B.Ag H H O
2 2 2
C.Fe O Fe(OH) FeCl
2 3 3 3
D.Na CO NaOH H O
2 3 2
13、氧化还原反应与四种基本类型反应的关系如下图,则下列化学反应属于阴影部分的是
A.4Fe(OH) +O +2H O=4Fe(OH)
2 2 2 3
B.2NaHCO Na CO +H O+CO ↑
3 2 3 2 2
C.4NH +5O 4NO+6H O
3 2 2
D.Zn+H SO ZnSO +H ↑
2 4= 4 2
14.下列反应中,HCl做氧化剂的是
A.Zn+2HCl=ZnCl +H ↑
2 2
B.Na CO +2HCl=2NaCl+CO ↑+H O
2 3 2 2
C.MnO +4HCl(浓) MnCl +2H O+Cl ↑
2 2 2 2
D.CuO+2HCl=CuCl +H O
2 2
第 II 卷(非选择题)
二、非选择题(本题共4小题,共52分)
15、(12分)某小组以Ba(OH) 、水、H SO 、Na SO 为实验对象探究离子反应发生的条
2 2 4 2 4
高一化学 第 3 页 共 6 页件。
实验1:向烧杯中依次加入下列试剂,记录灯泡变化
①Ba(OH) 粉末:灯泡不亮
2
②加入蒸馏水:灯泡变亮
③逐滴加入H SO 溶液,灯泡变化如下:
2 4
(1)Ba(OH) 与H SO 在溶液中能发生 反应。
2 2 4
A. 置换反应 B.酸碱中和反应 C.复分解反应
(2)①中灯泡不亮而②中加H O后灯泡变亮的原因是加水后Ba(OH) 发生了电离,其
2 2
电离方程式为 。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因 。
(4)实验2:用Na SO 溶液代替H SO 溶液,重复实验进行对照。加入Na SO 溶液过
2 4 2 4 2 4
程中灯泡不熄灭,原因是 。
(5)若向AgNO 溶液中慢慢通入HCl气体至恰好完全反应,测得混合溶液的导电能力
3
随时间变化的曲线,下列图像正确的是
A. B.
C. D.
(6)若向Ba(OH) 溶液中逐滴滴入NaHSO 溶液至沉淀质量最大,其离子方程式为
2 4
。
16、(12分)氯化铁溶液可以做净水剂。工业上将废弃铁制品先放入盛有过量稀盐酸的洗
槽中生成亚铁盐,再加入过量过氧化氢溶液反应就能生成氯化铁和水
(1)写出铁制品与稀盐酸反应的离子方程式 。
(2)向亚铁盐中加入过氧化氢溶液生成氯化铁和水的过程,从氧化还原反应的角度分
高一化学 第 4 页 共 6 页析,过氧化氢起到了 作用。
(3)某课外活动小组用氯化铁制备氢氧化铁胶体,并检验相关性质。
①判断FeCl 溶液的稳定性 氢氧化铁胶体(填“强于”或“弱于”)。
3
②将饱和FeCl 溶液滴入沸水中,继续加热直到红褐色,停止加热,所得分散系即为
3
Fe(OH) 胶体,写出反应的化学方程式 。
3
③区别FeCl 溶液和Fe(OH) 胶体最简单的方法 。
3 3
④关于制备的Fe(OH) 胶体,下列说法正确的是
3
A. Fe(OH) 胶体是电解质
3
B. Fe(OH) 胶体中的分散质粒子直径范围在1nm-100nm
3
C. 用滤纸将Fe(OH) 胶体过滤,烧杯中溶液为无色
3
17、(12分)由工业明胶制成的胶囊往往含有超标的重金属铬(Cr),从而对人体造成伤
害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO ) 中铬元素是+3价,则其中铁元素的化合价是 。CrO -是
2 2 2
一种酸根离子,则Fe(CrO ) 属于 (“酸”、“碱”、“盐”、“氧化物”)
2 2
(2)关于氧化还原反应:4Na FeO + 10H O = 8NaOH + 4Fe(OH) ↓+ 3 X
2 4 2 3
①X的化学式 。
②Na FeO 在该反应中做 ,Fe(OH) 是 (填字母)
2 4 3
A. 氧化剂 B.还原剂 C.氧化产物 D.还原产物
(3)用双线桥法标出电子转移的方向及数目
2H S + SO = 3S↓ + 2H O
2 2 2
18、(16分)利用分类法研究化学物质可系统、全面地认识物质的性质
(1)下列三组物质,均有一种物质的类别与其他三种不同。
①MgO 、Na O、CO 、CuO ②HCl、H O、H SO 、HNO ③NaOH、Na CO 、KOH
2 2 2 2 4 3 2 3
、Cu(OH)
2
三种物质依次是① ② ③ (填化学式)
(2)①Al②稀盐酸③ 固体④ ⑤ 固体⑥熔融态 ,以上物质
中属于能导电的电解质的是 (填编号)。
(3)在一条鱼、 虾绝迹的小河边有四座工厂
甲、乙、丙、丁(如 图),每个工厂只排放溶质
为 Na CO 、CuCl 、 Ca(OH) 、HCl 中的一种的
2 3 2 2
高一化学 第 5 页 共 6 页废液。某中学环保小组对河水监测时发现:①甲处河水呈乳白色,②乙处河水呈浅蓝色浑
浊③丙处河水由浑浊变澄清④丁处产生气泡,河水仍澄清,试推断:
(ⅰ)工厂排出的废液中含有的污染物乙是 (填化学式)。
(ⅱ)写出④中有关反应的离子方程式 。
(4)X、Y、Z中物质有如下转化关系:
根据上述转化关系,写出下列物质的化学式:X 、试剂乙 。
高一化学 第 6 页 共 6 页