文档内容
2024-2025 学年第一学期高一期中学情调研测试
化学试题
试卷满分:100分 考试时间:75分钟
可能用到的相对原子质量:H1 C12 O16 N14 Na23 S32 Cl35.5
单项选择题(共39分)
1.“加碘食盐”中加入的含碘物质是碘酸钾( ),它属于( )
A.酸 B.碱 C.盐 D.氧化物
2.下列化学用语表示正确的是( )
A. 中氧的化合价为-2
B.氧原子的结构示意图:
C. 的摩尔质量为:18g/mol
D.NaClO的电离方程式:
3.下列实验方法或操作正确的是( )
A.检验 B.制蒸馏水 C.分离水和酒精 D.稀释浓硫酸
4.铋(Bi)在医药方面有重要应用。下列关于 的说法不正确的是( )
A.质量数为209 B.中子数为209
C.电子数为83 D. 与 为同位素
5.下列溶液中的 物质的量浓度最大的是( )
A. 溶液 B. 溶液
C. 溶液 D. 溶液
阅读下列资料,完成6~8题:钠及其化合物应用广泛,Na与 反应可制得Ti, 可用作供氧剂和漂白剂,NaOH、
、 都是重要的化工原料。
6.下列物质的性质与用途具有对应关系的是( )
A.Na具强还原性,可用于制备Ti
B. 呈淡黄色,可用作呼吸面具中的供氧剂
C. 易溶于水,可用于去除物品表面的油污
D.钠钾合金能导电,可用作快中子反应堆的热交换剂
7.下列关于 和 的叙述中正确的是( )
A.两种溶液可以用澄清石灰水鉴别
B.常温下, 固体在水中溶解量更多
C.向 和 固体中分别滴加相同浓度的盐酸,后者反应更剧烈
D.将等质量 和 固体粉末置于大试管中充分加热, 剩余质量更多
8.下列物质的转化在给定条件下能实现的是( )
A. B.
C. D.
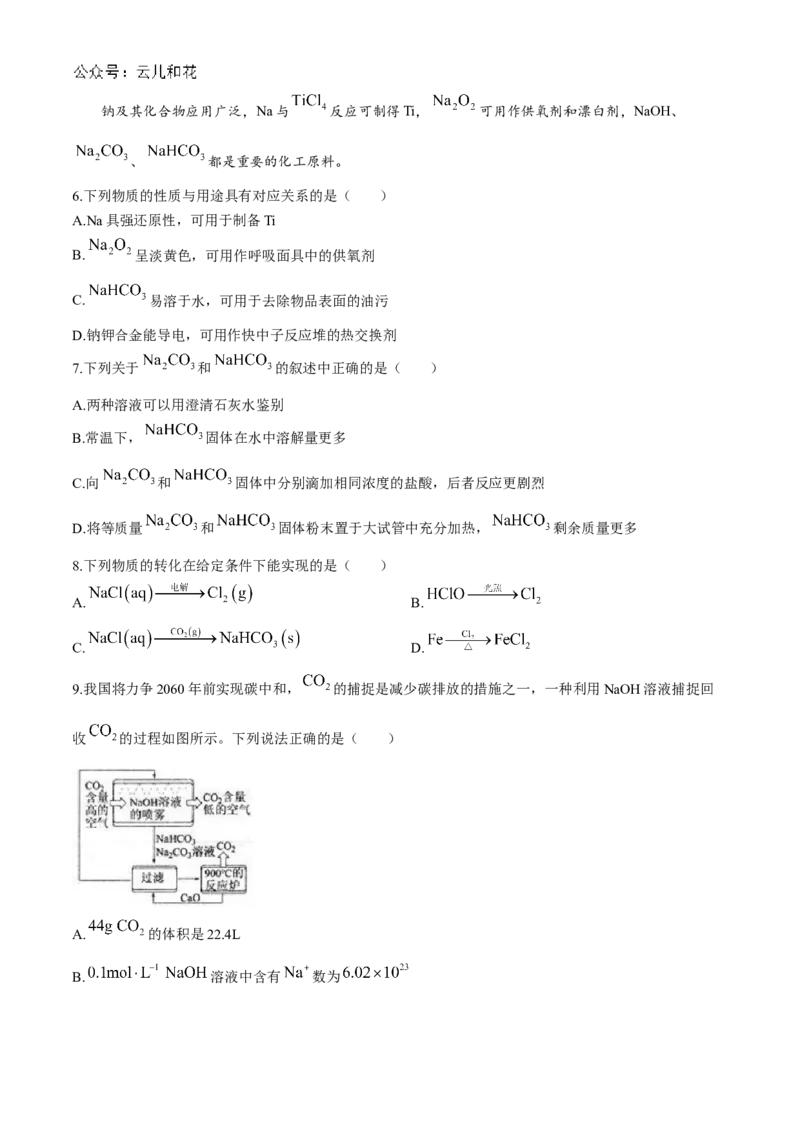
9.我国将力争2060年前实现碳中和, 的捕捉是减少碳排放的措施之一,一种利用NaOH溶液捕捉回
收 的过程如图所示。下列说法正确的是( )
A. 的体积是22.4L
B. 溶液中含有 数为C.该流程可实现全部回收
D.捕捉 时NaOH溶液常喷成雾状,是为了增大接触面积,使反应更快,更充分
10.实验室欲配制 的NaCl溶液。下列操作及误差分析正确的是( )
A.用托盘天平称取5.85gNaCl固体
B.定容时俯视容量瓶刻度线,所得溶液浓度偏高
C.加水时不慎超过了刻度线,用胶头滴管直接吸出多余液体
D.使用容量瓶时,容量瓶内留有水分未干燥,所得溶液浓度偏低
11.次磷酸钠( )可以用于镀铜,发生反应的离子方程式为
。下列说法正确的是( )
A. 中P元素被还原 B. 在反应中失去电子
C.Cu为还原产物 D.每有 参加反应则转移0.4mol电子
12.下列实验方案可行的是( )
选项 实验目的 实验方案
A 测定新制氯水pH值 蘸取氯水点在pH试纸上,与比色卡对照
B
除去 中的杂质HCl
将混合气体通入NaOH溶液洗气
加入稀的NaOH溶液并加热,将湿润的蓝色石蕊试纸靠近试
C
检验溶液中是否有 管口,观察试纸是否变红。
D
检验溶液中是否有 先加稀盐酸无明显现象,再加 溶液,观察是否有沉淀
13.将 加氢制甲醇( ),可实现 资源化利用和“零碳”排放,其转化流程如右图所示。
下列说法不正确的是( )
A.反应①中,电解水生成的 和 的物质的量之比为2:1
B.反应②中,生产 理论上要消耗标准状况下
C.转化过程中, 和 循环转化,无需额外补充D.制取等质量的甲醇时消耗的 与燃烧时生成的 相等,实现“零碳”排放
非选择题(61分)
14.(16分)
Ⅰ.每年10月23日上午6:02到晚上6:02被誉为“摩尔日”(MoleDay),这个时间的美式写法为6:02
10/23,外观与阿伏伽德罗常数 相似。试用物质的量的相关知识回答以下问题:
(1) 个 的质量为_______g, 中含有的质子个数约为_______。
(2)标准状况下,6.4g某气体的体积是8.96L,则此气体的相对分子质量为_______。
Ⅱ.现有以下物质:
①NaOH溶液;②液氨;③ 固体;④熔融 ;⑤铜;
其中属于属于电解质的_______(填序号);能导电的是_______(填序号)。
Ⅲ.已知: 。
(1)用“单线桥”在化学方程式中标出电子转移的方向和数目。
(2)若参加反应的 的物质的量为0.1mol,则产生标准状况下氯气的体积为_______L,被氧化的
HCl质量为_______g。
15.(14分)碳酸钠可作为基准物质用于定量分析,也可作制备过碳酸钠的原料。
Ⅰ.实验室某瓶碳酸钠溶液瓶体部分标签如图所示。
试剂名称: 溶液
【溶质】
【 摩尔质量】106g/mol
【质量分数】10.6%
【密度】1g/mL
某实验需用 的 溶液,现用该“ 溶液”配制,需要用量筒量取该“
溶液”的体积为_______mL。在配制过程中,除需要量筒、烧杯、玻璃棒外还必需的玻璃仪器有
_______。
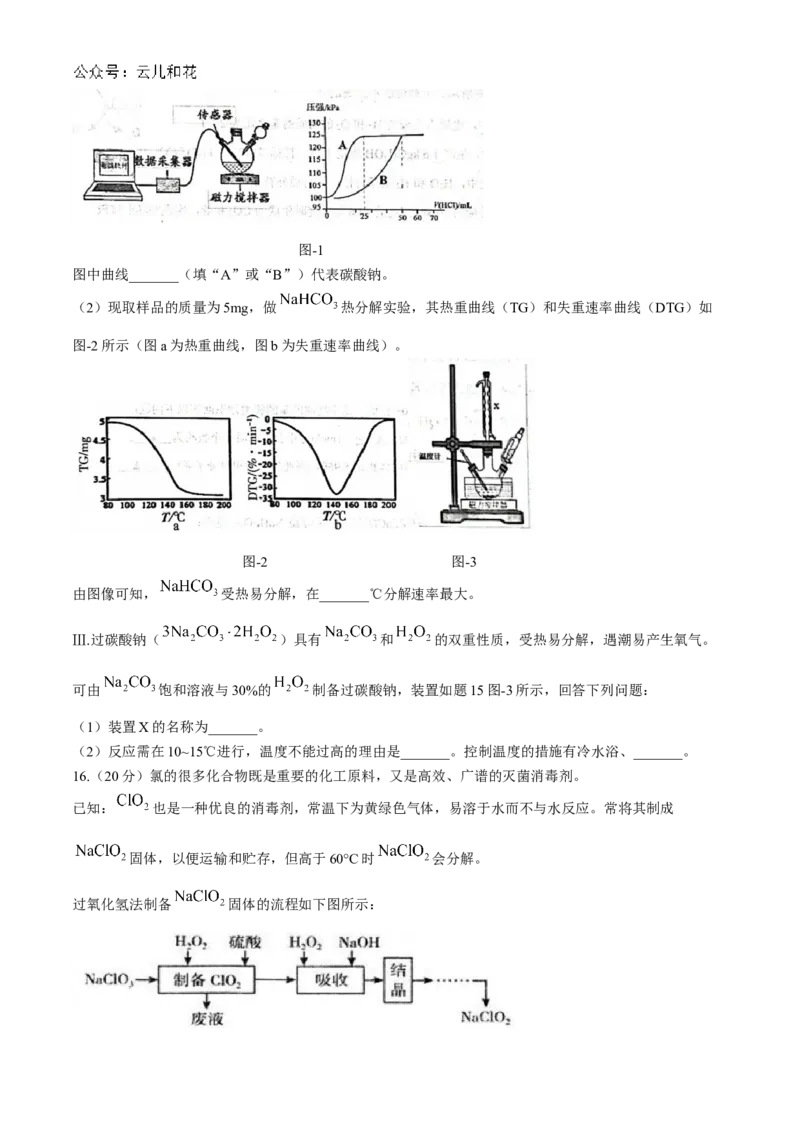
Ⅱ.数字实验能更清晰地的呈现实验现象。为认识碳酸钠和碳酸氢钠性质做如下实验:
(1)分别取 的 和 溶液,用分液漏斗缓慢滴加 的稀盐酸,
用压强传感器测定容器中的压强变化如图-1所示。图-1
图中曲线_______(填“A”或“B”)代表碳酸钠。
(2)现取样品的质量为5mg,做 热分解实验,其热重曲线(TG)和失重速率曲线(DTG)如
图-2所示(图a为热重曲线,图b为失重速率曲线)。
图-2 图-3
由图像可知, 受热易分解,在_______℃分解速率最大。
Ⅲ.过碳酸钠( )具有 和 的双重性质,受热易分解,遇潮易产生氧气。
可由 饱和溶液与30%的 制备过碳酸钠,装置如题15图-3所示,回答下列问题:
(1)装置X的名称为_______。
(2)反应需在10~15℃进行,温度不能过高的理由是_______。控制温度的措施有冷水浴、_______。
16.(20分)氯的很多化合物既是重要的化工原料,又是高效、广谱的灭菌消毒剂。
已知: 也是一种优良的消毒剂,常温下为黄绿色气体,易溶于水而不与水反应。常将其制成
固体,以便运输和贮存,但高于60°C时 会分解。
过氧化氢法制备 固体的流程如下图所示:(1) 的氯元素化合价为_______。
(2)“废液”中回收得到的主要物质是_______(填化学式)。
(3)在“制备 ”流程中, 也可改用其他物质代替,最宜选用_______。
A. B.酸性高锰酸钾 C.金属锌
(4)流程中所需的 可由 、 与酸反应制得。实验室通过上述某种过氧化物与适量稀硫
酸反应,过滤后即可制得较纯净的 溶液,则最好选择的过氧化物是_______。
(5)关于上述流程出现物质和操作,下列说法正确的是_______。
A. 与氯气从颜色上难以区分 B. 可以用向下排空气法收集
C.在“吸收”流程中, 作还原剂 D.“结晶”可采用蒸发结晶法
(6) 也可制得一种有效成分为 、 、 的“二氧化氯泡腾片”,能快速
溶于水,得到 溶液,并溢出大量气泡。
①上述过程中,溢出大量气泡的离子方程式是_______。
②生成 的离子方程式为: ,每生成 转移电子的物
质的量为_______mol。
③ 在杀菌消毒过程中会产生副产物NaClO,实验室可用 与NaClO反应将其转化为NaCl而除去,
其反应的化学方程式为_______。
(7)国家对饮用水中 的含量有具体要求,实验室通过 滴定法测定含氯消毒剂消毒后的饮用水
中 含量,具体操作如下:准确移取25.00mL饮用水样品溶液于锥形瓶中,加入5%的 溶液作指
示剂,用 的 标准溶液滴定至终点,共消耗 标准溶液12.50mL。该饮用水样
品中 为_______ 。(写出计算过程)
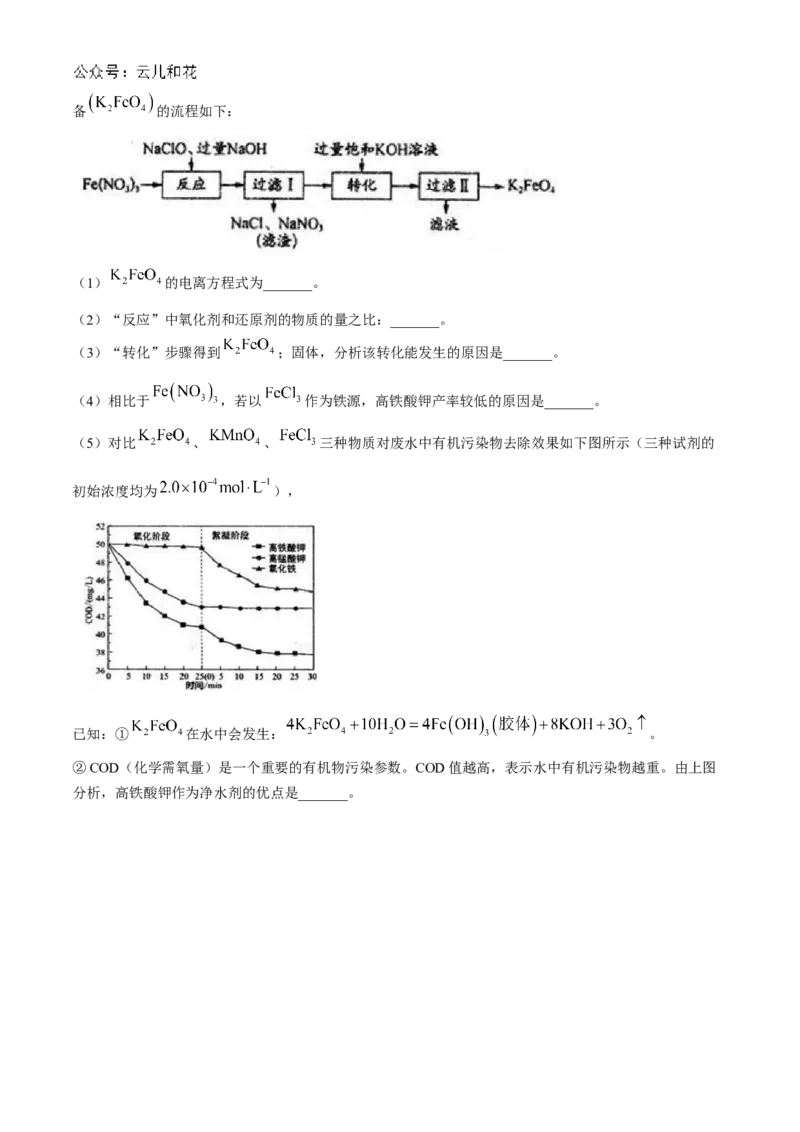
17.(11分)高铁酸钾( )是一种新型、高效、多功能净水剂。它能溶于水,微溶于KOH浓溶液,
具有强氧化性,其氧化性强于 。在酸性或中性溶液中快速分解,在碱性溶液中较稳定。工业上湿法制备 的流程如下:
(1) 的电离方程式为_______。
(2)“反应”中氧化剂和还原剂的物质的量之比:_______。
(3)“转化”步骤得到 ;固体,分析该转化能发生的原因是_______。
(4)相比于 ,若以 作为铁源,高铁酸钾产率较低的原因是_______。
(5)对比 、 、 三种物质对废水中有机污染物去除效果如下图所示(三种试剂的
初始浓度均为 ),
已知:① 在水中会发生: 。
②COD(化学需氧量)是一个重要的有机物污染参数。COD值越高,表示水中有机污染物越重。由上图
分析,高铁酸钾作为净水剂的优点是_______。化学试题答案
题号 1 2 3 4 5 6 7 8 9 10 11 12 13
答案 C D A B B A C A D B C D C
14.(每空2分,共16分)
Ⅰ.(1)8.5 (2)16
Ⅱ.③④ ①④⑤
Ⅲ.(1)
(2)6.72 21.9
15.(每空2分。共14分)
Ⅰ 50.0(答50也给分) 500mL容量瓶、胶头滴管
Ⅱ(1)B(2) 140
Ⅲ(1)球形冷凝管(答冷凝管也给分)
(2)防止过氧化氢分解;缓慢滴加过氧化氢溶液或搅拌;
16.(除特殊说明,每空2分,共20分)
(1)+3 (2) (3)a (4) (5)ac
(6)① ②1 ③
(7) (2分)
(2分)
17.(除特殊说明,每空2分,共11分)
(1)
(2)3:2(3分)
(3) 在浓KOH中的溶解度较小
(4) 和 发生副反应造成反应物的量减少,或答生成的 会氧化 ,造成高铁酸钾产率下
降(答对一点给全分)
(5)高铁酸钾中铁的价态为+6价,具有强氧化性,能杀菌消毒;生成的 (胶体)具有吸附性,
能吸附水中的悬浮颗粒,达到净水的目的。(强氧化性与吸附性加上相应文字说明各1分)
(答案仅供参考,其他合理答案也给分