文档内容
班级 姓名 学号 分数
第 06 单元 化学反应与能量
(B 卷•提升能力)
(时间:90分钟,满分:100分)
一、选择题(本题共16小题,每小题3分,共48分)
1.下列说法正确的是( )
A.化学键的变化必然会引起能量变化,所以能量变化也一定会引起化学变化
B.所有化学变化的能量都可以通过原电池转化为电能
C.所有化学变化一定遵循质量守恒和能量守恒
D.化学变化一定会引起物质种类的变化,所以反应体系内物质种类变化一定是发生化学变化
2.一种环保型燃料——丙烷,其燃烧时发生反应的化学方程式为 C H +5O――→3CO +4HO。下列说
3 8 2 2 2
法中不正确的是( )
A.火炬燃烧时化学能只转化为热能
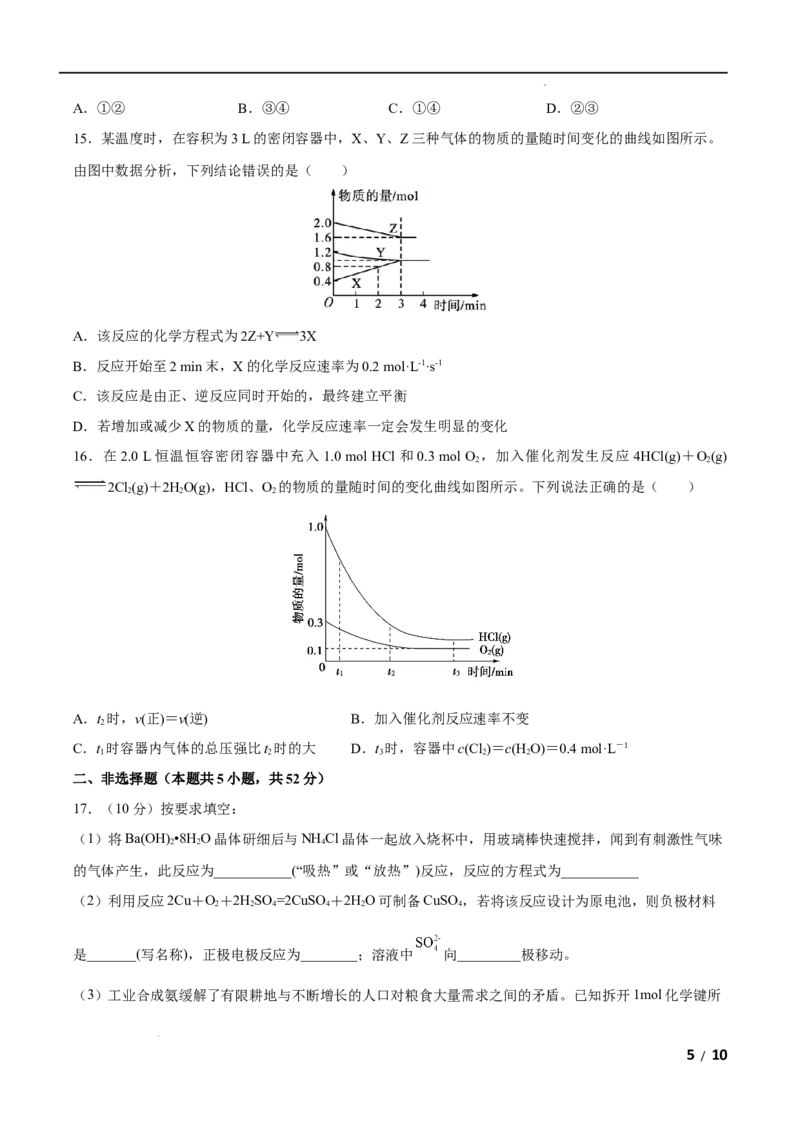
B.所有的化学反应都会伴随着能量变化,有能量变化的物质变化不一定是化学反应
C.1 mol C H 和5 mol O 所具有的总能量大于3 mol CO 和4 mol H O所具有的总能量
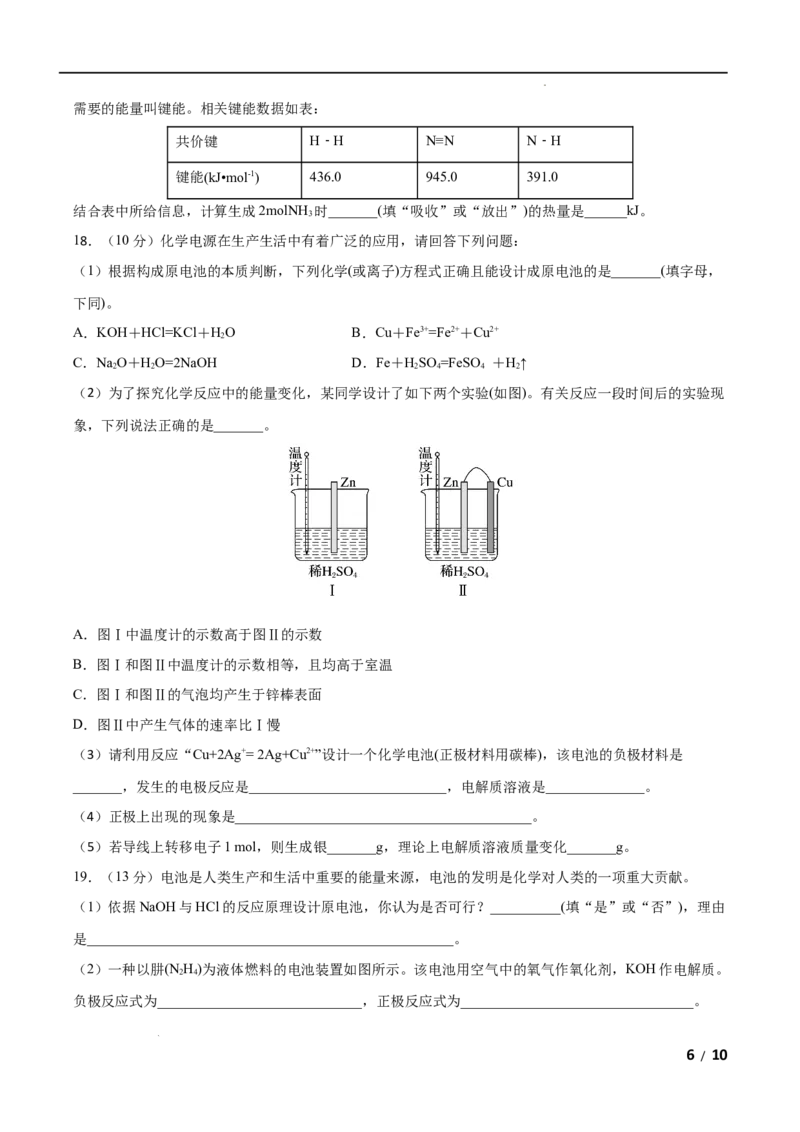
3 8 2 2 2
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
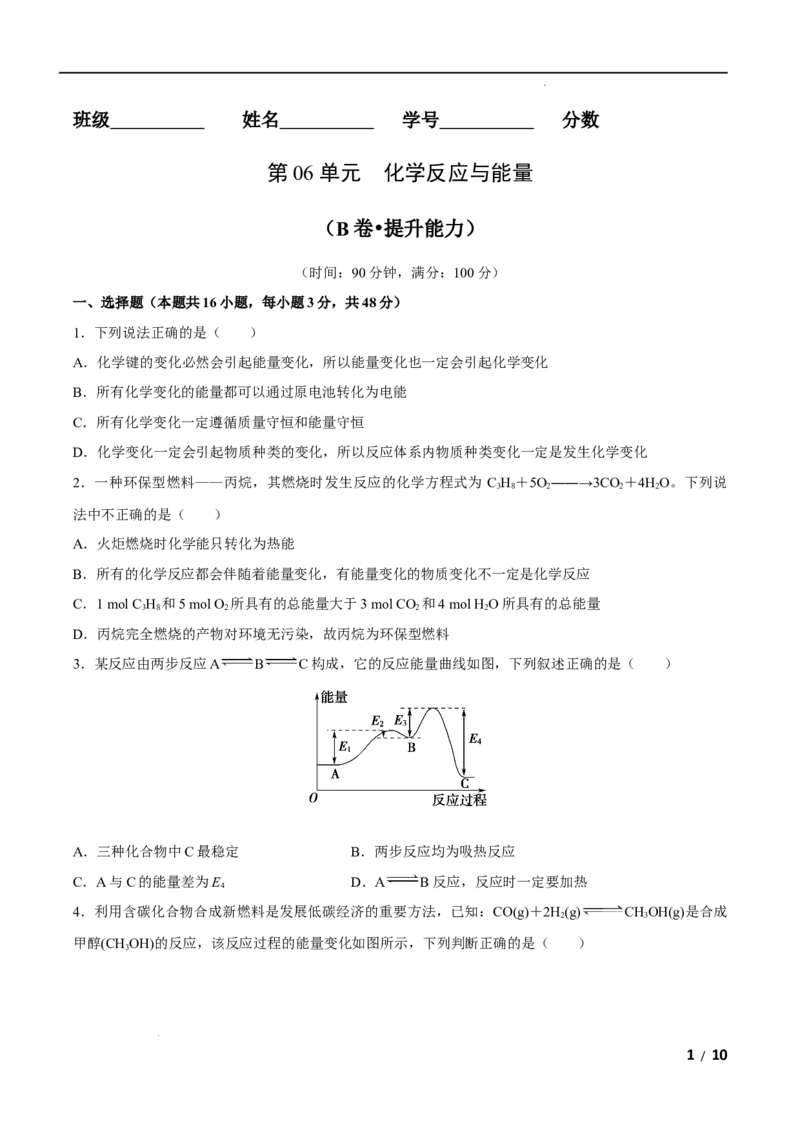
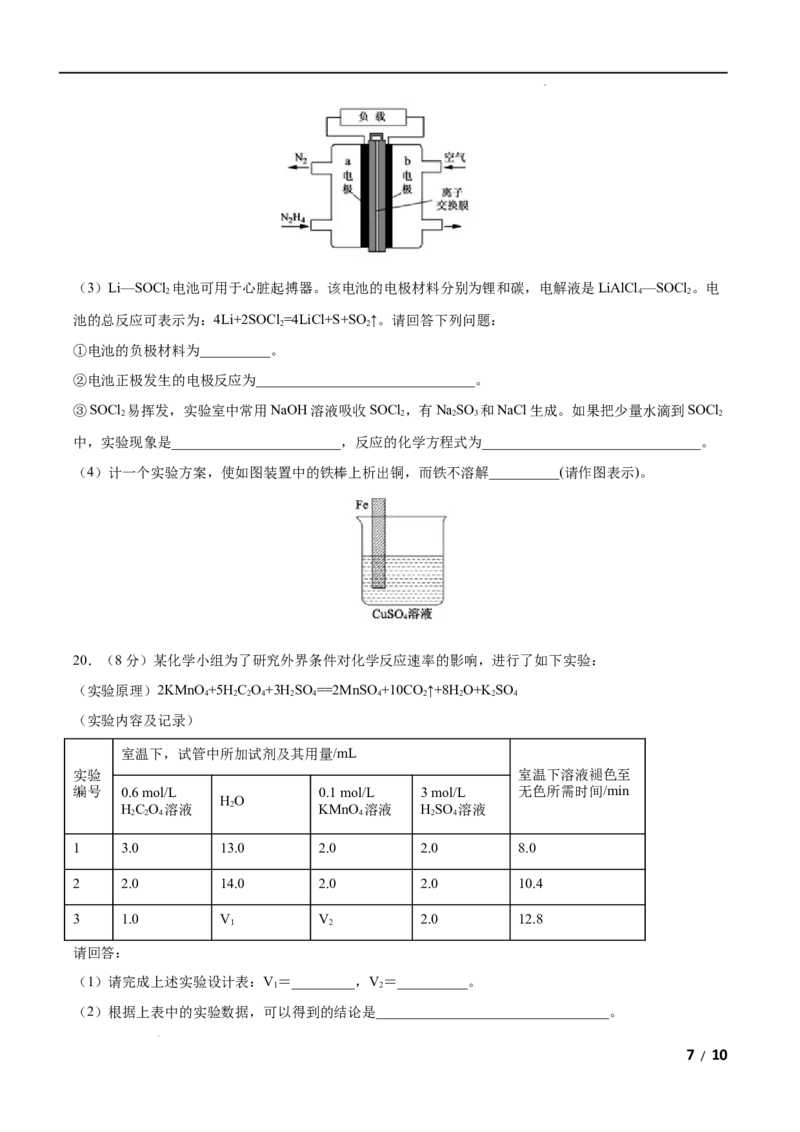
3.某反应由两步反应A B C构成,它的反应能量曲线如图,下列叙述正确的是( )
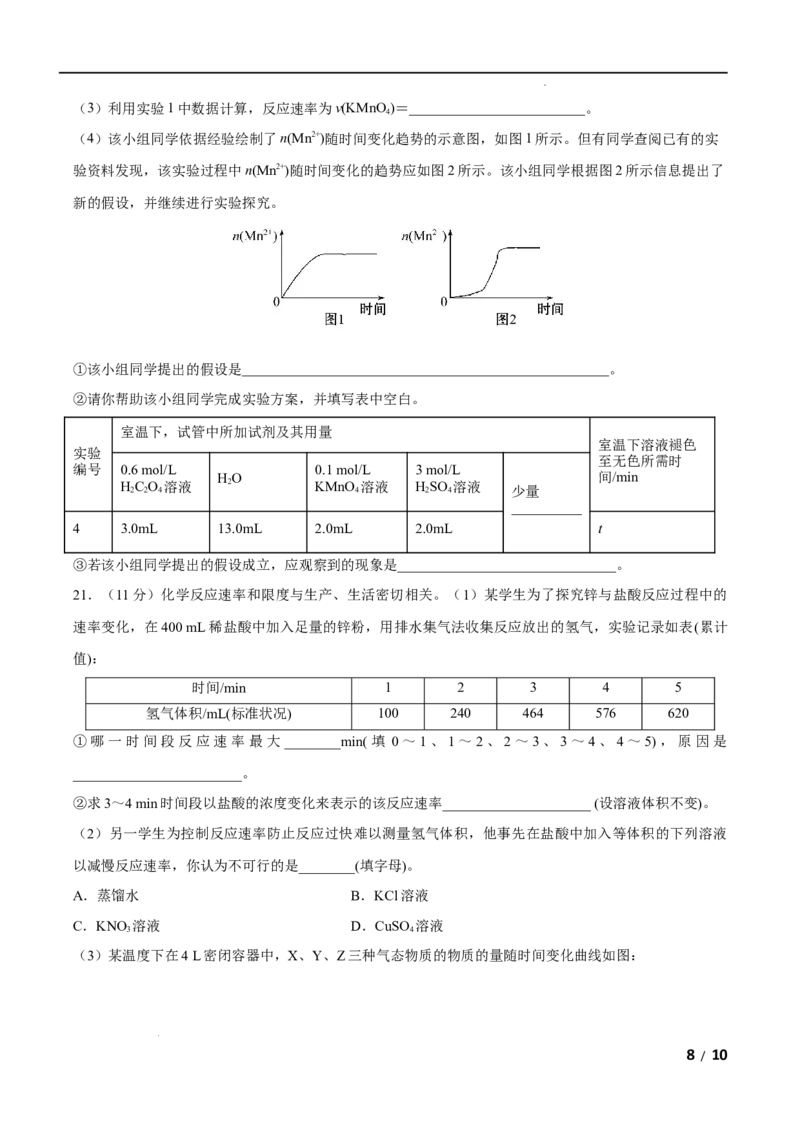
A.三种化合物中C最稳定 B.两步反应均为吸热反应
C.A与C的能量差为E D.A B反应,反应时一定要加热
4
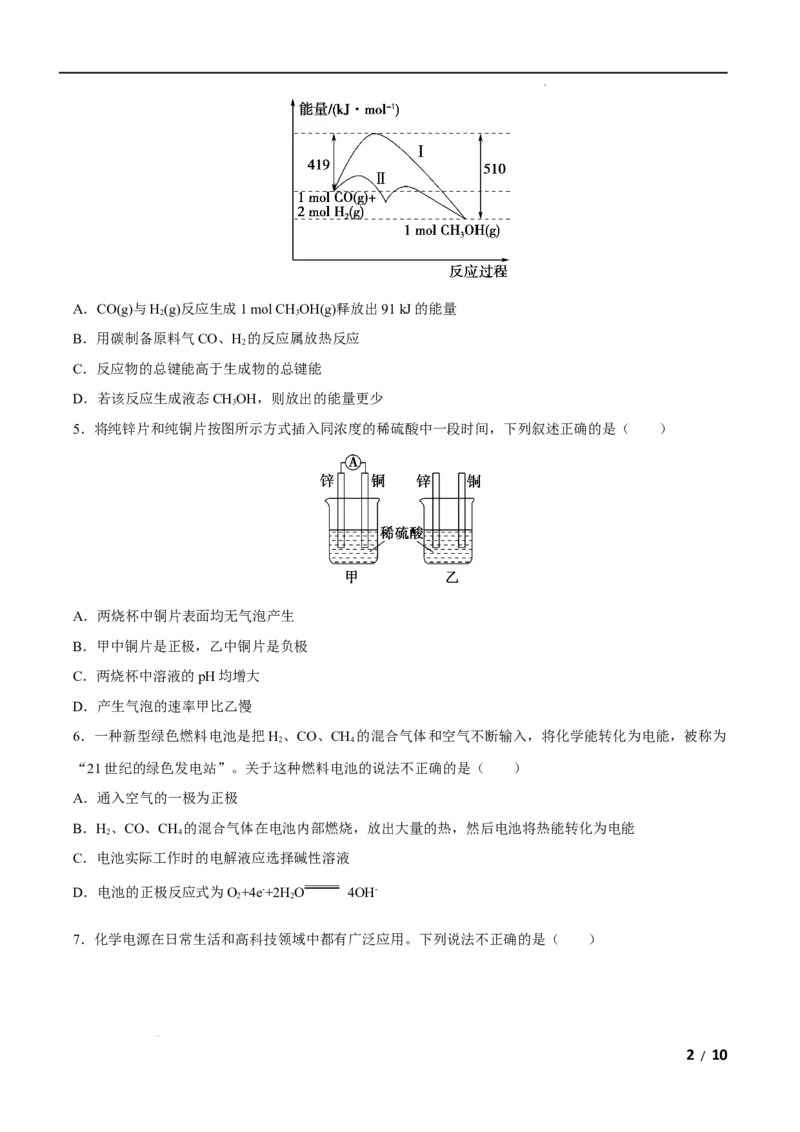
4.利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知:CO(g)+2H(g) CHOH(g)是合成
2 3
甲醇(CHOH)的反应,该反应过程的能量变化如图所示,下列判断正确的是( )
3
1 / 10
学科网(北京)股份有限公司A.CO(g)与H(g)反应生成1 mol CH OH(g)释放出91 kJ的能量
2 3
B.用碳制备原料气CO、H 的反应属放热反应
2
C.反应物的总键能高于生成物的总键能
D.若该反应生成液态CHOH,则放出的能量更少
3
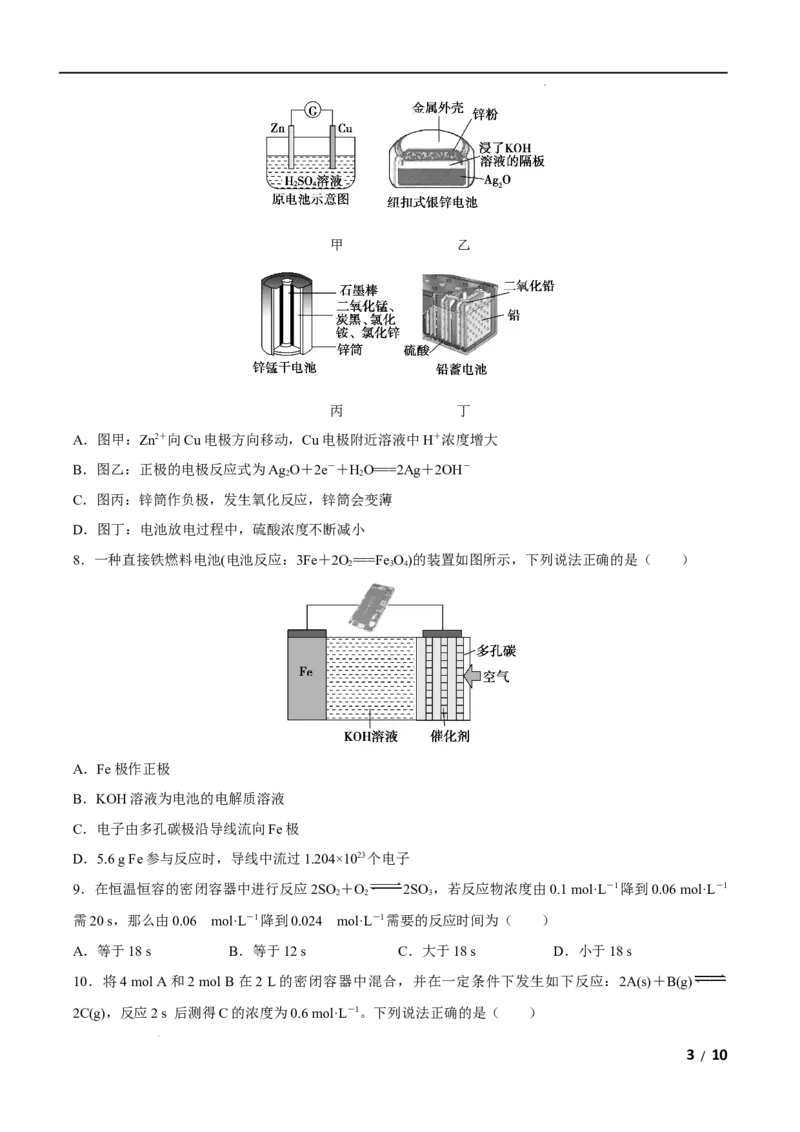
5.将纯锌片和纯铜片按图所示方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
6.一种新型绿色燃料电池是把H 、CO、CH 的混合气体和空气不断输入,将化学能转化为电能,被称为
2 4
“21世纪的绿色发电站”。关于这种燃料电池的说法不正确的是( )
A.通入空气的一极为正极
B.H、CO、CH 的混合气体在电池内部燃烧,放出大量的热,然后电池将热能转化为电能
2 4
C.电池实际工作时的电解液应选择碱性溶液
D.电池的正极反应式为O+4e-+2H O 4OH-
2 2
7.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
2 / 10
学科网(北京)股份有限公司甲 乙
丙 丁
A.图甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增大
B.图乙:正极的电极反应式为Ag O+2e-+HO===2Ag+2OH-
2 2
C.图丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.图丁:电池放电过程中,硫酸浓度不断减小
8.一种直接铁燃料电池(电池反应:3Fe+2O===Fe O)的装置如图所示,下列说法正确的是( )
2 3 4
A.Fe极作正极
B.KOH溶液为电池的电解质溶液
C.电子由多孔碳极沿导线流向Fe极
D.5.6 g Fe参与反应时,导线中流过1.204×1023个电子
9.在恒温恒容的密闭容器中进行反应2SO +O 2SO ,若反应物浓度由0.1 mol·L-1降到0.06 mol·L-1
2 2 3
需20 s,那么由0.06 mol·L-1降到0.024 mol·L-1需要的反应时间为( )
A.等于18 s B.等于12 s C.大于18 s D.小于18 s
10.将4 mol A和2 mol B在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(s)+B(g)
2C(g),反应2 s 后测得C的浓度为0.6 mol·L-1。下列说法正确的是( )
3 / 10
学科网(北京)股份有限公司A.用物质A表示2 s内的平均反应速率为0.3 mol·L-1·s-1
B.用物质B表示2 s内的平均反应速率为0.6 mol·L-1·s-1
C.2 s时v(C)=0.3 mol·L-1·s-1
D.2 s时物质B的浓度为0.7 mol·L-1
11.NO 和 CO 都是汽车尾气里的有害物质,它们能缓慢地反应生成氮气和二氧化碳气体:2NO+
2CO===N +2CO。对此反应,下列叙述正确的是( )
2 2
A.使用催化剂能加快反应速率
B.压强增大不影响化学反应速率
C.冬天气温低,反应速率降低,对人体危害减小
D.无论外界条件怎样改变,均对此化学反应的速率无影响
12.硫代硫酸钠溶液与稀硫酸反应的化学方程式为NaSO+H SO NaSO +SO↑+S↓+H O,下列各组实
2 2 3 2 4 2 4 2 2
验中最先出现浑浊的是( )
NaSO 溶液 稀硫酸 HO
2 2 3 2
实验
反应 V/mL c/(mol·L-1) V/mL c/(mol·L-1) V/mL
A 25 5 0.1 10 0.1 5
B 25 5 0.2 5 0.2 10
C 35 5 0.1 10 0.1 5
D 35 5 0.2 5 0.2 10
13.把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速
率的主要因素是( )
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
14.一定条件下,对于反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c 、c 、c(均不为零)。
1 2 3
达平衡时,X、Y、Z 浓度分别为 0.1 mol·L-1、0.3 mol·L-1和 0.08 mol·L-1,则下列判断不合理的是
( )
①c∶c =1∶3 ②平衡时,Y和Z的生成速率之比为2∶3 ③平衡时X和Y的转化率不相等 ④c 的取
1 2 1
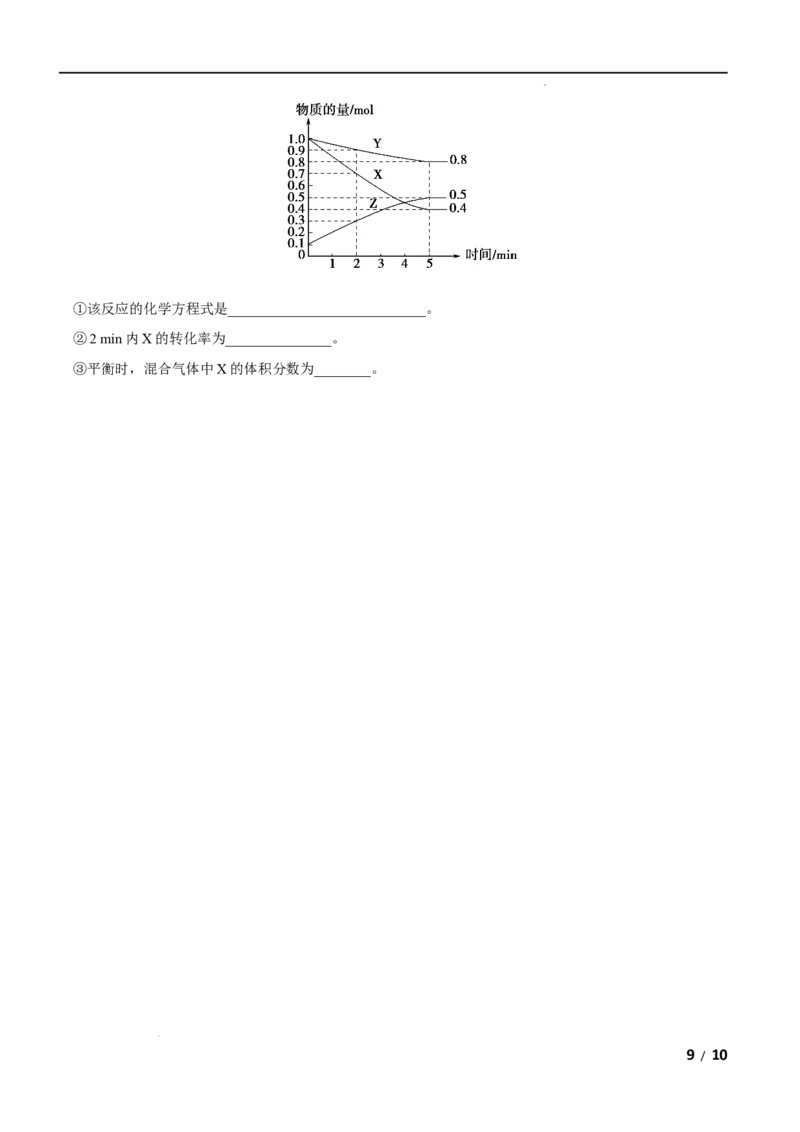
值范围为0