文档内容
高一 12 月学情检测
化学试题
试卷满分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1 O-16 Na-23 S-32 K-39 Fe-56 Cl-35.5
I卷(选择题,共42分)
选择题:共14题,每题3分,共42分。每小题只有一个选项最符合题意。
1. 我国承诺在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当,下列措施不利于实现
“碳中和”的是( )
A. 研究CO2 转化为淀粉的技术 B. 加强CO2 的捕集和再利用
C. 践行节能低碳的生活方式 D. 加大化石能源的消费比重
2. 反应NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓可用于联合制碱。下列说法正确的是( )
A. 氯离子的结构示意图: B. 中子数为10的氧原子:
C. 反应体系中核外电子总数相等 微粒只有NH3 和
D. NaHCO3 电离方程式:NaHCO3=Na++H++
3. 下列制取、净化Cl2 、验证其氧化性并进行尾气吸收的装置和原理能达到实验目的的是( )
A B C D
制取Cl2 除去HCl 验证Cl2 氧化性 吸收尾气
A. A B. B C. C D. D
4.下列物质属于电解质的是( )A. Mg B. SO2 C.乙醇 D.HCl
5.实验室制取少量 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
A.用装置甲制取 气体 B.用装置乙制取 水溶液
C.用装置丙吸收尾气中的 D.用干燥pH试纸检验 水溶液的酸性
6.下列有关物质性质与用途具有对应关系的是( )
A.NaHCO 受热易分解,可用于制胃酸中和剂
3
B.NaSO 具有还原性,可用于废水脱氯(Cl)
2 3 2
C. 浓硫酸具有脱水性,可作气体干燥剂
D.Al O 是两性氧化物,可用作耐高温材料
2 3
7. 下列说法正确 是( )
A. 常温常压下,17g OH- 中含有电子总数为10mol
B. 5.6g铁粉和氯气完全反应时失去的电子数为0.2mol
C. 0.2mol/LAlCl3 溶液中Cl- 物质的量为0.6mol
D. 7.8gNa2O2 中含有阴阳离子的总数为0.4mol
8. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 将SO2 通入酸性高锰酸钾溶液,溶液褪色 SO2 具有漂白性
B 将除去氧化膜的铝片放入浓硫酸中,无明显现象 常温下铝和浓硫酸不反应
取少量食盐样品,溶于水,向其中加入淀粉溶液, 该食盐样品中没有添加
C
溶液不变蓝 KIO3
D
取少量Na2SO3 固体样品配成溶液,加入足量盐酸酸
该Na2SO3 样品变质化,再加氯化钡溶液,有白色沉淀产生
A A B. B C. C D. D
9. 下列指定反应的离子方程式正确的是( )
A. 向NaClO溶液中通入少量SO2 :2ClO-+SO2+H2O=2HClO+
B. 向水中加入金属钠:2Na+2H2O=2OH-+2Na++H2↑
C. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH++H++SO =BaSO4↓十H2O
10. 以菱镁矿(主要成分为MgCO3 ,含少量FeCO3 等物质) 为原料制备MgCl2 ·6H2O的实验流程如下图所
示。下列说法正确的是( )
A. MgCO3 与稀盐酸反应的离子方程式为CO +2H+ = CO2↑+H2O
B. 氧化过程说明氧化性: Cl2>Fe3+
C. “沉铁”后的溶液中大量存在Mg2+ 、NH 、OH- 、Cl-
D. 蒸干并灼烧MgCl2 溶液可获得MgCl2 ·6H2O
11. 在给定条件下,下列制备过程涉及的物质转化均可实现的是( )
A. HCl制备: 溶液 和
B. 金属Mg制备: 溶液
C. 纯碱工业: 溶液
D. 硫酸工业:
12. 下列图示的实验或操作正确的是( )A. 酿制的米酒获取酒精用装置① B. 检测氯水的pH用装置②
C. 分离出碘 CCl4 溶液用装置③ D. 装置④是萃取振荡时放气
13. 据史料记载,我国在明代就有了利用绿矾FeSO4·7H2O和硝酸钾制备硝酸的工艺,其主要流程如图所示。
已知“煅烧”后产生SO2 、SO3 和H2O三种气体。
下列说法不正确的是( )
A. 将煅烧产生的三种气体通入BaCl2 溶液,产生两种白色沉淀
B. 煅烧过程中铁元素的化合价升高
C. “吸收”过程中发生的氧化还原反应为2SO2+2H2O+O2=2H2SO4
D. 加入硝酸钾制得硝酸是因为硫酸的沸点高于硝酸
14. 海水资源综合利用的部分过程如下图所示,下列说法正确的是( )
→制盐工业:粗盐→精盐→饱和食盐水→氯碱工业
海
→制溴工业:
水
→制镁工业:
A. 工业上通过电解饱和食盐水制备金属钠和氯气
B. 制溴工业中用SO2 水溶液吸收溴蒸汽,生成HBr和H2SO3
C. 在制溴工业中,通过氧化、还原、再氧化的步骤实现了溴的富集
D. 在制镁工业中,工业常NaOH溶液作为Mg2+ 沉淀剂
Ⅱ卷(选择题,共58分)
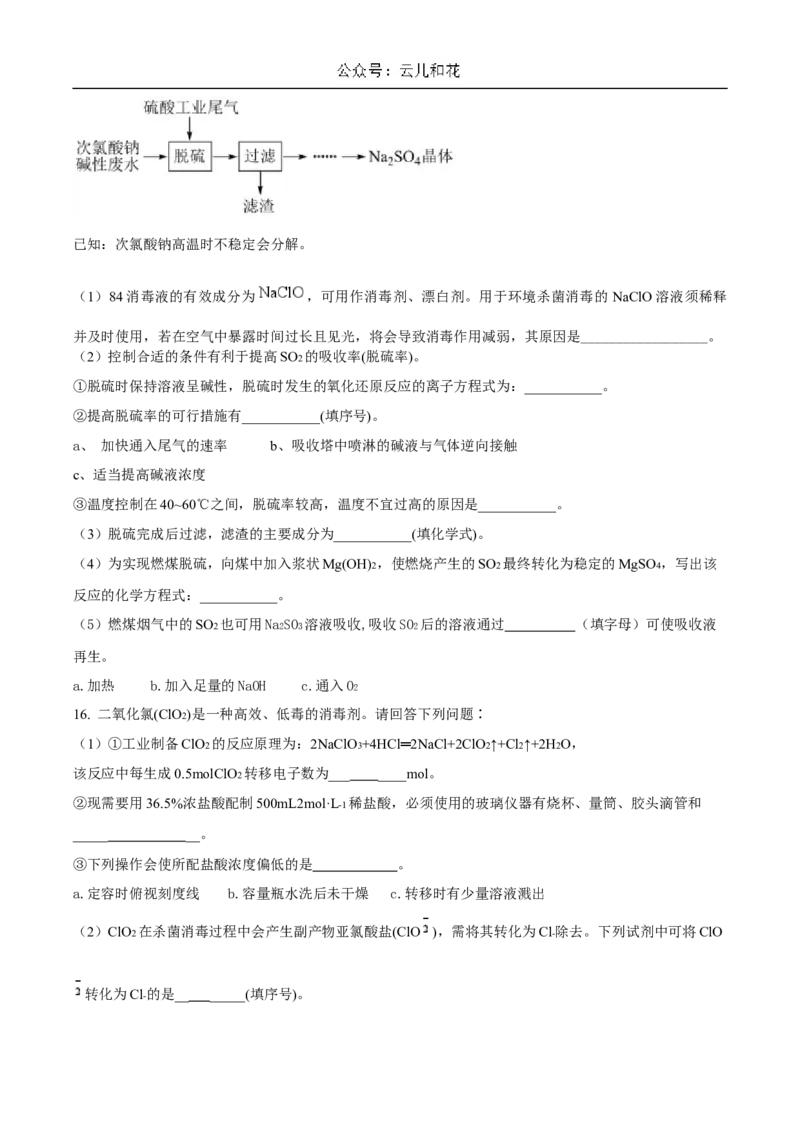
15. 由次氯酸钠碱性废水(含有杂质Ca2+)处理硫酸工业尾气的流程如下:已知:次氯酸钠高温时不稳定会分解。
(1)84消毒液的有效成分为 ,可用作消毒剂、漂白剂。用于环境杀菌消毒的 NaClO溶液须稀释
并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是__________________。
(2)控制合适的条件有利于提高SO2 的吸收率(脱硫率)。
①脱硫时保持溶液呈碱性,脱硫时发生的氧化还原反应的离子方程式为:___________。
②提高脱硫率的可行措施有___________(填序号)。
a、 加快通入尾气的速率 b、吸收塔中喷淋的碱液与气体逆向接触
c、适当提高碱液浓度
③温度控制在40~60℃之间,脱硫率较高,温度不宜过高的原因是___________。
(3)脱硫完成后过滤,滤渣的主要成分为___________(填化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 ,使燃烧产生的SO2 最终转化为稳定的MgSO4 ,写出该
反应的化学方程式:___________。
(5)燃煤烟气中的SO2 也可用Na
2
SO
3
溶液吸收,吸收SO
2
后的溶液通过 (填字母)可使吸收液
再生。
a.加热 b.加入足量的NaOH c.通入O
2
16. 二氧化氯(ClO2)是一种高效、低毒的消毒剂。请回答下列问题∶
(1)①工业制备ClO2 的反应原理为:2NaClO3+4HCl═2NaCl+2ClO2↑+Cl2↑+2H2O,
该反应中每生成0.5molClO2 转移电子数为___ ____mol。
②现需要用36.5%浓盐酸配制500mL2mol·L-1 稀盐酸,必须使用的玻璃仪器有烧杯、量筒、胶头滴管和
_____ __。
③下列操作会使所配盐酸浓度偏低的是 。
a.定容时俯视刻度线 b.容量瓶水洗后未干燥 c.转移时有少量溶液溅出
(2)ClO2 在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl- 除去。下列试剂中可将ClO
转化为Cl- 的是__ _____(填序号)。A.O2 B. KI C.KMnO4 D.SO2
(3)用ClO2 处理过的饮用水常含有一定量有害的ClO2 。我国规定饮用水中ClO2 的含量在0.1~0.8mg·L-1 。
测定水样中ClO2 的含量的过程如下:
步骤1:量取25.00mL水样加入锥形瓶中;
步骤2:用稀H2SO4 调节溶液呈酸性,加入足量的KI晶体充分反应;
步骤3:逐滴加入2.00×10-3mol·L-1 的Na2S2O3 溶液,恰好完全反应时,消耗Na2S2O3 溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI,根据上述数据计算并
判断该水样中ClO2 的含量是否符合国家规定。_______(请写出计算过程)
Ⅰ
17. 和 在生活、生产中有着广泛的应用,以氯化钠为原料制备 和
的部分工艺流程如下:
(1)海水晒盐获得的粗盐中含有杂质 ,需要进行粗盐的精制。实验过程如下:
称取一定质量的粗盐,加水充分溶解,向所得溶液中依次加入稍过量的NaOH溶液、甲溶液、乙溶液,过滤;
向滤液中加入足量盐酸,蒸发结晶,制得精盐。甲溶液为____ _______溶液(填化学式)。实验中不取
样出来进行分析,判断NaOH溶液加入量己“稍过量”的实验方法及现象是_______
____。
(2)反应I过滤所得的 需要洗涤、干燥。其中检验 是否洗涤干净的操作是
___________ 。
(3)处理母液的两种方法:
方法一:向母液中加入石灰乳,发生反应生成的_____ (填化学式)可循环利用。
方法二:向母液中加入细小的食盐颗粒并降温,可得到 晶体,加入食盐的目的是____。
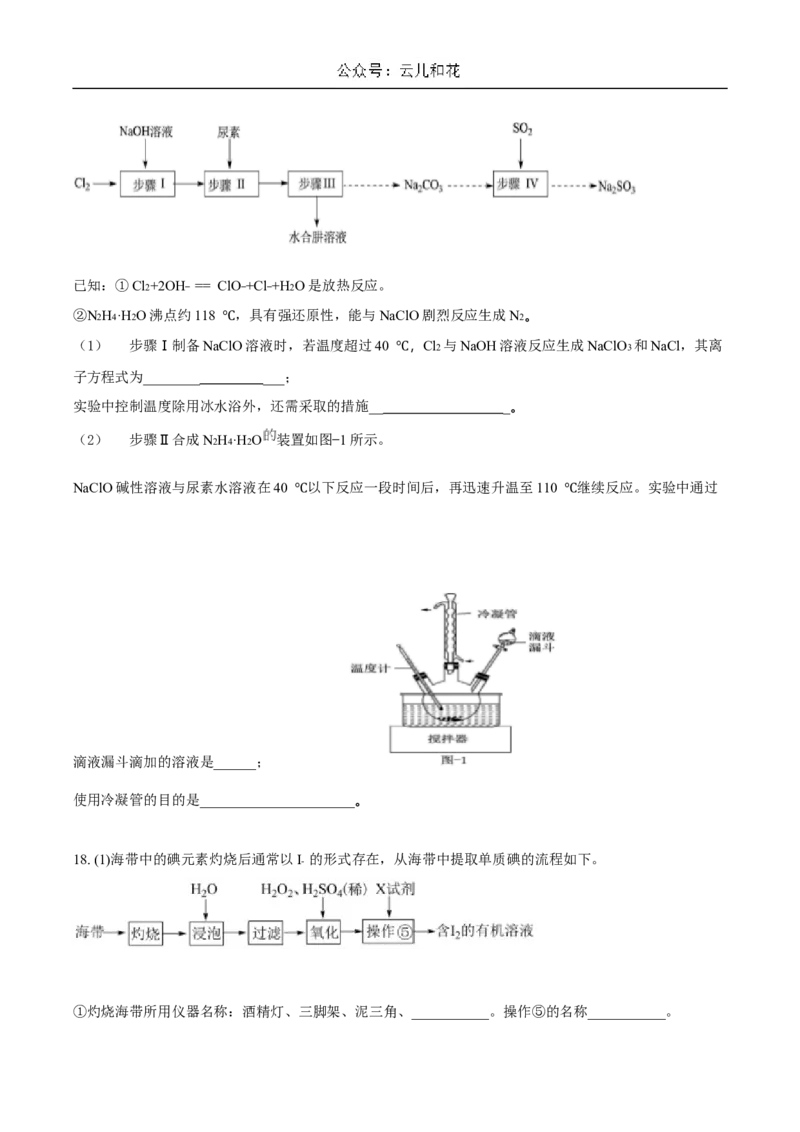
Ⅱ. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2 为原料可制备N2H4·H2O(水合肼)和无水Na2SO3 ,其主要
实验流程如下:已知:①Cl2+2OH− == ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ,具有强还原性,能与NaClO剧烈反应生成N2。
(1) 步骤Ⅰ制备NaC℃lO溶液时,若温度超过40 ,Cl2 与NaOH溶液反应生成NaClO3 和NaCl,其离
子方程式为________ ___; ℃
实验中控制温度除用冰水浴外,还需采取的措施__ _。
(2) 步骤Ⅱ合成N2H4·H2O 装置如图−1所示。
NaClO碱性溶液与尿素水溶液在40 以下反应一段时间后,再迅速升温至110 继续反应。实验中通过
℃ ℃
滴液漏斗滴加的溶液是______;
使用冷凝管的目的是______________________。
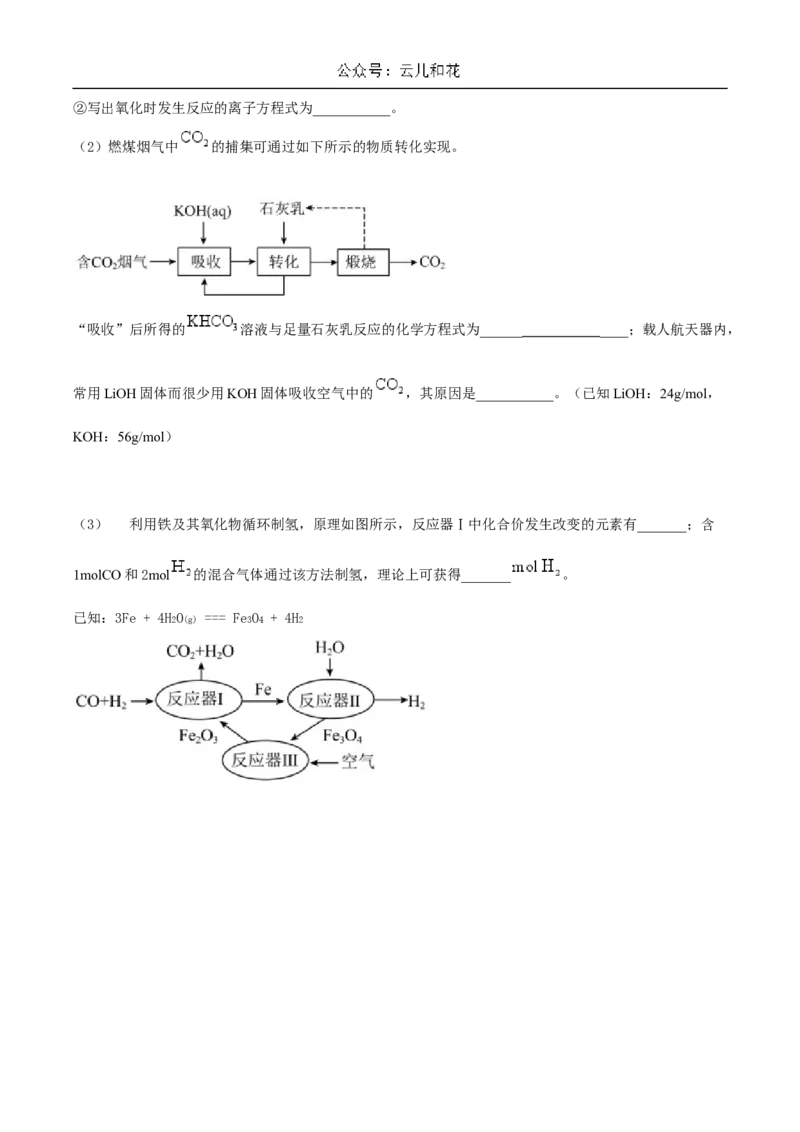
18. (1)海带中的碘元素灼烧后通常以I- 的形式存在,从海带中提取单质碘的流程如下。
①灼烧海带所用仪器名称:酒精灯、三脚架、泥三角、___________。操作⑤的名称___________。②写出氧化时发生反应的离子方程式为___________。
(2)燃煤烟气中 的捕集可通过如下所示的物质转化实现。
“吸收”后所得的 溶液与足量石灰乳反应的化学方程式为______ ____;载人航天器内,
常用LiOH固体而很少用KOH固体吸收空气中的 ,其原因是___________。(已知LiOH:24g/mol,
KOH:56g/mol)
(3) 利用铁及其氧化物循环制氢,原理如图所示,反应器Ⅰ中化合价发生改变的元素有_______;含
1molCO和2mol 的混合气体通过该方法制氢,理论上可获得_______ 。
已知:3Fe + 4H O === Fe O + 4H
2 (g) 3 4 2化学答案
选择题(42分)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D B C D C B A D B B A C A C
非选择题(58分)
计算题4分,其余每空均2分,选择有错0分,漏1分,方程式系数错1分
o、 (1)NaClO溶液吸收空气中的CO2 后产生HClO,HClO见光分解
(2) ClO- +SO2 +2OH-=Cl- + +H2O bc
① ②
温度过高,SO2 溶解度小,次氯酸钠不稳定会分解
(3)③CaSO4 (4)O2 +2SO2 +2Mg(OH)2=2MgSO4 +2H2O (5)a b
16.(1) 0.5 玻璃棒、500mL容量瓶 c (2) BD
(3) ①n(Na2S2O3)=②2.00×10-3mol·L-1×20.00×10-3L=4③.00×10-5mol
ClO2~5Na2S2O3
n(ClO2)=1/5n(Na2S2O3)=4.00×10-5×1/5mol=8.00×10-6mol
ClO2 的含量为 =21.6 mg·L-1>0.8 mg·L-1 ,不符合
17.Ⅰ(1)BaCl 静置,向上层清液中继续滴加NaOH溶液,若无白色沉淀出现则已稍过量
2
(2)取少许最后一次洗涤滤液于试管中,滴加HNO 酸化的AgNO 溶液,若无白色沉淀生成,则说明洗涤干
3 3
净
(3) 降低 的溶解度
Ⅱ(1) 3Cl2+6OH− 5Cl−+ClO3−+3H2O 缓慢通入Cl2
(2) NaClO碱性溶液 减少水合肼的挥发
18.(1) . 坩埚 萃取(萃取、分液) 2I-+H2O2+2H+=I2+2H2O
① ②
(2)
相同质量的LiOH固体可吸收更多二氧化碳
(3) C、H、Fe 8/3