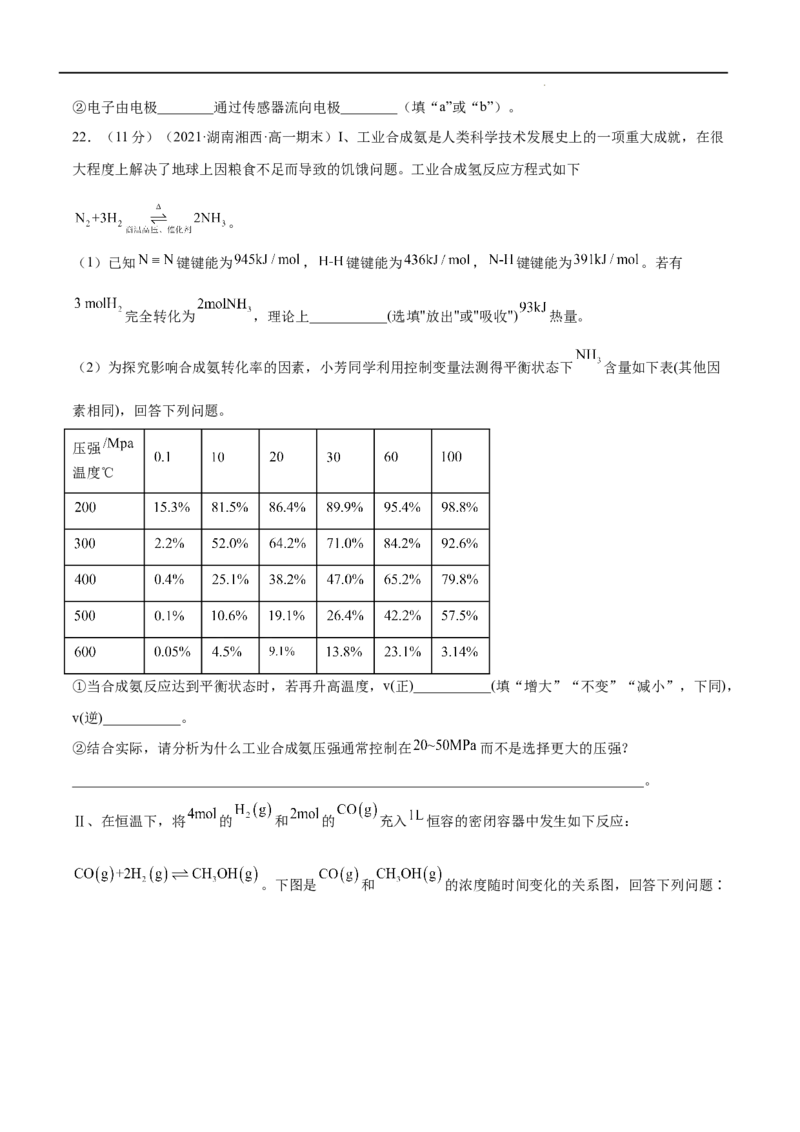文档内容
班级 姓名 学号 分数
第 06 单元 化学反应与能量
(A卷·夯实基础)
(时间:75分钟,满分:100分)
一、选择题(本题共18小题,每小题3分,共54分)
1.关于能源和能量转化,下列说法正确的是
A.太阳能电池的能量转化:光能→化学能→电能
B.生物光合作用中的能量转化:光能(太阳能)→生物质能(化学能)
C.化学反应过程中,除了物质变化外,可能伴有能量变化
D.燃气灶具中的能量转化:化学能全部转化为热能
2.(2021·浙江高一月考)下列有关化学反应限度的说法不正确的是( )
A.任何可逆反应的进程都有一定限度
B.化学反应的限度决定了反应物在该条件下转化为生成物的最大转化率
C.化学平衡状态是指一定条件下进行的可逆反应达到的最大限度
D.化学反应的限度不可以通过改变条件而改变
3.(2021·吉林·敦化市实验中学校高一期末)中国新一代运载火箭“长征七号”,已于2016年6月25首
飞。火箭所需要的巨大能量由特制的燃料来提供,有关燃料燃烧过程中的变化,下列说法不正确的是
A.所有的燃烧过程均是放热的
B.需要点燃才能发生的燃烧过程是吸热的
C.所有燃料在燃烧过程中均会发生化学键的断裂
D.燃烧后产物的总能量一定小于反应物的总能量
4.下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀 反应
B. 与 的反应
C.灼热的炭与 反应
D.甲烷在 中的燃烧反应
学科网(北京)股份有限公司5.石墨在一定条件下可转化为金刚石,已知12g石墨完全转化为金刚石时,要吸收QkJ的热量,下列说法
正确的是
A.石墨不如金刚石稳定
B.金刚石与石墨的结构是相同的
C.等物质的量的石墨与金刚石完全燃烧,金刚石放出的热量多
D.等物质的量的石墨与金刚石完全燃烧,石墨放出的热量多
6.最近,科学家用巨型计算机进行模拟后确认,由60个N原子可结合成N 分子,N 变成N 时放出巨大
60 60 2
能量,下列说法中不正确的是
A.N 与N 都是氮的同素异形体
60 2
B.N 转化为N 属化学变化
60 2
C.N 的总能量高于N 的总能量
60 2
D.N 变为N 的反应是放热反应,说明N 比N 更稳定
60 2 60 2
7.已知H+Cl―→HCl并放出a kJ的热量,下列叙述中正确的是( )
A.HCl分子内每个原子都达到了8电子稳定结构
B.HCl分子的能量比H、Cl原子的能量之和低
C.1 mol HCl断键成1 mol H、1 mol Cl要释放出a kJ热量
D.氢原子和氯原子靠电子得失形成共价键
8.(2021·河南商丘·高一期末)金属镁和铝设计成如图所示的原电池。下列说法正确的是
A.铝作该原电池的负极
B.溶液中 向 极移动
C. 电极的电极反应式为
D.电流方向为 A
9.把锌片、铜片用导线连接后插入硫酸铜溶液中,当电路中有0.4mol电子通过时,负极的质量变化是
A.减少13g B.增加6.5g C.增加13g D.减少11.2g
10.下列电池工作时,O 在正极得电子的是( )
2
学科网(北京)股份有限公司A B C D
锌锰电池 铅蓄电池 氢氧燃料电池 镍镉电池
11.有a、b、c、d四种金属电极,有关的实验装置及部分实验现象如下:
实验装置
部分实验 a极质量减小,b极质 b极有气体产生,c极 d极溶解,c极有气体 电流从a极流向
现象 量增大 无变化 产生 d极
由此可判断这四种金属的活动性顺序是
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
12.已知反应 ,在不同条件下,用不同物质表示其反应速率,分别为
①
②
③
④
则此反应在不同条件下进行最快的是
A.②③ B.①③ C.②④ D.②
13.下列设计的实验方案能达到相应实验目的的是
选项 实验目的 实验方案
取5mL 0.1mol/L KI溶液,滴加0.1mol/L FeCl 溶液5~6滴,充分反应,可
A 探究化学反应的限度 3
根据溶液中既含I 又含I-的实验事实判断该反应是可逆反应
2
比较Mg与Al的金
B 常温下,将Mg、Al与NaOH溶液组成原电池
属活动性
学科网(北京)股份有限公司探究不同催化剂对同 相同条件下,向两支盛有等体积等浓度HO 溶液的试管中分别滴入5滴等
C 2 2
一反应速率的影响 浓度的CuSO 溶液和FeCl 溶液
4 3
探究浓度对化学反应 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解
D
速率的影响 完
14.一定温度下,向一恒容密闭容器中充入2 mol SO 和1 mol O ,在一定条件下发生反应:
2 2
2SO (g)+O(g) 2SO (g),下列有关说法正确的是( )
2 2 3
A.当O 的浓度⇌不变时,反应达到平衡状态
2
B.达到化学平衡时,正反应和逆反应的速率相等且都为零
C.当单位时间内消耗a mol O,同时消耗2a mol SO 时,反应达到平衡状态
2 2
D.当SO 、O、SO 的分子数之比为2:1:2时,反应达到平衡状态
2 2 3
15.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒
定温度下使其达到分解平衡HNCOONH (s) 2NH (g)+CO (g)。能判断该反应已经达到化学平衡的是
2 4 3 2
①v(NH )正=2v(CO )逆
3 2
②密闭容器中总压强不变
③密闭容器中混合气体的密度不变
④密闭容器中混合气体的平均相对分子质量不变
⑤密闭容器混合气体的总物质的量不变
⑥密闭容器中CO 的体积分数不变
2
⑦混合气体总质量不变
A.①②④⑤⑦ B.①②③⑤⑦ C.①④⑤⑥⑦ D.②③④⑤⑥
16.在一定温度下,将1 mol A和2 mol B放入容积为5 L的某密闭容器中发生反应:
A(s)+2B(g) C(g)+2D(g)。5 min后达到平衡,测得容器内B的浓度减少了0.2 mol·L-1,则下列叙述不正
确的是( ⇌)
A.在5 min内该反应用C的浓度变化表示的反应速率为0.02 mol·L-1·min-1
B.平衡时B的转化率为50%
C.平衡时B的体积分数约为33.3%
D.初始时的压强与平衡时的压强比为4:5
17.(2021·河北石家庄·高一阶段练习)在5L的恒容密闭容器中进行反应4NH (g)+5O(g) 4NO(g)
3 2
+6H O(g),起始时,通入4molNH 和5molO ,20min后反应达到平衡,此时测得NO的物质的量为2mol。
2 3 2
下列有关说法中错误的是
A.升高温度,化学反应速率增大
学科网(北京)股份有限公司B.其他条件保持不变,加入催化剂,反应速率将增大
C.达到平衡后,5v(NH )=4v(O)
3 2
D.其他条件保持不变,延长反应时间可提高反应的限度
18.(2021·河南信阳·高一期末)某实验小组研究一定温度下的反应: ,根据表格中实验
数据绘制的浓度-时间曲线如图所示,下列说法错误的是
t/min 0 1 2 3
c(M)/mol/L 0.16 0.10 0.04 0.02
c(N)/mol/L 0 0.03 0.06 0.07
A.曲线b是M的浓度变化曲线
B.在3min内,随着N浓度越大,正反应速率减小,逆反应速率增大
C.1~3min内,
D. 时, ,反应达到平衡状态
二、非选择题(本题共4小题,共46分)
19.(8分)(1)H+Cl=2HCl的反应过程如下图所示:
2 2
①根据上图填写下表:
化学键 断裂或形成1 mol 反应中能量变化
学科网(北京)股份有限公司化学键时能量变化
Cl—Cl 吸收243 kJ
共吸收___________ kJ
H—H 吸收436 kJ
H—Cl 放出431 kJ 共放出___________ kJ
②该反应___________(填“放出”或“吸收”)___________ kJ热量。
(2)硅是太阳能电池的重要材料。工业冶炼纯硅的原理是:
粗硅冶炼:(a)SiO+2C Si+2CO↑。
2
精炼硅:(b)Si+3HCl SiHCl +H;
3 2
(c)SiHCl +H Si+3HCl。
3 2
化学反应与能量变化如图所示,回答下列问题:
①(a)是___________反应,(b)是___________反应,(c)是___________反应(填“吸热”或“放热”)。
②反应(b)破坏反应物中的化学键所吸收的能量___________(填“大于”或“小于”)形成生成物中化学键所
放出的能量。
20.(15分)(2021·北京昌平·高一期末)电池是人类生产生活能源的重要来源之一。
I.如图是一个原电池装置。
(1)该装置是利用反应a设计的原电池装置,反应a的离子方程式是_____________________;反应b:
学科网(北京)股份有限公司NaOH+HCl=NaCl+H O是否也可以设计成原电池,理由是_______________________________。
2
(2)按照构成电池的基本要素来看,负极反应物是(填化学式,下同) _____________,正极反应物是
_________________,正极材料是_____________________,离子导体是_____________________。
(3)铜电极上发生反应的电极反应式是_______________________________。
(4)完整说明该原电池装置是如何形成电流的___________________________________________________。
II.如图是利用反应c设计的原电池装置。
(5)反应c的离子方程式是_______________________________。
(6)该装置将氧化反应和还原反应分开进行,还原反应在___________(选填“铁”或者“石墨”)上发生。
21.(12分)燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_________________________________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1 mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析
仪的工作原理如图所示,该装置中电解质为氧化钇—氧化钠,其中O2-可以在固体介质NASICON中自由
移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①工作时,O2-由电极________向电极________移动(填“a”或“b”);
学科网(北京)股份有限公司②电子由电极________通过传感器流向电极________(填“a”或“b”)。
22.(11分)(2021·湖南湘西·高一期末)I、工业合成氨是人类科学技术发展史上的一项重大成就,在很
大程度上解决了地球上因粮食不足而导致的饥饿问题。工业合成氢反应方程式如下
。
(1)已知 键键能为 , 键键能为 , 键键能为 。若有
完全转化为 ,理论上___________(选填"放出"或"吸收") 热量。
(2)为探究影响合成氨转化率的因素,小芳同学利用控制变量法测得平衡状态下 含量如下表(其他因
素相同),回答下列问题。
压强
温度℃
①当合成氨反应达到平衡状态时,若再升高温度,v(正)___________(填“增大”“不变”“减小”,下同),
v(逆)___________。
②结合实际,请分析为什么工业合成氨压强通常控制在 而不是选择更大的压强?
_________________________________________________________________________________。
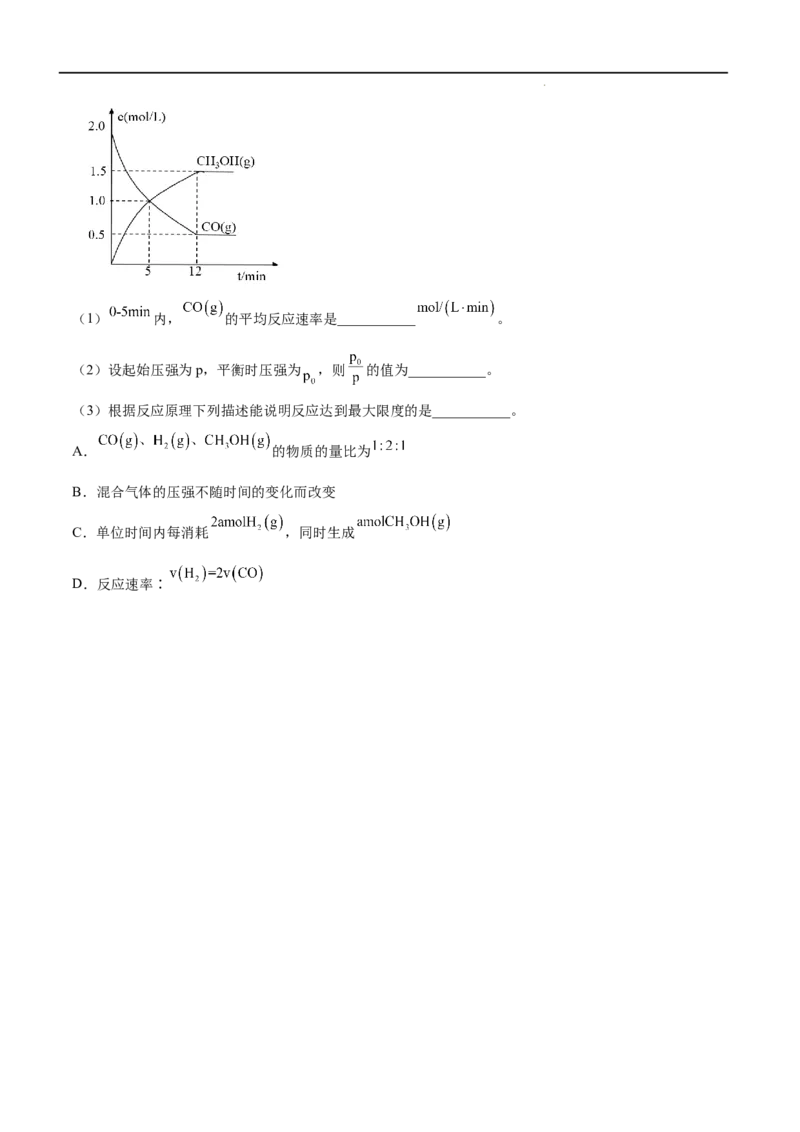
Ⅱ、在恒温下,将 的 和 的 充入 恒容的密闭容器中发生如下反应:
。下图是 和 的浓度随时间变化的关系图,回答下列问题∶
学科网(北京)股份有限公司(1) 内, 的平均反应速率是___________ 。
(2)设起始压强为p,平衡时压强为 ,则 的值为___________。
(3)根据反应原理下列描述能说明反应达到最大限度的是___________。
A. 的物质的量比为
B.混合气体的压强不随时间的变化而改变
C.单位时间内每消耗 ,同时生成
D.反应速率∶
学科网(北京)股份有限公司学科网(北京)股份有限公司