文档内容
江苏省扬州中学2024-2025学年第二学期3月自主学习效果评估
高一化学试卷
2025.3
可能用到的相对原子质量 H-1 C-12 N-14 O-16 Cl-35.5 Na-23 Mg-24
Cu-64
一、单选题
1.化学与科技、生产、生活密切相关。下列说法错误的是
A.“嫦娥号”飞船带回的月壤中含有 ,它与 互为同位素
B.中国空间站使用的碳纤维,是一种新型无机非金属材料
C.“天宫”实验舱太阳能电池采用砷化镓(GaAs)作为半导体,该电池将太阳能转化为
电能
D.“天宫课堂”实验过饱和乙酸钠溶液结晶形成温热的“冰球”,是吸热过程
2. NCl 常用作漂白剂,一种制取NCl 的反应为2HCl+NH Cl NCl +3H↑。下列说
3 3 4 3 2
法正确的是
A. HCl的电子式为 B. NH Cl属于离子化合物
4
C. 含1个中子的H原子可以表示为 D. 该反应将化学能转化为电能
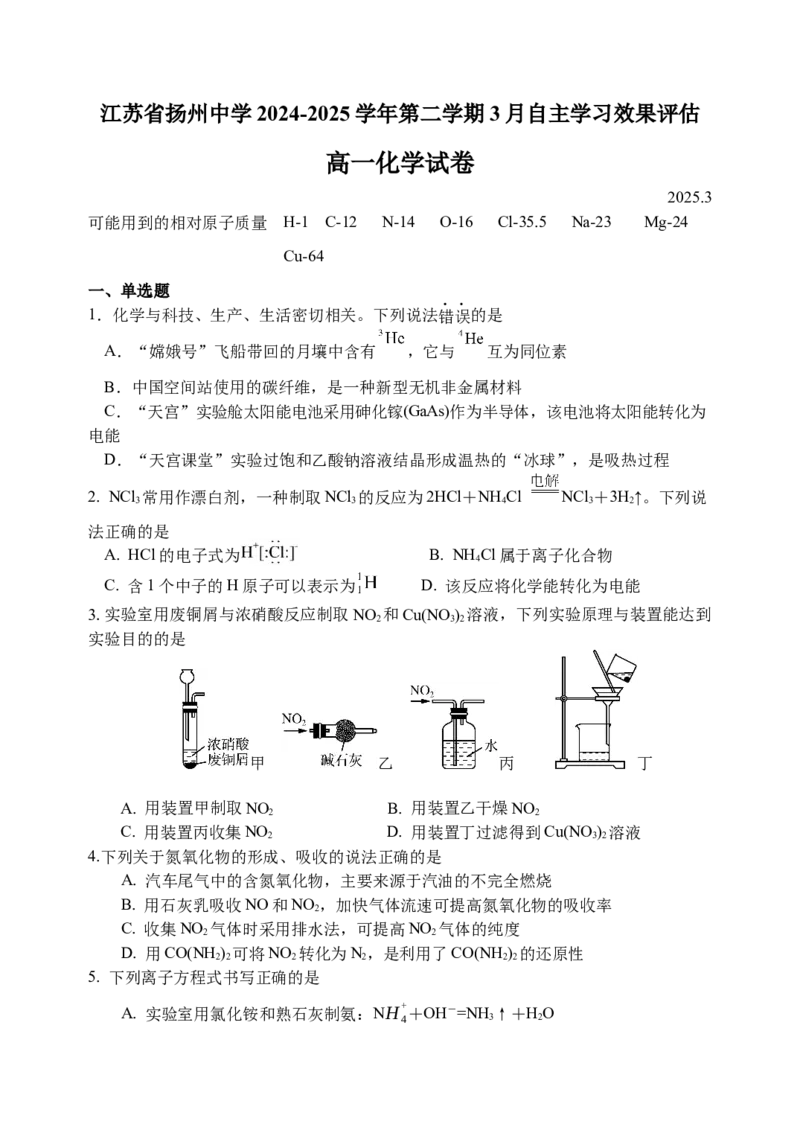
3.实验室用废铜屑与浓硝酸反应制取NO 和Cu(NO ) 溶液,下列实验原理与装置能达到
2 3 2
实验目的的是
甲 乙 丙 丁
A. 用装置甲制取NO B. 用装置乙干燥NO
2 2
C. 用装置丙收集NO D. 用装置丁过滤得到Cu(NO ) 溶液
2 3 2
4.下列关于氮氧化物的形成、吸收的说法正确的是
A. 汽车尾气中的含氮氧化物,主要来源于汽油的不完全燃烧
B. 用石灰乳吸收NO和NO ,加快气体流速可提高氮氧化物的吸收率
2
C. 收集NO 气体时采用排水法,可提高NO 气体的纯度
2 2
D. 用CO(NH) 可将NO 转化为N,是利用了CO(NH) 的还原性
2 2 2 2 2 2
5. 下列离子方程式书写正确的是
A.
实验室用氯化铵和熟石灰制氨:NH+
+OH-=NH ↑+HO
4 3 2B. NaOH溶液与NH
Cl溶液混合加热:NH+
+OH-=NH ·H O
4 4 3 2
C. 氨水中加入盐酸:NH ·H
O+H+=NH+
+HO
3 2 4 2
D. 氨水中加入氯化铁溶液:Fe3++3OH-===Fe(OH) ↓
3
6.采取下列措施对增大化学反应速率有明显效果的是
A.CaCO 与盐酸反应制取CO 时,将块状大理石改为粉末状大理石
3 2
B.铁与稀硫酸反应制备氢气,改用浓硫酸
C.NaSO 溶液与BaCl 溶液反应时,增大压强
2 4 2
D.钾与水反应时,增加水的用量
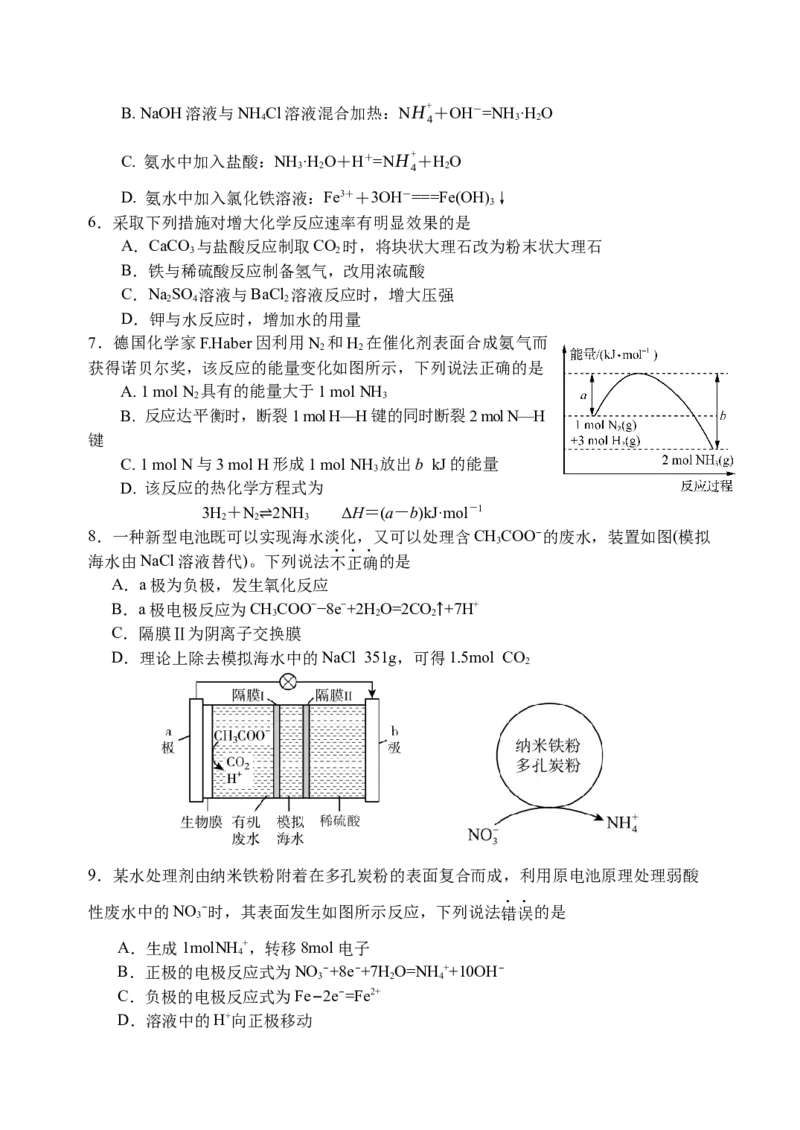
7.德国化学家F.Haber因利用N 和H 在催化剂表面合成氨气而
2 2
获得诺贝尔奖,该反应的能量变化如图所示,下列说法正确的是
A. 1 mol N 具有的能量大于1 mol NH
2 3
B. 反应达平衡时,断裂1 mol H—H键的同时断裂2 mol N—H
键
C. 1 mol N与3 mol H形成1 mol NH 放出b kJ的能量
3
D. 该反应的热化学方程式为
3H+N 2NH ΔH=(a-b)kJ·mol-1
2 2 3
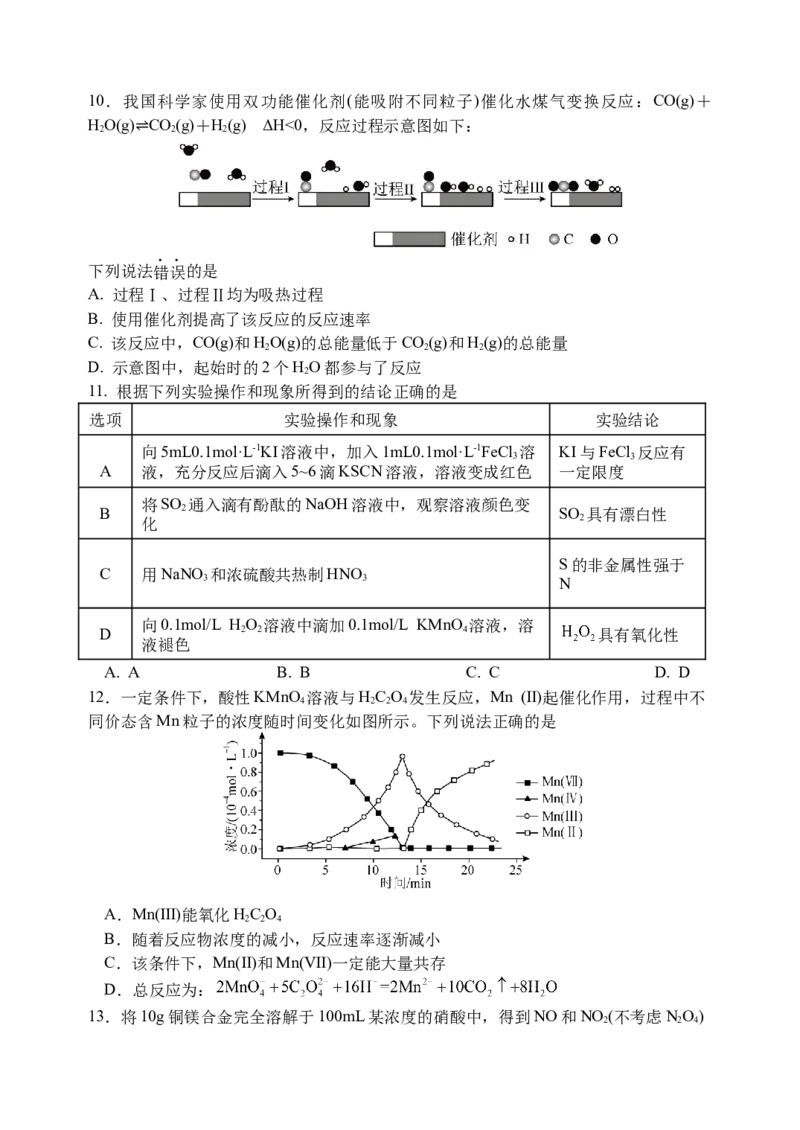
8.一种新型电池既可以实现海水淡化,又可以处理含CHCOO−的废水,装置如图(模拟
3
⇌
海水由NaCl溶液替代)。下列说法不正确的是
A.a极为负极,发生氧化反应
B.a极电极反应为CHCOO−−8e−+2H O=2CO↑+7H+
3 2 2
C.隔膜Ⅱ为阴离子交换膜
D.理论上除去模拟海水中的NaCl 351g,可得1.5mol CO
2
9.某水处理剂由纳米铁粉附着在多孔炭粉的表面复合而成,利用原电池原理处理弱酸
性废水中的NO −时,其表面发生如图所示反应,下列说法错误的是
3
A.生成1molNH +,转移8mol电子
4
B.正极的电极反应式为NO −+8e−+7H O=NH ++10OH−
3 2 4
C.负极的电极反应式为Fe−2e−=Fe2+
D.溶液中的H+向正极移动10.我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+
HO(g) CO(g)+H(g) ΔH<0,反应过程示意图如下:
2 2 2
⇌
下列说法错误的是
A. 过程Ⅰ、过程Ⅱ均为吸热过程
B. 使用催化剂提高了该反应的反应速率
C. 该反应中,CO(g)和HO(g)的总能量低于CO(g)和H(g)的总能量
2 2 2
D. 示意图中,起始时的2个HO都参与了反应
2
11. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论
向5mL0.1mol·L-1KI溶液中,加入1mL0.1mol·L-1FeCl 溶 KI与FeCl 反应有
3 3
A 液,充分反应后滴入5~6滴KSCN溶液,溶液变成红色 一定限度
将SO 通入滴有酚酞的NaOH溶液中,观察溶液颜色变
B 2 SO 具有漂白性
化 2
S的非金属性强于
C 用NaNO 和浓硫酸共热制HNO
3 3 N
向0.1mol/L HO 溶液中滴加0.1mol/L KMnO 溶液,溶
D 2 2 4 具有氧化性
液褪色
A. A B. B C. C D. D
12.一定条件下,酸性KMnO 溶液与HC O 发生反应,Mn (Ⅱ)起催化作用,过程中不
4 2 2 4
同价态含Mn粒子的浓度随时间变化如图所示。下列说法正确的是
A.Mn(Ⅲ)能氧化HC O
2 2 4
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,Mn(Ⅱ)和Mn(Ⅶ)一定能大量共存
D.总反应为:
13.将10g铜镁合金完全溶解于100mL某浓度的硝酸中,得到NO和NO (不考虑NO)
2 2 4共0.3mol,向反应后的溶液中加入1 mol/L NaOH溶液0.8L,此时溶液呈中性,金属离
子已完全沉淀,沉淀质量为18.5g。下列说法错误的是
A.混合气体中NO和NO 的体积之比为1:2
2
B.合金中铜与镁的物质的量之比为2:3
C.该硝酸的物质的量浓度为12 mol/L
D.铜镁合金溶解后,溶液中剩余HNO 的物质的量为0.3mol
3
二、非选择题
14. (15分) H 、CO、CH 等都是重要的能源,也是重要的化工原料。
2 4
(1) 25 ℃,101 kPa时,8.0 g CH 完全燃烧生成二氧化碳气体和液态水放出445.1 kJ热量。
4
写出该反应的热化学方程式:__________________________________。
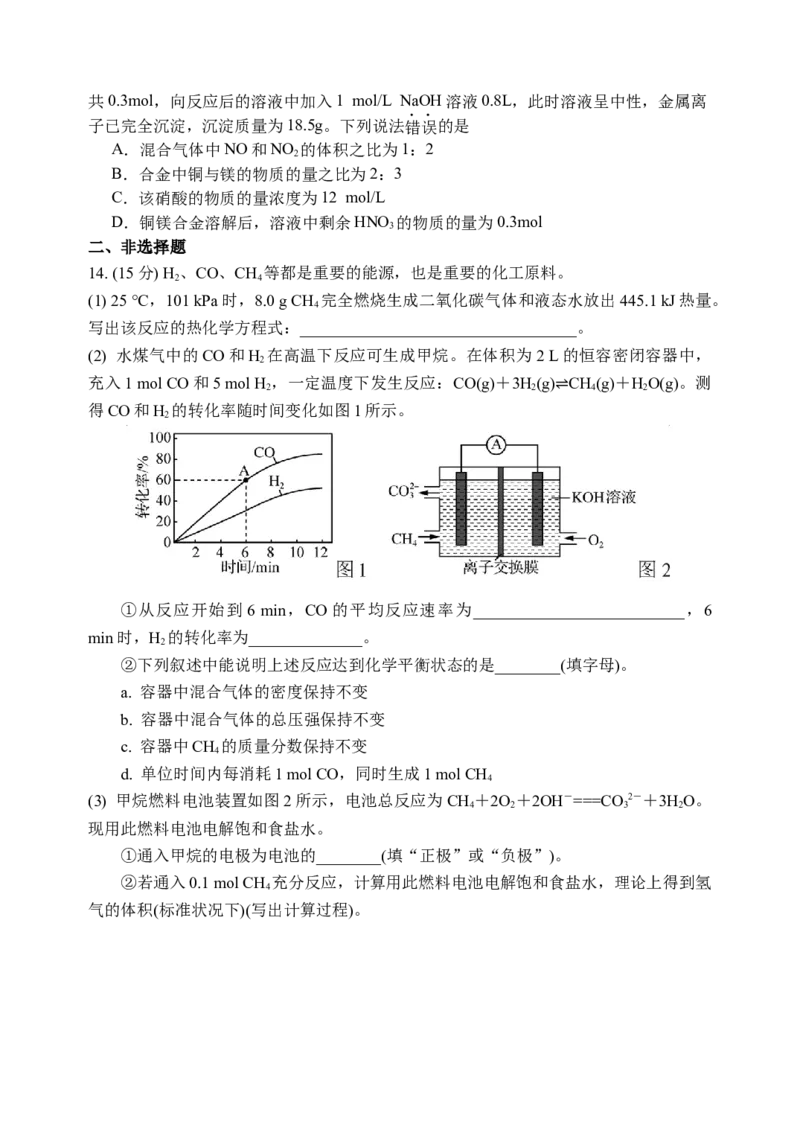
(2) 水煤气中的CO和H 在高温下反应可生成甲烷。在体积为2 L的恒容密闭容器中,
2
充入1 mol CO和5 mol H ,一定温度下发生反应:CO(g)+3H(g) CH(g)+HO(g)。测
2 2 4 2
得CO和H 的转化率随时间变化如图1所示。
2 ⇌
①从反应开始到 6 min,CO的平均反应速率为__________________________,6
min时,H 的转化率为______________。
2
②下列叙述中能说明上述反应达到化学平衡状态的是________(填字母)。
a. 容器中混合气体的密度保持不变
b. 容器中混合气体的总压强保持不变
c. 容器中CH 的质量分数保持不变
4
d. 单位时间内每消耗1 mol CO,同时生成1 mol CH
4
(3) 甲烷燃料电池装置如图2所示,电池总反应为CH +2O +2OH-===CO 2-+3HO。
4 2 3 2
现用此燃料电池电解饱和食盐水。
①通入甲烷的电极为电池的________(填“正极”或“负极”)。
②若通入0.1 mol CH 充分反应,计算用此燃料电池电解饱和食盐水,理论上得到氢
4
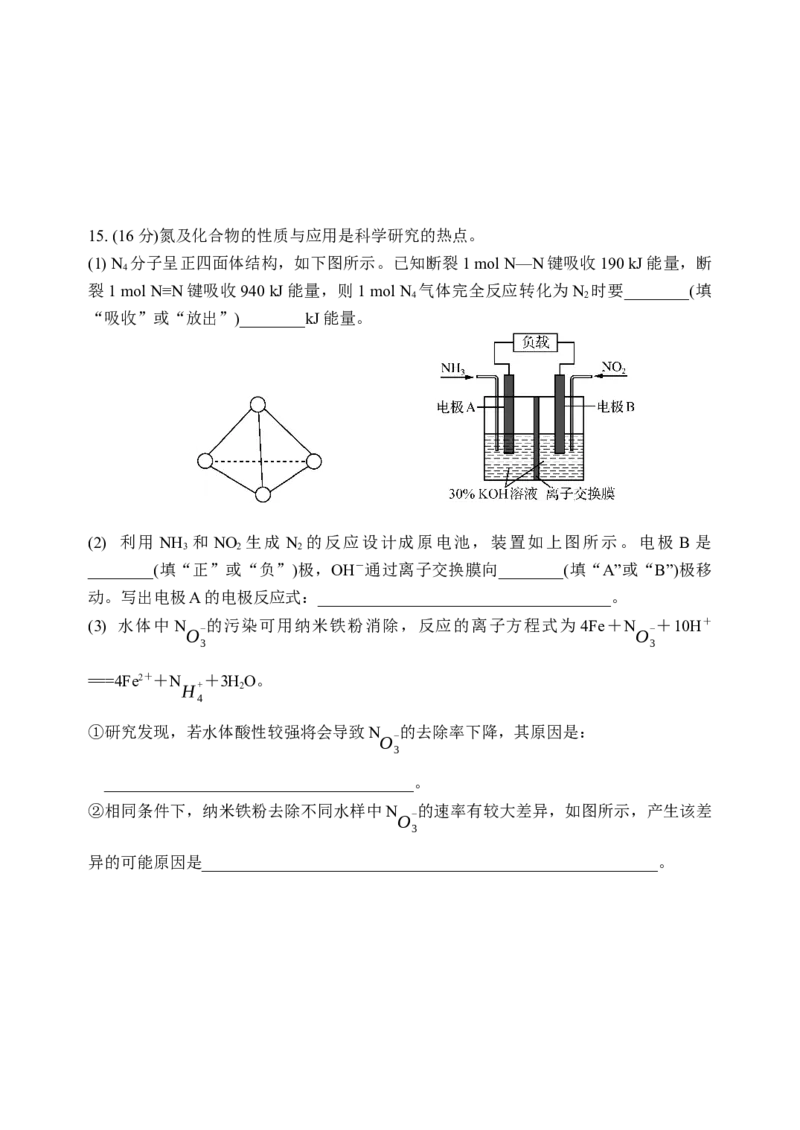
气的体积(标准状况下)(写出计算过程)。15. (16分)氮及化合物的性质与应用是科学研究的热点。
(1) N 分子呈正四面体结构,如下图所示。已知断裂1 mol N—N键吸收190 kJ能量,断
4
裂1 mol N≡N键吸收940 kJ能量,则1 mol N 气体完全反应转化为N 时要________(填
4 2
“吸收”或“放出”)________kJ能量。
(2) 利用 NH 和 NO 生成 N 的反应设计成原电池,装置如上图所示。电极 B 是
3 2 2
________(填“正”或“负”)极,OH-通过离子交换膜向________(填“A”或“B”)极移
动。写出电极A的电极反应式:____________________________________。
(3) 水体中 N 的污染可用纳米铁粉消除,反应的离子方程式为 4Fe+N +10H+
O- O-
3 3
===4Fe2++N +3HO。
H+ 2
4
①研究发现,若水体酸性较强将会导致N 的去除率下降,其原因是:
O-
3
______________________________________。
②相同条件下,纳米铁粉去除不同水样中N 的速率有较大差异,如图所示,产生该差
O-
3
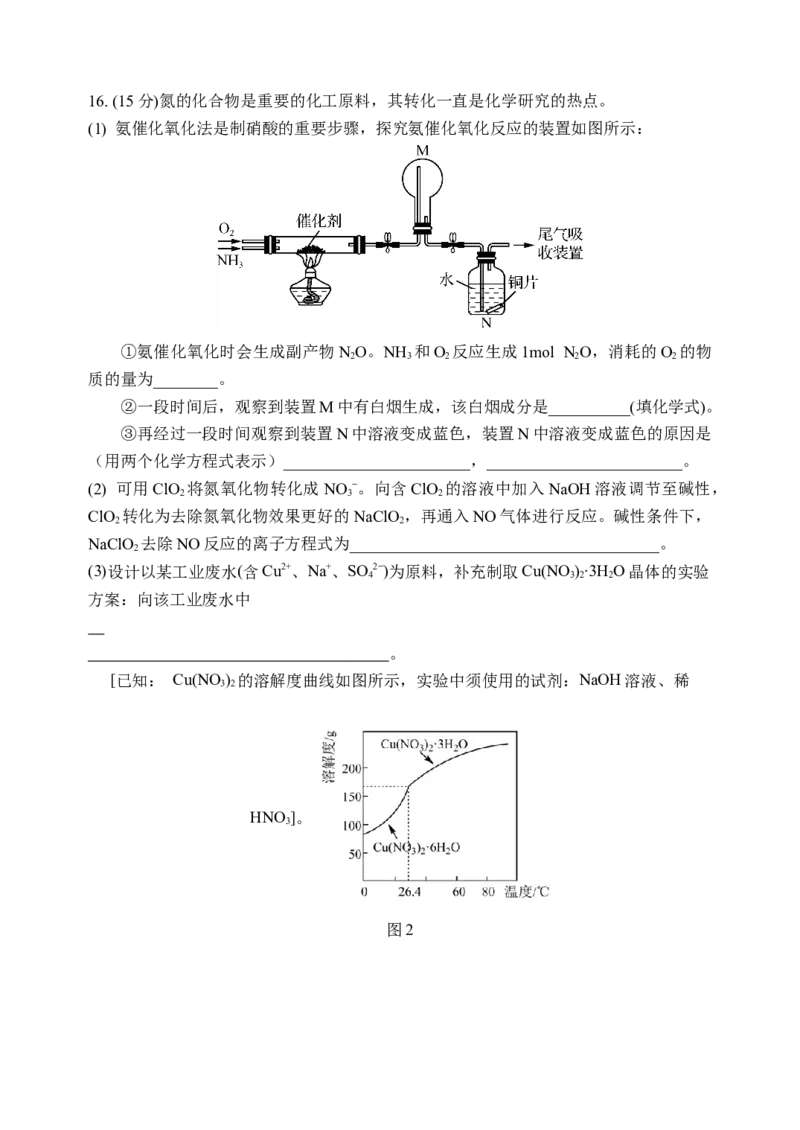
异的可能原因是________________________________________________________。16. (15分)氮的化合物是重要的化工原料,其转化一直是化学研究的热点。
(1) 氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
①氨催化氧化时会生成副产物NO。NH 和O 反应生成1mol NO,消耗的O 的物
2 3 2 2 2
质的量为________。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是__________(填化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是
(用两个化学方程式表示)_______________________,________________________。
(2) 可用ClO 将氮氧化物转化成NO −。向含ClO 的溶液中加入NaOH溶液调节至碱性,
2 3 2
ClO 转化为去除氮氧化物效果更好的NaClO,再通入NO气体进行反应。碱性条件下,
2 2
NaClO 去除NO反应的离子方程式为______________________________________。
2
(3)设计以某工业废水(含Cu2+、Na+、SO 2−)为原料,补充制取Cu(NO )∙3H O晶体的实验
4 3 2 2
方案:向该工业废水中
。
[已知: Cu(NO ) 的溶解度曲线如图所示,实验中须使用的试剂:NaOH溶液、稀
3 2
HNO]。
3
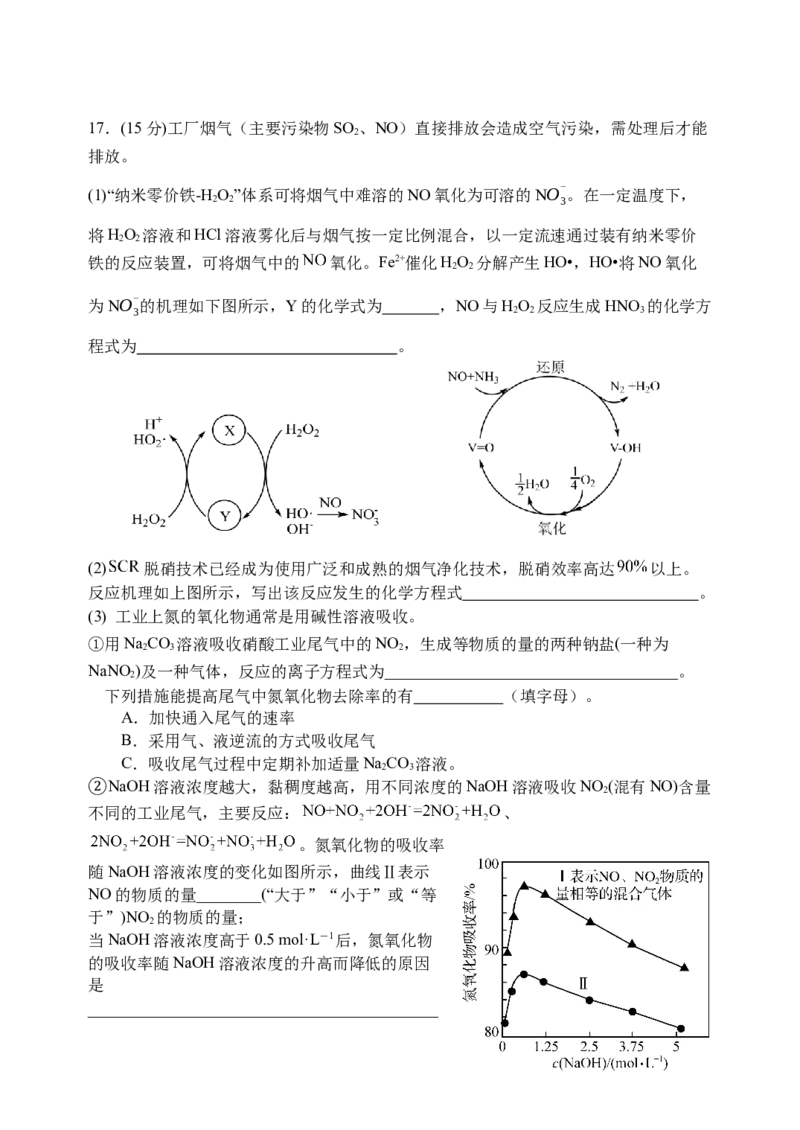
图217.(15分)工厂烟气(主要污染物SO 、NO)直接排放会造成空气污染,需处理后才能
2
排放。
(1)“纳米零价铁-H
O”体系可将烟气中难溶的NO氧化为可溶的NO-
。在一定温度下,
2 2 3
将HO 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价
2 2
铁的反应装置,可将烟气中的 氧化。Fe2+催化HO 分解产生HO•,HO•将NO氧化
2 2
为NO-
的机理如下图所示,Y的化学式为 ,NO与HO 反应生成HNO 的化学方
3 2 2 3
程式为 。
(2) 脱硝技术已经成为使用广泛和成熟的烟气净化技术,脱硝效率高达 以上。
反应机理如上图所示,写出该反应发生的化学方程式 。
(3) 工业上氮的氧化物通常是用碱性溶液吸收。
①用NaCO 溶液吸收硝酸工业尾气中的NO ,生成等物质的量的两种钠盐(一种为
2 3 2
NaNO )及一种气体,反应的离子方程式为____________________________________。
2
下列措施能提高尾气中氮氧化物去除率的有 (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaCO 溶液。
2 3
NaOH溶液浓度越大,黏稠度越高,用不同浓度的NaOH溶液吸收NO (混有NO)含量
2
不同的工业尾气,主要反应: 、
②
。氮氧化物的吸收率
随NaOH溶液浓度的变化如图所示,曲线Ⅱ表示
NO的物质的量________(“大于”“小于”或“等
于”)NO 的物质的量;
2
当NaOH溶液浓度高于0.5 mol·L-1后,氮氧化物
的吸收率随NaOH溶液浓度的升高而降低的原因
是
___________________________________________。3月自主学习效果评估高一化学参考答案
1 2 3 4 5 6 7
D B D D C A B
8 9 10 11 12 13
C B C A A C
14.(15分) (1) CH (g)+2O(g)===CO(g)+2HO(l) ΔH=-890.2 kJ·mol-1(3分)
4 2 2 2
(2) 0.05 mol·L-1·min-1 (2分)36% (2分) ②bc(2分)
(3) 负极(2分) ②(理论上)燃料电池与电解池中电子转移的数目相等。
①
由题意可得:CH~CO2-~8e-~4H
4 3 2
①
1 4
0.1 mol n(H )
2
1/0.1 mol=4/n(H)
2
解得n(H )=0.4 mol
2
V(H )=0.4 mol×22.4 L·mol-1=8.96 L(4分)
2
15. (16分)(1) 放出(2分) 740(2分)
(2) 正(2分) A(2分) 2NH +6OH--6e-===N+6HO(3分)
3 2 2
(3) 纳米铁粉与H+反应生成H(2分) 纳米铁粉与置换出的Cu形成原电池增大反应
2
速率或Cu、Cu2+催化纳米铁粉去除NO-
的反应(3分)
3
16. (15分)(1) 2mol(3分) ②NH NO (2分)
4 3
4NO +O+2HO===4HNO(或3NO +2HO===2HNO+NO)、3Cu+
2 2 2 3 2 2 3
①
8HNO(稀)===3Cu(NO )+2NO↑+4HO (4分)
3 3 2 2
③
(2)
3ClO- +4NO+4OH-===3Cl-+4NO-
+2HO(3分)
2 3 2
(3)向工业废水中加入NaOH溶液充分反应,过滤,洗涤滤渣2~3次,(1分)向滤渣中
加入稀硝酸至固体完全溶解,(1分)蒸发浓缩,降温至温度略高于26.4℃结晶,过滤,
洗涤,干燥(1分)(共3分)
17.(15分)(1) Fe3+或FeCl (2分) (2
3
分)
(2) (2分)
(3) 2NO
+CO2- ===NO- +NO-
+CO (2分) BC(2分)
2 3 2 3 2
②大于①(2分) NaOH溶液浓度越大,黏稠度越来越高,(气体在液体中的流动性变
差,不利于气体的吸收,)所以对氮氧化物的吸收率下降。(3分)