文档内容
第八章 化学与可持续发展
第一节 自然资源的开发利用
第 1 课时 金属矿物的开发利用
1.有关金属的冶炼原理,下列说法正确的是( )
A.肯定发生的是置换反应
B.肯定发生的是分解反应
C.肯定发生的是还原反应
D.只能用金属作还原剂冶炼金属
2.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被
人类开发利用的大致年限,之所以有先后,主要取决于( )
A.金属的化合价高低
B.金属的活动性强弱
C.金属的导电性强弱
D.金属在地壳中的含量多少
3.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
A.用胆矾炼铜 B.用铁矿石炼铁
C.烧结黏土制陶瓷 D.打磨磁石制指南针
4.在冶金工业上,均不能用通常的化学还原剂制得的一组是( )
A.Na、Ca、Mg、Al、K
B.Na、K、Zn、Fe、Hg
C.Zn、Fe、Cu、Ag、Sn
D.Mg、Al、Zn、Fe、Pb
5.化学学科的发展对人类文明进步起到了极为重要的作用。下列认识正确的是( )
A.人类对金、银、铜、铁、铝的认识与其在自然界的分布无关
B.人类解决吃、穿、住、行最有效的方法就是大力开发石油及其产品
C.工业上可用电解熔融态的MgCl 、AlCl 来制备Mg、Al
2 3
D.工业上可用空气、Cu、稀硫酸来制备CuSO
4
6.金属锂是密度最小的金属,等质量的金属锂能释放出更多的电子,故常用来制造高能量电池。
已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是( )A.电解法 B.热还原法
C.热分解法 D.铝热法
7.铝用来焊接钢轨是利用( )
A.铝与氧气反应生成稳定的保护层
B.铝是热的良导体
C.铝是强还原剂,铝热反应放热
D.铝合金强度大
8.下列反应原理中,不符合工业冶炼金属实际情况的是( )
A.2Ag O=====4Ag+O↑
2 2
B.2Al O(熔融)=====4Al+3O↑
2 3 2
C.2MgO=====2Mg+O↑
2
D.4CO+Fe O=====3Fe+4CO
3 4 2
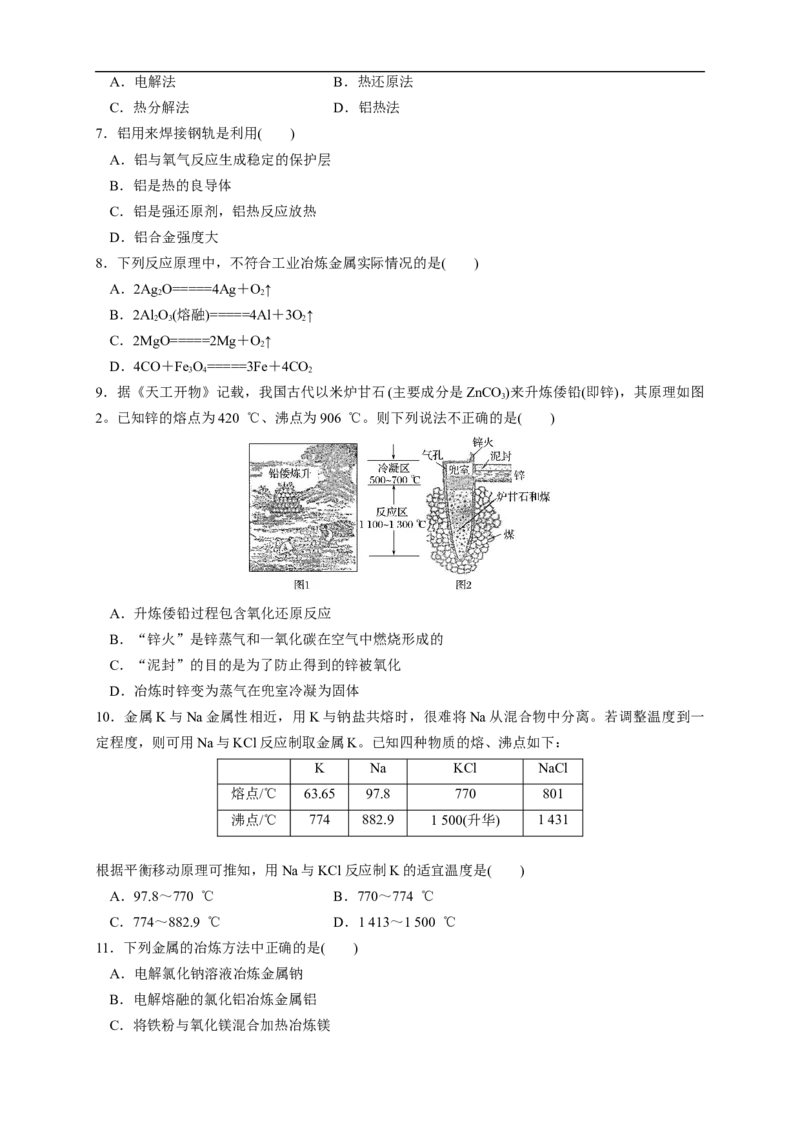
9.据《天工开物》记载,我国古代以米炉甘石(主要成分是ZnCO )来升炼倭铅(即锌),其原理如图
3
2。已知锌的熔点为420 ℃、沸点为906 ℃。则下列说法不正确的是( )
A.升炼倭铅过程包含氧化还原反应
B.“锌火”是锌蒸气和一氧化碳在空气中燃烧形成的
C.“泥封”的目的是为了防止得到的锌被氧化
D.冶炼时锌变为蒸气在兜室冷凝为固体
10.金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一
定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点/℃ 63.65 97.8 770 801
沸点/℃ 774 882.9 1 500(升华) 1 431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1 413~1 500 ℃
11.下列金属的冶炼方法中正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁D.用一氧化碳还原氧化铁冶炼铁
12.热还原法冶炼金属的反应一定是( )
A.氧化还原反应 B.置换反应
C.复分解反应 D.分解反应
13.我国古代“药金”的冶炼方法是将炉甘石(ZnCO)和赤铜矿(Cu O)与木炭按一定的比例混合后
3 2
加热至800 ℃,这种方法可炼出有金子般光泽的“药金”。下列叙述正确的是( )
A.“药金”实质上是铜锌合金
B.冶炼炉中炉甘石直接被木炭还原为锌
C.用王水可区别黄金和“药金”
D.用灼烧法不能区别黄金和“药金”
14.以辉铜矿(Cu S)为原料冶炼铜,其反应原理可表示为Cu S+O=====2Cu+SO 。下列说法不正
2 2 2 2
确的是( )
A.化合价发生变化的元素有3种
B.Cu S在该反应中既是氧化剂又是还原剂
2
C.1 mol O 参加反应时,上述反应转移电子总物质的量为4 mol
2
D.SO 被分离、回收后氧化生成SO ,可作为制取硫酸的原料
2 3
15.下列说法不正确的是( )
A.自然界中不存在游离态的金属
B.金属活动性不同,冶炼方法也有所不同
C.地球上金属矿物资源有限,因此应提高金属矿物的利用率
D.废旧金属的回收利用有利于环境保护
16.能用铝作原料来冶炼难熔的金属是因为( )
A.铝的密度小,熔点较低
B.铝在空气中燃烧放出大量的热
C.铝在金属活动性顺序表中排在较前面
D.铝具有还原性,发生铝热反应时放出大量热
17.如图为铝热反应的实验装置,请回答下列问题:
(1)该实验装置中还缺____________,引发铝热反应的操作为_____________________。
(2)若将氧化铁换成氧化镁,该反应________(填“能”或“不能”)发生,理由是__________。
(3)写出铝热反应的两个用途_____________________________。
18.孔雀石的主要成分为CuCO·Cu(OH) ,某同学设计从孔雀石中冶炼金属铜的方案如下:
3 2
①将孔雀石粉碎后加过量的稀硫酸;
②将反应后的混合物过滤;
③向滤液中加入一种金属粉末。根据上述实验方案,试回答:
(1)第①步反应中的现象为____________________________。
(2)第③步加入的金属粉末是__________,理由是________________________________。
(3)若向滤液中加入过量生石灰后,过滤,将沉淀加热灼烧后再通入________________气体,可制得
较纯净的铜。
19.钛(Ti)被称为继铁、铝之后的第三金属,钛白(TiO)是目前最好的白色颜料。制备TiO 和Ti的
2 2
原料是钛铁矿,我国的钛铁矿储量居世界首位。用含 Fe O 的钛铁矿(主要成分为FeTiO)制备TiO
2 3 3 2
流程如下:
(1)步骤①加Fe的目的是______________________;步骤②冷却的目的是______________。
(2)上述制备TiO 的过程中,可以利用的副产物是__________________;考虑成本和废物综合利用
2
因素,废液中应加入____________处理。
(3)由金红石(TiO)制取单质钛(Ti),涉及到的步骤为
2
―→――――→
反应TiCl +2Mg===2MgCl +Ti在Ar气氛中进行的理由是__________________________。
4 2