文档内容
2022-2023 学年高一化学上学期期中测试卷 04
(考试时间:90分钟 试卷满分:100分)
考试内容:新教材人教必修1第一、二章 难度:★★★★☆
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 Si-28 S-32
Fe-56 Cu-64
一、选择题(本题共25个小题,每小题2分,共50分。在每小题给出的四个选项中,只有
一项是符合题目要求的。)
1.下列物质属于电解质且在该状态下能导电的是( )
A.熔融NaCl B.Cu C.液态HCl D.KNO
3
2.下列电离方程式中,正确的是( )
A.NaHCO =Na++H++ CO2- B.KClO=K++Cl-+3O2-
3 3 3
C.Ca(NO )=Ca2++2(NO)2- D.NaHSO=Na++H++SO2-(水溶液)
3 2 3 4 4
3.火药的爆炸反应为:2KNO+S+3C=KS+N↑+3CO ↑,其中被还原的元素是( )
3 2 2 2
A.N B.C C.N和S D.N和C
4.关于物质的分类说法正确的是( )
A.粒子直径在1-100纳米之间的碳酸钙属于胶体
B.纯碱属于碱
C.同种元素组成的物质有可能是混合物
D.三氧化硫的水溶液能导电,三氧化硫属于电解质
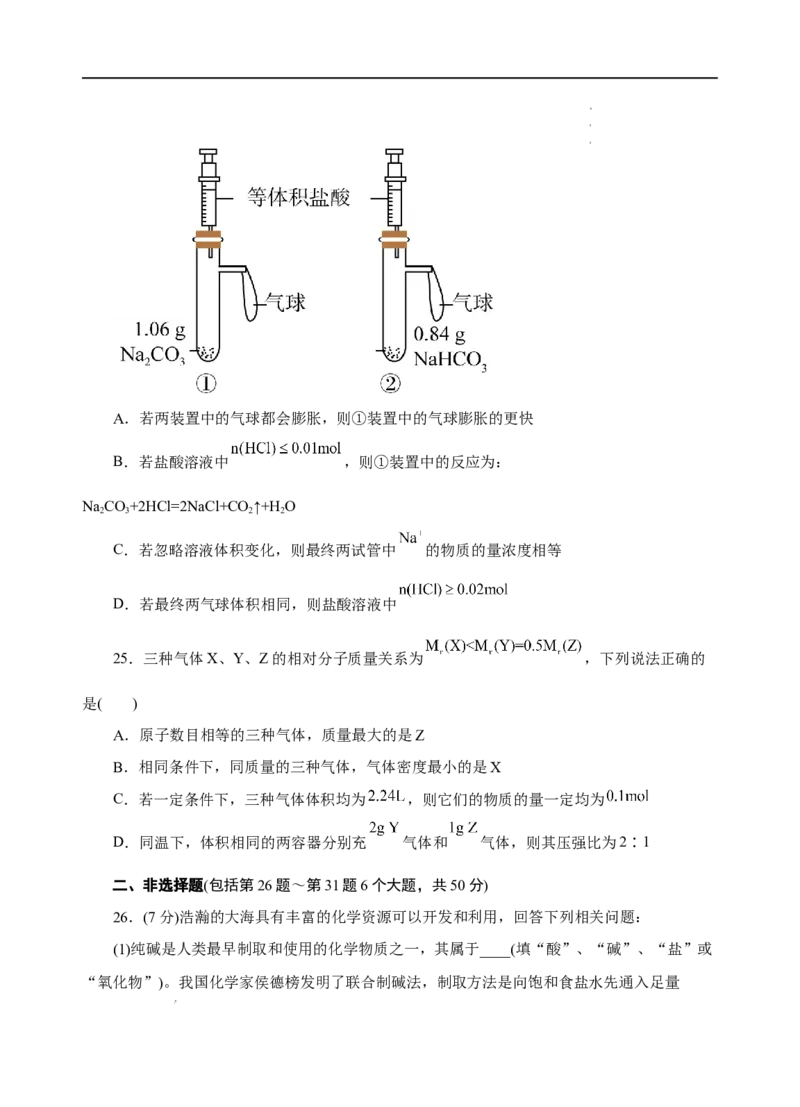
5.光纤通讯是一种现代化的通讯手段,光纤通讯容量大,一对光纤上可同时传送3万门电
话的信号。制造光导纤维的主要原料是SiO 下列关于SiO 的说法正确的是( )
2, 2
A.SiO 摩尔质量是60 B.1 mol SiO 中含有1 mol O
2 2 2
C.1.5mol SiO 中含有1.806×1024个氧原子 D.1 mol SiO 质量是60 g mol-1
2 2
6.下列物质分类的正确组合是( )
碱 酸 盐 碱性氧化物 酸性氧化物
A Cu (OH) CO HSO NaHCO NaO CO
2 2 3 2 4 3 2 2 2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司B NaOH NaHSO NaCl NaO CO
4 2
C NaCO NH CaCl MgO SO
2 3 3 2 2
D Ba(OH) HNO CaCO CaO SO
2 3 3 3
7.实现下列物质之间的转化,需要加入还原剂才能实现的是( )
A.CuO → Cu B.Fe2+ → Fe3+ C.SO → H SO D.CO → CO
3 2 4 2
【答案】A
【解析】A项,氧化铜转化为铜时,铜元素的化合价降低被还原,需要加入还原剂才能实
现,故A正确;B项,亚铁离子转化为铁离子时,铁元素的化合价升高被氧化,需要加入氧化
剂才能实现,故B错误;C项,三氧化硫转化为硫酸时,没有元素发生化合价变化,属于非氧
化还原反应,不需要加入还原剂就能实现,故C错误;D项,一氧化碳转化为二氧化碳时,碳
元素的化合价升高被氧化,需要加入氧化剂才能实现,故B错误;故选A。
8.氢化钠(NaH)可在野外用作生氢剂,其中氧元素为-1价。NaH用作生氢剂时的化学反应
原理为:NaH + H O = NaOH + H ↑。下列有关该反应的说法中,正确的是( )
2 2
A.HO中的氢元素被还原 B.该反应属于复分解反应
2
C.NaH是氧化剂 D.该反应属于置换反应
【答案】A
【解析】由方程式可知,反应中氢化钠中氢元素化合价升高被氧化,氢化钠是反应的还原
剂,水分子中氢元素的化合价降低被还原,水是氧化剂。A项,反应中水分子中氢元素的化合
价降低被还原,故A正确;B项,该反应为氧化还原反应,不是复分解反应,故B错误;C项,
反应中氢化钠中氢元素化合价升高被氧化,氢化钠是反应的还原剂,故C错误;D项,由方程
式可知,反应中没有单质参与反应,该反应不属于置换反应,故D错误;故选A。
9.分类是科学研究的重要方法,下列物质分类不正确的是( )
A.化合物:干冰,冰水混合物,烧碱,小苏打
B.非电解质:乙醇,四氯化碳,氯气,葡萄糖
C.同素异形体:活性炭,C ,石墨烯,金刚石
60
D.混合物:空气,纯净矿泉水,水煤气,84消毒液
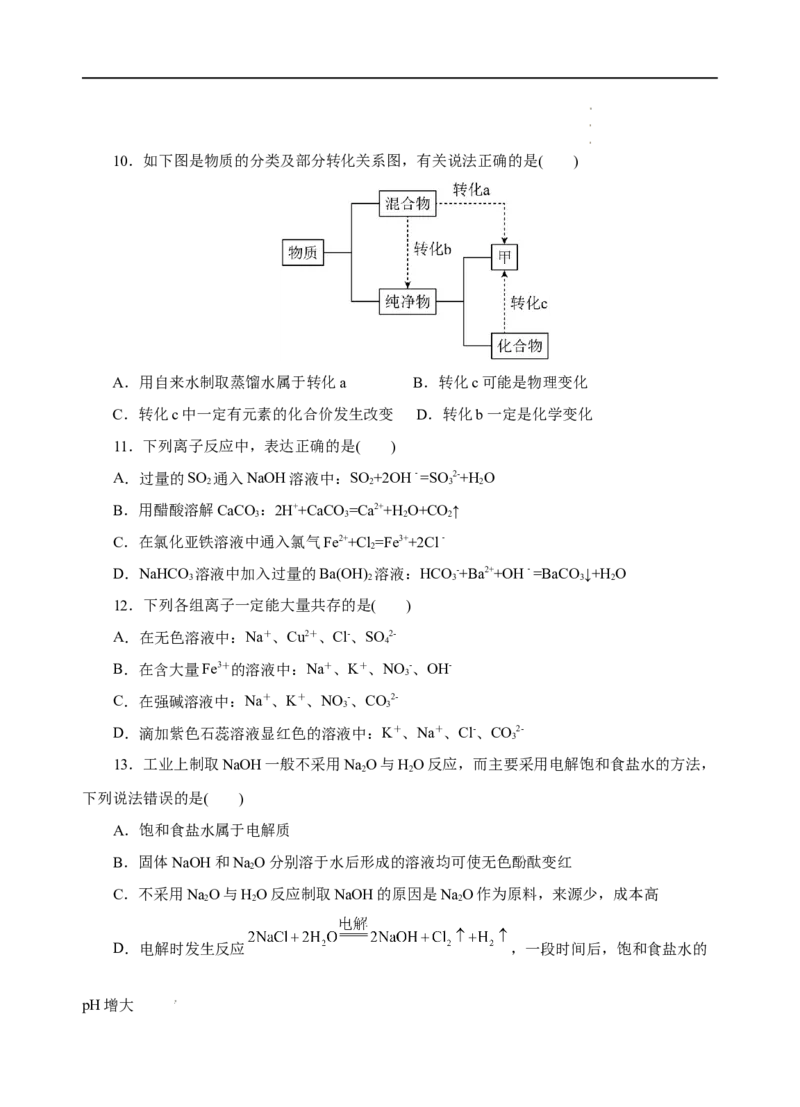
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司10.如下图是物质的分类及部分转化关系图,有关说法正确的是( )
A.用自来水制取蒸馏水属于转化a B.转化c可能是物理变化
C.转化c中一定有元素的化合价发生改变 D.转化b一定是化学变化
11.下列离子反应中,表达正确的是( )
A.过量的SO 通入NaOH溶液中:SO +2OH﹣=SO2-+H O
2 2 3 2
B.用醋酸溶解CaCO :2H++CaCO =Ca2++H O+CO↑
3 3 2 2
C.在氯化亚铁溶液中通入氯气Fe2++Cl=Fe3++2Cl﹣
2
D.NaHCO 溶液中加入过量的Ba(OH) 溶液:HCO -+Ba2++OH﹣=BaCO ↓+H O
3 2 3 3 2
12.下列各组离子一定能大量共存的是( )
A.在无色溶液中:Na+、Cu2+、Cl-、SO 2-
4
B.在含大量Fe3+的溶液中:Na+、K+、NO -、OH-
3
C.在强碱溶液中:Na+、K+、NO -、CO2-
3 3
D.滴加紫色石蕊溶液显红色的溶液中:K+、Na+、Cl-、CO2-
3
13.工业上制取NaOH一般不采用NaO与HO反应,而主要采用电解饱和食盐水的方法,
2 2
下列说法错误的是( )
A.饱和食盐水属于电解质
B.固体NaOH和NaO分别溶于水后形成的溶液均可使无色酚酞变红
2
C.不采用NaO与HO反应制取NaOH的原因是NaO作为原料,来源少,成本高
2 2 2
D.电解时发生反应 ,一段时间后,饱和食盐水的
pH增大
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司14.已知N 代表阿伏加德罗常数,下列关于摩尔质量的说法正确的是( )
A
A.2molCO 的摩尔质量是1molCO 摩尔质量的2倍
2 2
B.任何物质的摩尔质量都等于它的相对分子质量或相对原子质量
C.某一个氯原子的质量是a g,则该氯原子的摩尔质量是a N g/mol
A
D.某气体在标准状况的密度为ρg/L,则该气体的摩尔质量为22.4ρg/L
15.下列溶液中c(Cl-)与50mL 1mol/L AlCl 溶液中c(Cl-)相等的是( )
3
A.150 mL 1 mol/L的NaCl溶液 B.75 mL 1 mol/L的FeCl 溶液
3
C.150 mL 0.5 mol/L的MgCl 溶液 D.75 mL 2 mol/L的NH Cl溶液
2 4
16.设N 表示阿伏加德罗常数,下列叙述正确的是( )
A
A.25℃、101kPa时,11.2L H 中含有的原子数为N
2 A
B.1mol/L Na SO 溶液中离子总数为3N
2 4 A
C.0℃、101kPa时,22.4L H O中含有的分子数为N
2 A
D.25 ℃、101k Pa下,64 g SO 中含有的原子数为3N
2 A
17.亚硝酸钠(NaNO )具有致癌作用,许多腌制食品中含NaNO 。酸性KMnO 溶液与亚硝
2 2 4
酸钠反应的离子反应为MnO -+NO-+H+→Mn2++NO-+H O (未配平)。下列叙述错误的是( )
4 2 3 2
A.生成1mol Mn2+,转移5mol电子
B.该反应中氮元素被氧化
C.该反应氧化产物与还原产物的物质的量之比为2∶5
D.配平后,HO的化学计量数为3
2
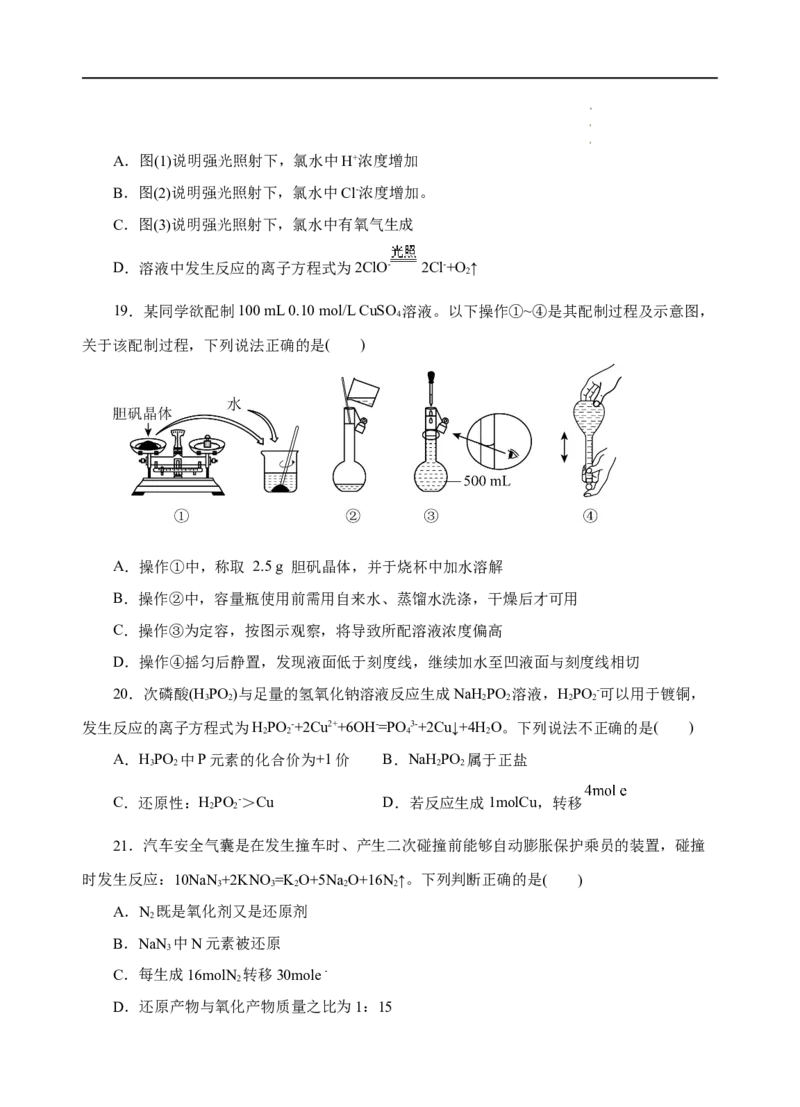
18.数字化实验将传感器、数据采集器和计算机一起相连,采集实验过程中各种物理量变
化的数据并记录和呈现,如图采集的用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口
瓶中数据,得到如图曲线。下列说法错误的是( )
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.图(1)说明强光照射下,氯水中H+浓度增加
B.图(2)说明强光照射下,氯水中Cl-浓度增加。
C.图(3)说明强光照射下,氯水中有氧气生成
D.溶液中发生反应的离子方程式为2ClO- 2Cl-+O ↑
2
19.某同学欲配制100 mL 0.10 mol/L CuSO 溶液。以下操作①~④是其配制过程及示意图,
4
关于该配制过程,下列说法正确的是( )
A.操作①中,称取 2.5 g 胆矾晶体,并于烧杯中加水溶解
B.操作②中,容量瓶使用前需用自来水、蒸馏水洗涤,干燥后才可用
C.操作③为定容,按图示观察,将导致所配溶液浓度偏高
D.操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切
20.次磷酸(H PO )与足量的氢氧化钠溶液反应生成NaH PO 溶液,HPO -可以用于镀铜,
3 2 2 2 2 2
发生反应的离子方程式为HPO -+2Cu2++6OH-=PO3-+2Cu↓+4H O。下列说法不正确的是( )
2 2 4 2
A.HPO 中P元素的化合价为+1价 B.NaH PO 属于正盐
3 2 2 2
C.还原性:HPO ->Cu D.若反应生成1molCu,转移
2 2
21.汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞
时发生反应:10NaN +2KNO =K O+5Na O+16N↑。下列判断正确的是( )
3 3 2 2 2
A.N 既是氧化剂又是还原剂
2
B.NaN 中N元素被还原
3
C.每生成16molN 转移30mole﹣
2
D.还原产物与氧化产物质量之比为1:15
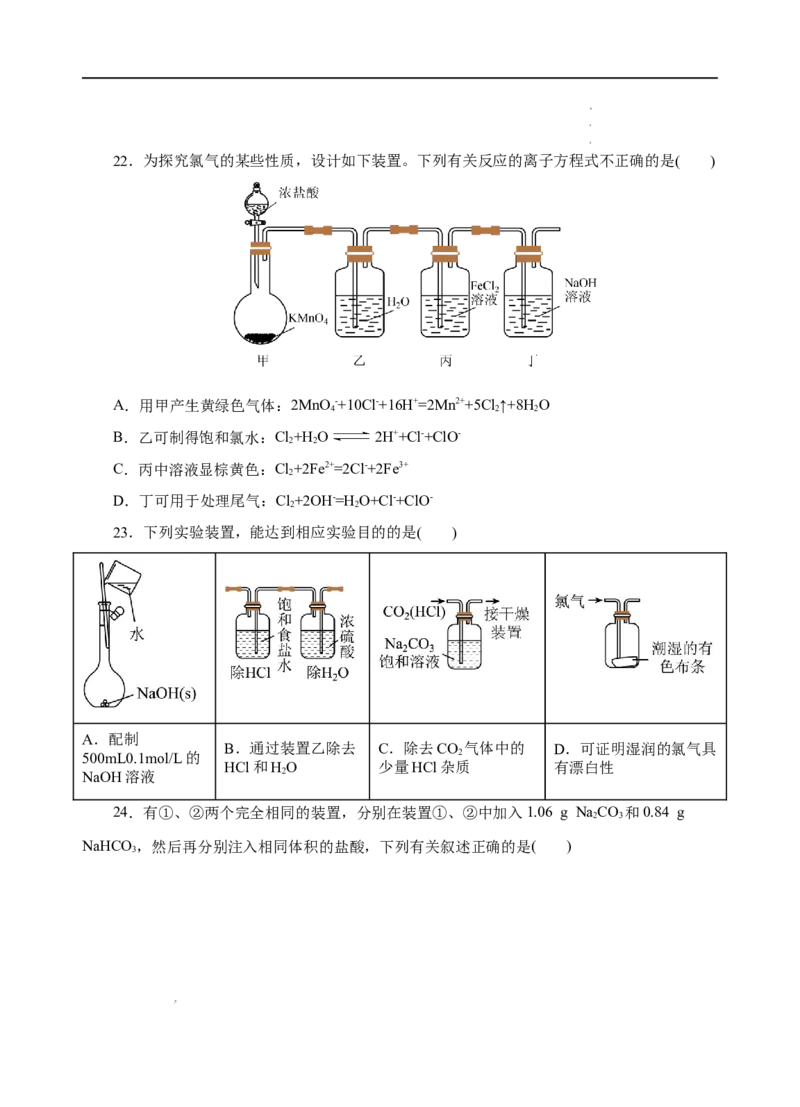
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司22.为探究氯气的某些性质,设计如下装置。下列有关反应的离子方程式不正确的是( )
A.用甲产生黄绿色气体:2MnO -+10Cl-+16H+=2Mn2++5Cl↑+8H O
4 2 2
B.乙可制得饱和氯水:Cl+H O 2H++Cl-+ClO-
2 2
C.丙中溶液显棕黄色:Cl+2Fe2+=2Cl-+2Fe3+
2
D.丁可用于处理尾气:Cl+2OH-=H O+Cl-+ClO-
2 2
23.下列实验装置,能达到相应实验目的的是( )
A.配制
B.通过装置乙除去 C.除去CO 气体中的 D.可证明湿润的氯气具
500mL0.1mol/L的 2
HCl和HO 少量HCl杂质 有漂白性
NaOH溶液 2
24.有①、②两个完全相同的装置,分别在装置①、②中加入1.06 g Na CO 和0.84 g
2 3
NaHCO ,然后再分别注入相同体积的盐酸,下列有关叙述正确的是( )
3
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司A.若两装置中的气球都会膨胀,则①装置中的气球膨胀的更快
B.若盐酸溶液中 ,则①装置中的反应为:
NaCO+2HCl=2NaCl+CO ↑+H O
2 3 2 2
C.若忽略溶液体积变化,则最终两试管中 的物质的量浓度相等
D.若最终两气球体积相同,则盐酸溶液中
25.三种气体X、Y、Z的相对分子质量关系为 ,下列说法正确的
是( )
A.原子数目相等的三种气体,质量最大的是Z
B.相同条件下,同质量的三种气体,气体密度最小的是X
C.若一定条件下,三种气体体积均为 ,则它们的物质的量一定均为
D.同温下,体积相同的两容器分别充 气体和 气体,则其压强比为2∶1
二、非选择题(包括第26题~第31题6个大题,共50分)
26.(7分)浩瀚的大海具有丰富的化学资源可以开发和利用,回答下列相关问题:
(1)纯碱是人类最早制取和使用的化学物质之一,其属于____(填“酸”、“碱”、“盐”或
“氧化物”)。我国化学家侯德榜发明了联合制碱法,制取方法是向饱和食盐水先通入足量
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司NH ,再通入过量CO,得到_____(填化学式)晶体,过滤,再由该晶体制得纯碱的实验操作方法
3 2
为_____。
(2)目前很多自来水厂使用ClO 来消毒、杀菌。
2
工业制取ClO 的反应:2NaClO+H O+H SO =2ClO ↑+O ↑+Na SO +2H O,该反应的氧化产
2 3 2 2 2 4 2 2 2 4 2
物为____,若制得33.75gClO ,转移电子的数目为_____。
2
(3)从海水提取镁,需经下列步骤提纯MgCl 晶体。
2
①往引入的海水中加入____(填化学试剂),沉降,过滤,洗涤得到Mg(OH) 。
2
②将Mg(OH) 与HCl中和,反应的离子方程式为____,溶液蒸发结晶,可得MgCl 晶体。
2 2
27.(10分)实验室以铁碳化合物 为主要原料,制备FeCl 溶液,步骤如下:
3
步骤Ⅰ:称取 铁碳化合物,在足量空气中高温灼烧,生成有磁性的固体X。
步骤Ⅱ:将X与过量 的盐酸反应,向反应后溶液中加入过量HO 溶液。
2 2
步骤Ⅲ:将“步骤Ⅱ”所得的溶液加热煮沸一段时间,冷却。
回答下列问题:
(1)步骤Ⅰ中用到的硅酸盐仪器有酒精灯、玻璃棒、___________、___________,若
充分反应,则X的质量=___________g。
(2)实验室有各种规格的常用容量瓶,用 的盐酸和蒸馏水配制210 mL3mol·L-1盐酸。
①配制时需要用量筒量取___________ mL 12mol·L-1的盐酸。
②下列操作导致所配溶液浓度偏高的是___________(填标号)。
a.定容时俯视刻度线 b.转移溶液时有液体溅出
c.配制溶液时容量瓶中有少许蒸馏水 d.量取 的盐酸时仰视读数
(3)步骤Ⅱ中X与过量盐酸反应后,溶液中含有的盐的化学式为FeCl 、___________,若要
2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司将60Ml1mol·L-1FeCl 溶液中的 氧化,需要消耗___________ mL6mol·L-1HO 。
2 2 2
(4)用步骤Ⅲ所制得的FeCl 溶液制备 胶体的具体操作为___________,检验制备胶体
3
成功的方法是___________。
28.(11分) “新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活
中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式_______;
②已知KMnO 与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:
4
2KMnO +16HCl=2KCl+2MnCl +5Cl↑+8H O,15.8g KMnO 能和 _______gHCl发生上述反应、
4 2 2 2 4
其中有_______molHCl被氧化、产生的Cl 在标准状况下的体积为_______L;
2
③实验室还可以利用如下反应制取氯气:KClO+6HCl(浓)= KCl+3Cl ↑+3H O。若制取标准
3 2 2
状况下6.72L氯气,反应过程中转移电子的物质的量为_______;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此
次抗击新冠病毒中发挥了重要作用 :
①浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表
示为:___;(已知酸性:HCO >HClO> HCO -)
2 3 3
②某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO 的混合溶液,经
3
测定ClO-与 的个数比为1∶3,写出该反应的化学方程式:___________________;
(3)世界卫生组织将ClO 定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面
2
有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO 作消毒剂时和氯气一样,
2
还原产物均为Cl-,ClO 的消毒效率是氯气的_______倍。
2
29.(8分) “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生
活中去”道理。请填空:
(1)如图1收集Cl 的正确装置是 _______。
2
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(2)将灼热的铜丝伸入盛有氯气的集气瓶中,反应现象为 _______。
(3)将反应后的产物溶于水配成饱和溶液,向溶液中加入一小块金属钠,反应的方程式为
_______。
(4)某同学设计了如图2实验装置进一步研究氯气的漂白性,已知通入的氯气中还含有空气
和水蒸气。
图2
回答下列问题:浓HSO 的作用是 _______。与研究目的直接相关的实验现象是 _______。
2 4
该实验设计存在事故隐患,应在D处增加一装置,该装置中应加入NaOH溶液以除去多余的氯
气,该反应的化学方程式为 _______。
30.(8分) “84消毒液”能有效杀灭新冠肺炎病毒,可用于物品表面的杀菌消毒。小铭同学
购买了一瓶“84消毒液”,该消毒液通常稀释到100倍(体积比)使用。查阅相关资料和消毒液包
装说明得到如图信息:
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司(1)该“84消毒液”NaClO物质的量浓度约为____(保留1位小数)。
(2)工业上可用Cl 与浓氢氧化钠溶液反应制取“84消毒液”,请写出反应的化学方程式
2
____。
(3)一瓶上述“84消毒液”理论上能吸收空气中____L的CO(标准状况下)而变质。(已知:
2
CO+NaClO+H O=NaHCO +HClO)
2 2 3
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,请用化学方程式解释其原因____,某消
毒小组人员用18.4mol•L-1的浓硫酸配制500mL2.3mol•L-1的稀硫酸用于增强“84消毒液”的消毒
能力,需取用浓硫酸的体积为____mL。
31.(6分)将5.48g固体试样xNaCO·yNaHCO 溶于水中,分成两等份,一份加入足量
2 3 3
Ba(OH) 溶液,充分反应后,静置过滤,得5.91g沉淀。另一份逐滴滴加1.00 mol·L-1的稀盐酸,
2
当滴加V mL盐酸时,产生的气体体积恰好达到最大值。求:
(1)反应消耗的Ba(OH) 为_______mol。
2
(2)该试样组成的化学式为_______。
(3)V=_______mL。
学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司学学学科科科网网网(((北北北京京京)股))份股股有份份限有有公限限司公公司司