文档内容
山东省名校联盟2024-2025学年高一下学期3月校际联考
化学试题B
一、单选题
1.化学与生产、生活、科技息息相关。下列叙述错误的是
A.高温结构陶瓷是新型无机非金属材料
B.黑色金属材料包括铁、铬、锰及其化合物
C.华为最新的手机芯片麒麟9000S的基础材料硅晶圆的主要成分是硅
D.常利用过渡元素单质制备特种合金来制造火箭、导弹、宇宙飞船等
2.科学家通过测量不同碳库中 与 的比值追踪碳的来源和流动,帮助了解全球碳循环过程。下列有
关叙述正确的是
A. 与 间的转化属于化学变化 B. 与 化学性质不相同
C.等质量的 与 的质子数相同 D.每个 的质量约为
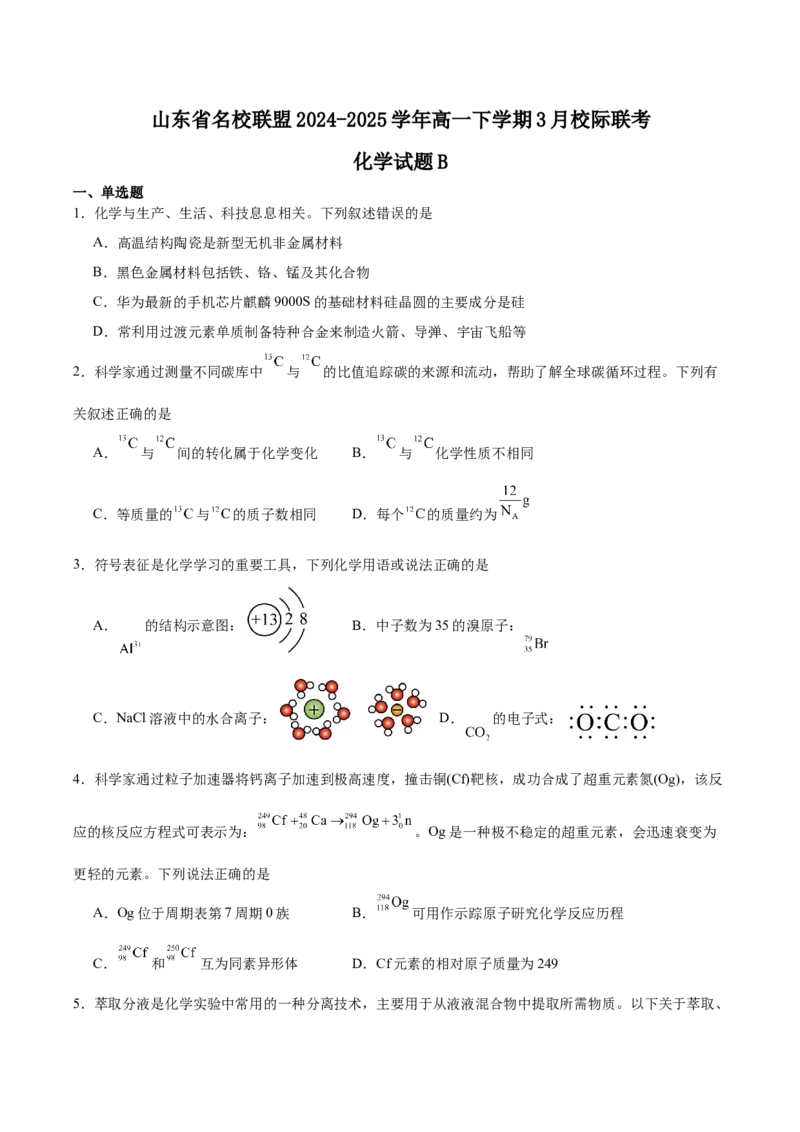
3.符号表征是化学学习的重要工具,下列化学用语或说法正确的是
A. 的结构示意图: B.中子数为35的溴原子:
C.NaCl溶液中的水合离子: D. 的电子式:
4.科学家通过粒子加速器将钙离子加速到极高速度,撞击铜(Cf)靶核,成功合成了超重元素氮(Og),该反
应的核反应方程式可表示为: 。Og是一种极不稳定的超重元素,会迅速衰变为
更轻的元素。下列说法正确的是
A.Og位于周期表第7周期0族 B. 可用作示踪原子研究化学反应历程
C. 和 互为同素异形体 D.Cf元素的相对原子质量为249
5.萃取分液是化学实验中常用的一种分离技术,主要用于从液液混合物中提取所需物质。以下关于萃取、分液操作的叙述中,正确的是
A.从碘水中提取碘单质可选用酒精作有机萃取剂
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.需依次将下层液体和上层液体从下口放出至不同烧杯中
D.分液时,需先将上口玻璃塞打开或将玻璃塞上的凹槽对准漏斗口上的小孔,再打开活塞
6.已知短周期主族元素X、Y、Z、M、N原子序数依次增大。X的一种单质是空气中含量最高的物质;Y
的最外层电子数是次外层的3倍;Z、M、N的最高价氧化物对应的水化物两两之间均可反应。下列叙述正
确的是
A.原子半径: B.X单质很稳定,不能被氧化或还原
C.M的氧化物可用作耐火材料 D.N的氢化物一定为强酸
7.硒(34Se)与硫在元素周期表中位于同一主族,性质相近,是生产生活中重要的非金属元素。以工业硒
(含S、C等杂质)为原料制备高纯硒的工艺流程如下。
下列说法不正确的是
A.硒为第4周期第VIA族元素
B.燃烧得到的 属于酸性氧化物
C.向水洗溶液加入几滴酸性高锰酸钾溶液,溶液褪色
D.燃烧消耗的 与还原消耗的 的物质的量之比为
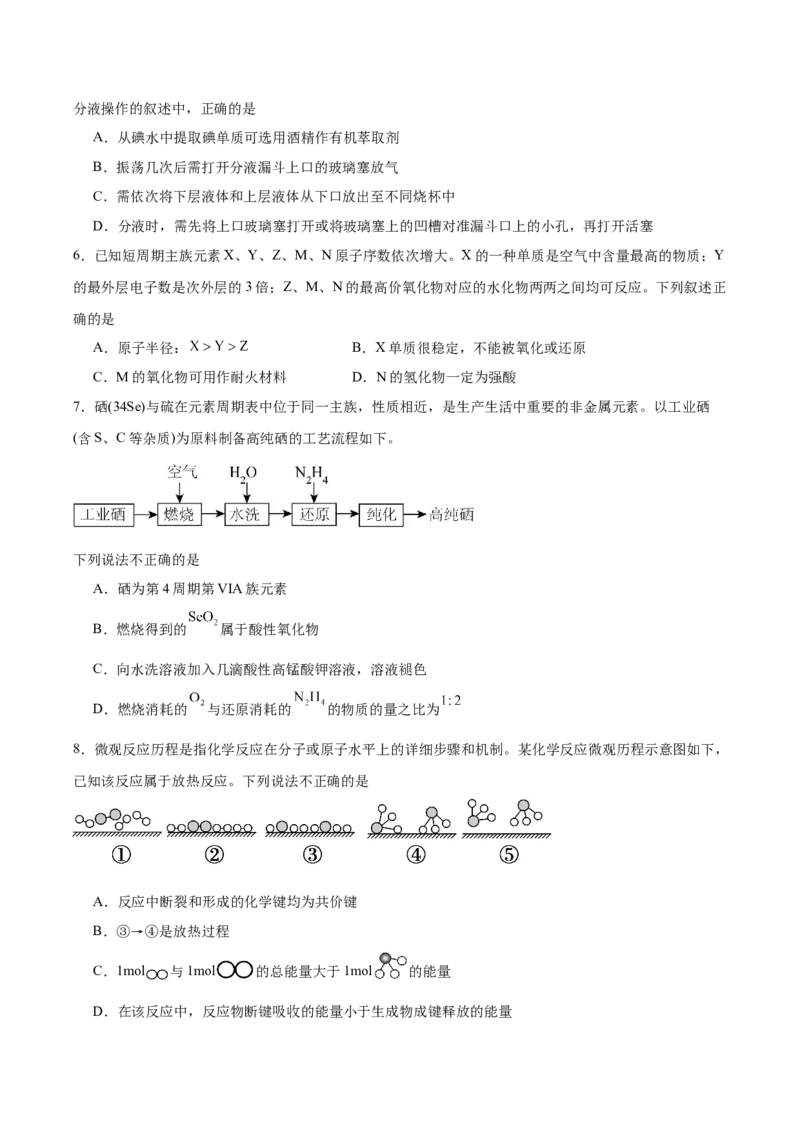
8.微观反应历程是指化学反应在分子或原子水平上的详细步骤和机制。某化学反应微观历程示意图如下,
已知该反应属于放热反应。下列说法不正确的是
A.反应中断裂和形成的化学键均为共价键
B.③→④是放热过程
C.1mol 与1mol 的总能量大于1mol 的能量
D.在该反应中,反应物断键吸收的能量小于生成物成键释放的能量9.铷(Rb)是一种碱金属元素,原子序数为37,由于其较高的反应性和稀有性,铷在科学研究和工业应用
中有一些独特的创新用途。下列有关铷(Rb)的说法不正确的是
A.单质铷能与水常温下反应生成氢气 B.碳酸铷不稳定易分解
C.灼烧氯化铷,火焰可能有特殊颜色 D.铷的最高价氧化物的水化物是强碱
10.元素周期表揭示了化学元素间的内在联系,下面对元素周期表的有关叙述正确的是
A.同一周期中ⅡA与ⅢA族元素原子的核电荷数相差均为1
B.第3周期所有主族元素的最高正化合价均等于它的族序数
C.原子序数之差为2的两种元素不可能位于同一主族
D.第IA、第IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
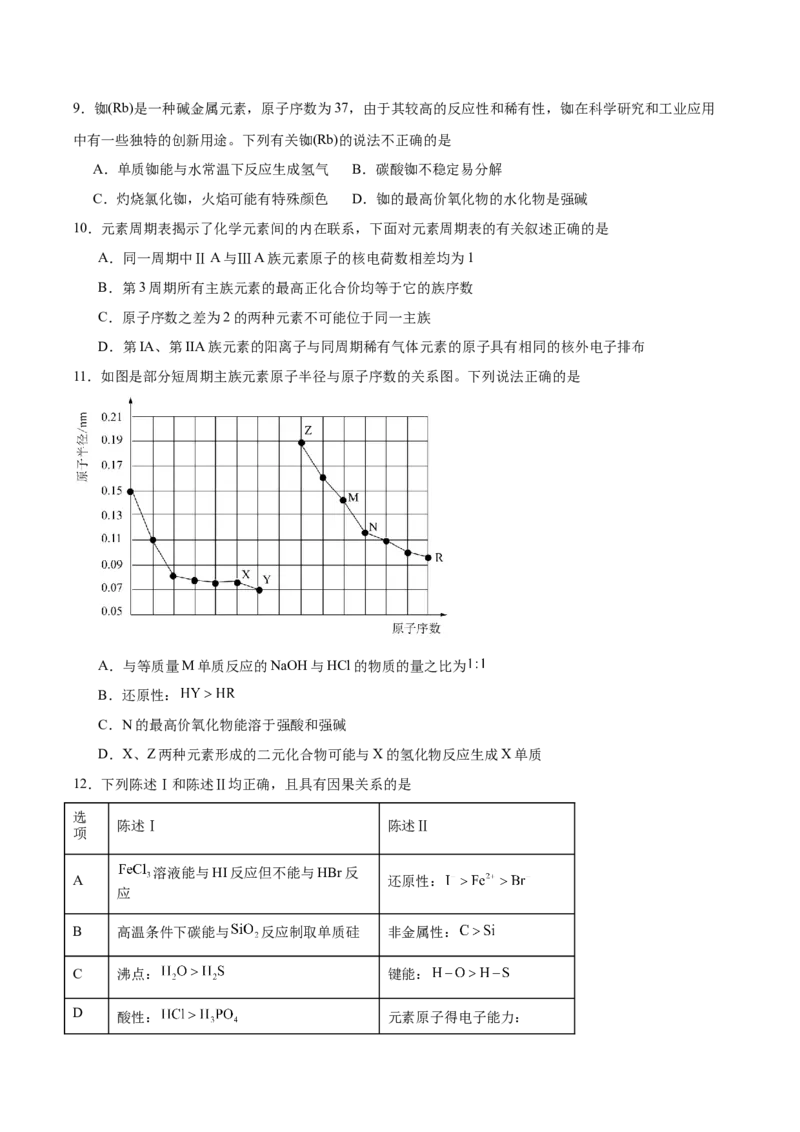
11.如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是
A.与等质量M单质反应的NaOH与HCl的物质的量之比为
B.还原性:
C.N的最高价氧化物能溶于强酸和强碱
D.X、Z两种元素形成的二元化合物可能与X的氢化物反应生成X单质
12.下列陈述Ⅰ和陈述Ⅱ均正确,且具有因果关系的是
选
陈述Ⅰ 陈述Ⅱ
项
溶液能与HI反应但不能与HBr反
A 还原性:
应
B 高温条件下碳能与 反应制取单质硅 非金属性:
C 沸点: 键能:
D
酸性: 元素原子得电子能力:A.A B.B C.C D.D
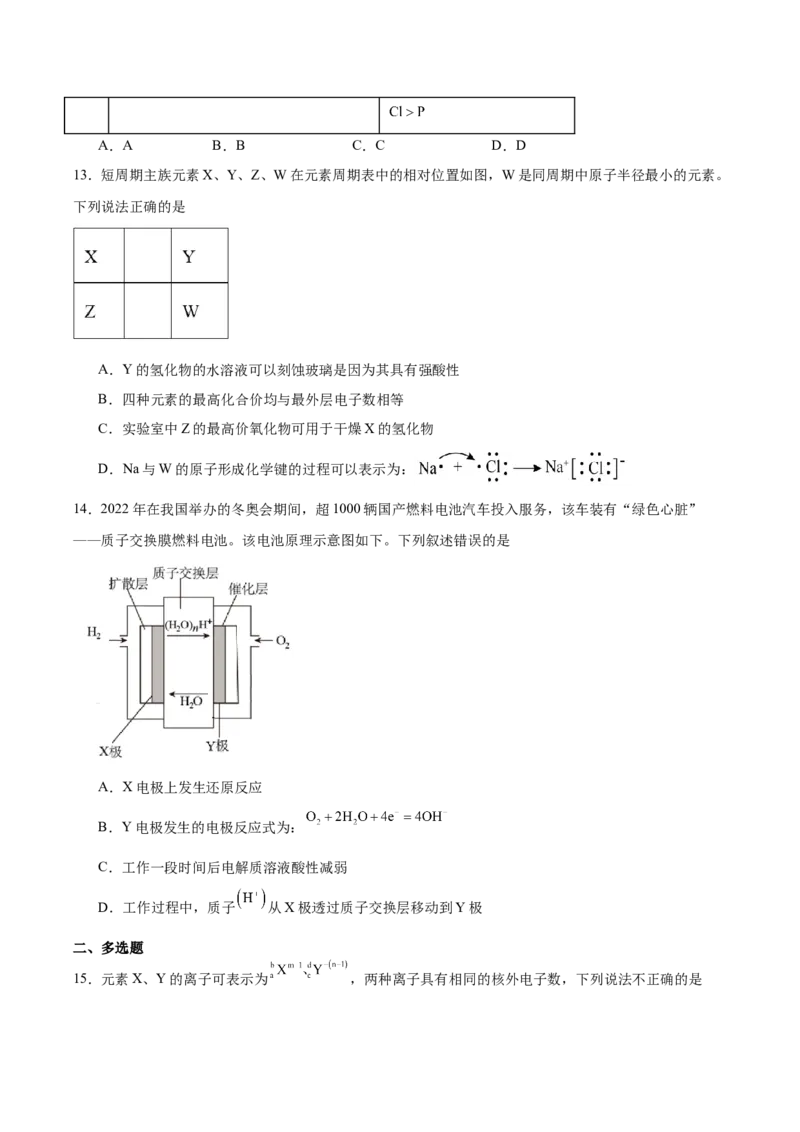
13.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如图,W是同周期中原子半径最小的元素。
下列说法正确的是
A.Y的氢化物的水溶液可以刻蚀玻璃是因为其具有强酸性
B.四种元素的最高化合价均与最外层电子数相等
C.实验室中Z的最高价氧化物可用于干燥X的氢化物
D.Na与W的原子形成化学键的过程可以表示为:
14.2022年在我国举办的冬奥会期间,超1000辆国产燃料电池汽车投入服务,该车装有“绿色心脏”
——质子交换膜燃料电池。该电池原理示意图如下。下列叙述错误的是
A.X电极上发生还原反应
B.Y电极发生的电极反应式为:
C.工作一段时间后电解质溶液酸性减弱
D.工作过程中,质子 从X极透过质子交换层移动到Y极
二、多选题
15.元素X、Y的离子可表示为 ,两种离子具有相同的核外电子数,下列说法不正确的是A. 含有的中子数为 B.
C.X、Y一定处于不同周期 D.Y元素的摩尔质量为
三、解答题
16.我国科学家最近合成一种高能盐 ,X、Y、Z、M为原子序数依次增大的短周期
元素;该盐的两种阳离子 与 均为10电子离子;M的最高价含氧酸是最强酸。
回答下列问题:
(1)Y的元素符号为 ,其在元素周期表中的位置为 。
(2)X分别与Y、Z形成的最简单二元化合物的稳定性由大到小顺序为 。
(3)得电子能力Z (填“>”或“<”)Y,请用原子结构知识解释其原因 。
(4)M单质与足量 混合,现象为 ,发生反应的化学方程式为 ,生成物中化合物
的电子式为 。
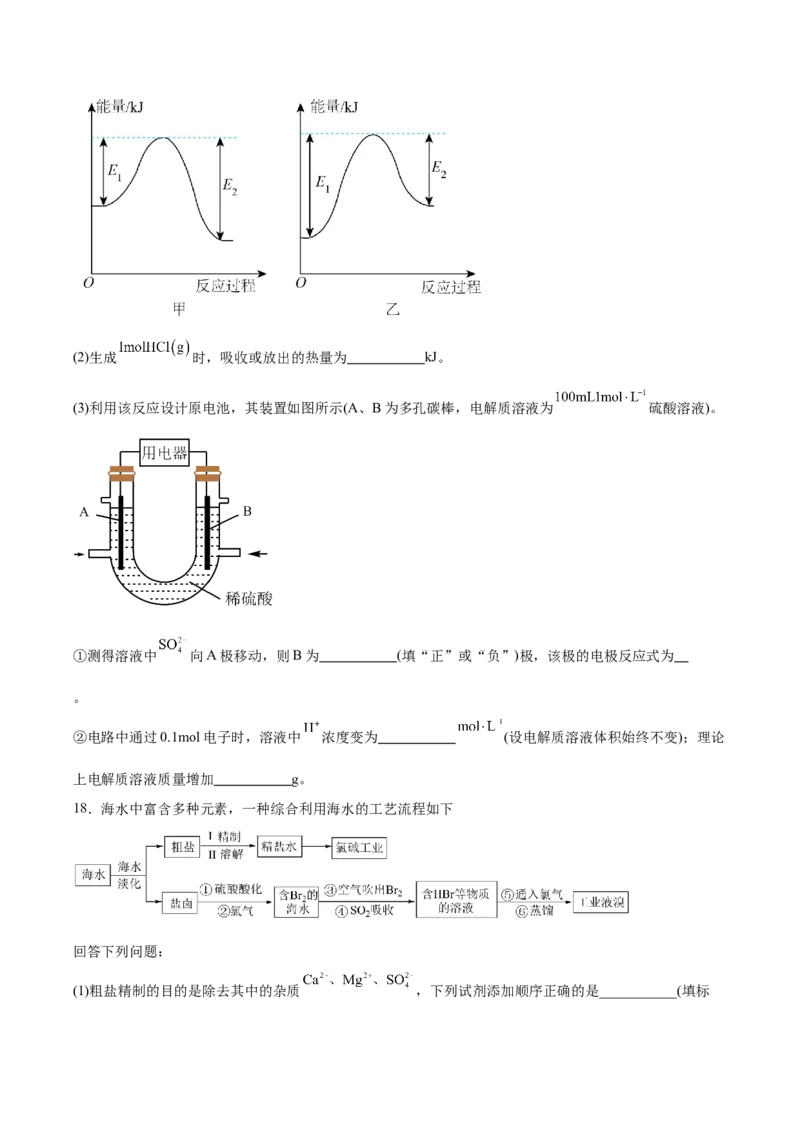
17. 在 中燃烧生成 的反应过程如图所示:
回答下列问题:
(1)下图中可以表示该反应能量变化的为 (填“甲”或“乙”);该图中 。(2)生成 时,吸收或放出的热量为 kJ。
(3)利用该反应设计原电池,其装置如图所示(A、B为多孔碳棒,电解质溶液为 硫酸溶液)。
①测得溶液中 向A极移动,则B为 (填“正”或“负”)极,该极的电极反应式为
。
②电路中通过0.1mol电子时,溶液中 浓度变为 (设电解质溶液体积始终不变);理论
上电解质溶液质量增加 g。
18.海水中富含多种元素,一种综合利用海水的工艺流程如下
回答下列问题:
(1)粗盐精制的目的是除去其中的杂质 ,下列试剂添加顺序正确的是___________(填标号)。
A. B.
C. D.
(2)步骤④发生反应的离子方程式为 ;下列试剂可以代替 的有 (填标号)。
A.酸性 溶液 B. 溶液 C. 溶液 D.NaCl溶液
(3)含 的海水不直接蒸馏的原因是 。
(4)处理1000L海水时,若消耗 标准状况下体积为17.92L,则海水中溴元素含量为
(不考虑过程中 的消耗)。
(5)空气吹出的 也可用 溶液吸收,生成NaBr和NaBrO,发生反应的化学方程式为 ,
则⑤中试剂需改为 (填化学式)。
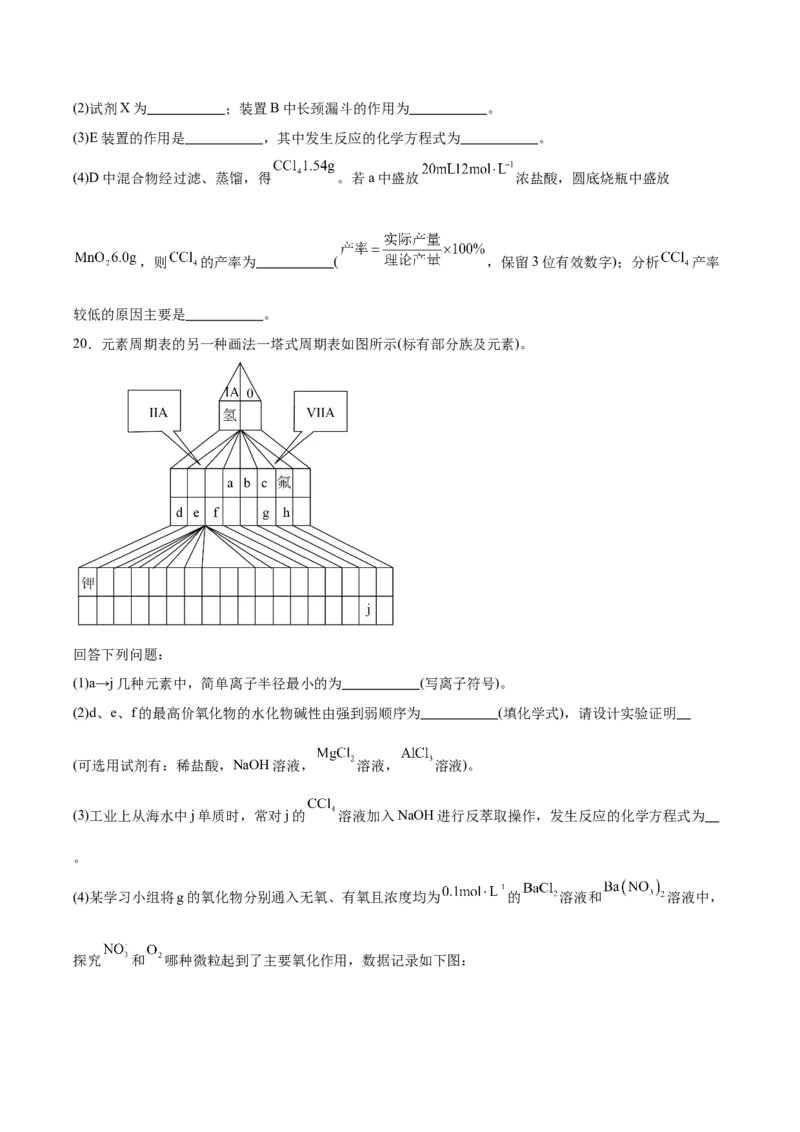
19.四氯化碳( )主要用作有机溶剂、灭火剂等。某化学小组如图装置模拟用 与 反应制备四氯化
碳(铁作催化剂,在85℃~95℃反应;加热及夹持装置略)。
已知:① 的沸点46.5℃,可与溴水反应生成硫酸和氢溴酸;
②球形冷凝器可冷凝回流四氯化碳。
回答下列问题:
(1)仪器a的名称为 ,导管的作用为 。(2)试剂X为 ;装置B中长颈漏斗的作用为 。
(3)E装置的作用是 ,其中发生反应的化学方程式为 。
(4)D中混合物经过滤、蒸馏,得 。若a中盛放 浓盐酸,圆底烧瓶中盛放
,则 的产率为 ( ,保留3位有效数字);分析 产率
较低的原因主要是 。
20.元素周期表的另一种画法一塔式周期表如图所示(标有部分族及元素)。
回答下列问题:
(1)a→j几种元素中,简单离子半径最小的为 (写离子符号)。
(2)d、e、f的最高价氧化物的水化物碱性由强到弱顺序为 (填化学式),请设计实验证明
(可选用试剂有:稀盐酸,NaOH溶液, 溶液, 溶液)。
(3)工业上从海水中j单质时,常对j的 溶液加入NaOH进行反萃取操作,发生反应的化学方程式为
。
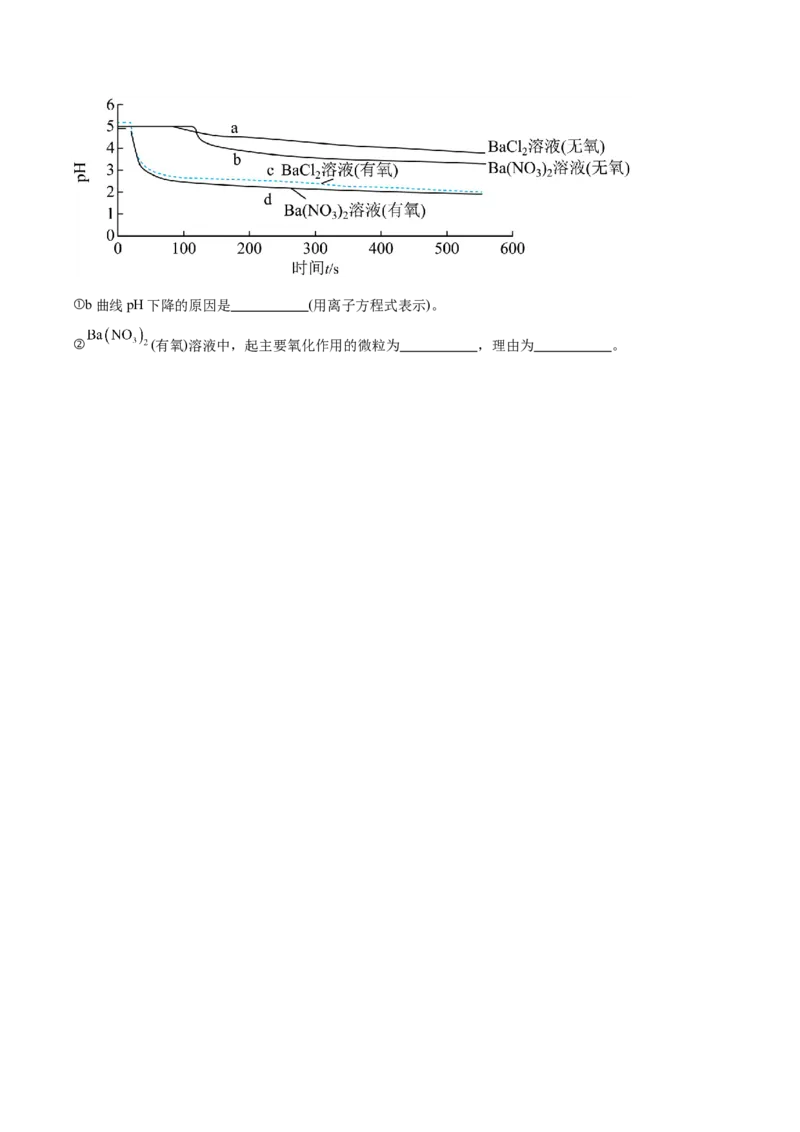
(4)某学习小组将g的氧化物分别通入无氧、有氧且浓度均为 的 溶液和 溶液中,
探究 和 哪种微粒起到了主要氧化作用,数据记录如下图:①b曲线pH下降的原因是 (用离子方程式表示)。
② (有氧)溶液中,起主要氧化作用的微粒为 ,理由为 。题号 1 2 3 4 5 6 7 8 9 10
答案 B D A A D C D C B B
题号 11 12 13 14 15
答案 D A D AB BC
16.(1) N 第二周期第ⅤA族
(2)H O>NH
2 3
(3) > N、O位于同一周期,从左到右,核电荷数依次增多,原子半径逐渐减小,得电子能力逐渐
增强,则得电子能力:O>N
(4) 产生白烟,同时黄绿色逐渐变浅直至消失
17.(1) 甲 679
(2)91.5
(3) 正极 Cl+2e-=2Cl- 3 3.65
2
18.(1)BC
(2) C
(3)开始得到的溴浓度低,直接蒸馏,成本高
(4)
(5) 3Br +6Na CO+3H O=5NaBr+NaBrO +6NaHCO
2 2 3 2 3 3
19.(1) 恒压滴液漏斗 平衡气压,便于浓盐酸顺利流下
(2) 饱和食盐水 平衡气流,控制气体流速,防止装置发生堵塞
(3) 吸收挥发出的二硫化碳 CS+8Br +10H O=2HSO +16HBr+CO
2 2 2 2 4 2
(4) 33.3% 实验中Cl 可能因浓度不足提前终止反应,且部分气体逸散,导致最终CCl 产率偏低
2 4
20.(1)O2-
(2) NaOH>Mg(OH) >Al(OH) 将NaOH溶液和 溶液混合可以制备氢氧化镁,氢氧化钠过量,
2 3
氢氧化镁不溶解,将NaOH溶液和 溶液混合,生成氢氧化铝,氢氧化钠过量时,氢氧化铝溶解
(3)I +2NaOH=NaI+NaIO+H O
2 2