文档内容
第三章 铁 金属材料
单元测试卷
时间:90分钟 满分:100分
一、 选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.天然氧化铝晶体俗称刚玉,常因含有杂质而呈各种色彩。下列叙述不正确的( )
A.刚玉中混入微量的铬元素称为红宝石
B.刚玉中混入微量的钛元素或铁元素称为蓝宝石
C.蓝宝石和红宝石都是制作名贵首饰的材料
D.蓝宝石和红宝石都只能从自然界中来获得
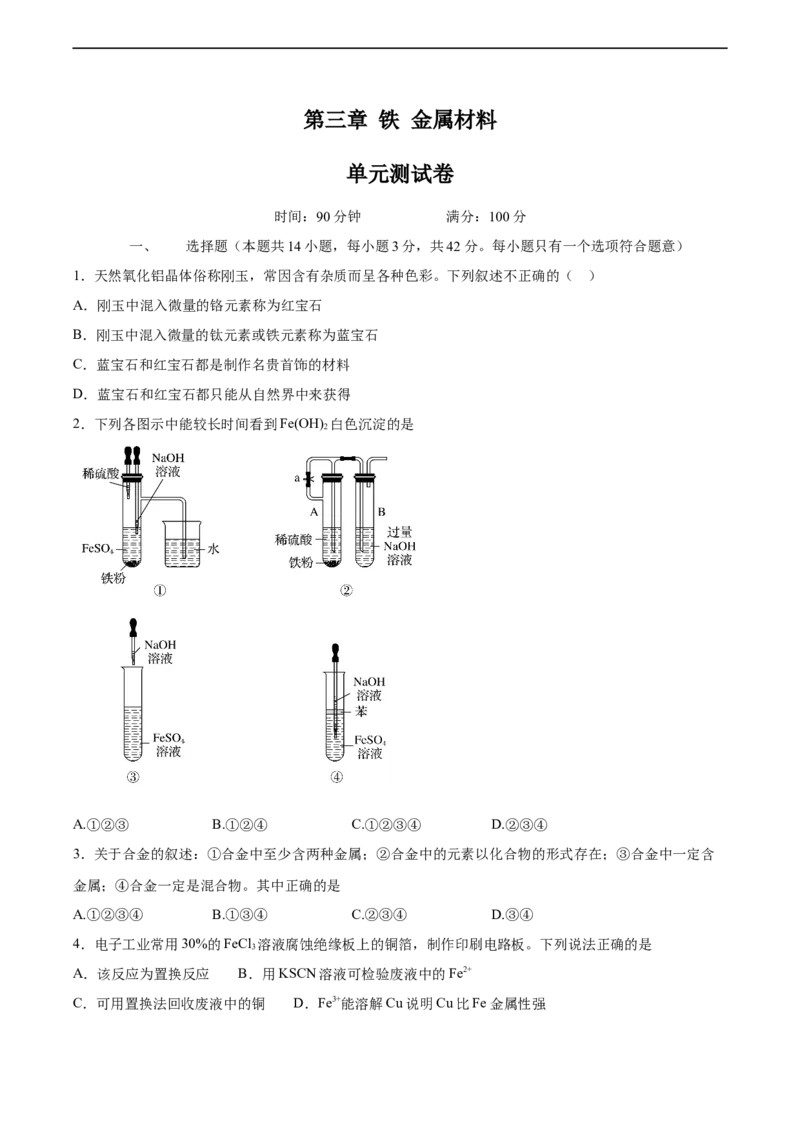
2.下列各图示中能较长时间看到Fe(OH) 白色沉淀的是
2
A.①②③ B.①②④ C.①②③④ D.②③④
3.关于合金的叙述:①合金中至少含两种金属;②合金中的元素以化合物的形式存在;③合金中一定含
金属;④合金一定是混合物。其中正确的是
A.①②③④ B.①③④ C.②③④ D.③④
4.电子工业常用30%的FeCl 溶液腐蚀绝缘板上的铜箔,制作印刷电路板。下列说法正确的是
3
A.该反应为置换反应 B.用KSCN溶液可检验废液中的Fe2+
C.可用置换法回收废液中的铜 D.Fe3+能溶解Cu说明Cu比Fe金属性强5.下列物质的鉴别方法是运用化学方法且正确的是
A.用 NaOH 溶液鉴别 NaCO 溶液和 NaHCO 溶液
2 3 3
B.用 KSCN 溶液鉴别 FeCl 溶液和 FeCl 溶液
3 2
C.用澄清石灰水鉴别 SO 和 CO 两种气体
2 2
D.利用丁达尔效应鉴别 Fe(OH) 胶体和 FeCl 溶液
3 3
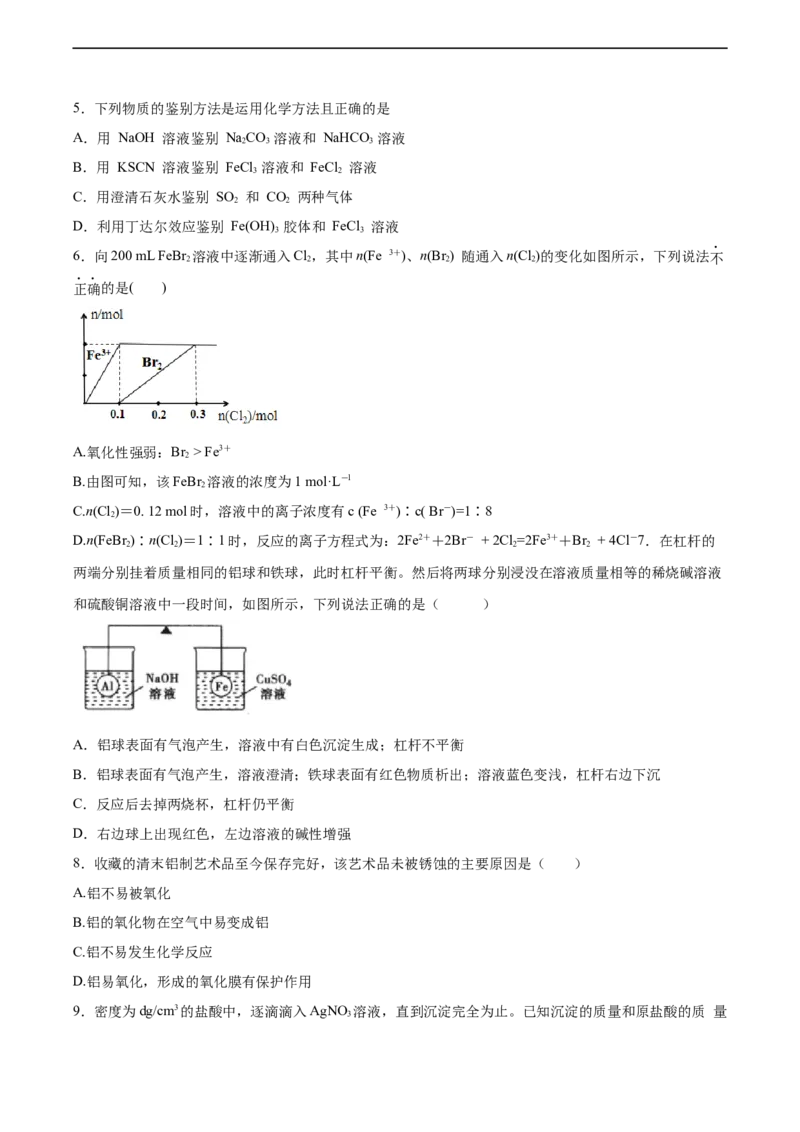
6.向200 mL FeBr 溶液中逐渐通入Cl,其中n(Fe 3+)、n(Br) 随通入n(Cl )的变化如图所示,下列说法不
2 2 2 2
正确的是( )
A.氧化性强弱:Br > Fe3+
2
B.由图可知,该FeBr 溶液的浓度为1 mol·L-l
2
C.n(Cl )=0. 12 mol时,溶液中的离子浓度有c (Fe 3+)∶c( Br-)=1∶8
2
D.n(FeBr)∶n(Cl )=1∶1时,反应的离子方程式为:2Fe2++2Br- + 2Cl =2Fe3++Br + 4Cl-7.在杠杆的
2 2 2 2
两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液
和硫酸铜溶液中一段时间,如图所示,下列说法正确的是( )
A.铝球表面有气泡产生,溶液中有白色沉淀生成;杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出;溶液蓝色变浅,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的碱性增强
8.收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝不易发生化学反应
D.铝易氧化,形成的氧化膜有保护作用
9.密度为dg/cm3的盐酸中,逐滴滴入AgNO 溶液,直到沉淀完全为止。已知沉淀的质量和原盐酸的质 量
3相等,则原盐酸的物质的量浓度为:
A.25.4d mol/L B.12.7d mol/L C.7d mol/L D.6.35d mol/L
10.下列实验操作和现象、结论或目的均正确的是( )
选项 操作和现象 结论或目的
向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,
A 红砖中含有氧化铁
滴加KSCN溶液2~3滴,溶液呈红色
CO还原Fe O 得到的黑色固体加入盐酸溶解后再加入KSCN
B 2 3 黑色固体中没有Fe O
溶液,溶液不显红色 3 4
取少量Fe(NO ) 试样加水溶解,加稀HSO 酸化,滴加
C 3 2 2 4 该Fe(NO ) 试样已经变质
KSCN溶液,溶液变为红色 3 2
D 向某溶液中通入Cl,然后再加入KSCN溶液变红色 原溶液中含有Fe2+
2
11.等质量的CuO和MgO粉末分别溶于同体积的硝酸中,无固体剩余,得到的Cu(NO ) 和Mg(NO) 的物
3 2 3 2
质的量浓度分别为a mol•L﹣1和bmol•L﹣1(假设反应前后溶液体积无明显变化),则a与b的关系为
( )
A.a=b B.a=2b C.2a=b D.a=5b
12.一定量的 在 中燃烧后,所得混合气体用100mL3.00mol/L的NaOH溶液恰好完全吸收,测得溶
液中含0.05molNaClO。氢气和氯气物质的量之比是( )
A.2:3 B.3:1 C.1:1 D.3:2
13.将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种
试剂,这种试剂是( )
A.KSCN B.BaCl C.HCl D.NaOH
2
14.取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,
则两份铝片的质量之比为
A.1:6 B.2:3 C.3:2 D.1:1
二、综合题(本题共4小题,共58分)
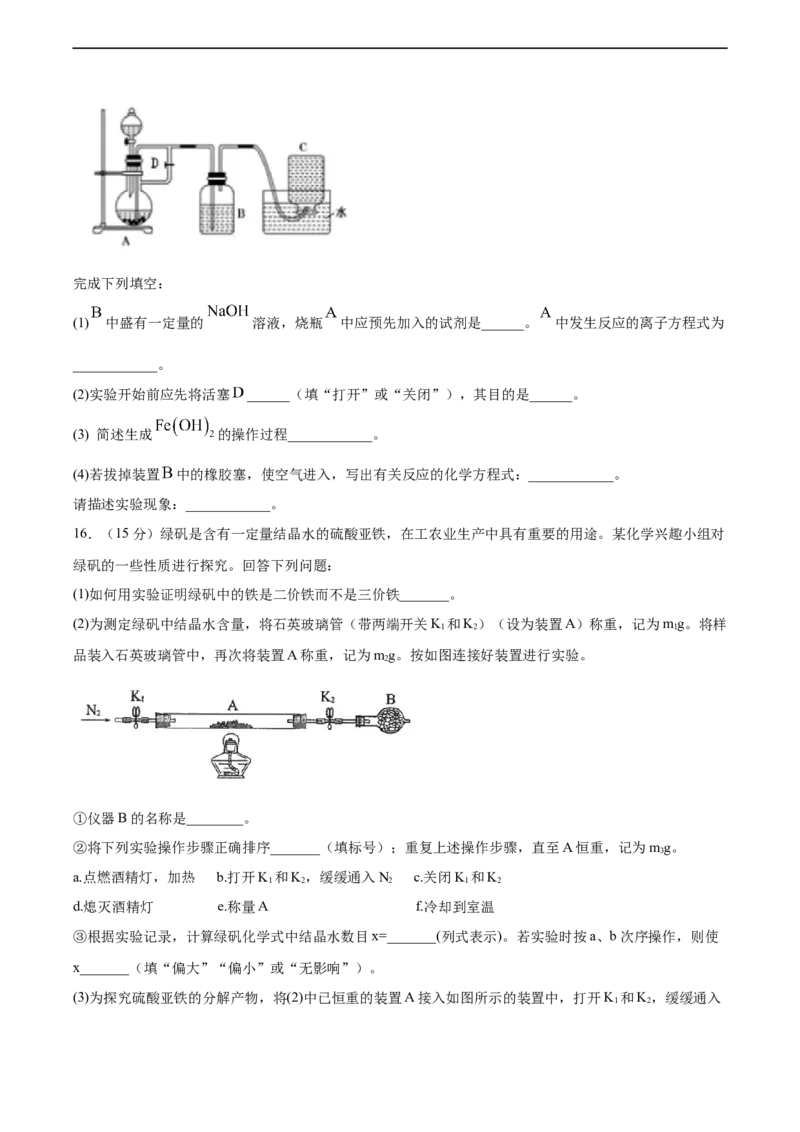
15.(15分)下图所示装置可用来制取和观察 在空气中被氧化时的颜色变化,实验时必须使用
铁屑、稀硫酸、 溶液,其他试剂任选。完成下列填空:
(1) 中盛有一定量的 溶液,烧瓶 中应预先加入的试剂是______。 中发生反应的离子方程式为
____________。
(2)实验开始前应先将活塞 ______(填“打开”或“关闭”),其目的是______。
(3) 简述生成 的操作过程____________。
(4)若拔掉装置 中的橡胶塞,使空气进入,写出有关反应的化学方程式:____________。
请描述实验现象:____________。
16.(15分)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对
绿矾的一些性质进行探究。回答下列问题:
(1)如何用实验证明绿矾中的铁是二价铁而不是三价铁_______。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K 和K)(设为装置A)称重,记为mg。将样
1 2 1
品装入石英玻璃管中,再次将装置A称重,记为mg。按如图连接好装置进行实验。
2
①仪器B的名称是________。
②将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为mg。
3
a.点燃酒精灯,加热 b.打开K 和K,缓缓通入N c.关闭K 和K
1 2 2 1 2
d.熄灭酒精灯 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______(列式表示)。若实验时按a、b次序操作,则使
x_______(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K 和K,缓缓通入
1 2N,加热。实验后反应管中残留固体为红色粉末。
2
①C中的溶液为BaCl ,其作用是______。D溶液为______,D中可观察到的现象为_______。
2
②写出硫酸亚铁高温分解反应的化学方程式________。
③有同学认为该实验装置存在一定缺陷,请你谈谈完善该试验装置的措施____。
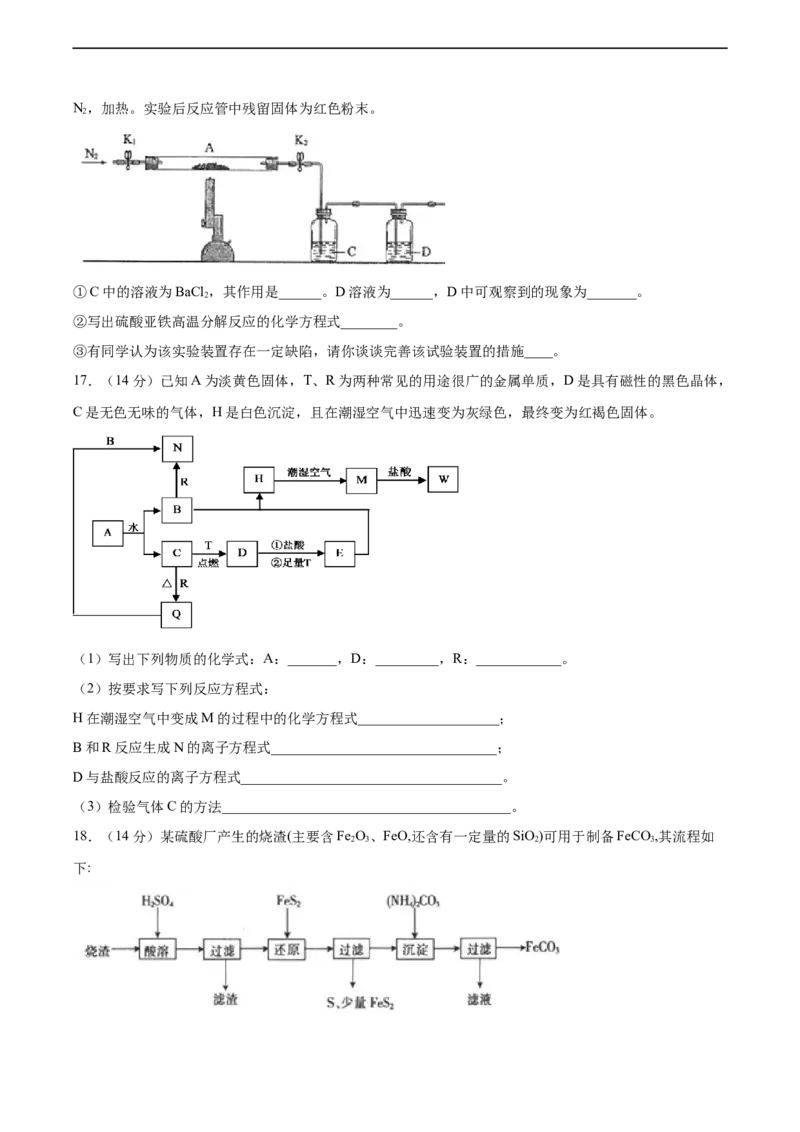
17.(14分)已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,
C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式:A:_______,D:_________,R:____________。
(2)按要求写下列反应方程式:
H在潮湿空气中变成M的过程中的化学方程式____________________;
B和R反应生成N的离子方程式________________________________;
D与盐酸反应的离子方程式_____________________________________。
(3)检验气体C的方法_________________________________________。
18.(14分)某硫酸厂产生的烧渣(主要含Fe O、FeO,还含有一定量的SiO)可用于制备FeCO,其流程如
2 3 2 3
下:已知:还原时,FeS 与HSO 不反应,Fe3+通过反应Ⅰ、Ⅱ被还原,其中反应ⅠW为
2 2 4
FeS+14Fe3++8H O=15Fe2++2SO2-+16H+。
2 2 4
(1)反应Ⅰ中还原剂是_________
(2)滤渣的成分是_______(填名称)。
(3)所得FeCO 需充分洗涤,检验FeCO 是否洗净的方法是____________
3 3
(4)①配平反应的离子方程式: ____________
②还原前后溶液中部分离子的浓度见下表(溶液体积变化忽略不计):
离子浓度(mol/L)
离子
还原前 还原后
Fe2+ 0.10 2.50
SO 2- 3.50 3.70
4
则反应Ⅰ、Ⅱ中生成Fe2+的物质的量之比为____